È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Costruzione di microelettrodi potenziali di campo locale per registrazioni in vivo da più strutture cerebrali contemporaneamente
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Il presente protocollo descrive la costruzione di array di microelettrodi su misura per registrare i potenziali di campo locale in vivo da più strutture cerebrali contemporaneamente.
Abstract
I ricercatori hanno spesso bisogno di registrare i potenziali di campo locali (LFP) contemporaneamente da diverse strutture cerebrali. La registrazione da più regioni cerebrali desiderate richiede diversi progetti di microelettrodi, ma gli array di microelettrodi disponibili in commercio spesso non offrono tale flessibilità. Qui, il presente protocollo delinea la progettazione semplice di array di microelettrodi su misura per registrare LFP da più strutture cerebrali contemporaneamente a diverse profondità. Questo lavoro descrive la costruzione dei microelettrodi bilaterali corticali, striatali, ventrolaterali e ninigrali come esempio. Il principio di progettazione delineato offre flessibilità e i microelettrodi possono essere modificati e personalizzati per registrare LFP da qualsiasi struttura calcolando le coordinate stereotassiche e cambiando rapidamente la costruzione di conseguenza per indirizzare diverse regioni del cervello in topi liberamente mobili o anestetizzati. L'assemblaggio del microelettrodo richiede strumenti e forniture standard. Questi array di microelettrodi personalizzati consentono agli investigatori di progettare facilmente array di microelettrodi in qualsiasi configurazione per tracciare l'attività neuronale, fornendo registrazioni LFP con risoluzione al millisecondo.
Introduzione
I potenziali di campo locale (LFP) sono i potenziali elettrici registrati dallo spazio extracellulare nel cervello. Sono generati da squilibri di concentrazione ionica al di fuori dei neuroni e rappresentano l'attività di una piccola popolazione localizzata di neuroni, consentendo di monitorare con precisione l'attività di una specifica regione del cervello rispetto alle registrazioni EEG su macroscala1. Come stima, i microelettrodi LFP separati da 1 mm corrispondono a due popolazioni di neuroni completamente diverse. Mentre il segnale EEG viene filtrato dal tessuto cerebrale, dal liquido cerebrospinale, dal cranio, dai muscoli e dalla pelle, il segnale LFP è un marcatore affidabile dell'attività neuronale locale1.
I ricercatori hanno spesso bisogno di registrare simultaneamente LFP da diverse strutture cerebrali, ma gli array di microelettrodi disponibili in commercio spesso non offrono tale flessibilità. Qui, il presente protocollo descrive microelettrodi completamente personalizzabili e facilmente costruibili per registrare simultaneamente LFP da qualsiasi regione del cervello desiderata a diverse profondità. Sebbene gli LFP siano stati ampiamente utilizzati per registrare l'attività neuronale di una specifica regione del cervello 2,3,4,5,6,7,8,9, l'attuale design facilmente personalizzabile consente di registrare LFP da qualsiasi regione cerebrale superficiale o profonda multipla 11,12 . Il protocollo può anche essere modificato per costruire qualsiasi array di microelettrodi desiderato determinando le coordinate stereotassiche delle regioni del cervello e assemblando l'array di conseguenza. Questi microelettrodi con una frequenza di campionamento di 10 kHz e una resistenza di 60-70 kΩ (lunghezza 2 cm) ci consentono di registrare LFP con precisione al millisecondo. I dati possono quindi essere amplificati da un amplificatore a 16 canali, filtrati (passa basso 1 Hz, passaggio alto 5 kHz) e digitalizzati.
Protocollo
Il presente lavoro è approvato dal Comitato per la cura e l'uso degli animali dell'Università della Virginia. Per gli esperimenti sono stati utilizzati topi C57Bl/6 di entrambi i sessi (7-12 settimane). Gli animali sono stati mantenuti su un ciclo di luce di 12 ore / 12 ore di buio e hanno avuto accesso ad libitum al cibo e all'acqua.
1. Costruzione di microelettrodi
- Per costruire i microelettrodi, utilizzare filo di nichel-cromo rivestito di diamemetico da 50 μm (diametro) (vedi Tabella dei materiali). Nastro adesivo a un'estremità del filo sul retro della piattaforma e avvolgere il filo tre volte attorno alla manopola più vicina sulla piattaforma (Figura 1A, C).
NOTA: qui è stata utilizzata una piattaforma acrilica con due manopole (2 x 5 pollici), ma è possibile utilizzare qualsiasi piattaforma.- Allungare il filo attorno alla seconda manopola più lontana per creare due loop tra le manopole. Avvolgere il filo altre tre volte attorno alla prima manopola per fissare il filo in posizione e fissare nuovamente l'estremità sul retro della piattaforma.
NOTA: dopo che i fili sono stati separati (passaggi 1.2-1.3.1), devono esserci due fili su ciascun lato (quattro fili in totale, Figura 1B).
- Allungare il filo attorno alla seconda manopola più lontana per creare due loop tra le manopole. Avvolgere il filo altre tre volte attorno alla prima manopola per fissare il filo in posizione e fissare nuovamente l'estremità sul retro della piattaforma.
- Posizionare le barre di tensione sotto i fili con il nastro avvolto attorno a loro (lato appiccicoso verso l'alto) (Figura 1C).
NOTA: per le barre di tensione sono stati utilizzati pezzi acrilici triangolari, con nastro avvolto attorno a loro (lato appiccicoso all'esterno per fissare i fili). Il lato appiccicoso del nastro al di fuori delle barre di tensione manterrà i fili in posizione per regolare la distanza tra loro. Le barre di tensione devono essere a ~ 2,5 cm di distanza dalle manopole e i fili non devono essere allentati. - Usando un microscopio e una pinza fine, fare uno spazio di 3 mm o 4,5 mm tra i fili (spazio di 3 mm tra i fili per creare microelettrodi corticali (Ctx) - nucleo talamico ventrolaterale (VL); spazio di 4,5 mm per creare microelettrodi striatali (Str) - nigrali (SNR)) (Figura 1B).
- Se l'ingrandimento viene utilizzato al microscopio, assicurarsi di calcolare e regolare la differenza di ingrandimento e la distanza effettiva tra i fili.
NOTA: se i microelettrodi sono costruiti per strutture diverse da quelle utilizzate qui, la distanza tra i fili deve essere regolata sulla distanza stereotassica tra le strutture. La Figura 2B fornisce un esempio di come saranno organizzati i fili; di conseguenza, le coordinate stereotassiche per altre strutture devono essere regolate.
- Se l'ingrandimento viene utilizzato al microscopio, assicurarsi di calcolare e regolare la differenza di ingrandimento e la distanza effettiva tra i fili.
- Tagliare quattro piccoli pezzi di plastica (spessore 0,5 mm) ~ 6 mm (larghezza) x 3 mm (altezza) (Figura 1C).
NOTA: Qualsiasi pezzo di plastica può essere utilizzato purché abbia uno spessore di 0,5 mm; qui, sono stati utilizzati tubi quadrati in cui sono stati venduti i perni (Pins, vedi Tabella dei materiali). Se si utilizza uno spessore diverso, aggiungere più o meno pezzi di plastica per adattarsi alle coordinate stereotassiche richieste. - Applicare la colla (vedi Tabella dei materiali) sulla plastica e posizionarli sui fili (Figura 1C). Posizionare i pezzi di plastica a ~ 1,0 cm di distanza dal centro del filo, che è a 1,0 cm di distanza dalla barra di tensione. Rimuovere l'eccesso di supercolla con un batuffolo di cotone.
- Dopo che la supercolla si è asciugata, tagliare i fili usando forbici fini, nell'ordine indicato nella Figura 1C.
- Tagliare quattro tubi di vetro da 7 mm utilizzando un kit disponibile in commercio (vedere Tabella dei materiali) e inserire i fili degli elettrodi nei tubi di vetro come indicato nella Figura 2A.
- Inserire le coppie di elettrodi VL e SNR nei tubi di vetro.
NOTA: solo i fili per le strutture profonde devono essere inseriti nei tubi di vetro per supportare l'impianto chirurgico. Assicurarsi di non inserire elettrodi corticali nel tubo di vetro.
- Inserire le coppie di elettrodi VL e SNR nei tubi di vetro.
- Metti la colla alla base dei tubi di vetro per collegarli alla plastica. Attendere un po 'di tempo fino a quando la colla si asciuga.
- Tagliare i tubi e i fili di vetro usando un bisturi come indicato nella Tabella 1; assicurarsi che le lunghezze dei microelettrodi siano corrette. Se i microelettrodi prendono di mira strutture diverse, regolare la distanza di taglio in base alle coordinate stereotassiche richieste.
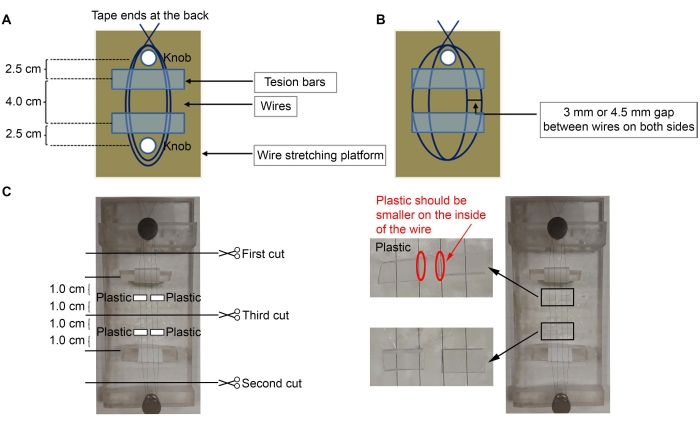
Figura 1: Schema della costruzione del microelettrodo. (A) Installazione di fili sulla piattaforma con barre di tensione sotto i fili. (B) Lo spazio tra i fili. (C) Quattro pezzi di plastica sono incollati ai fili. Fare clic qui per visualizzare una versione più grande di questa figura.
| Ctx · | Str | VL | SNR | |
| AP (Anteriore/Posteriore) | 2.2 | 1.2 | -1.3 | -3.3 |
| ML (Mediale/Laterale) | 1.8 | 1.5 | 1 | 1.5 |
| DV (Dorsale/Ventrale) | 0.5 | 3.5 | 4 | 4.75 |
| Lunghezza dell'elettrodo | 4 | 4.75 | 5.25 | 6 |
Tabella 1: Coordinate e dimensioni dell'impianto stereotassico dei microelettrodi.
2. Assemblaggio di array di microelettrodi
- Utilizzare la colla per attaccare le materie plastiche nell'ordine desiderato delle regioni target. Un esempio di elettrodi corticali, talamici, striatali e nigrali è mostrato nella Figura 2B,C.
- Posizionare la coppia di elettrodi Ctx-VL a faccia in giù (il lato con i fili dell'elettrodo deve essere rivolto verso il basso) e collegare due pezzi di plastica vuoti da 6 mm x 3 mm sulla parte superiore con colla.
- Sopra i tre pezzi di plastica, posizionare la seconda coppia di elettrodi Ctx-VL con gli elettrodi rivolti verso l'alto (utilizzare un microscopio e assicurarsi che gli elettrodi VL siano allineati).
NOTA: L'allineamento degli elettrodi bilaterali (qui, l'allineamento degli elettrodi VL sinistro e destro) è essenziale per indirizzare le strutture bilaterali desiderate in modo appropriato. - Utilizzare la colla per fissare gli elettrodi SNR sulla parte superiore con gli elettrodi SNR a 2,0 mm di distanza dagli elettrodi VL e ~ 5,0 mm di distanza dagli elettrodi corticali (i fili degli elettrodi SNR devono essere rivolti verso l'alto).
- Ripetere il passaggio 2.1.3. per l'altro lato (i fili dell'elettrodo SNR devono essere rivolti verso l'esterno dell'array di microelettrodi).
- Applicare resina epossidica intorno alla plastica per legare insieme gli elettrodi. Evitare di mettere resina epossidica sugli elettrodi.
- Prendi un filo spesso e fai un anello su un'estremità. Immergere il cappio nella soluzione epossidica e posizionarlo sulla plastica, assicurandosi che il filo spesso sia piatto (Figura 2D) in modo che per i passaggi successivi, questo filo possa essere utilizzato come maniglia. Attendere che gli elettrodi siano completamente asciutti.
- Tagliare i fili a 2 cm, come mostrato nella Figura 2E.
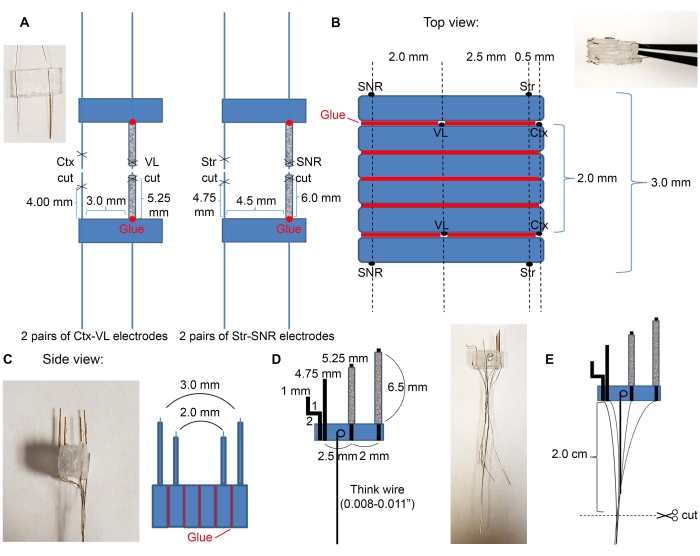
Figura 2: Costruzione e dimensioni del microelettrodo. (A) Quattro coppie di elettrodi si sono formate dopo che i fili sono stati tagliati con le forbici, come indicato nella Figura 1C (2 coppie di elettrodi Ctx-VL e 2 coppie di elettrodi Str-SNR). Inserire elettrodi a struttura profonda (VL e SNR) nei tubi di vetro e incollare le loro basi alla plastica (punti rossi). (B) Vista dall'alto: le coppie di elettrodi di (A) sono incollate in una pila per creare il nucleo del microelettrodo. Le linee rosse indicano le linee di colla. (C) Vista frontale laterale di (B). (D) Il filo spesso era attaccato ai microelettrodi. (E) I fili sono raggruppati come indicato e le estremità isolate vengono raschiate e tagliate in 2 cm. Fare clic qui per visualizzare una versione più grande di questa figura.
3. Connessione microelettrodo all'auricolare
- Raggruppare i fili come indicato nella Figura 2E e raschiare via 1 mm delle estremità isolate con un bisturi.
- Piegare gli elettrodi corticali come mostrato nella Figura 3A. Separare i fili come mostrato nella Figura 3B. Usando una pinza fine, fai un anello all'estremità di ciascun filo (Figura 3B).
- Tenere in mano un auricolare a 10 pin con un emostato (vedere Tabella dei materiali) e utilizzare l'estremità in legno di un batuffolo di cotone per applicare quantità minime di flusso sui perni (Figura 3C). Assicurarsi di non mettere il flusso all'esterno dei pin per evitare cortocircuiti tra i pin.
- Usando l'estremità di legno di un batuffolo di cotone, applicare il flusso agli anelli del filo.
- Saldare i passanti del filo all'auricolare a 10 pin come mostrato nella Figura 3C. Dopo la saldatura, asciugare l'auricolare per evitare cortocircuiti tra i pin.
- Prendi un filo sottile (0,005-0,008 pollici) per i fili di riferimento e di terra e rimuovi la plastica da un'estremità. Fai un anello sull'altra estremità del filo.
- Saldare il lato spogliato dei fili di riferimento e di terra ai rispettivi pin (Figura 3A,C).
- Tenendo premuto il filo spesso (Figura 2D), applicare il cemento cranioplastico attorno ai microelettrodi, specialmente dove i fili si collegano ai perni. Evitare di toccare le estremità dell'elettrodo effettivo con il cemento.
- Dopo che il cemento si asciuga, metti la resina epossidica alla base dei tubi di vetro, dei fili del microelettrodo striatale e dell'intero elettrodo. Evitare di toccare le estremità dell'elettrodo effettivo con resina epossidica. Attendere che gli elettrodi siano completamente asciutti.
- Gli elettrodi sono pronti. Praticare fori nel cranio del mouse (secondo le coordinate stereotassiche richieste) utilizzando un trapano dentale e impiantare l'auricolare come mostrato nella Figura 3D abbassando l'auricolare con microelettrodi rivolti verso il cranio e i fori appropriati. L'auricolare può essere collegato al braccio stereotassico per il supporto durante l'impianto.
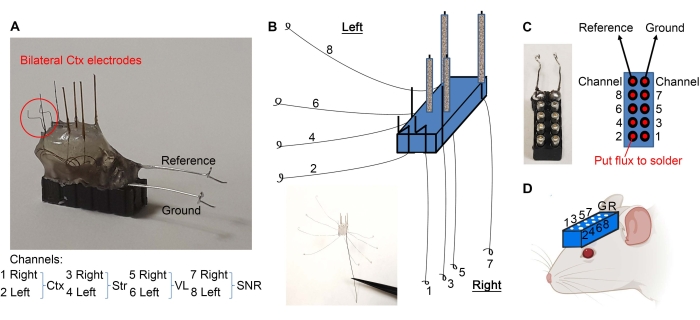
Figura 3: Impianto di microelettrodi. (A) Gli elettrodi corticali sono piegati come indicato. (B) I fili sono separati per creare anelli alle estremità. (C) Il flusso (ai punti rossi) e i fili ad anello sono saldati all'auricolare a 10 pin, assicurando che ogni filo vada al pin appropriato. (D) L'auricolare viene impiantato per registrare gli LFP. Fare clic qui per visualizzare una versione più grande di questa figura.
4. Marcatura della posizione dell'elettrodo dopo le registrazioni
- Al termine delle registrazioni LFP, confermare la corretta posizione degli elettrodi nella regione target applicando una corrente sulle punte degli elettrodi per effettuare una lesione e attendendo 30 minuti prima di perfondere il mouse.
NOTA: impostazioni della lesione per confermare la posizione delle punte dell'elettrodo: singolo scoppio, 40 μA, impulso monofasico a onda quadra da 0,75 ms, 50 Hz, 30 s. - Anestetizzare i topi con isoflurano (fino a quando il topo non si è addormentato) e perfondere10 transcardialmente con il 4% di paraformaldeide (PFA) in tampone fosfato di sodio 0,1 M. Sezionare il cervello (40 μm di spessore) su un criostato (vedi Tabella dei materiali) e colorare con DAPI (0,02% in PBS). Confermare la posizione corretta degli elettrodi dalla presenza delle lesioni della punta dell'elettrodo come mostrato nella Figura 4B,C.
NOTA: La percentuale di isoflurano deve essere applicata seguendo le linee guida del singolo istituto.
5. Misurazione della resistenza dell'elettrodo
- Misurare la resistenza degli elettrodi e controllare il cortocircuito tra gli elettrodi utilizzando un ohmmetro multi-range (vedi Tabella dei materiali). Impostare la scala di resistenza su R x 10.000, indicando che una deflessione unitaria nel puntatore corrisponde alla resistenza di 1 kΩ. Gli elettrodi lunghi 2 cm devono avere una resistenza di 60-70 kΩ.
- Personalizza l'auricolare prendendo dieci pin singoli (vedi Tabella dei materiali). Saldare ogni perno con un sottile filo di rame a più fili in un cavo.
- Premere i perni saldati con le code dei cavi corrispondenti nella presa di accoppiamento a doppia fila a 10 pin (prese corrispondenti). Premere i perni aperti della presa di accoppiamento nell'auricolare LFP. In questo modo, ogni elettrodo LFP ha un filo di cavo designato nell'assieme.
- Immergere la punta di ciascun elettrodo LFP (la cui resistenza deve essere misurata) in soluzione salina naCl allo 0,9% (concentrazione di NaCl nel sangue). Collegare l'estremità del filo del cavo che corrisponde all'elettrodo LFP al terminale positivo dell'ohmmetro.
- Utilizzare un filo a bassa resistenza (̴100 Ω) con un lato nell'acqua salina e l'altro lato come estremità aperta. Collegare l'estremità aperta del filo a bassa resistenza alla terra del puntatore dell'ohmmetro.
NOTA: questa disposizione completa il circuito e richiede una deflessione del puntatore dell'ohmmetro.
- Utilizzare un filo a bassa resistenza (̴100 Ω) con un lato nell'acqua salina e l'altro lato come estremità aperta. Collegare l'estremità aperta del filo a bassa resistenza alla terra del puntatore dell'ohmmetro.
- Assicurarsi che non vi sia alcun collegamento elettrico tra due elettrodi sull'auricolare. Controllare l'isolamento elettrico degli elettrodi LFP a coppie (messa a terra: un cavo corrisponde a un elettrodo; positivo: un altro cavo corrisponde a un altro elettrodo). Scartare gli elettrodi se in questo caso si osserva una deflessione.
Risultati
In questo lavoro, i microelettrodi LFP sono stati utilizzati per mappare la diffusione del sequestro attraverso i gangli della base11. Le registrazioni LFP simultanee sono state eseguite dalla corteccia premotoria destra (dove si trovava il focus delle convulsioni) e dal VL, striato e SNR sinistro (Figura 4). L'inizio del sequestro è stato identificato come deflessione della traccia di tensione almeno il doppio della linea di base (Figura 4A
Discussione
Storicamente, gli array di microelettrodi sono stati ampiamente utilizzati per registrare l'attività neuronale da una specifica regione cerebrale di interesse 2,3,4,5,6,7,8,9,13. Tuttavia, il nostro facile design a microe...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato supportato dal National Institute of Health (RO1 NS120945, R37NS119012 to JK) e dall'UVA Brain Institute.
Materiali
| Name | Company | Catalog Number | Comments |
| Amplifier 16-Channel | A-M Systems | Model 3600 | Amplifier |
| Cranioplasty cement | Coltene | Perm Reeline/Repair Resin Type II Class I Shade - Clear | Cement to hold microelectrodes |
| Cryostat Microtome | Precisionary | CF-6100 | To slice brain |
| Diamel-coatednickel-chromium wire | Johnson Matthey Inc. | 50 µm | Microelectrode wire |
| Dremel | Dremel | 300 Series | To drill holes in mouse skull |
| Epoxy | CEC Corp | C-POXY 5 | Fast setting adhesive |
| Hemostat | Any | To hold the headset | |
| Forceps | Any | To hold microelectrodes | |
| Light microscope | Nikon | SMZ-10 | To see alignment |
| Ohmmeter | Any | To measurre resistance | |
| Pins (Headers and matching Sockets) | Mill-Max | Interconnects, 833 series, 2 mm grid gull wing surface mount headers and sockets | To attach microelectrodes to |
| Polymicro Tubing Kit | Neuralynx | ID 100 ± 04 µm, OD 164 ± 06 µm, coating thickness 12 µm | Glass tubes |
| Pulse Stimulator | A-M Systems | Model 2100 | To mark the microelectrode location at the end of the recordings |
| Scissors | Any | To cut microelectrodes | |
| Superglue | Gorilla | Adhesive | |
| Thick wire 0.008 in. – 0.011 in. | A-M Systems | 791900 | Tick wire to hold the microelectrode array |
| Thin wire 0.005 in. - 0.008 in. | A-M Systems | 791400 | Thin wire for reference and ground |
Riferimenti
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents-EEG, ECoG, LFP and spikes. Nature Reviews Neuroscience. 13, 407-420 (2012).
- Hubel, D. H., Wiesel, T. N. Receptive fields of single neurones in the cat's striate cortex. The Journal of Physiology. 148 (3), 574-591 (1959).
- O'Keefe, J. Place units in the hippocampus of the freely moving rat. Experimental Neurology. 51 (1), 78-109 (1976).
- Fyhn, M., Molden, S., Witter, M. P., Moser, E. I., Moser, M. B. Spatial representation in the entorhinal cortex. Science. 305 (5688), 1258-1264 (2004).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nature Neuroscience. 7, 446-451 (2004).
- Buckmaster, P. S., Edward Dudek, F. In vivo intracellular analysis of granule cell axon reorganization in epileptic rats. Journal of Neurophysiology. 81 (2), 712-721 (1999).
- Driscoll, N., et al. Multimodal in vivo recording using transparent graphene microelectrodes illuminates spatiotemporal seizure dynamics at the microscale. Communications Biology. 4, 1-14 (2021).
- Roy, D. S., et al. Memory retrieval by activating engram cells in mouse models of early Alzheimer's disease. Nature. 531, 508-512 (2016).
- Igarashi, K. M., Lu, L., Colgin, L. L., Moser, M. B., Moser, E. I. Coordination of entorhinal-hippocampal ensemble activity during associative learning. Nature. 510, 143-147 (2014).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Brodovskaya, A., Shiono, S., Kapur, J. Activation of the basal ganglia and indirect pathway neurons during frontal lobe seizures. Brain. 144 (7), 2074-2091 (2021).
- Ren, X., Brodovskaya, A., Hudson, J. L., Kapur, J. Connectivity and neuronal synchrony during seizures. The Journal of Neuroscience. 41 (36), 7623-7635 (2021).
- Chang, E. H., Frattini, S. A., Robbiati, S., Huerta, P. T. Construction of microdrive arrays for chronic neural recordings in awake behaving mice. Journal of Visualized Experiments. (77), e50470 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon