Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Aufbau von lokalen Feldpotential-Mikroelektroden für in vivo Aufnahmen aus mehreren Gehirnstrukturen gleichzeitig
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll beschreibt die Konstruktion von maßgeschneiderten Mikroelektrodenarrays, um lokale Feldpotentiale in vivo aus mehreren Gehirnstrukturen gleichzeitig aufzuzeichnen.
Zusammenfassung
Forscher müssen oft lokale Feldpotentiale (LFPs) gleichzeitig von mehreren Gehirnstrukturen erfassen. Die Aufzeichnung aus mehreren gewünschten Hirnregionen erfordert unterschiedliche Mikroelektrodendesigns, aber kommerziell erhältliche Mikroelektrodenarrays bieten oft keine solche Flexibilität. Hier skizziert das vorliegende Protokoll das einfache Design von maßgeschneiderten Mikroelektrodenarrays, um LFPs von mehreren Gehirnstrukturen gleichzeitig in verschiedenen Tiefen aufzuzeichnen. Diese Arbeit beschreibt exemplarisch die Konstruktion der bilateralen kortikalen, striatischen, ventrolateralen thalamischen und nigralen Mikroelektroden. Das skizzierte Designprinzip bietet Flexibilität, und die Mikroelektroden können modifiziert und angepasst werden, um LFPs von jeder Struktur aufzuzeichnen, indem stereotaktische Koordinaten berechnet und die Konstruktion schnell entsprechend geändert wird, um verschiedene Gehirnregionen in frei beweglichen oder betäubten Mäusen anzusprechen. Die Mikroelektrodenmontage erfordert Standardwerkzeuge und -zubehör. Diese kundenspezifischen Mikroelektroden-Arrays ermöglichen es den Ermittlern, Mikroelektroden-Arrays in jeder Konfiguration zu entwerfen, um die neuronale Aktivität zu verfolgen und LFP-Aufzeichnungen mit einer Auflösung von Millisekunden bereitzustellen.
Einleitung
Lokale Feldpotentiale (LFPs) sind die elektrischen Potentiale, die aus dem extrazellulären Raum im Gehirn aufgezeichnet werden. Sie werden durch Ionenkonzentrationsungleichgewichte außerhalb von Neuronen erzeugt und repräsentieren die Aktivität einer kleinen, lokalisierten Population von Neuronen, so dass die Aktivität einer bestimmten Gehirnregion im Vergleich zu den makroskaligen EEG-Aufzeichnungen 1 genau überwachtwerden kann. Als Schätzung entsprechen die LFP-Mikroelektroden, die durch 1 mm getrennt sind, zwei völlig unterschiedlichen Populationen von Neuronen. Während das EEG-Signal von Hirngewebe, Zerebrospinalflüssigkeit, Schädel, Muskeln und Haut gefiltert wird, ist das LFP-Signal ein zuverlässiger Marker für die lokale neuronale Aktivität1.
Forscher müssen oft gleichzeitig LFPs aus mehreren Gehirnstrukturen aufzeichnen, aber kommerziell erhältliche Mikroelektroden-Arrays bieten oft keine solche Flexibilität. Hier beschreibt das vorliegende Protokoll vollständig anpassbare, einfach zu konstruierende Mikroelektroden, um LFPs aus jeder gewünschten Hirnregion in verschiedenen Tiefen gleichzeitig aufzuzeichnen. Obwohl LFPs ausgiebig verwendet wurden, um die neuronale Aktivität einer bestimmten Gehirnregionaufzuzeichnen 2,3,4,5,6,7,8,9, ermöglicht das derzeit leicht anpassbare Design die Aufzeichnung von LFPs aus mehreren oberflächlichen oder tiefen Hirnregionen 11,12 . Das Protokoll kann auch modifiziert werden, um ein beliebiges Mikroelektrodenarray zu konstruieren, indem stereotaktische Koordinaten der Gehirnregionen bestimmt und das Array entsprechend zusammengesetzt wird. Diese Mikroelektroden mit einer Abtastrate von 10 kHz und einem Widerstand von 60-70 kΩ (2 cm Länge) ermöglichen es uns, LFPs mit einer Genauigkeit von Millisekunden aufzunehmen. Die Daten können dann durch einen 16-Kanal-Verstärker verstärkt, gefiltert (Tiefpass 1 Hz, Hochpass 5 kHz) und digitalisiert werden.
Protokoll
Die vorliegende Arbeit wurde vom Animal Care and Use Committee der University of Virginia genehmigt. Für die Experimente wurden C57Bl/6-Mäuse beiderlei Geschlechts (7-12 Wochen) verwendet. Die Tiere wurden in einem 12 h Hell/12 h Dunkelzyklus gehalten und hatten ad libitum Zugang zu Nahrung und Wasser.
1. Aufbau von Mikroelektroden
- Um die Mikroelektroden zu konstruieren, verwenden Sie 50 μm (Durchmesser) diamellbeschichteten Nickel-Chrom-Draht (siehe Materialtabelle). Kleben Sie ein Ende des Drahtes an der Rückseite der Plattform ab, und wickeln Sie den Draht dreimal um den nächstgelegenen Knopf auf der Plattform (Abbildung 1A,C).
HINWEIS: Hier wurde eine Acrylplattform mit zwei Knöpfen (2 x 5 Zoll) verwendet, aber jede Plattform kann verwendet werden.- Strecken Sie den Draht um den am weitesten entfernten zweiten Knopf, um zwei Schlaufen zwischen den Knöpfen zu machen. Wickeln Sie den Draht noch drei weitere Male um den ersten Knopf, um den Draht an Ort und Stelle zu befestigen, und kleben Sie das Ende wieder an der Rückseite der Plattform.
HINWEIS: Nachdem die Drähte getrennt wurden (Schritte 1.2-1.3.1), müssen sich auf jeder Seite zwei Drähte befinden (insgesamt vier Drähte, Abbildung 1B).
- Strecken Sie den Draht um den am weitesten entfernten zweiten Knopf, um zwei Schlaufen zwischen den Knöpfen zu machen. Wickeln Sie den Draht noch drei weitere Male um den ersten Knopf, um den Draht an Ort und Stelle zu befestigen, und kleben Sie das Ende wieder an der Rückseite der Plattform.
- Platzieren Sie die Spannstangen unter den Drähten, wobei das Band um sie gewickelt ist (klebrige Seite nach oben) (Abbildung 1C).
HINWEIS: Für die Spannstangen wurden dreieckige Acrylstücke verwendet, um die Klebeband gewickelt war (klebrige Seite außen, um die Drähte zu befestigen). Die klebrige Seite des Bandes außerhalb der Spannstangen hält die Drähte an Ort und Stelle, um den Abstand zwischen ihnen einzustellen. Die Zugstäbe müssen ~ 2,5 cm von den Knöpfen entfernt sein, und die Drähte dürfen nicht locker sein. - Machen Sie mit einem Mikroskop und einer feinen Pinzette entweder einen Abstand von 3 mm oder 4,5 mm zwischen den Drähten (3 mm Abstand zwischen den Drähten, um kortikale (Ctx) - ventrolaterale Thalamuskern (VL) Mikroelektroden herzustellen; 4,5 mm Spalt zur Herstellung von striatalen (Str) - nigralen (SNR) Mikroelektroden) (Abbildung 1B).
- Wenn am Mikroskop eine Vergrößerung verwendet wird, stellen Sie sicher, dass Sie den Unterschied in der Vergrößerung und den tatsächlichen Abstand zwischen den Drähten berechnen und anpassen.
HINWEIS: Wenn Mikroelektroden für andere als die hier verwendeten Strukturen konstruiert werden, muss der Abstand zwischen den Drähten an den stereotaktischen Abstand zwischen den Strukturen angepasst werden. Abbildung 2B zeigt ein Beispiel für die Organisation der Drähte. Dementsprechend müssen die stereotaktischen Koordinaten für andere Strukturen angepasst werden.
- Wenn am Mikroskop eine Vergrößerung verwendet wird, stellen Sie sicher, dass Sie den Unterschied in der Vergrößerung und den tatsächlichen Abstand zwischen den Drähten berechnen und anpassen.
- Schneiden Sie vier kleine Kunststoffstücke (0,5 mm dick) ~6 mm (Breite) x 3 mm (Höhe) (Abbildung 1C).
HINWEIS: Alle Kunststoffteile können verwendet werden, solange sie 0,5 mm dick sind; Hier wurden quadratische Schläuche verwendet, in denen die Stifte verkauft wurden (Pins, siehe Materialtabelle). Wenn eine andere Dicke verwendet wird, fügen Sie bitte mehr oder weniger Kunststoffteile hinzu, um die erforderlichen stereotaktischen Koordinaten zu passen. - Tragen Sie Kleber (siehe Materialtabelle) auf den Kunststoff auf und legen Sie ihn auf die Drähte (Abbildung 1C). Legen Sie Kunststoffteile ~ 1,0 cm von der Mitte des Drahtes entfernt, die 1,0 cm von der Zugstange entfernt ist. Entfernen Sie den überschüssigen Sekundenkleber mit einem Wattestäbchen.
- Nachdem der Sekundenkleber getrocknet ist, schneiden Sie die Drähte mit einer feinen Schere in der in Abbildung 1C angegebenen Reihenfolge.
- Schneiden Sie vier 7-mm-Glasröhren mit einem handelsüblichen Kit (siehe Materialtabelle) und setzen Sie die Elektrodendrähte in die Glasröhren ein, wie in Abbildung 2A dargestellt.
- Führen Sie VL- und SNR-Elektrodenpaare in die Glasröhren ein.
HINWEIS: Nur die Drähte für tiefe Strukturen müssen in die Glasröhren eingeführt werden, um die chirurgische Implantation zu unterstützen. Achten Sie darauf, keine kortikalen Elektroden in das Glasröhrchen einzuführen.
- Führen Sie VL- und SNR-Elektrodenpaare in die Glasröhren ein.
- Legen Sie den Kleber an die Basis der Glasröhren, um sie mit dem Kunststoff zu verbinden. Warten Sie einige Zeit, bis der Kleber trocknet.
- Die Glasröhren und Drähte werden mit einem Skalpell geschnitten, wie in Tabelle 1 angegeben; Stellen Sie sicher, dass die Längen der Mikroelektroden korrekt sind. Wenn die Mikroelektroden auf unterschiedliche Strukturen abzielen, passen Sie den Schnittabstand entsprechend den erforderlichen stereotaktischen Koordinaten an.
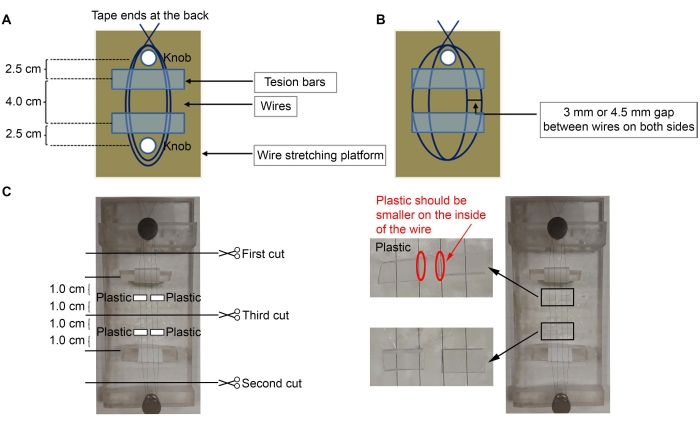
Abbildung 1: Schematische Darstellung des Mikroelektrodenaufbaus . (A) Aufbau von Drähten auf der Plattform mit Zugstäben unterhalb der Drähte. (B) Der Abstand zwischen den Drähten. (C) Vier Stück Kunststoff werden auf die Drähte geklebt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| ctx | Str | VL | SNR | |
| AP (Vorder-/Hinterseite) | 2.2 | 1.2 | -1.3 | -3.3 |
| ML (Medial/Lateral) | 1.8 | 1.5 | 1 | 1.5 |
| DV (Dorsal/Ventral) | 0.5 | 3.5 | 4 | 4.75 |
| Elektrodenlänge | 4 | 4.75 | 5.25 | 6 |
Tabelle 1: Stereotaktische Implantationskoordinaten und Abmessungen der Mikroelektroden.
2. Mikroelektroden-Array-Baugruppe
- Verwenden Sie den Kleber, um Kunststoffe in der gewünschten Reihenfolge der Zielregionen zu befestigen. Ein Beispiel für kortikale, thalamische, striatale und nigrale Elektroden ist in Abbildung 2B,C dargestellt.
- Platzieren Sie das Ctx-VL-Elektrodenpaar mit der Vorderseite nach unten (die Seite mit Elektrodendrähten muss nach unten zeigen) und verbinden Sie zwei 6 mm x 3 mm leere Kunststoffstücke oben mit Klebstoff.
- Legen Sie das zweite Ctx-VL-Elektrodenpaar auf die drei Kunststoffteile mit den nach oben gerichteten Elektroden (verwenden Sie ein Mikroskop und stellen Sie sicher, dass die VL-Elektroden ausgerichtet sind).
HINWEIS: Die Ausrichtung der bilateralen Elektroden (hier die Ausrichtung der linken und rechten VL-Elektroden) ist unerlässlich, um die gewünschten bilateralen Strukturen angemessen anzusprechen. - Verwenden Sie den Kleber, um die SNR-Elektroden oben mit den SNR-Elektroden 2,0 mm von den VL-Elektroden und ~ 5,0 mm von den kortikalen Elektroden entfernt zu befestigen (die SNR-Elektrodendrähte müssen nach oben zeigen).
- Wiederholen Sie Schritt 2.1.3. für die andere Seite (die SNR-Elektrodendrähte müssen außerhalb des Mikroelektrodenarrays zugewandt sein).
- Tragen Sie Epoxidharz um den Kunststoff auf, um die Elektroden miteinander zu verbinden. Vermeiden Sie es, Epoxidharz auf die Elektroden zu geben.
- Nehmen Sie einen dicken Draht und machen Sie eine Schleife an einem Ende. Tauchen Sie die Schlaufe in die Epoxidlösung und legen Sie sie auf den Kunststoff, um sicherzustellen, dass der dicke Draht flach liegt (Abbildung 2D), damit dieser Draht für die nächsten Schritte als Griff verwendet werden kann. Warten Sie, bis die Elektroden vollständig trocken sind.
- Schneiden Sie die Drähte auf 2 cm ab, wie in Abbildung 2E dargestellt.
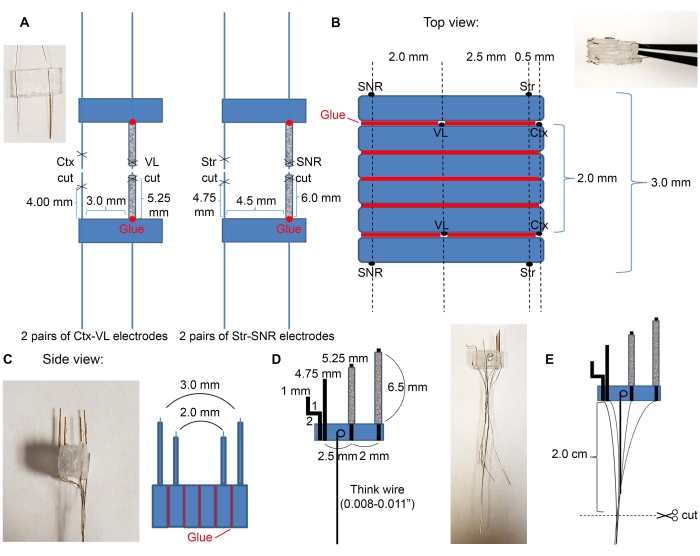
Abbildung 2: Aufbau und Abmessungen der Mikroelektroden. (A) Vier Elektrodenpaare, die gebildet wurden, nachdem die Drähte mit einer Schere geschnitten wurden, wie in Abbildung 1C dargestellt (2 Paare von Ctx-VL-Elektroden und 2 Paare von Str-SNR-Elektroden). Führen Sie Tiefenstrukturelektroden (VL und SNR) in die Glasröhren ein und kleben Sie ihre Basen auf Kunststoff (rote Punkte). (B) Draufsicht: Die Elektrodenpaare von (A) werden in einen Stapel geklebt, um den Mikroelektrodenkern zu erzeugen. Rote Linien zeigen Klebelinien an. (C) Vordere Seitenansicht von (B). (D) Der dicke Draht war an den Mikroelektroden befestigt. (E) Die Drähte werden wie angegeben gruppiert, und die isolierten Enden werden abgekratzt und in 2 cm geschnitten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
3. Mikroelektrodenverbindung zum Headset
- Gruppieren Sie die Drähte wie in Abbildung 2E dargestellt und kratzen Sie 1 mm der isolierten Enden mit einem Skalpell ab.
- Biegen Sie die kortikalen Elektroden, wie in Abbildung 3A dargestellt. Trennen Sie die Drähte wie in Abbildung 3B dargestellt. Machen Sie mit einer feinen Pinzette eine Schleife am Ende jedes Drahtes (Abbildung 3B).
- Halten Sie ein 10-poliges Headset mit einem Hämostat (siehe Materialtabelle) und verwenden Sie das Holzende eines Wattestäbchens, um minimale Mengen an Flussmittel auf die Stifte aufzutragen (Abbildung 3C). Stellen Sie sicher, dass kein Flussmittel außerhalb der Pins platziert wird, um einen Kurzschluss zwischen den Pins zu vermeiden.
- Verwenden Sie das Holzende eines Wattestäbchens, um Flussmittel auf die Drahtschlaufen aufzutragen.
- Löten Sie die Kabelschlaufen an das 10-polige Headset, wie in Abbildung 3C dargestellt. Trocknen Sie das Headset nach dem Löten, um einen Kurzschluss zwischen den Pins zu vermeiden.
- Nehmen Sie einen dünnen Draht (0,005-0,008 Zoll) für die Referenz- und Erdungsdrähte und entfernen Sie den Kunststoff von einem Ende. Machen Sie eine Schleife am anderen Ende des Drahtes.
- Löten Sie die abisolierte Seite der Referenz- und Massedrähte an die jeweiligen Stifte (Abbildung 3A,C).
- Halten Sie den dicken Draht fest (Abbildung 2D), tragen Sie Kranioplastikzement um die Mikroelektroden auf, insbesondere dort, wo die Drähte mit den Stiften verbunden sind. Vermeiden Sie es, die eigentlichen Elektrodenenden mit dem Zement zu berühren.
- Nachdem der Zement getrocknet ist, legen Sie Epoxidharz an die Basis der Glasröhren, der striatalen Mikroelektrodendrähte und der gesamten Elektrode. Vermeiden Sie es, die eigentlichen Elektrodenenden mit Epoxidharz zu berühren. Warten Sie, bis die Elektroden vollständig trocken sind.
- Die Elektroden sind fertig. Bohren Sie Löcher in den Schädel der Maus (gemäß den erforderlichen stereotaktischen Koordinaten) mit einem Zahnbohrer und implantieren Sie das Headset wie in Abbildung 3D gezeigt, indem Sie das Headset mit Mikroelektroden zum Schädel und den entsprechenden Löchern hin absenken. Das Headset könnte zur Unterstützung während der Implantation am stereotaktischen Arm befestigt werden.
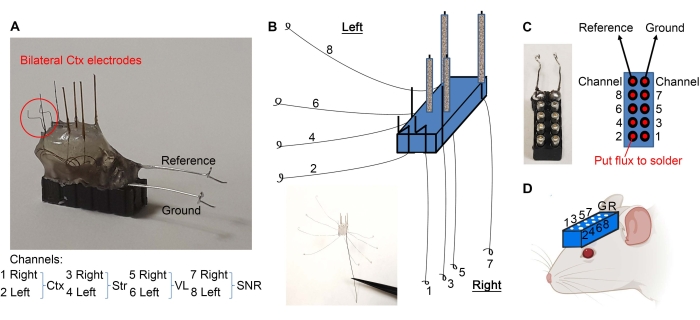
Abbildung 3: Mikroelektrodenimplantation. (A) Die kortikalen Elektroden sind wie angegeben gebogen. (B) Die Drähte werden getrennt, um Schleifen an den Enden zu bilden. (C) Das Flussmittel (an den roten Punkten) und die Schlingendrähte werden mit dem 10-poligen Headset verlötet, um sicherzustellen, dass jedes Kabel zu seinem entsprechenden Pin geht. (D) Das Headset wird implantiert, um LFPs aufzuzeichnen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
4. Markieren der Elektrodenposition nach Aufnahmen
- Bestätigen Sie am Ende der LFP-Aufzeichnungen die korrekte Position der Elektroden im Zielbereich, indem Sie einen Strom an den Elektrodenspitzen anlegen, um eine Läsion zu erzeugen, und 30 Minuten warten, bevor Sie die Maus durchbluten.
HINWEIS: Läsionseinstellungen zur Bestätigung der Position der Elektrodenspitzen: Single burst, 40 μA, 0,75 ms monophasischer Rechteckwellenpuls, 50 Hz, 30 s. - Betäuben Sie die Mäuse mit Isofluran (bis die Maus einschlief) undperfundierten Sie 10 transkardial mit 4% Paraformaldehyd (PFA) in 0,1 M Natriumphosphatpuffer. Schneiden Sie das Gehirn (40 μm dick) auf einen Kryostaten (siehe Materialtabelle) und färben Sie es mit DAPI (0,02% in PBS). Bestätigen Sie die korrekte Position der Elektroden durch das Vorhandensein der Elektrodenspitzenläsionen, wie in Abbildung 4B,C gezeigt.
HINWEIS: Der Prozentsatz des Isoflurans muss gemäß den Richtlinien der einzelnen Institutionen angewendet werden.
5. Messung des Elektrodenwiderstandes
- Messen Sie den Widerstand der Elektroden und überprüfen Sie den Kurzschluss zwischen den Elektroden mit einem Mehrbereichs-Ohmmeter (siehe Materialtabelle). Stellen Sie die Widerstandsskala auf R x 10.000 ein, was darauf hinweist, dass eine Einheitsauslenkung im Zeiger einem Widerstand von 1 kΩ entspricht. 2 cm lange Elektroden müssen einen Widerstand von 60-70 kΩ haben.
- Passen Sie das Headset an, indem Sie zehn einzelne Pins nehmen (siehe Materialtabelle). Löten Sie jeden Stift mit einem dünnen, mehradrigen Kupferdraht in einem Kabel.
- Drücken Sie die gelöteten Stifte mit den entsprechenden Kabelendeln in die 10-polige zweireihige Gegensteckbuchse (passende Buchsen). Drücken Sie die offenen Pins der Gegensteckdose in das LFP-Headset. Auf diese Weise hat jede LFP-Elektrode einen designierten Kabeldraht in der Baugruppe.
- Tauchen Sie die Spitze jeder LFP-Elektrode (deren Widerstand gemessen werden soll) in 0,9% NaCl-Kochsalzlösung (NaCl-Konzentration im Blut). Verbinden Sie das Kabeldrahtende, das der LFP-Elektrode entspricht, mit dem Pluspol des Ohmmeters.
- Verwenden Sie einen Draht mit niedrigem Widerstand ( ̴100 Ω) mit einer Seite im Salzwasser und der anderen Seite als offenes Ende. Verbinden Sie das offene Ende des widerstandsarmen Drahtes mit der Masse des Ohmmeterzeigers.
HINWEIS: Diese Anordnung vervollständigt die Schaltung und führt zu einer Ablenkung des Ohmmeterzeigers.
- Verwenden Sie einen Draht mit niedrigem Widerstand ( ̴100 Ω) mit einer Seite im Salzwasser und der anderen Seite als offenes Ende. Verbinden Sie das offene Ende des widerstandsarmen Drahtes mit der Masse des Ohmmeterzeigers.
- Stellen Sie sicher, dass keine elektrische Verbindung zwischen zwei Elektroden am Headset besteht. Überprüfen Sie die elektrische Isolierung von paarweisen LFP-Elektroden (Masse: ein Kabel entspricht einer Elektrode; positiv: ein anderes Kabel entspricht einer anderen Elektrode). Entsorgen Sie die Elektroden, wenn in diesem Fall eine Durchbiegung beobachtet wird.
Ergebnisse
In dieser Arbeit wurden die LFP-Mikroelektroden verwendet, um die Anfallsausbreitung durch die Basalganglien11 zu kartieren. Simultane LFP-Aufnahmen wurden vom rechten prämotorischen Kortex (wo sich der Anfallsfokus befand) und der linken VL, dem Striatum und dem SNR durchgeführt (Abbildung 4). Der Anfallsbeginn wurde als Ablenkung der Spannungsspur identifiziert, die mindestens doppelt so hoch war wie der Ausgangswert (Abbildung 4A, ro...
Diskussion
In der Vergangenheit wurden Mikroelektroden-Arrays häufig verwendet, um neuronale Aktivität aus einer bestimmten Gehirnregion von Interesseaufzuzeichnen 2,3,4,5,6,7,8,9,13. Unser einfaches Mikroelektrodendesign ermöglic...
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Arbeit wurde vom National Institute of Health (RO1 NS120945, R37NS119012 bis JK) und dem UVA Brain Institute unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Amplifier 16-Channel | A-M Systems | Model 3600 | Amplifier |
| Cranioplasty cement | Coltene | Perm Reeline/Repair Resin Type II Class I Shade - Clear | Cement to hold microelectrodes |
| Cryostat Microtome | Precisionary | CF-6100 | To slice brain |
| Diamel-coatednickel-chromium wire | Johnson Matthey Inc. | 50 µm | Microelectrode wire |
| Dremel | Dremel | 300 Series | To drill holes in mouse skull |
| Epoxy | CEC Corp | C-POXY 5 | Fast setting adhesive |
| Hemostat | Any | To hold the headset | |
| Forceps | Any | To hold microelectrodes | |
| Light microscope | Nikon | SMZ-10 | To see alignment |
| Ohmmeter | Any | To measurre resistance | |
| Pins (Headers and matching Sockets) | Mill-Max | Interconnects, 833 series, 2 mm grid gull wing surface mount headers and sockets | To attach microelectrodes to |
| Polymicro Tubing Kit | Neuralynx | ID 100 ± 04 µm, OD 164 ± 06 µm, coating thickness 12 µm | Glass tubes |
| Pulse Stimulator | A-M Systems | Model 2100 | To mark the microelectrode location at the end of the recordings |
| Scissors | Any | To cut microelectrodes | |
| Superglue | Gorilla | Adhesive | |
| Thick wire 0.008 in. – 0.011 in. | A-M Systems | 791900 | Tick wire to hold the microelectrode array |
| Thin wire 0.005 in. - 0.008 in. | A-M Systems | 791400 | Thin wire for reference and ground |
Referenzen
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents-EEG, ECoG, LFP and spikes. Nature Reviews Neuroscience. 13, 407-420 (2012).
- Hubel, D. H., Wiesel, T. N. Receptive fields of single neurones in the cat's striate cortex. The Journal of Physiology. 148 (3), 574-591 (1959).
- O'Keefe, J. Place units in the hippocampus of the freely moving rat. Experimental Neurology. 51 (1), 78-109 (1976).
- Fyhn, M., Molden, S., Witter, M. P., Moser, E. I., Moser, M. B. Spatial representation in the entorhinal cortex. Science. 305 (5688), 1258-1264 (2004).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nature Neuroscience. 7, 446-451 (2004).
- Buckmaster, P. S., Edward Dudek, F. In vivo intracellular analysis of granule cell axon reorganization in epileptic rats. Journal of Neurophysiology. 81 (2), 712-721 (1999).
- Driscoll, N., et al. Multimodal in vivo recording using transparent graphene microelectrodes illuminates spatiotemporal seizure dynamics at the microscale. Communications Biology. 4, 1-14 (2021).
- Roy, D. S., et al. Memory retrieval by activating engram cells in mouse models of early Alzheimer's disease. Nature. 531, 508-512 (2016).
- Igarashi, K. M., Lu, L., Colgin, L. L., Moser, M. B., Moser, E. I. Coordination of entorhinal-hippocampal ensemble activity during associative learning. Nature. 510, 143-147 (2014).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Brodovskaya, A., Shiono, S., Kapur, J. Activation of the basal ganglia and indirect pathway neurons during frontal lobe seizures. Brain. 144 (7), 2074-2091 (2021).
- Ren, X., Brodovskaya, A., Hudson, J. L., Kapur, J. Connectivity and neuronal synchrony during seizures. The Journal of Neuroscience. 41 (36), 7623-7635 (2021).
- Chang, E. H., Frattini, S. A., Robbiati, S., Huerta, P. T. Construction of microdrive arrays for chronic neural recordings in awake behaving mice. Journal of Visualized Experiments. (77), e50470 (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten