Method Article
Fijación de tejido embrionario de ratón para análisis citonémico
En este artículo
Resumen
Aquí, se proporciona un protocolo optimizado paso a paso para la fijación, inmunotinción y seccionamiento de embriones para detectar filopodias de señalización especializada llamadas citonemas en tejidos de ratón en desarrollo.
Resumen
El modelado tisular del desarrollo y la homeostasis tisular postdesarrollo dependen de la entrega controlada de señales celulares llamadas morfógenos. Los morfógenos actúan de una manera dependiente de la concentración y el tiempo para especificar distintos programas transcripcionales que instruyen y refuerzan el destino celular. Un mecanismo por el cual se aseguran umbrales apropiados de señalización de morfógenos es a través de la entrega de las proteínas de señalización por filopodias especializados llamados citonemas. Los citonemas son muy delgados (≤200 nm de diámetro) y pueden crecer hasta longitudes de varios cientos de micras, lo que hace que su preservación para el análisis de imágenes fijas sea un desafío. Este artículo describe un método refinado para el manejo delicado de embriones de ratón para fijación, inmunotinción y sección gruesa para permitir la visualización de citonemas utilizando microscopía confocal estándar. Este protocolo se ha utilizado con éxito para visualizar citonemas que conectan distintos compartimentos de señalización celular durante el desarrollo del tubo neural del ratón. La técnica también se puede adaptar para detectar citonemas en todos los tipos de tejido para facilitar el interrogatorio de la señalización del desarrollo a una resolución sin precedentes.
Introducción
El desarrollo embrionario se orquesta a través de la activación coordinada de las vías de señalización del morfógeno. Los morfógenos son proteínas pequeñas y secretadas que se clasifican en Sonic Hedgehog (SHH), factor de crecimiento transformador β (TGF-β) / proteína morfogénica ósea (BMP), sitio de integración sin alas (WNT) y familias de fibroblastos y factor de crecimiento epidérmico (FGF / EGF). Los morfógenos se producen y liberan de los centros de organización celular durante el desarrollo del tejido y establecen gradientes de señalización a través de los campos organizadores de las células para informar la morfogénesis tisular 1,2,3,4,5. Una representación de gradientes de morfógenos se encuentra en el sistema nervioso en desarrollo, donde el presunto sistema nervioso central está modelado a través de la activación de la vía del morfógeno. Este tejido, conocido como el tubo neural, está compuesto por gradientes opuestos de SHH secretados por la notocorda más ventral y la placa del piso, y WNT / BMP secretados desde la placa del techo dorsal, para modelar distintas regiones progenitoras neurales6. El tubo neural se usa comúnmente para interrogar la integridad del gradiente de morfógeno en la investigación del desarrollo.
La formación de gradiente de morfógeno se basa en una regulación estricta de la dispersión de la señal7. Un mecanismo celular por el cual esto ocurre es a través de la formación de filopodios de señalización larga llamados citonemas que facilitan la entrega directa de morfógenos de las células productoras de señal a poblaciones celulares objetivo específicas. Se ha observado que los citonemas extienden cientos de micrómetros para depositar morfógenos en las membranas celulares receptoras de señal 8,9. La interrupción del transporte de morfógenos mediado por citonema conduce a anomalías del desarrollo tanto en moscas como en vertebrados, destacando su importancia durante el modelado de tejidos 10,11,12,13,14.
Hasta la fecha, se han documentado citonemas en modelos de Drosophila, polluelos y peces cebra, pero las imágenes de las estructuras en embriones de mamíferos en desarrollo siguen siendo un desafío 8,9,15. Un obstáculo para obtener imágenes efectivas de citonemas en tejidos complejos de mamíferos in situ es su naturaleza delgada y frágil, lo que los hace susceptibles al daño por métodos de fijación convencionales8. Previamente habíamos desarrollado y optimizado protocolos para un fijador de microscopía electrónica modificada (MEM-fix) para preservar citonemas en células cultivadas y permitir su estudio mediante microscopía confocal16,17.
El uso de la técnica MEM-fix ha permitido identificar algunas de las moléculas implicadas en la formación y función del citonema inducida por SHH 11,16,17. Sin embargo, la confirmación de estos hallazgos en el contexto fisiológicamente relevante del patrón del tubo neural requirió el desarrollo de nuevas técnicas para fijar e obtener imágenes del tejido embrionario de ratón. Aquí se describe un protocolo para fijar embriones de ratón de una manera que mantenga la integridad del citonema y permita la inmunotinción y la posterior seccionamiento del tejido embrionario para el análisis confocal. Este protocolo se desarrolló utilizando una proteína fluorescente verde (GFP) atada a la membrana para etiquetar las extensiones de membrana de las células productoras de SHH en el tubo neural en desarrollo. La implementación de este protocolo abordará preguntas sin respuesta relacionadas con la prevalencia y la importancia de los citonemas en el desarrollo de sistemas de mamíferos.
Protocolo
Este protocolo sigue las pautas de cuidado de animales aprobadas por el Comité Institucional de Cuidado y Uso de Animales (IACUC) y St. Jude Children's Research Hospital. Todas las cepas se cruzaron cinco generaciones a la cepa C57BL /6J.
1. Aislamiento embrionario y tinción de montura entera
- Críe hembras de 6 semanas de edad y controle la presencia de tapón vaginal.
- Eutanasia de la presa embarazada por inhalaciónde CO 2 en una cámara de CO2 seguida de luxación cervical de acuerdo con las pautas de AVMA18. Haga una incisión en Y en la cavidad peritoneal usando tijeras y fórceps de disección. Extirpar el útero que contiene los embriones E9.5 según las directrices institucionales aprobadas.
- Diseccionar los embriones en medio de crecimiento completo (Medio Águila Modificada de Dulbecco, suplementado con aminoácidos no esenciales, Na-piruvato, L-glutamina y suero bovino fetal al 10%). Use fórceps para extraer el saco vitelino, la placenta y las membranas circundantes.
NOTA: Cuando sea necesario, guarde cada saco vitelino para el genotipado embrionario. - Enjuague los embriones aislados en la solución de sal equilibrada de Hank (HBSS) para eliminar cualquier tejido amniótico residual y sangre.
- Prepare el fijador. Agregue paraformaldehído (PFA) a HBSS para obtener una concentración final de trabajo de 4% de PFA.
PRECAUCIÓN: El PFA es un químico tóxico, por lo que se debe evitar la inhalación o la exposición directa de la piel. La preparación de la solución fijadora se realiza bajo una campana extractora de humos con el equipo de protección personal adecuado de guantes y una bata de laboratorio. - Agregue 1 ml de fijador a cada pocillo de una placa de 24 pocillos y coloque cada embrión en un pozo individual. Incubar los embriones en fijador durante 45 min con agitación suave en un balancín.
NOTA: Crítico: Todos los lavados e incubaciones deben hacerse con agitación suave (máximo 20 RPM) en un balancín o agitador circular, ya que el manejo abrupto o el movimiento de los embriones destruirán los citonemas fijos. Use una pipeta para quitar suavemente todas las soluciones. - Retire el fijador y lave los embriones 3 x 30 min en solución salina tamponada con fosfato (PBS) con Ca2+ y Mg2+ con Tritón al 0,1% añadido.
- Después del lavado, incube los embriones en solución bloqueadora (PBS con Ca2+ y Mg2+, Tritón al 0,1% y suero de cabra al 5%) con agitación suave. Bloque 2 x 1 h. Después de la segunda incubación de bloqueo, realice un enjuague rápido de los embriones con una solución de bloqueo fresca.
- Durante el segundo paso de bloqueo, prepare la solución primaria de anticuerpos11. Diluya los anticuerpos a la concentración optimizada en PBS con Ca2+ y Mg2+, 0.1% Tween-20 y 5% de suero de cabra.
NOTA: Para una visualización mejorada de la GFP de membrana, se puede utilizar el anti-GFP de pollo (1:250). - Retire la solución de bloqueo y agregue 1 ml de solución de anticuerpos primarios a cada pocillo. Incubar a 4 °C con rotación suave durante 3 días.
- Después de la incubación primaria de anticuerpos, lave los embriones 5 x 1 h a 20 RPM en un balancín en PBS con Ca2+ y Mg2+, 0.1% Tween-20 y 5% suero de cabra.
- Preparar la solución secundaria de anticuerpos utilizando fragmentos secundarios de F(ab')2 a una dilución de 1:1.000 en PBS con Ca2+ y Mg2+, Tween-20 al 0,1% y suero de cabra al 5%.
NOTA: El uso de fragmentos de F(ab')2 mejora en gran medida la penetración de anticuerpos en la muestra. - Agregue 1 ml de solución de anticuerpos secundarios a cada pocillo. Incubar con balanceo suave a 4 °C en la oscuridad durante 3 días.
NOTA: Importante: A partir de este momento, minimice la exposición del embrión a la luz directa. Opcional: Para prevenir el crecimiento bacteriano, agregue azida de sodio al 0,2% a la solución secundaria de anticuerpos. - Retire la solución secundaria de anticuerpos y lave los embriones 3 x 30 min en PBS con Ca2+ y Mg2+, Tween-20 al 0,1% y suero de cabra al 5%. Si no realiza la tinción de actina con faloidina u otros colorantes de actina, después del primer lavado, agregue 4′,6-diamidino-2-fenilindol (DAPI) a PBS con Ca2+ y Mg2+, 0.1% Tween-20 y 5% suero de cabra e incube durante 1 h, seguido de lavados de 3 x 30 min como se describió anteriormente.
NOTA: En este punto, los embriones se pueden almacenar durante la noche a 4 ° C en PBS o HBSS en la oscuridad hasta el paso de incrustación al día siguiente. Sin embargo, se recomienda que los embriones se incrusten y se seccionen inmediatamente.
2. Incrustación, seccionamiento y montaje de embriones
- Prepare una solución de agarosa de bajo punto de fusión (LMP) al 4% p/v disuelta en HBSS o PBS con Ca2+ y Mg2+ hasta un volumen final de ~3 mL por embrión. Agregue el peso apropiado de agarosa LMP a HBSS o PBS con Ca2+ y Mg2+ y microondas hasta que se disuelva la agarosa LMP.
NOTA: Una vez que la agarosa LMP se disuelva, guarde la solución en un baño de cuentas, incubadora o baño de agua a 55 ° C para evitar que la solución de agarosa LMP se solidifique. - Use una placa de 12 pocillos como molde de incrustación para embriones. Coloque la placa de 12 pocillos en el baño de cuentas a 55 °C. Agregue 2.5-3 ml de agarosa LMP al 4% a cada pozo que contendrá un embrión.
NOTA: Aunque se pueden usar otros moldes, los volúmenes de placa de 12 pocillos son óptimos para preparar el bloque de agarosa en etapas posteriores para la sección. - Usando una cuchara perforada, transfiera los embriones a pozos individuales que contengan una solución de agarosa LMP al 4% (Figura 1A).
- Transfiera la placa de 12 pocillos del baño de cuentas a un banco. Use puntas de pipeta para incrustar y orientar suavemente el embrión para que esté centrado dentro de la solución. Una vez que los embriones estén orientados, coloque la placa a -20 ° C durante 10 minutos para permitir una solidificación rápida del bloque.
CRÍTICO: Asegúrese de que el embrión esté colocado en el centro del bloque. Los embriones que se hunden hasta el fondo o están demasiado cerca del borde del molde probablemente serán desalojados del bloque de agarosa mientras se seccionan.
- Transfiera la placa de 12 pocillos del baño de cuentas a un banco. Use puntas de pipeta para incrustar y orientar suavemente el embrión para que esté centrado dentro de la solución. Una vez que los embriones estén orientados, coloque la placa a -20 ° C durante 10 minutos para permitir una solidificación rápida del bloque.
- Retire todo el bloque de agarosa del pozo con un bisturí y corte un bloque rectangular alrededor del embrión dejando ~ 0,3 cm de bloque en cada lado. Permita una longitud adicional a lo largo del extremo caudal del embrión. Cuando esté montado en el vibratomo, oriente el embrión en posición vertical en la sección superior del bloque (Figura 1B).
- Aplicar una tira de cinta adhesiva al portamuestras del vibratomo y superponer el bloque de agarosa a la cinta, orientado así la cuchilla generará secciones axiales del embrión en una secuencia anterior (craneal) a posterior.
- Llene la cámara del vibratomo con HBSS frío para asegurarse de que la muestra esté completamente sumergida y luego rodee la cámara con hielo.
- Ajuste la velocidad del vibratomo a 0,2 mm/s y la frecuencia entre 5 y 7 (50-70 Hz) con un grosor de corte ajustado a 100 μm. Realizar seccionamiento axial en serie del embrión.
NOTA: Utilice una velocidad lenta para la seccionamiento. Si la velocidad de corte aumenta por encima de 0,25 mm/s, la seccionamiento puede desgarrar el embrión o desalojar el embrión del bloque.- Durante la serie de seccionamiento, use fórceps para transferir suavemente secciones individuales a un plato separado de 60 mm lleno de HBSS. Use fórceps para agarrar el bloque, no el tejido, para evitar el daño tisular y la destrucción de los citonemas.
NOTA: Las secciones de tejido deben permanecer dentro del bloque de agarosa. Si el tejido cae fuera del bloque hacia la cámara vibratome, transfiera suavemente levantando la sección. No agarre ni pellizque el tejido. CRÍTICO: Cualquier plegamiento de secciones de tejido o manejo abrupto destruirá citonemas fijos en las secciones de tejido.
- Durante la serie de seccionamiento, use fórceps para transferir suavemente secciones individuales a un plato separado de 60 mm lleno de HBSS. Use fórceps para agarrar el bloque, no el tejido, para evitar el daño tisular y la destrucción de los citonemas.
- Si no realiza la tinción de F-actina, continúe con el paso 2.10.
- Para realizar la tinción de F-actina, retire el HBSS e incube las secciones durante 40 min con actina-red y solución dapi diluida en PBS con Ca2+ y Mg2+, Tween-20 al 0,1% y suero de cabra al 5% a temperatura ambiente.
- Lavar secciones 3 x 20 min en PBS con Ca2+ y Mg 2+ y Tween-20 al 0,1%.
- Usando un rotulador hidrofóbico, dibuje una barrera hidrofóbica alrededor de los bordes de un portaobjetos de microscopio cargado y agregue un pequeño volumen de HBSS para llenar el área.
- Use fórceps o una cuchara perforada para transferir secciones a la diapositiva.
NOTA: Cualquier sección de tejido que no esté recubierta de agarosa se puede transferir a través de una pipeta de transferencia. - Retire el exceso de bloque de agarosa con fórceps.
- Una vez que todas las secciones se hayan transferido a la diapositiva, retire el exceso de líquido a través del pipeteo y la esquina de una toallita absorbente, y luego agregue varias gotas de medio de montaje a la diapositiva. Use suficiente medio de montaje para cubrir toda el área de la cubierta cuando se cure. Monte el cubrebocas colocándolo suavemente en la diapositiva.
NOTA: Evite aplicar presión o perturbar el deslizamiento hasta que el medio de montaje se haya curado.
3. Imágenes
- Realizar imágenes de secciones de tejido en cualquier microscopio confocal o de mayor resolución11. Analizar un mínimo de tres embriones por genotipo.
NOTA: Las imágenes de las secciones de tejido se adquirieron utilizando un microscopio confocal TCS SP8 STED 3x, seguido de la deconvolución LIGHTNING.
Resultados
El uso de un molde más grande de una placa de 12 pocillos con 2.5-3 ml de solución de agarosa por pocillo fue ideal para incrustar y suspender varios embriones durante un corto período de tiempo (Figura 1A). El área de exceso permite una orientación correcta al cortar el bloque de agarosa para la sección. Al cortar el bloque de agarosa, es importante mantener el exceso de agarosa a lo largo de la parte inferior del bloque, donde se pegará a la cinta en el soporte del objeto. El embrión debe estar en la mitad superior del bloque (Figura 1B). Sin embargo, la sección inferior no debe ser demasiado grande, ya que el exceso de bloque aumenta las posibilidades de alterar el ángulo de corte a medida que la cuchilla empuja hacia el bloque mientras se secciona. Se muestran ejemplos de secciones correctamente orientadas (Figura 1C,D).
Durante el desarrollo de este protocolo, la sección del vibratomo se comparó con la sección de criostato. La seccionamiento del criostato del tejido rara vez conserva extensiones celulares (Figura 2 criostato y Figura 3A, B vibratomo). Las secciones de criostato permitieron la detección de algunos fragmentos de membrana GFP positivos entre las células de la notocorda y el tubo neural (figura 2A punta de flecha) y entre las células adyacentes del tubo neural (figura 2B, puntas de flecha B' ). Sin embargo, la tinción de F-actina de las extensiones celulares en las células mesenquimales altamente filamentosas que rodean el tubo neural se vio afectada en las secciones de criostato (Figura 2C, flecha C' , vs Figura 3C, D). Estos resultados de criostato indican que solo quedan algunos rastros de extensiones celulares rotas siguiendo este método. Por lo tanto, se prefiere la sección del vibratoma para preservar eficientemente estas delicadas extensiones para su posterior análisis.
La interrupción mínima de todo el embrión y las secciones de tejido individuales es esencial para obtener imágenes de alta calidad de las extensiones celulares. Las secciones de tejido que han sufrido algún plegamiento o pandeo serán evidentes por la ausencia de la notocorda o una gran separación (>30 μm) entre la notocorda y la placa del piso ventral del tubo neural (Figura 3B). Esto generalmente se acompaña de pérdida de células mesenquimales que normalmente rodean el tubo neural (Figura 3A, flecha). Las secciones dañadas también resultarán en una pérdida de extensiones de membrana celular visibles que migran entre las células epiteliales (Figura 3B en comparación con la Figura 3A, puntas de flecha). Incluso distorsiones menores en las secciones pueden causar la fragmentación de las extensiones basadas en actina y la formación de grandes espacios entre las celdas (Figura 3D, puntas de flecha, en comparación con la Figura 3C bien conservada), lo que subraya la necesidad de un manejo delicado en todos los pasos.
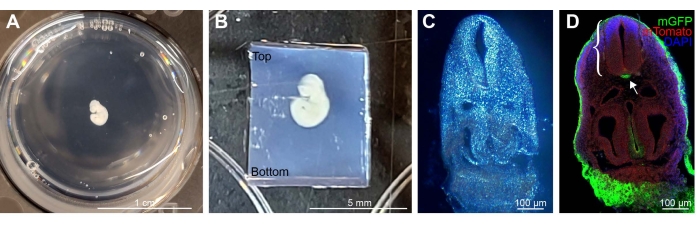
Figura 1: Ejemplo de E9.5 Shh-Cre; Rosa26 mTmG embrión teñido, incrustado y seccionado. (A) Un solo embrión en una placa de 12 pocillos, incrustado en agarosa LMP al 4%. (B) Ejemplo de un embrión correctamente orientado dentro del bloque de agarosa cortado a medida para el montaje del vibratomo. El exceso de bloque de agarosa está presente a lo largo de la parte inferior. (C) Imagen de campo brillante de sección embrionaria de 100 μm de espesor incrustada en agarosa LMP. (D) Imágenes de inmunofluorescencia de una sección después de la extracción de agarosa. MGFP teñido con anti-GFP (verde) representa células que expresan Shh en el tejido, con otros linajes celulares que expresan tomate de membrana (rojo), DAPI en azul. El tubo neural (corchete) y la notocorda mGFP positiva (flecha) son claramente visibles. Barras de escala = 1 cm (A), 5 mm (B) y 100 μm (C,D). Abreviaturas: LMP = bajo punto de fusión; mGFP = proteína fluorescente verde de membrana; Shh = Erizo sónico; DAPI = 4',6-diamidino-2-fenilindol. Haga clic aquí para ver una versión más grande de esta figura.
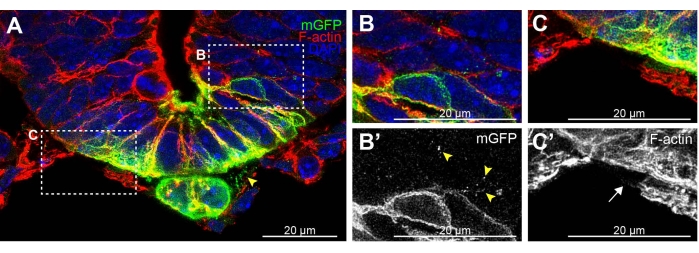
Figura 2: Ejemplo de placa de piso y notocorda del tubo neural seccionada con criostato con extensiones de membrana fragmentadas. (A) E9.5 Shh-Cre de 20 μm de espesor; Rosa26 mTmG 19,20,21 sección teñida para GFP (verde), F-actina (rojo) y DAPI (azul). Los puntos mGFP son visibles entre la notocorda y la placa del piso (punta de flecha) y (B, B') que migran entre las células adyacentes del tubo neural. (C,C') La tinción de F-actina no detecta ningún citonema claro en las células mesenquimales que rodean el tubo neural (flecha). Barras de escala = 20 μm. Abreviaturas: mGFP = proteína fluorescente verde de membrana; Shh = Erizo sónico; DAPI = 4',6-diamidino-2-fenilindol. Haga clic aquí para ver una versión más grande de esta figura.
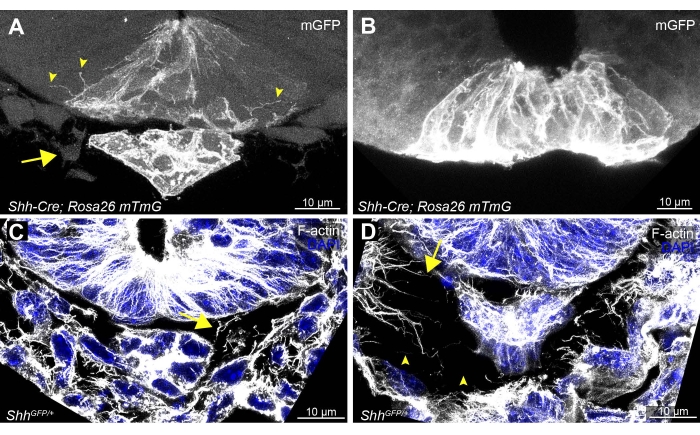
Figura 3: Ejemplos de secciones de tejido vibratome óptimas y subóptimas y tinción de la placa del piso del tubo neural, notocorda y células circundantes. Ejemplos de secciones delicadamente manejadas (A, C), en comparación con (B) una sección de tejido plegado y (D) una sección mal manejada de un Shh-Cre; Rosa26 mTmG y un embrión ShhGFP/+ 19,20,21. Las secciones manejadas de manera óptima permiten la detección de citonemas entre las células epiteliales neurales de la placa del piso localizadas adyacentemente (A, puntas de flecha). El tubo neural adyacente a la notocorda (A, que expresa mGFP) y las células mesenquimales (A, flecha) deben ser visibles. (C,D) Las secciones teñidas con F-actina y DAPI deben tener un espaciado consistente de las células mesenquimales y citonemas (flechas) basadas en F-actina que rodean el tubo neural y la notocorda (C). Cualquier plegamiento menor o interrupción de las secciones puede causar huecos y fragmentos de F-actina rotos (D, puntas de flecha). Barras de escala = 10 μm. Abreviaturas: mGFP = proteína fluorescente verde de membrana; Shh = Erizo sónico; DAPI = 4',6-diamidino-2-fenilindol. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este protocolo fue desarrollado para la preservación de citonemas delicados en secciones de tejido embrionario para microscopía de fluorescencia de alta resolución. Hasta la fecha, la visualización de citonemas en el tejido a través de varios organismos modelo se ha basado en gran medida en la expresión ectópica de proteínas marcadas fluorescentemente utilizando imágenes de tejidos vivos. Desafortunadamente, el uso de imágenes en vivo marcadas fluorescentemente rara vez es propicio para el análisis de proteínas expresadas endógenamente, puede introducir limitaciones de tiempo y requiere etapas de imágenes y microscopios especializados. El método de tinción y seccionamiento descrito aquí preserva citonemas y otras extensiones celulares para permitir la inmunohistoquímica para la eventual detección de proteínas expresadas endógenamente. Esta tecnología facilitará nuevos conocimientos sobre cómo se transportan los morfógenos a través de diferentes tejidos in vivo y amplía el alcance de los sistemas modelo donde se pueden estudiar los citonemas.
Este protocolo utiliza tinción de montaje completo y sección gruesa del vibratome, lo que evita el uso de soluciones de equilibrio como el glicerol o soluciones crioprotectoras como la sacarosa. Su objetivo es minimizar el manejo de tejidos seccionados para permitir la máxima preservación de las extensiones celulares. La reducción del manejo del tejido después de la sección proporcionó consistentemente mejores resultados en la preservación general de los citonemas. Por lo tanto, la seccionamiento del embrión es uno de los pasos finales antes de la obtención de imágenes.
MEM-fix, una técnica de fijación desarrollada para la preservación de citonemas de células cultivadas, consiste en una combinación de glutaraldehído y PFA que permite mejorar la preservación 3D de la arquitectura celular innata comparable a sus dimensiones vivas16,17. Desafortunadamente, MEM-fix no fue útil para la fijación embrionaria porque el glutaraldehído puede autofluorescencia y limita severamente la penetración de anticuerpos y la unión al epítopo en las células debido a la alta actividad de reticulación de proteínas22,23. Por lo tanto, los protocolos de seccionamiento posteriores a las condiciones de fijación de PFA se optimizaron para permitir la preservación de las extensiones celulares en el tejido embrionario. Aunque el PFA puede preservar extensiones similares a un citonema en el tejido embrionario, el análisis de imágenes debe realizarse con precaución. El PFA puede causar deshidratación parcial de células y tejidos individuales, lo que lleva a una reducción menor del volumen y la formación de pequeños espacios extracelulares dentro del tejido fijo.
Este protocolo evita los pasos adicionales de la resaturación de sacarosa para la crioprotección y la limpieza de tejidos porque las soluciones de sacarosa o glicerol pueden causar una resaturación menor del tejido24. La hinchazón menor resultante puede destruir extensiones celulares fijas y citonemas que migran entre las células y a través de los tejidos. Esto fue evidente al comparar el vibratome de sección gruesa con las secciones de criostato. Aunque el aumento del grosor del tejido mejoró la preservación de los citonemas intactos, las secciones de criostato resaturadas con sacarosa tuvieron consistentemente una menor incidencia de citonemas detectables.
La optimización de este protocolo reveló que las secciones de 100 μm de espesor eran las mejores para garantizar la preservación de los citonemas intactos. Las secciones más delgadas se usan típicamente para obtener imágenes porque la mayoría de los microscopios confocales solo son capaces de obtener imágenes a una resolución suficiente para visualizar extensiones celulares a una profundidad de ~ 20-40 μm sin despejar25. Sin embargo, las fuerzas mecánicas y la distorsión aplicadas a las células embrionarias desde la cuchilla mientras se cortan secciones delgadas destruyen los citonemas. Las secciones más gruesas permiten un área más grande de profundidad dentro de la sección mientras preservan las extensiones intactas dentro del tejido. Además, el uso de secciones más gruesas permite una facilidad de manejo para evitar el plegado excesivo o el pandeo de las secciones de tejido.
Este protocolo fue optimizado para la máxima preservación de citonemas en tejido de embriones de ratón E8-10.5. La manipulación mínima del tejido después de la seccionamiento proporcionó una preservación general consistentemente mejorada de los citonemas. Es probable que se requiera una mayor optimización para adaptar la técnica para las etapas posteriores del desarrollo y las secciones de tejido adulto debido al aumento del tamaño y la complejidad del tejido. Esto requerirá seccionamiento seguido de tinción por inmunofluorescencia. Dicho tejido puede requerir pasos de limpieza adicionales y adaptación del manejo del tejido durante la sección para preservar extensiones similares al citonema. Estos pasos adicionales deberán considerarse y abordarse para futuras aplicaciones de este protocolo.
Divulgaciones
Los autores no tienen intereses contrapuestos que declarar.
Agradecimientos
Las imágenes se adquirieron utilizando microscopios mantenidos por el Núcleo de Imágenes de Biología Celular y Molecular en el St. Jude Children's Research Hospital. Las cepas de ratón se obtuvieron de JAX. Este trabajo fue apoyado por la subvención R35GM122546 (SKO) de los Institutos Nacionales de Salud y por ALSAC del St. Jude Children's Research Hospital.
Materiales
| Name | Company | Catalog Number | Comments |
| 12-well plate; Nunc Cell-Culture Treated | Thermo Scientific | 150628 (Fisher Scientific 12-565-321) | |
| 24-Well Plate, Round Nunc | Thermo Fisher Scientific | 142475 | |
| 60 mm dish | Corning, Falcon | 353004 (Fisher Scientific 08772F) | |
| Absorbant towels (Professional Kimtech Science Kimwipes) | Kimberly-Clark KIMTECH | 34155 (Fisher Scientific 06666A) | |
| Actin Red 555 ReadyProbes Reagent | Invitrogen | R37112 | |
| Alexa Fluor 488 AffiniPure F(ab')2 Fragment Donkey Anti-Chicken IgY (IgG) (H+L) | Jackson Immunoresearch Lab Inc | 703-546-155 | 1:1,000 working concentration |
| Bead Bath 6L 230V | Lab Armor | Item #12L048 (Mfr. Model #74220-706) | set to 55 °C |
| chicken anti-GFP | Aves Labs | SKU GFP-1020 | 1:250 working concentration |
| CO2 chamber | plexiglass chamber connected to a CO2 emitting line. | ||
| Confocal laser-scanning microscope | Leica Microsystems | model: Leica TCS SP8 | |
| DAPI Solution (1 mg/mL) | Thermo Fisher Scientific | 62248 | |
| Dissecting scissors (Vannas Scissors) | World Precision Instruments | 14003 | |
| Dulbecco's Modified Eagle Medium, high glucose, no glutamine | Thermo Fisher Scientific, Gibco | 11960044 | |
| Eppendorf Research Plus single channel pipette, 0.1-2.5 µL | Eppendorf | 3123000012 | |
| Eppendorf Research Plus single channel pipette, 0.5-10 µL | Eppendorf | 3123000020 | |
| Eppendorf Research Plus single channel pipette, 100-1,000 µL | Eppendorf | 3123000063 | |
| Eppendorf Research Plus single channel pipette, 20-200 µL | Eppendorf | 3123000055 | |
| Feather Disposable Scalpel #10 | Fisher Scientific | Catalog No.NC9999403 | |
| Fetal Bovine Serum, certified, United States | Thermo Fisher Scientific, Gibco | 16000044 | |
| Fisherbrand Fine Point High Precision Forceps | Fisher Scientific | 22-327379 | |
| Fisherbrand Labeling Tape | Fisher Scientific | 15-954 | |
| Formaldehyde, 16%, methanol free, Ultra Pure EM Grade | Polysciences | 18814-10 | |
| Hank's Balanced Salt Solution (HBSS) | Thermo Fisher Scientific, Gibco | 14025 | |
| ImmEdge Hydrophobic Barrier Pap Pen | Vector laboratories | H-4000 | |
| Leica Application Suite X (LAS X) with LIGHTNING | Leica Microsystems | Microscope software | |
| L-Glutamine (200 mM) | Thermo Fisher Scientific, Gibco | 25030081 | |
| Low Melting Point Agarose- UltraPure | Invitrogen | 16520 | |
| MEM Non-Essential Amino Acids Solution (100x) | Thermo Fisher Scientific, Gibco | 11140050 | |
| Moria MC 17 BIS Perforated Spoon | Fine Science Tools | 1037018 | |
| Mounting media (ProLong Diamond Antifade Mountant) | Thermo Fisher Scientific, Invitrogen | P36961 | |
| Mouse: B6.129X1(Cg)-Shhtm6Amc/J (ShhGFP/+) | The Jackson Laboratory | Strain #:008466 | |
| Mouse: B6.Cg-Shhtm1(EGFP/cre)Cjt/J (Shh-Cre) | The Jackson Laboratory | Strain #:005622 | |
| Mouse: C57BL/6J (B6) | The Jackson Laboratory | Strain #:000664 | |
| Mouse: Gt(ROSA)26Sortm4(ACTB-tdTomato,-EGFP)Luo/J (Rosa26 mTmG) | The Jackson Laboratory | Strain #:007576 | |
| Normal Goat Serum | Jackson ImmunoResearch | 005-000-121 (Fisher Scientific NC9660079) | |
| PBS + Ca2+ + Mg2+ | Thermo Fisher Scientific, Gibco | 14040133 | |
| Premium Microcentrifuge Tubes: 1.5 mL | Fisher Scientific | 05-408-129 | |
| SHARP Precision Barrier Tips, Extra Long for P-10 and Eppendorf 10 µL | Denville Scientific | P1096-FR | |
| SHARP Precision Barrier Tips, For P-1000 and Eppendorf 1,000, 1,250 µL | Denville Scientific | P1126 | |
| SHARP Precision Barrier Tips, For P-20 and Eppendorf 20 µL | Denville Scientific | P1121 | |
| SHARP Precision Barrier Tips, For P-200 and Eppendorf 200 µL | Denville Scientific | P1122 | |
| Sodium Azide | Sigma-Aldrich | S8032 | |
| Sodium Pyruvate (100 mM) (100x) | Thermo Fisher Scientific, Gibco | 11360070 | |
| Super Glue | Gorilla | ||
| SuperFrost Plus microscope slides | Fisher Scientific | 12-550-15 | |
| TPP centrifuge tubes, volume 15 mL, polypropylene | TPP Techno Plastic Products | 91015 | |
| TPP centrifuge tubes, volume 50 mL, polypropylene | TPP Techno Plastic Products | 91050 | |
| Transfer pipette, polyethylene | Millipore Sigma | Z135003 | |
| Triton X-100 | Sigma-Aldrich | T9284 | |
| Tween-20 | Sigma-Aldrich | P1379 | |
| Vari-Mix Platform Rocker | Thermo Fisher Scientific | 09-047-113Q | set to 20 RPM |
| Vibratome | Leica Biosytems | VT1000 S |
Referencias
- Crick, F. Diffusion in embryogenesis. Nature. 225 (5231), 420-422 (1970).
- Zeng, X., et al. A freely diffusible form of Sonic hedgehog mediates long-range signalling. Nature. 411 (6838), 716-720 (2001).
- Yu, S. R., et al. Fgf8 morphogen gradient forms by a source-sink mechanism with freely diffusing molecules. Nature. 461 (7263), 533-536 (2009).
- Zhou, S., et al. Free extracellular diffusion creates the Dpp morphogen gradient of the Drosophila wing disc. Current Biology. 22 (8), 668-675 (2012).
- Ribes, V., Briscoe, J. Establishing and interpreting graded Sonic Hedgehog signaling during vertebrate neural tube patterning: the role of negative feedback. Cold Spring Harbor Perspectives in Biology. 1 (2), 002014(2009).
- Le Dréau, G., Martí, E. Dorsal-ventral patterning of the neural tube: a tale of three signals. Developmental Neurobiology. 72 (12), 1471-1481 (2012).
- Kornberg, T. B., Guha, A. Understanding morphogen gradients: a problem of dispersion and containment. Current Opinion in Genetics & Development. 17 (4), 264-271 (2007).
- Ramirez-Weber, F. A., Kornberg, T. B. Cytonemes: cellular processes that project to the principal signaling center in Drosophila imaginal discs. Cell. 97 (5), 599-607 (1999).
- Sanders, T. A., Llagostera, E., Barna, M. Specialized filopodia direct long-range transport of SHH during vertebrate tissue patterning. Nature. 497 (7451), 628-632 (2013).
- Bischoff, M., et al. Cytonemes are required for the establishment of a normal Hedgehog morphogen gradient in Drosophila epithelia. Nature Cell Biology. 15 (11), 1269-1281 (2013).
- Hall, E. T., et al. Cytoneme delivery of sonic hedgehog from ligand-producing cells requires Myosin 10 and a dispatched-BOC/CDON co-receptor complex. eLife. 10, 61432(2021).
- Huang, H., Kornberg, T. B. Cells must express components of the planar cell polarity system and extracellular matrix to support cytonemes. eLife. 5, 18979(2016).
- Brunt, L., et al. Vangl2 promotes the formation of long cytonemes to enable distant Wnt/β-catenin signaling. Nature Communications. 12 (1), 2058(2021).
- Roy, S., Huang, H., Liu, S., Kornberg, T. B. Cytoneme-mediated contact-dependent transport of the Drosophila decapentaplegic signaling protein. Science. 343 (6173), 1244624(2014).
- Mattes, B., et al. Wnt/PCP controls spreading of Wnt/β-catenin signals by cytonemes in vertebrates. eLife. 7, 36953(2018).
- Bodeen, W. J., Marada, S., Truong, A., Ogden, S. K. A fixation method to preserve cultured cell cytonemes facilitates mechanistic interrogation of morphogen transport. Development. 144 (19), 3612-3624 (2017).
- Hall, E. T., Ogden, S. K. Preserve cultured cell cytonemes through a modified electron microscopy fixation. Bio-protocol. 8 (13), (2018).
- American Veterinary Medical Association. AVMA guidelines for the euthanasia of animals. American Veterinary Medical Association. , (2020).
- Harfe, B. D., et al. Evidence for an expansion-based temporal Shh gradient in specifying vertebrate digit identities. Cell. 118 (4), 517-528 (2004).
- Chamberlain, C. E., Jeong, J., Guo, C., Allen, B. L., McMahon, A. P. Notochord-derived Shh concentrates in close association with the apically positioned basal body in neural target cells and forms a dynamic gradient during neural patterning. Development. 135 (6), 1097-1106 (2008).
- Muzumdar, M. D., Tasic, B., Miyamichi, K., Li, L., Luo, L. A global double-fluorescent Cre reporter mouse. Genesis. 45 (9), 593-605 (2007).
- Bacallao, R., Sohrab, S., Phillips, C. Handbook Of Biological Confocal Microscopy. Pawley, J. B. , Springer US. 368-380 (2006).
- Tagliaferro, P., Tandler, C. J., Ramos, A. J., Pecci Saavedra, J., Brusco, A. Immunofluorescence and glutaraldehyde fixation. A new procedure based on the Schiff-quenching method. Journal of Neuroscience Methods. 77 (2), 191-197 (1997).
- Neckel, P. H., Mattheus, U., Hirt, B., Just, L., Mack, A. F. Large-scale tissue clearing (PACT): Technical evaluation and new perspectives in immunofluorescence, histology, and ultrastructure. Scientific Reports. 6 (1), 1-13 (2016).
- Clendenon, S. G., Young, P. A., Ferkowicz, M., Phillips, C., Dunn, K. W. Deep tissue fluorescent imaging in scattering specimens using confocal microscopy. Microscopy and Microanalysis. 17 (4), 614-617 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados