Method Article
Fixação de tecido de rato embrionário para análise de cytoneme
Neste Artigo
Resumo
Aqui, um protocolo passo-a-passo otimizado é fornecido para fixação, imunostaining e secção de embriões para detectar filopodia de sinalização especializada chamada citonês no desenvolvimento de tecidos de camundongos.
Resumo
A padronização do tecido de desenvolvimento e a homeostase do tecido pós-desenvolvimento dependem da entrega controlada de sinais celulares chamados morfogens. Os morfogens agem de forma dependente de concentração e tempo para especificar programas transcricionais distintos que instruem e reforcem o destino celular. Um mecanismo pelo qual os limiares apropriados de sinalização de morfogênio são assegurados é através da entrega das proteínas de sinalização por filopodia especializada chamada citonemes. Os citonemes são muito finos (≤200 nm de diâmetro) e podem crescer até comprimentos de várias centenas de mícrons, o que torna sua preservação para análise de imagem fixa desafiadora. Este artigo descreve um método refinado para manuseio delicado de embriões de camundongos para fixação, imunostaining e seção espessa para permitir a visualização de citonemas usando microscopia confocal padrão. Este protocolo foi usado com sucesso para visualizar citonemes que conectam compartimentos de sinalização celular distintos durante o desenvolvimento de tubos neurais do rato. A técnica também pode ser adaptada para detectar citonemas entre tipos de tecidos para facilitar o interrogatório de sinalização de desenvolvimento em resolução sem precedentes.
Introdução
O desenvolvimento embrionário é orquestrado através da ativação coordenada de vias de sinalização de morfogênio. Os morfogênios são proteínas pequenas e secretas que são categorizadas em Sonic Hedgehog (SHH), transformando o fator de crescimento β (TGF-β)/proteína morfogênica óssea (BMP), local de integração relacionado com asas (WNT) e famílias de fatores de fibroblasto e de crescimento epidérmico (FGF/EGF). Os morfogênios são produzidos e liberados de centros de organização celular durante o desenvolvimento de tecidos e estabelecem gradientes de sinalização em campos de organização de células para informar a morfogênesetecidual 1,2,3,4,5. Uma representação de gradientes de morfogênio é encontrada no sistema nervoso em desenvolvimento, onde o sistema nervoso central presuntivo é padronizado através da ativação da via morfogênio. Este tecido, chamado de tubo neural, é composto por gradientes opostos de SHH secretados pela placa ventral-mais notochord e piso, e WNTs/BMPs secretados da placa dorsal, para padronizar regiões progenitoras neurais distintas6. O tubo neural é comumente usado para interrogar a integridade do gradiente de morfogênio em pesquisas de desenvolvimento.
A formação de gradiente de morfogênio depende de uma regulação rigorosa da dispersão de sinal7. Um mecanismo celular pelo qual isso ocorre é através da formação de filopodia de sinalização longa chamada citonês que facilitam a entrega direta de morfogênios de células produtoras de sinais para populações específicas de células-alvo. Citonemes foram observados para estender centenas de micrômetros para depositar morfogens em membranas celulares receptoras de sinal 8,9. A interrupção do transporte de morfogênio mediado por cítonmo leva a anomalias de desenvolvimento em moscas e vertebrados, destacando sua importância durante a padronização tecidual 10,11,12,13,14.
Até o momento, citonês foram documentados em modelos de Drosophila, pintinhos e zebrafish, mas a imagem das estruturas em embriões mamíferos em desenvolvimento continua desafiando 8,9,15. Um obstáculo para efetivamente a imagem de citonês em complexos tecidos mamíferos in situ é sua natureza fina e frágil, o que os torna suscetíveis a danos pelos métodos convencionais de fixação8. Tínhamos desenvolvido e otimizado protocolos para uma microscopia eletrônica modificada fixação (MEM-fix) para preservar cítons em células cultivadas e habilitar seu estudo usando microscopia confocal16,17.
O uso da técnica de correção de MEM permitiu a identificação de algumas das moléculas envolvidas na formação de cítonma induzida pelo SHH e função 11,16,17. No entanto, a confirmação desses achados no contexto fisiologicamente relevante da padronização do tubo neural exigiu o desenvolvimento de novas técnicas para fixação e tecido embrionário de camundongos. Um protocolo para corrigir embriões de camundongos de uma maneira que mantenha a integridade do cítonmo e permita a imunostaining e a posterior secção de tecido embrionário para análise confocal é descrito aqui. Este protocolo foi desenvolvido utilizando uma proteína fluorescente verde de membrana (GFP) para rotular extensões de membrana das células produtoras de SHH no tubo neural em desenvolvimento. A implementação deste protocolo abordará questões sem resposta relativas à prevalência e significância das citonemas no desenvolvimento de sistemas mamíferos.
Protocolo
Este protocolo segue as diretrizes aprovadas de cuidados com animais do Comitê Institucional de Cuidados e Uso de Animais (IACUC) e do Hospital de Pesquisa Infantil de São Judas. Todas as cepas foram cruzadas cinco gerações para a cepa C57BL/6J.
1. Isolamento do embrião e coloração de montagem inteira
- Criar fêmeas de 6 semanas e monitorar a presença de plugue vaginal.
- Eutanize a barragem grávida por inalação de CO2 em uma câmara de CO2 seguida de deslocamento cervical de acordo com as diretrizes da AVMA18. Faça uma incisão Y na cavidade peritoneal usando tesouras dissecando e fórceps. Extirpar o útero contendo os embriões E9,5 conforme diretrizes institucionais aprovadas.
- Disseque os embriões em meio de crescimento completo (Dulbecco's Modified Eagle Medium, complementado com aminoácidos não essenciais, Na-piruato, L-glutamina e 10% de soro bovino fetal). Use fórceps para remover o saco de gema, placenta e membranas circundantes.
NOTA: Quando necessário, guarde cada saco de gema para genotipagem de embriões. - Enxágüe os embriões isolados na solução de sal balanceada de Hank (HBSS) para remover qualquer tecido amniótico residual e sangue.
- Prepare o fixador. Adicione paraformaldeído (PFA) ao HBSS para uma concentração final de trabalho de 4% de PFA.
ATENÇÃO: O PFA é um produto químico tóxico, por isso deve ser evitada a inalação ou exposição direta da pele. A preparação da solução fixa é realizada sob um capô de fumaça com o equipamento de proteção individual adequado de luvas e um jaleco. - Adicione 1 mL de fixação a cada poço de uma placa de 24 poços e coloque cada embrião em um poço individual. Incubar os embriões em fixação por 45 minutos com agitação suave em um roqueiro.
NOTA: Crítica: Todas as lavagens e incubações devem ser feitas com agitação suave (máximo 20 RPM) em um roqueiro ou agitador circular, pois o manuseio abrupto ou o movimento dos embriões destruirão as citonemas fixas. Use uma pipeta para remover suavemente todas as soluções. - Remova o fixador e lave os embriões 3 x 30 min em Salina Tamponada de Fosfato (PBS) com Ca2+ e Mg2+ com triton adicionado de 0,1%.
- Após a lavagem, incubar os embriões na solução de bloqueio (PBS com Ca2+ e Mg2+, 0,1% Triton e 5% soro de cabra) com agitação suave. Bloco 2 x 1 h. Após a segunda incubação de bloqueio, realize uma lavagem rápida dos embriões usando uma solução de bloqueio fresco.
- Durante a segunda etapa de bloqueio, prepare a solução primária de anticorpos11. Diluir os anticorpos para a concentração otimizada em PBS com Ca2+ e Mg2+, 0,1% Tween-20 e 5% soro de cabra.
NOTA: Para uma visualização aprimorada da membrana GFP, pode-se utilizar o anti-GFP de frango (1:250). - Remova a solução de bloqueio e adicione 1 mL de solução de anticorpos primários a cada poço. Incubar a 4 °C com rotação suave por 3 dias.
- Seguindo a incubação primária de anticorpos, lave os embriões 5 x 1 h a 20 RPM em um roqueiro em PBS com Ca2+ e Mg2+, 0,1% Tween-20 e 5% soro de cabra.
- Prepare a solução secundária de anticorpos utilizando secundários de fragmento F(ab')2 a uma diluição de 1:1.000 em PBS com Ca2+ e Mg2+, 0,1% Tween-20 e 5% soro de cabra.
NOTA: O uso de fragmentos F(ab')2 aumenta consideravelmente a penetração de anticorpos na amostra. - Adicione 1 mL de solução de anticorpos secundários a cada poço. Incubar com balanço suave a 4 °C no escuro por 3 dias.
NOTA: Importante: A partir deste ponto, minimize a exposição embrião à luz direta. Opcional: Para evitar o crescimento bacteriano, adicione 0,2% de azida de sódio à solução de anticorpos secundários. - Remova a solução de anticorpos secundários e lave os embriões 3 x 30 min em PBS com Ca2+ e Mg2+, 0,1% Tween-20 e 5% soro de cabra. Se não realizar coloração de actina com corantes de falo ou outros actinas, após a primeira lavagem, adicione 4',6-diamidino-2-fenilôle (DAPI) à PBS com Ca2+ e Mg2+, 0,1% Tween-20, e 5% soro de cabra e incubar por 1h, seguido por 3 x 30 min lavagens como descrito acima.
NOTA: Neste ponto, os embriões podem ser armazenados durante a noite a 4 °C em PBS ou HBSS no escuro até o passo de incorporação no dia seguinte. No entanto, recomenda-se que os embriões sejam incorporados e seccionados imediatamente.
2. Incorporação, secção e montagem de embriões
- Prepare uma solução de agarose de 4% c/v Low Melting Point (LMP) dissolvida no HBSS ou PBS com Ca2+ e Mg2+ para um volume final de ~3 mL por embrião. Adicione o peso apropriado de LMP agarose ao HBSS ou PBS com Ca2+ e Mg2+ e micro-ondas até que a agarose LMP seja dissolvida.
NOTA: Uma vez que a agarose LMP seja dissolvida, armazene a solução em um banho de contas, incubadora ou banho de água definido a 55 °C para evitar que a solução de agarose LMP se solidifique. - Use uma placa de 12 poços como molde de incorporação para embriões. Coloque a placa de 12 poços no banho de contas de 55 °C. Adicione 2,5-3 mL de 4% de LMP agarose a cada poço que irá conter um embrião.
NOTA: Embora outros moldes possam ser usados, volumes de placas de 12 poços são ideais para preparar o bloco de agarose em estágios posteriores para secção. - Utilizando uma colher perfurada, transfira os embriões para poços individuais contendo 4% de solução de agarose LMP (Figura 1A).
- Transfira a placa de 12 poços do banho de contas para um banco. Use pontas de pipeta para incorporar suavemente e orientar o embrião para que ele esteja centrado dentro da solução. Uma vez orientados os embriões, coloque a placa a -20 °C por 10 minutos para permitir a solidificação rápida do bloco.
CRÍTICA: Certifique-se de que o embrião está posicionado no centro do bloco. Embriões que afundam até o fundo ou estão muito perto da borda do molde provavelmente serão desalojados do bloco de agarose durante a secção.
- Transfira a placa de 12 poços do banho de contas para um banco. Use pontas de pipeta para incorporar suavemente e orientar o embrião para que ele esteja centrado dentro da solução. Uma vez orientados os embriões, coloque a placa a -20 °C por 10 minutos para permitir a solidificação rápida do bloco.
- Remova todo o bloco de agarose do poço usando um bisturi e corte um bloco retangular ao redor do embrião deixando ~0,3 cm de bloco em cada lado. Deixe um comprimento extra ao longo da extremidade caudal do embrião. Quando montado no vibratome, oriente o embrião em posição vertical na parte superior do bloco (Figura 1B).
- Aplique uma tira de fita no suporte do espécime do vibratome e supercole o bloco de agarose na fita, orientada para que a lâmina gere seções axiais do embrião em uma sequência anterior (craniana) para posterior.
- Encha a câmara de vibratome com HBSS frio para garantir que a amostra esteja totalmente imersa e, em seguida, cerque a câmara com gelo.
- Ajuste a velocidade do vibratome para 0,2 mm/s e a frequência entre 5 e 7 (50-70 Hz) com espessura cortada definida para 100 μm. Realizar seção axial serial do embrião.
NOTA: Use uma velocidade lenta para secção. Se a velocidade de corte for aumentada acima de 0,25 mm/s, a secção pode rasgar o embrião ou desalojar o embrião do bloco.- Durante a série de secção, use fórceps para transferir suavemente seções individuais para um prato separado de 60 mm cheio de HBSS. Use fórceps para pegar o bloco, não o tecido, para evitar danos teciduais e destruição de citonemes.
NOTA: As seções teciduais devem permanecer dentro do bloco de agarose. Se o tecido cair do bloco para a câmara vibratome, transfira suavemente levantando a seção para fora. Não pegue ou belisque o tecido. CRÍTICA: Qualquer dobra de seções de tecido ou manuseio abrupto destruirá citonês fixos nas seções teciduais.
- Durante a série de secção, use fórceps para transferir suavemente seções individuais para um prato separado de 60 mm cheio de HBSS. Use fórceps para pegar o bloco, não o tecido, para evitar danos teciduais e destruição de citonemes.
- Se não estiver executando a coloração F-actin, proceda à etapa 2.10.
- Para realizar a coloração F-actin, remova as seções HBSS e incubar por 40 min com a solução Actin-Red e DAPI diluída em PBS com Ca2+ e Mg2+, 0,1% Tween-20 e 5% soro de cabra à temperatura ambiente.
- Lavar seções 3 x 20 min em PBS com Ca2+ e Mg2+ e 0,1% Tween-20.
- Usando uma caneta marcadora hidrofóbica, desenhe uma barreira hidrofóbica ao redor das bordas de um slide de microscópio carregado e adicione um pequeno volume de HBSS para encher a área.
- Use fórceps ou uma colher perfurada para transferir seções para o slide.
NOTA: Quaisquer seções de tecido que não estejam envoltos em agarose podem ser transferidas através de uma pipeta de transferência. - Remova o excesso de bloco de agarose usando fórceps.
- Uma vez que todas as seções tenham sido transferidas para o slide, remova o excesso de líquido através da tubulação e do canto de uma toalha absorvente e, em seguida, adicione várias gotas de meio de montagem ao slide. Use meio de montagem suficiente para cobrir toda a área de deslizamento de cobertura quando curado. Monte a mancha de cobertura colocando-a suavemente no slide.
NOTA: Evite aplicar pressão ou deslizamento de cobertura perturbador até que o meio de montagem tenha curado.
3. Imagem
- Realize imagens de seções de tecido em qualquer microscópio confocal ou de maior resolução11. Analise um mínimo de três embriões por genótipo.
NOTA: Imagens de seções teciduais foram adquiridas utilizando um microscópio confocal TCS SP8 STED 3x, seguido de desconvolução relâmpago.
Resultados
O uso de um molde maior de uma placa de 12 poços com 2,5-3 mL de solução agarose por poço foi ideal para incorporar e suspender vários embriões durante um curto período de tempo (Figura 1A). A área em excesso permite uma orientação correta ao cortar o bloco de agarose para secção. Ao cortar o bloco de agarose, é importante manter o excesso de agarose ao longo da parte inferior do bloco onde ele será colado à fita no suporte do objeto. O embrião deve estar na metade superior do bloco (Figura 1B). No entanto, a seção inferior não deve ser muito grande, pois o excesso de bloco aumenta as chances de alterar o ângulo de corte à medida que a lâmina empurra para dentro do bloco durante a seção. Exemplos de seções corretamente orientadas são mostrados (Figura 1C,D).
Ao desenvolver este protocolo, a seção vibratome foi comparada com a secção criostat. Seção criostat do tecido raramente preservada extensões celulares (Figura 2 criostat e figura 3A,B vibratome). As seções de criostatia permitiram a detecção de alguns fragmentos de membrana gfp-positivo entre células do tubo notochord e neural (Figura 2A da ponta de flecha) e entre células de tubo neural adjacentes (Figura 2B, B' pontas de flecha). No entanto, a coloração F-actin de extensões celulares nas células mesenquimais altamente filamentosas ao redor do tubo neural foi prejudicada em seções criostat (Figura 2C, C' seta, vs Figura 3C,D). Estes resultados criostat indicam que apenas alguns traços de extensões celulares quebradas permanecem seguindo este método. Assim, a secção vibratome é preferível preservar eficientemente essas delicadas extensões para análise posterior.
A interrupção mínima de seções de embriões inteiros e tecidos individuais é essencial para imagens de alta qualidade de extensões celulares. As seções teciduais submetidas a qualquer dobra ou dobramento serão evidentes pela ausência do notochord ou de uma grande separação (>30 μm) entre a placa notochord e o piso ventral do tubo neural (Figura 3B). Isso é geralmente acompanhado pela perda de células mesenquimais que normalmente circundam o tubo neural (Figura 3A, seta). As seções danificadas também resultarão na perda de extensões de membrana celular visíveis migrando entre células epiteliais (Figura 3B em comparação com a Figura 3A, pontas de flecha). Mesmo pequenas distorções nas seções podem causar fragmentação de extensões baseadas em actina e grandes lacunas para se formar entre células (Figura 3D, pontas de flecha, em comparação com a Figura 3C bem preservada), ressaltando a necessidade de manuseio delicado em todas as etapas.
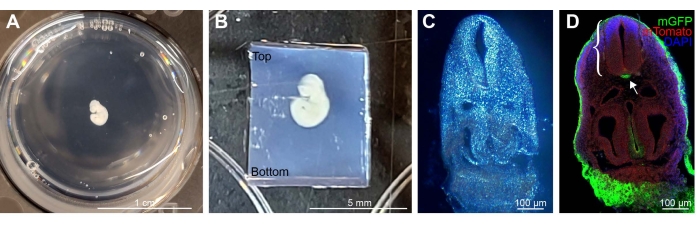
Figura 1: Exemplo de E9.5 Shh-Cre; Rosa26 mTmG manchado, incorporado e seccionado embrião. (A) Um único embrião em uma placa de 12 poços, embutido em 4% de LMP agarose. (B) Exemplo de um embrião corretamente orientado dentro do bloco de agarose reduzido ao tamanho para montagem de vibratome. O excesso de bloco de agarose está presente ao longo do fundo. (C) Imagem de campo brilhante de seção de embrião de 100 μm de espessura embutida em LMP agarose. (D) Imagem de imunofluorescência de uma seção após a remoção da agarose. MGFP (verde) anti-GFP representa células que expressam Shh no tecido, com outras linhagens celulares expressando membrana Tomate (vermelho), DAPI em azul. O tubo neural (suporte) e o notochord mGFP positivo (seta) são claramente visíveis. Barras de escala = 1 cm (A), 5 mm (B) e 100 μm (C,D). Abreviaturas: LMP = ponto de fusão baixo; mGFP = membrana verde proteína fluorescente; Shh = Sonic Hedgehog; DAPI = 4',6-diamidino-2-fenildole. Clique aqui para ver uma versão maior desta figura.
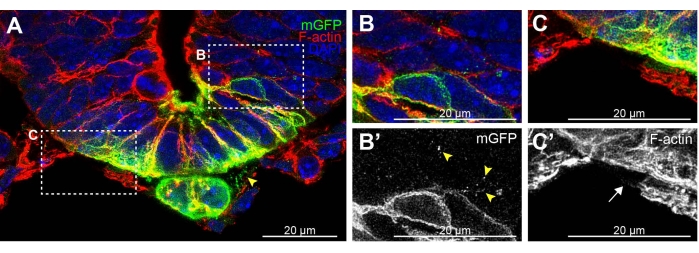
Figura 2: Exemplo de placa do piso do tubo neural seccionada por criostat e notochord com extensões de membrana fragmentada. (A) 20 μm de espessura E9,5 Shh-Cre; Seção Rosa26 mTmG 19,20,21 manchada para GFP (verde), F-actin (vermelho) e DAPI (azul). punctas mGFP são visíveis entre o notochord e a placa de piso (ponta de flecha) e (B,B') migrando entre células adjacentes do tubo neural. (C,C') A coloração f-actin não detecta quaisquer citonemas claras em células mesenquimais ao redor do tubo neural (seta). Barras de escala = 20 μm. Abreviaturas: mGFP = proteína fluorescente verde da membrana; Shh = Sonic Hedgehog; DAPI = 4',6-diamidino-2-fenildole. Clique aqui para ver uma versão maior desta figura.
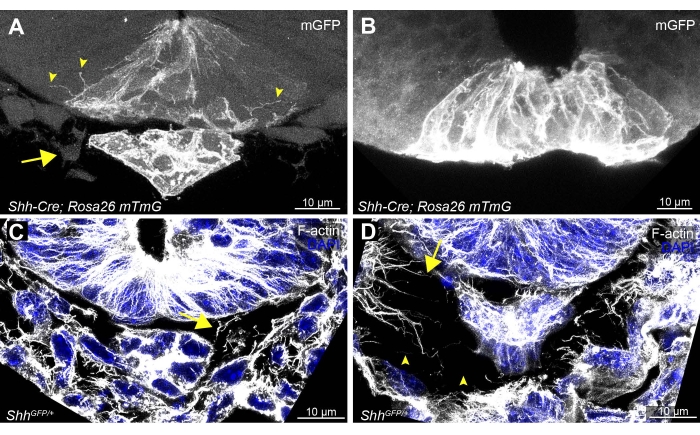
Figura 3: Exemplos de seções de tecido vibratome vibratome ideal e subótimal e coloração da placa do piso do tubo neural, notochord e células circundantes. Exemplos de seções delicadamente manuseadas (A,C), em comparação com (B) uma seção de tecido dobrado e (D) uma seção mal manuseada a partir de um Shh-Cre; Rosa26 mTmG e um embrião ShhGFP/+ 19,20,21. Seções bem manuseadas permitem a detecção de citonês entre células epiteliais de placa de piso localizadas adjacentes (A, pontas de flecha). O notochord adjacente do tubo neural (A, mGFP-expressing) e as células mesenquimais (A, seta) devem ser visíveis. (C,D) As seções manchadas de F-actin e DAPI devem ter espaçamento consistente de células mesenquimais e citonês baseados em F-actin (setas) ao redor do tubo neural e notochord (C). Qualquer pequeno dobramento ou interrupção das seções pode causar lacunas e fragmentos de ato de F quebrados (D, pontas de flecha). Barras de escala = 10 μm. Abreviaturas: mGFP = proteína fluorescente verde da membrana; Shh = Sonic Hedgehog; DAPI = 4',6-diamidino-2-fenildole. Clique aqui para ver uma versão maior desta figura.
Discussão
Este protocolo foi desenvolvido para a preservação de citonemas delicadas em seções de tecido embrionário para microscopia de fluorescência de alta resolução. Até o momento, a visualização de citonês no tecido em vários organismos modelos tem se apoiado em grande parte na expressão ectópica de proteínas fluorescentes rotuladas usando imagens de tecido vivo. Infelizmente, o uso de imagens vivas fluorescentes é raramente propício à análise de proteínas expressas endógenas, pode introduzir restrições de tempo e requer estágios de imagem especializados e microscópios. O método de coloração e secção descrito aqui preserva citonês e outras extensões celulares para permitir a imunohistoquímica para a eventual detecção de proteínas expressas endógenas. Essa tecnologia facilitará novas percepções sobre como os morfogens são transportados através de diferentes tecidos in vivo e expande o escopo de sistemas de modelos onde citonemes podem ser estudados.
Este protocolo utiliza coloração de montagem total e seção de vibratome, o que evita o uso de soluções de equilíbrio, como glicerol ou soluções crioprotetores, como sacarose. Tem como objetivo minimizar o manuseio de tecidos seccionados para permitir a preservação máxima das extensões celulares. O manuseio reduzido do tecido após a secção proporcionou resultados consistentemente melhores na preservação geral das citonemas. Assim, a secção do embrião é um dos passos finais antes da imagem.
Mem-fix, uma técnica de fixação desenvolvida para a preservação de cântons de células cultivadas, consiste em uma combinação de glutaraldeído e PFA que permite uma melhor preservação 3D da arquitetura celular inata comparável às suas dimensões vivas16,17. Infelizmente, a correção de MEM não foi útil para a fixação de embriões porque o glutaraldeído pode auto-fluoresce e limita severamente a penetração de anticorpos e a ligação de epítope nas células devido à atividade transversal de alta proteína22,23. Assim, os protocolos de secção pós as condições de fixação da PFA foram otimizados para permitir a preservação de extensões celulares em tecido embrionário. Embora a PFA possa preservar extensões semelhantes a cíton em tecido embrionário, a análise de imagem deve ser realizada com cautela. A PFA pode causar desidratação parcial de células e tecidos individuais, levando à redução de volume menor e à formação de pequenos espaços extracelulares dentro do tecido fixo.
Este protocolo evita as etapas extras de resaturação de sacarose para crioproteção e limpeza tecidual porque soluções de sacarose ou glicerol podem causar uma pequena resaturação do tecido24. O pequeno inchaço resultante pode destruir extensões celulares fixas e citonês migrando entre células e através de tecidos. Isso ficou evidente quando comparava vibratoma de seção grossa com seções de criostat. Embora o aumento da espessura do tecido tenha melhorado a preservação de citonês intactos, as seções criostatas resaturadas de sacarose consistentemente apresentaram menor incidência de citonês detectáveis.
A otimização deste protocolo revelou que seções de 100 μm de espessura foram as melhores para garantir a preservação de citonemas intactas. Seções mais finas são tipicamente usadas para imagens porque a maioria dos microscópios confocal só são capazes de imagens em resolução suficiente para visualizar extensões celulares a uma profundidade de ~20-40 μm sem limpar25. No entanto, as forças mecânicas e distorções aplicadas às células embrionárias da lâmina enquanto cortam seções finas destrói citonês. Seções mais grossas permitem uma maior área de profundidade dentro da seção, preservando extensões intactas dentro do tecido. Além disso, o uso de seções mais grossas permite a facilidade de manuseio para evitar dobras excessivas ou dobras das seções teciduais.
Este protocolo foi otimizado para a máxima preservação de citonemas no tecido de embriões de camundongos E8-10.5. A manipulação mínima do tecido após a secção proporcionou uma preservação global consistentemente melhorada das citonês. É provável que mais otimização seja necessária para adaptar a técnica para estágios de desenvolvimento posteriores e seções de tecido adulto devido ao aumento do tamanho e da complexidade tecidual. Isso exigirá secção seguida de coloração de imunofluorescência. Esse tecido pode exigir etapas adicionais de limpeza e adaptação do manuseio de tecidos durante a secção para preservar extensões semelhantes a cítonmo. Essas etapas adicionais precisarão ser consideradas e tratadas para futuras aplicações deste protocolo.
Divulgações
Os autores não têm interesses concorrentes para declarar.
Agradecimentos
As imagens foram adquiridas usando microscópios mantidos pelo Núcleo de Imagem de Biologia Celular e Molecular do Hospital de Pesquisa Infantil de St. Jude. Cepas de rato foram obtidas de JAX. Este trabalho foi apoiado pelo Instituto Nacional de Saúde do Grant R35GM122546 (SKO) e pela ALSAC do Hospital de Pesquisa Infantil de São Judas.
Materiais
| Name | Company | Catalog Number | Comments |
| 12-well plate; Nunc Cell-Culture Treated | Thermo Scientific | 150628 (Fisher Scientific 12-565-321) | |
| 24-Well Plate, Round Nunc | Thermo Fisher Scientific | 142475 | |
| 60 mm dish | Corning, Falcon | 353004 (Fisher Scientific 08772F) | |
| Absorbant towels (Professional Kimtech Science Kimwipes) | Kimberly-Clark KIMTECH | 34155 (Fisher Scientific 06666A) | |
| Actin Red 555 ReadyProbes Reagent | Invitrogen | R37112 | |
| Alexa Fluor 488 AffiniPure F(ab')2 Fragment Donkey Anti-Chicken IgY (IgG) (H+L) | Jackson Immunoresearch Lab Inc | 703-546-155 | 1:1,000 working concentration |
| Bead Bath 6L 230V | Lab Armor | Item #12L048 (Mfr. Model #74220-706) | set to 55 °C |
| chicken anti-GFP | Aves Labs | SKU GFP-1020 | 1:250 working concentration |
| CO2 chamber | plexiglass chamber connected to a CO2 emitting line. | ||
| Confocal laser-scanning microscope | Leica Microsystems | model: Leica TCS SP8 | |
| DAPI Solution (1 mg/mL) | Thermo Fisher Scientific | 62248 | |
| Dissecting scissors (Vannas Scissors) | World Precision Instruments | 14003 | |
| Dulbecco's Modified Eagle Medium, high glucose, no glutamine | Thermo Fisher Scientific, Gibco | 11960044 | |
| Eppendorf Research Plus single channel pipette, 0.1-2.5 µL | Eppendorf | 3123000012 | |
| Eppendorf Research Plus single channel pipette, 0.5-10 µL | Eppendorf | 3123000020 | |
| Eppendorf Research Plus single channel pipette, 100-1,000 µL | Eppendorf | 3123000063 | |
| Eppendorf Research Plus single channel pipette, 20-200 µL | Eppendorf | 3123000055 | |
| Feather Disposable Scalpel #10 | Fisher Scientific | Catalog No.NC9999403 | |
| Fetal Bovine Serum, certified, United States | Thermo Fisher Scientific, Gibco | 16000044 | |
| Fisherbrand Fine Point High Precision Forceps | Fisher Scientific | 22-327379 | |
| Fisherbrand Labeling Tape | Fisher Scientific | 15-954 | |
| Formaldehyde, 16%, methanol free, Ultra Pure EM Grade | Polysciences | 18814-10 | |
| Hank's Balanced Salt Solution (HBSS) | Thermo Fisher Scientific, Gibco | 14025 | |
| ImmEdge Hydrophobic Barrier Pap Pen | Vector laboratories | H-4000 | |
| Leica Application Suite X (LAS X) with LIGHTNING | Leica Microsystems | Microscope software | |
| L-Glutamine (200 mM) | Thermo Fisher Scientific, Gibco | 25030081 | |
| Low Melting Point Agarose- UltraPure | Invitrogen | 16520 | |
| MEM Non-Essential Amino Acids Solution (100x) | Thermo Fisher Scientific, Gibco | 11140050 | |
| Moria MC 17 BIS Perforated Spoon | Fine Science Tools | 1037018 | |
| Mounting media (ProLong Diamond Antifade Mountant) | Thermo Fisher Scientific, Invitrogen | P36961 | |
| Mouse: B6.129X1(Cg)-Shhtm6Amc/J (ShhGFP/+) | The Jackson Laboratory | Strain #:008466 | |
| Mouse: B6.Cg-Shhtm1(EGFP/cre)Cjt/J (Shh-Cre) | The Jackson Laboratory | Strain #:005622 | |
| Mouse: C57BL/6J (B6) | The Jackson Laboratory | Strain #:000664 | |
| Mouse: Gt(ROSA)26Sortm4(ACTB-tdTomato,-EGFP)Luo/J (Rosa26 mTmG) | The Jackson Laboratory | Strain #:007576 | |
| Normal Goat Serum | Jackson ImmunoResearch | 005-000-121 (Fisher Scientific NC9660079) | |
| PBS + Ca2+ + Mg2+ | Thermo Fisher Scientific, Gibco | 14040133 | |
| Premium Microcentrifuge Tubes: 1.5 mL | Fisher Scientific | 05-408-129 | |
| SHARP Precision Barrier Tips, Extra Long for P-10 and Eppendorf 10 µL | Denville Scientific | P1096-FR | |
| SHARP Precision Barrier Tips, For P-1000 and Eppendorf 1,000, 1,250 µL | Denville Scientific | P1126 | |
| SHARP Precision Barrier Tips, For P-20 and Eppendorf 20 µL | Denville Scientific | P1121 | |
| SHARP Precision Barrier Tips, For P-200 and Eppendorf 200 µL | Denville Scientific | P1122 | |
| Sodium Azide | Sigma-Aldrich | S8032 | |
| Sodium Pyruvate (100 mM) (100x) | Thermo Fisher Scientific, Gibco | 11360070 | |
| Super Glue | Gorilla | ||
| SuperFrost Plus microscope slides | Fisher Scientific | 12-550-15 | |
| TPP centrifuge tubes, volume 15 mL, polypropylene | TPP Techno Plastic Products | 91015 | |
| TPP centrifuge tubes, volume 50 mL, polypropylene | TPP Techno Plastic Products | 91050 | |
| Transfer pipette, polyethylene | Millipore Sigma | Z135003 | |
| Triton X-100 | Sigma-Aldrich | T9284 | |
| Tween-20 | Sigma-Aldrich | P1379 | |
| Vari-Mix Platform Rocker | Thermo Fisher Scientific | 09-047-113Q | set to 20 RPM |
| Vibratome | Leica Biosytems | VT1000 S |
Referências
- Crick, F. Diffusion in embryogenesis. Nature. 225 (5231), 420-422 (1970).
- Zeng, X., et al. A freely diffusible form of Sonic hedgehog mediates long-range signalling. Nature. 411 (6838), 716-720 (2001).
- Yu, S. R., et al. Fgf8 morphogen gradient forms by a source-sink mechanism with freely diffusing molecules. Nature. 461 (7263), 533-536 (2009).
- Zhou, S., et al. Free extracellular diffusion creates the Dpp morphogen gradient of the Drosophila wing disc. Current Biology. 22 (8), 668-675 (2012).
- Ribes, V., Briscoe, J. Establishing and interpreting graded Sonic Hedgehog signaling during vertebrate neural tube patterning: the role of negative feedback. Cold Spring Harbor Perspectives in Biology. 1 (2), 002014(2009).
- Le Dréau, G., Martí, E. Dorsal-ventral patterning of the neural tube: a tale of three signals. Developmental Neurobiology. 72 (12), 1471-1481 (2012).
- Kornberg, T. B., Guha, A. Understanding morphogen gradients: a problem of dispersion and containment. Current Opinion in Genetics & Development. 17 (4), 264-271 (2007).
- Ramirez-Weber, F. A., Kornberg, T. B. Cytonemes: cellular processes that project to the principal signaling center in Drosophila imaginal discs. Cell. 97 (5), 599-607 (1999).
- Sanders, T. A., Llagostera, E., Barna, M. Specialized filopodia direct long-range transport of SHH during vertebrate tissue patterning. Nature. 497 (7451), 628-632 (2013).
- Bischoff, M., et al. Cytonemes are required for the establishment of a normal Hedgehog morphogen gradient in Drosophila epithelia. Nature Cell Biology. 15 (11), 1269-1281 (2013).
- Hall, E. T., et al. Cytoneme delivery of sonic hedgehog from ligand-producing cells requires Myosin 10 and a dispatched-BOC/CDON co-receptor complex. eLife. 10, 61432(2021).
- Huang, H., Kornberg, T. B. Cells must express components of the planar cell polarity system and extracellular matrix to support cytonemes. eLife. 5, 18979(2016).
- Brunt, L., et al. Vangl2 promotes the formation of long cytonemes to enable distant Wnt/β-catenin signaling. Nature Communications. 12 (1), 2058(2021).
- Roy, S., Huang, H., Liu, S., Kornberg, T. B. Cytoneme-mediated contact-dependent transport of the Drosophila decapentaplegic signaling protein. Science. 343 (6173), 1244624(2014).
- Mattes, B., et al. Wnt/PCP controls spreading of Wnt/β-catenin signals by cytonemes in vertebrates. eLife. 7, 36953(2018).
- Bodeen, W. J., Marada, S., Truong, A., Ogden, S. K. A fixation method to preserve cultured cell cytonemes facilitates mechanistic interrogation of morphogen transport. Development. 144 (19), 3612-3624 (2017).
- Hall, E. T., Ogden, S. K. Preserve cultured cell cytonemes through a modified electron microscopy fixation. Bio-protocol. 8 (13), (2018).
- American Veterinary Medical Association. AVMA guidelines for the euthanasia of animals. American Veterinary Medical Association. , (2020).
- Harfe, B. D., et al. Evidence for an expansion-based temporal Shh gradient in specifying vertebrate digit identities. Cell. 118 (4), 517-528 (2004).
- Chamberlain, C. E., Jeong, J., Guo, C., Allen, B. L., McMahon, A. P. Notochord-derived Shh concentrates in close association with the apically positioned basal body in neural target cells and forms a dynamic gradient during neural patterning. Development. 135 (6), 1097-1106 (2008).
- Muzumdar, M. D., Tasic, B., Miyamichi, K., Li, L., Luo, L. A global double-fluorescent Cre reporter mouse. Genesis. 45 (9), 593-605 (2007).
- Bacallao, R., Sohrab, S., Phillips, C. Handbook Of Biological Confocal Microscopy. Pawley, J. B. , Springer US. 368-380 (2006).
- Tagliaferro, P., Tandler, C. J., Ramos, A. J., Pecci Saavedra, J., Brusco, A. Immunofluorescence and glutaraldehyde fixation. A new procedure based on the Schiff-quenching method. Journal of Neuroscience Methods. 77 (2), 191-197 (1997).
- Neckel, P. H., Mattheus, U., Hirt, B., Just, L., Mack, A. F. Large-scale tissue clearing (PACT): Technical evaluation and new perspectives in immunofluorescence, histology, and ultrastructure. Scientific Reports. 6 (1), 1-13 (2016).
- Clendenon, S. G., Young, P. A., Ferkowicz, M., Phillips, C., Dunn, K. W. Deep tissue fluorescent imaging in scattering specimens using confocal microscopy. Microscopy and Microanalysis. 17 (4), 614-617 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados