Method Article
In vivo Imágenes de calcio de campo amplio y dos fotones de un ratón usando una ventana craneal grande
En este artículo
Resumen
El presente protocolo describe la fabricación de una ventana craneal grande (6 x 3 mm2) utilizando envoltura de alimentos, silicona transparente y vidrio de cubierta. Esta ventana craneal permite experimentos in vivo de imágenes de calcio de campo amplio y dos fotones en el mismo ratón.
Resumen
Las imágenes de calcio de campo amplio del neocórtex del ratón permiten observar la actividad neuronal de toda la corteza relacionada con varias funciones cerebrales. Por otro lado, las imágenes de dos fotones pueden resolver la actividad de los circuitos neuronales locales a nivel de una sola célula. Es fundamental hacer una ventana craneal grande para realizar análisis a escala múltiple utilizando ambas técnicas de imagen en el mismo ratón. Para lograr esto, uno debe eliminar una gran sección del cráneo y cubrir la superficie cortical expuesta con materiales transparentes. Anteriormente, se han desarrollado cráneos de vidrio y ventanas craneales a base de polímeros para este propósito, pero estos materiales no se fabrican fácilmente. El presente protocolo describe un método simple para hacer una ventana craneal grande que consiste en una película de envoltura de cloruro de polivinilideno (PVDC) disponible comercialmente, un tapón de silicona transparente y un vidrio de cubierta. Para obtener imágenes de la superficie dorsal de todo un hemisferio, el tamaño de la ventana fue de aproximadamente 6 x 3 mm2. No se observaron vibraciones cerebrales severas independientemente de una ventana tan grande. Es importante destacar que la condición de la superficie del cerebro no se deterioró durante más de un mes. Las imágenes de campo amplio de un ratón que expresa un indicador de calcio codificado genéticamente (GECI), GCaMP6f, específicamente en astrocitos, revelaron respuestas sincronizadas en unos pocos milímetros. Las imágenes de dos fotones del mismo ratón mostraron respuestas prominentes de calcio en astrocitos individuales durante varios segundos. Además, se aplicó una capa delgada de un virus adenoasociado a la película de PVDC y se expresó con éxito GECI en neuronas corticales sobre la ventana craneal. Esta técnica es confiable y rentable para hacer una ventana craneal grande y facilita la investigación de la dinámica neuronal y glial y sus interacciones durante el comportamiento a nivel macroscópico y microscópico.
Introducción
Las imágenes de calcio de campo amplio investigan eficazmente el patrón de actividad espaciotemporal en una gran área del cerebro animal 1,2,3. Las imágenes de campo amplio se han utilizado ampliamente para observar toda la superficie cortical de los roedores, ya que su corteza es relativamente plana 2,3,4,5,6,7,8,9,10. Los ratones transgénicos o los ratones inyectados con virus adenoasociados (AAV), que expresan específicamente GECI en varias células, como neuronas y células gliales, se pueden usar para imágenes de calcio de campo amplio11,12,13. Sin embargo, la resolución espacial de esta técnica no suele ser suficiente para resolver la actividad de células individuales in vivo14. Tampoco es adecuado para obtener imágenes de células ubicadas en capas más profundas.
Por otro lado, las imágenes de calcio de dos fotones pueden observar la actividad de múltiples células simultáneamente con resolución espacial subcelular, lo que permite la observación de la actividad de células individuales incluso en dendritas neuronales y procesos gliales 15,16,17,18,19,20,21,22. También puede observar células en capas más profundas de la corteza cerebral23,24. Aunque los avances tecnológicos recientes en microscopía de dos fotones permiten obtener imágenes de regiones corticales de milímetros de ancho 25,26,27,28,29, todavía es difícil observar un área comparable a las imágenes de campo amplio mediante imágenes de dos fotones.
Para comprender la relevancia fisiológica de la actividad cerebral de una sola célula a todo el cerebro, es fundamental cerrar la brecha entre la actividad de las regiones corticales en toda la corteza y la de resolución de una sola célula en los circuitos neuronales locales. Por lo tanto, una combinación de imágenes de calcio de campo amplio y dos fotones realizadas en el mismo ratón es especialmente efectiva. Para realizar esto, se debe crear una ventana craneal amplia y estable, idealmente durante un largo período.
Anteriormente, se han desarrollado varias técnicas para hacer ventanas craneales para permitir la obtención de imágenes de campo amplio y de dos fotones en el mismo ratón30,31. Las ventanas de vidrio de cubierta de forma trapezoidal (cráneo de cristal), que se moldean en la forma de la superficie cortical para reemplazar el hueso eliminado, permiten el acceso óptico a través de toda la corteza32. Alternativamente, las ventanas craneales a base de polímeros se pueden hacer con tereftalato de polietileno (PET)33 o fluoropolímeros amorfos recubiertos de polietilenonanohoja 34. Se ha demostrado que cada método mantiene una ventana estable durante más de 1 mes. Sin embargo, producir estas ventanas no es fácil, y los materiales y equipos utilizados son a menudo caros.
El presente estudio describe un nuevo método para hacer una ventana craneal grande utilizando la película PVDC (envoltura plástica de alimentos) (Figura 1). Usando esta ventana, se pueden realizar experimentos de imágenes de campo amplio y de dos fotones in vivo en los mismos ratones. También se ha demostrado que los GECI podrían expresarse en neuronas en una amplia área de la corteza de ratones formando una capa delgada de película que contiene partículas AAV en la envoltura.
Protocolo
Los procedimientos experimentales fueron aprobados por el Comité de Experimentación Animal de la Universidad de Yamanashi. En este estudio se utilizaron ratones de tipo salvaje (C57BL / 6J, Japan SLC) y transgénicos que expresan GECI anclado a la membrana (Lck-GCaMP6f) en astrocitos. Los ratones transgénicos se obtuvieron cruzando ratones AldH1l1-CreERT2 [B6N. Ratones FVB-Tg(Aldh1l1-cre/ERT2)1Khakh/J, obtenidos comercialmente, ver Tabla de materiales] y ratones Flx-Lck-GCaMP6f [C57BL/6N-Gt(ROSA)26Sor/J, obtenidos comercialmente]. Los ratones transgénicos fueron tratados con tamoxifeno (20 mg/ml) durante 5 días (0,05 mL/10 g pc, i.p.) para expresar GCaMP6f. Todos los ratones utilizados eran machos y hembras de al menos 4 semanas de edad. El esquema de la ventana se muestra en la Figura 1A, y el procedimiento quirúrgico se resume en la Figura 1B.
1. Preparación para la cirugía de ventana craneal
- Anestesiar ratones con isoflurano (inducción: 3%, cirugía: 1%-1,5%, caudal: 0,2-0,3 L/min). Confirme la profundidad de la anestesia por la pérdida del reflejo de pellizco de la cola o del dedo del pie. Mantener la temperatura corporal utilizando una almohadilla térmica (36-38 °C). Aplique ungüento para los ojos con un hisopo de algodón para evitar que los ojos de los ratones se sequen bajo anestesia.
- Inyecte la solución de manitol al 15% (ver Tabla de materiales) por vía intraperitoneal (3 ml/100 g de peso corporal). Fije la cabeza del ratón en un marco estereotáxico con barras para los oídos. Retire el vello de la cabeza del ratón con una afeitadora y crema depilatoria.
- Desinfecte la superficie de la piel con povidona yodada y alcohol tres veces. Aplique lidocaína tópicamente para proporcionar analgesia preventiva. Retire la piel sobre el área de interés con tijeras quirúrgicas y exponga el cráneo (tamaño: 15 x 15 mm). Si hay sangrado, use un hisopo de algodón para detener el sangrado.
NOTA: En este estudio, se eliminó la piel para observar la corteza prefrontal a la corteza visual. - Retire el periostio sobre el cráneo expuesto usando una microcureta y seque la superficie del cráneo para unir firmemente la placa de la cabeza al cráneo con cemento dental (ver Tabla de materiales) (Figura 2B).
NOTA: La placa de cabeza hecha a medida se crea utilizando una impresora 3D. El archivo de diseño se deposita en el repositorio de Github (https://github.com/Satoshi-Manita/Head-plates). - Fije la placa de la cabeza con cemento dental (Figura 2C). Espere al menos 20 minutos para que el cemento se endurezca. Asegure la placa de cabeza con el soporte de la placa de cabeza35.
2. Hacer la ventana craneal
- Retire el cemento adicional sobre el cráneo con un taladro dental (consulte la Tabla de materiales). Tenga cuidado de no perforar el hueso y dañar el cerebro al perforar.
- Marque el área a cortar con un bolígrafo y corte en el hueso con un bisturí. Rome la punta del bisturí para asegurarse de que la punta no penetre en el cráneo (Figura suplementaria 1). Haga referencia al atlas cerebral para determinar dónde hacer la ventana.
NOTA: Para el presente estudio, se creó una ventana entre -2 mm y +4 mm desde bregma en el eje anteroposterior y desde la sutura sagital hasta +3 mm en el eje mediolateral, incluyendo las cortezas motora, somatosensorial y visual. - Raspa el hueso repetidamente con un bisturí para profundizar el surco hasta que el hueso en el área a recortar se mueva bien cuando se toque ligeramente.
- Retire el hueso inciso con pinzas finas. No empuje el colgajo óseo hacia el cerebro, ya que puede dañar el cerebro (Figura 1Ba).
NOTA: Si se observa sangrado después de extraer el hueso, aplique y aspire inmediatamente líquido cefalorraquídeo artificial (ACSF, consulte la Tabla de materiales) y repita este proceso hasta que se detenga el sangrado. Alternativamente, coloque una esponja de gelatina hemostática (aproximadamente cubos cuadrados de 3 mm) empapada en el ACSF en el punto de sangrado. - Si no se retira la duramadre, continúe con el paso 2.7.
- Retire la duramadre siguiendo los pasos a continuación.
- Retire la duramadre, por ejemplo, en las siguientes situaciones; transfección utilizando el método de película fibroína-AAV36 y observando estructuras pequeñas como espinas dendríticas.
- Cortar la duramadre con una pipeta de vidrio tirado con una punta cónica de unos 10 μm. Para expandir este corte sobre toda la ventana, use una aguja en forma de U.
- Ajuste el zoom del estereomicroscopio a 60-100x y retire la duramadre cortada con pinzas ultrafinas. Si la eliminación de la duramadre causa sangrado, enjuague con ACSF o use una esponja de gelatina para detener el sangrado.
- Recorta la envoltura de PVDC.
- Esterilice una pieza grande (por ejemplo, 10 x 15 mm) de envoltura de PVDC (aproximadamente 11 μm, consulte la Tabla de materiales, Figura 2Aa) en autoclave y con etanol al 70%.
- Bajo un microscopio estereoscópico, use pinzas y un bisturí para cortar una envoltura del tamaño requerido.
NOTA: El tamaño de la envoltura debe ser aproximadamente 10 mm más grande que el tamaño de la ventana craneal, pero más pequeño que la abertura de la placa principal. Para una ventana craneal de 6 x 3 mm 2, prepare una envoltura de 15 x 10 mm2.
- Coloque la envoltura con precisión siguiendo los pasos a continuación.
- Coloque la envoltura en la superficie del cerebro, dejando el ACSF en la superficie. Aspire el ACSF del borde de la envoltura, permitiendo que la envoltura se adhiera firmemente a la superficie del cerebro (Figura 1Bb, c).
NOTA: La envoltura utilizada es resistente a las arrugas, por lo que simplemente colocarla en la superficie del cerebro casi no produce arrugas. - Recorte la envoltura con un bisturí y unas pinzas para que haya aproximadamente un margen de 1 mm entre el borde de la ventana craneal y la envoltura (Figura 1Bd).
- Una vez que la envoltura esté en su lugar, pegue el borde de la envoltura al cráneo con un adhesivo biológico (consulte la Tabla de materiales, Figura 2D). Deje que el adhesivo se seque durante unos 30 minutos.
- Coloque la envoltura en la superficie del cerebro, dejando el ACSF en la superficie. Aspire el ACSF del borde de la envoltura, permitiendo que la envoltura se adhiera firmemente a la superficie del cerebro (Figura 1Bb, c).
- Aplicar el elastómero de silicona transparente.
- Aplique el elastómero de silicona transparente disponible comercialmente (consulte la Tabla de materiales) en la parte superior de la envoltura utilizando un dispensador con una punta mezcladora (Figura 1B e, 2Ab-d) y coloque el vidrio de la cubierta (0.12-0.17 mm de espesor) en la parte superior (Figura 2E).
- Selle el perímetro del vidrio de la cubierta con película impermeable, superglue o cemento dental (Figura 1Bf).
- Después de la cirugía, controle al ratón hasta que recupere la conciencia para mantener la decúbito esternal. Después de eso, mantenga a los ratones individualmente y permítales recuperarse en su jaula doméstica durante al menos 7 días.
- Para reducir el estrés y el dolor, administre agentes antiinflamatorios y analgésicos (p. ej., dexametasona y ketoprofeno, 5 mg/kg cada uno, p.i.).
- Controle a los ratones regularmente para detectar infecciones. Si se confirma una infección, administre un fármaco antimicrobiano (p. ej., enrofloxacino al 10 %, 1,7 μL/ml) en el agua potable hasta que se elimine la infección (generalmente menos de 4 semanas).
3. Hacer película AAV en envoltura de plástico usando solución de fibroína
NOTA: El paso 3 es opcional.
- Preparar solución de fibroína a partir de capullos de gusanos de seda siguiendo un método previamente publicado37.
- En resumen, hervir los capullos de gusanos de seda normales disponibles comercialmente (5 g, ver Tabla de materiales) en solución de carbonato de sodio (0.02 M, 2 L). Lave los capullos en agua ultrapura y seque durante la noche.
- Disolver los capullos secos en solución de bromuro de litio (9,3 M, 20% p/v fibroína) mientras se calienta en un horno a 60 °C durante 4 h. Dializar la solución de capullo disuelta, centrifugar (dos veces a 12.700 x g, a 4 °C durante 20 min)37 y recoger el sobrenadante.
- Prepare la película de fibroína-AAV siguiendo los pasos a continuación.
- Mezclar las soluciones de fibroína y AAV20 en una proporción de 1:4 en un pequeño tubo de muestra con una micropipeta. Deje caer una alícuota de la solución mixta de fibroína-AAV sobre la envoltura de plástico para la ventana craneal y séquela durante al menos 3 h.
NOTA: Para la expresión en un área de 3 mm de diámetro, aplicar una gota de 5 μL de solución de fibroína-AAV. Esta proporción determina la cantidad de solución para un área determinada. - Después del secado, corte la envoltura de plástico en el tamaño requerido para la ventana (por ejemplo, 10 x 15 mm) y colóquela en la superficie del cerebro. A continuación, siga el método mencionado anteriormente desde el paso 2.8.1 en adelante.
NOTA: Antes de colocar la envoltura en la superficie del cerebro, retire el ACSF en la superficie del cerebro tanto como sea posible. Esto se debe a que se espera que el ACSF disuelva la película de fibroína-AAV y reduzca la concentración de partículas de AAV. - Espere alrededor de 2-4 semanas después de crear la ventana tratada con AAV hasta que los GECI se expresen lo suficiente. Durante este proceso, verifique el estado de los ratones y las ventanas regularmente.
- Mezclar las soluciones de fibroína y AAV20 en una proporción de 1:4 en un pequeño tubo de muestra con una micropipeta. Deje caer una alícuota de la solución mixta de fibroína-AAV sobre la envoltura de plástico para la ventana craneal y séquela durante al menos 3 h.
4. Imágenes y análisis de calcio
NOTA: Para obtener detalles sobre las imágenes y el análisis, consulte los informes publicados anteriormente 1,2,38.
- Realice imágenes de campo amplio siguiendo los pasos a continuación.
- Inmovilice el ratón utilizando un dispositivo de fijación de la cabeza bajo un macroscopio de fluorescencia de lente en tándem (consulte la Tabla de materiales).
- Ilumine la corteza cerebral de ratones con luz de excitación de una fuente de luz LED de 465 nm a través de un filtro de excitación, espejo dicroico y lente objetiva.
- Recopile las imágenes de fluorescencia de la corteza cerebral mediante una cámara CCD a través de una lente objetiva (1.0x), espejo dicroico, filtro de emisión y lente de imagen (2.0x). La combinación de estas lentes da un aumento total de aproximadamente 0.5x.
- Adquiera imágenes a una frecuencia de muestreo de 50 Hz. Después de la adquisición de datos, analice las imágenes utilizando el software ImageJ. Seleccione la región de interés (ROI) manualmente. Calcule el cambio de fluorescencia en cada ROI como ΔF / F = (Ft - F0) / F0, donde Ft es el valor de fluorescencia bruto de cada cuadro y F0 es el valor de fluorescencia promedio obtenido de una imagen promedio de todos los cuadros.
NOTA: Un programa de macro para ImageJ se deposita en GitHub (https://github.com/Satoshi-Manita/ImageJ-macro), que calcula imágenes ΔF/F a partir de datos de imágenes de calcio.
- Realice imágenes de dos fotones siguiendo los pasos a continuación.
- Inmovilice el ratón bajo un microscopio de dos fotones utilizando un dispositivo de fijación de la cabeza. Identifique el área a fotografiar utilizando el microscopio en modo de campo claro con una lente de objetivo de bajo aumento (5x).
- Cambie a imágenes de dos fotones. Utilice una lente de objetivo de gran aumento (16x o 25x) e ilumine el láser para la excitación de dos fotones.
NOTA: Lck-GCaMP6f22 verde y XCaMP-R36 rojo fueron excitados por un láser ultrarrápido en longitudes de onda de excitación de 920 nm y 1070 nm, respectivamente. - Adquirir imágenes de fluorescencia a 30 Hz. Después de la adquisición de datos, corrija los artefactos de movimiento mediante la función de registro del software suite2p39. Obtenga ROI y ΔF/F de las imágenes utilizando el mismo método para imágenes de campo amplio.
- Trazar los datos usando python con las siguientes bibliotecas: NumPy, Matplotlib y Pandas (consulte Tabla de materiales).
Resultados
Evaluación de una ventana craneal grande realizada utilizando los métodos de envoltura PVDC
Inmediatamente después de la cirugía, el éxito o el fracaso se pueden verificar de un vistazo por la condición de la superficie cortical, como sangrado y cambio de color debido a daño o isquemia. Mucho tiempo después de la cirugía, la superficie cortical puede cubrirse con una membrana blanca opaca debido a una infección, o la sangre puede cubrir la ventana debido al sangrado (Figura 2G). En estos casos, la corteza puede no estar en condiciones saludables y las imágenes pueden no ser posibles. Estos podrían ser causados por envolturas parcialmente cortadas o fijación insuficiente de la envoltura por el adhesivo. Si la infección se observa repetidamente, puede ser eficaz aplicar antibióticos, por ejemplo, sulfato de gentamicina (10 μL, 50 mg / ml), sobre la superficie del cerebro en la colocación de la ventana. La regeneración de meninges o huesos también se observa cuando el espacio vertical entre la superficie cortical y la envoltura es grande. Para evitar esto, es crucial aplicar la envoltura lo más apretada posible a la superficie del cerebro durante la preparación de la ventana. Esto se puede lograr colocando una envoltura de plástico en la superficie del cerebro y succionando la mayor cantidad posible de ACSF. En ausencia de ACSF, se puede hacer simplemente colocando la envoltura de plástico en la superficie del cerebro. Se determina que el cerebro y los vasos sanguíneos no están dañados por el hecho de que el color del cerebro no está descolorido y los vasos sanguíneos no están cortados.
La longevidad de la ventana depende en gran medida de la calidad de la cirugía. Cuando la afección es buena, no hay signos de infección, sangrado o regeneración más de 1 mes después de la cirugía (Figura 2F y Figura 3B). En 8 de cada 10 ratones, la ventana podría mantenerse despejada hasta 10 semanas o más. Las ventanas en dos de los ratones no pudieron mantenerse adecuadamente debido a una infección o sangrado. Aunque la ventana grande puede ser propensa a estrés mecánico o impacto, no se observaron ventanas rotas o agrietadas.
Para evaluar la calidad de imagen de la nueva ventana craneal con la envoltura, la silicona y el vidrio, la función de dispersión de puntos se comparó debajo de la nueva ventana con la de la ventana de vidrio convencional mediante la obtención de imágenes de perlas fluorescentes de 0,1 μm en agar (ver Archivo Suplementario 1). Los resultados no mostraron diferencias en el ancho total a la mitad máximo (FWHM) para ambas condiciones. [Eje X (μm): vidrio solamente, 1.99 ± 0.07, envoltura, 1.76 ± 0.13, eje Y (μm): vidrio solamente, 2.11 ± 0.27, envoltura, 1.90 ± 0.15, eje Z (μm): vidrio solamente, 25.29 ± 0.71, envoltura, 26.64 ± 1.02, N = 7 cuentas, p > 0.05, la prueba U de Mann-Whitney, Figura suplementaria 2A, B]. Por lo tanto, los nuevos elementos añadidos (envoltura y silicona) no deterioraron la calidad de la imagen.
Los artefactos de vibración causados por la respiración, los latidos del corazón y el movimiento del cuerpo están presentes en imágenes de campo amplio y de dos fotones. Para determinar cuánto vibra la nueva ventana craneal, se seleccionó una pequeña partícula fluorescente de los datos de imágenes de dos fotones in vivo y se examinó cuánto se movió su imagen durante 60 s. Se encontró que la desviación estándar del centroide de esa partícula fluorescente era de aproximadamente 0,3 μm, que es comparable a la de una ventana de vidrio convencional (Figura complementaria 2C). Esto indica que debido a que el cerebro estaba sujeto por un tapón de silicona transparente y un vidrio de cubierta, las vibraciones eran comparables a las observadas en ventanas convencionales más pequeñas, y el registro de imágenes fuera de línea era suficiente para eliminar los artefactos de vibración.
En imágenes de calcio de campo amplio, se pudo observar que la actividad cortical se propaga a través de la corteza inducida por la estimulación sensorial (Figura 3A-D, K-N). Las imágenes de dos fotones permitieron la observación de imágenes de fluorescencia unicelular específicas de neuronas y células gliales (Figura 3E, O). Los cambios de fluorescencia inducidos por la estimulación sensorial se pueden observar en células individuales (Figura 3E-J, O-T).
Expresión de indicadores de calcio codificados genéticamente (GECI) en una amplia área de la corteza cerebral utilizando la envoltura PVDC y AAV
La envoltura de PVDC para la ventana podría aplicarse para expresar proteínas funcionales en un área amplia de la corteza. Esto se logra utilizando AAV y fibroína, una proteína componente de los capullos de gusanos de seda que han sido ampliamente aplicados como biomateriales37. Un estudio previo mostró que la fibroína podía mezclarse con AAVs, formando películas implantadas en el cerebro para expresar proteínas funcionales como opsinas fotoactivables o GECIs36. En el presente estudio, el AAV que expresa GECI y fibroína se mezcló y secó en la envoltura, y se utilizó una envoltura recubierta de AAV para la ventana craneal. Esto resultó en la expresión de GECI en la amplia área de la corteza 2-4 semanas después de la cirugía (Figura 3K-M). Dado que la ventana era grande, se pueden visualizar diferentes áreas corticales del mismo ratón (Figura 3M-T).
Para confirmar la eficiencia de expresión de este método, se contó el número de células que expresan GECI en el cerebro fijo (Figura complementaria 2D). Se encontró que la presente estrategia utilizando la envoltura con fibroína-AAV resultó en la expresión de GECI con una eficiencia de aproximadamente 20% tanto en capas superficiales como más profundas (L2/3: 20,78%, célula que expresa XCaMP-R: 32 células, DAPI: 154 ubicaciones, L5: 20,08%, célula que expresa XCaMP-R: 51 células, DAPI: 254 ubicaciones). Por lo tanto, este método expresó GECIs en células no solo en capas superficiales sino también en capas más profundas.
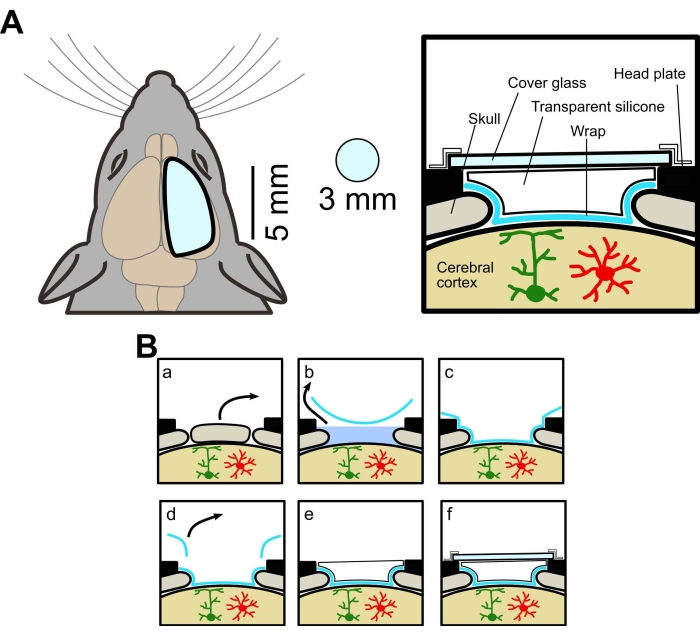
Figura 1: Diagrama conceptual de la ventana craneal grande. (A) Izquierda, dibujo esquemático de la nueva ventana craneal. Es más grande que la ventana convencional (3 mm de diámetro). Derecha, vista transversal. El método para hacer una ventana craneal grande utiliza envoltura de alimentos, elastómero de silicona transparente y vidrio de cubierta, lo que permite obtener imágenes de campo amplio y dos fotones del mismo ratón. (B) Procedimiento de fabricación de ventanas craneales: (a) Extracción de hueso. b) Retirada de la FSCA debajo de la envoltura. (c) Adherencia de la envoltura a la superficie del cerebro mediante la eliminación de ACSF. d) Cortar el exceso de envoltura. e) Aplicación de silicona transparente. f) Colocación de la cubierta de vidrio. Haga clic aquí para ver una versión más grande de esta figura.
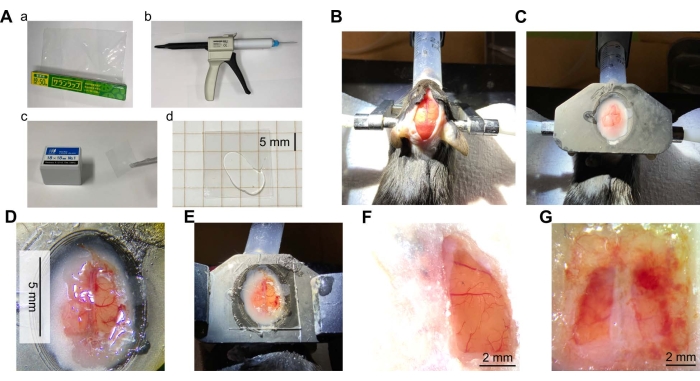
Figura 2: Descripción general de la cirugía de ventana craneal. (A) Materiales y equipos necesarios para la ventana craneal. a) Película de envoltura de cloruro de polivinilideno (PVDC). b) Un dispensador de elastómero de silicona transparente con punta de mezcla. c) Cubrir el vidrio. d) Silicona transparente colocada entre dos piezas del vidrio de la cubierta. (B) Fotografía de la piel de la cabeza del ratón incisa para exponer el cráneo. El ratón fue anestesiado y la cabeza del ratón fue inmovilizada con barras para los oídos. Luego se depiló la cabeza, se trató con analgesia local y se le incidió la piel. (C) Fotografía después de la instalación de una placa de cabeza. Una placa de cabeza (hecha de resina de una impresora 3D) se unió a la cabeza del ratón con cemento dental. (D) Fotografía de una ventana craneal. La ventana craneal se creó en la corteza del hemisferio derecho del cerebro del ratón. Se retiró la duramadre y se pegó la envoltura en su lugar. (E) Una foto de la ventana hecha de la envoltura con la silicona transparente y el vidrio de la cubierta en la parte superior. (F) Un ejemplo típico de una ventana exitosa (hemisferio derecho, 7 semanas después de la cirugía). (G) Ejemplo de ventana fallida (ambos hemisferios, 5 semanas después de la cirugía). Haga clic aquí para ver una versión más grande de esta figura.
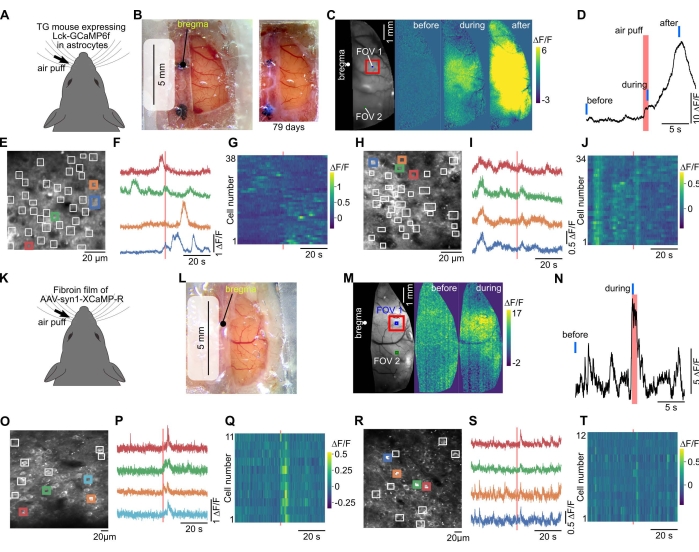
Figura 3: La ventana grande permite obtener imágenes de calcio de campo amplio y de dos fotones del mismo ratón. (A) La imagen de calcio se realizó en un ratón transgénico que expresaba GECI anclado a la membrana (Lck-GCaMP6f) en astrocitos40. (B) A la izquierda, se creó una gran ventana con envoltura de plástico, silicona transparente y vidrio de cubierta. Las imágenes de campo amplio se realizaron a través de esta ventana. Derecha, se capturó una foto 79 días después de la instalación de la ventana craneal. (C) Cuando se aplicó estimulación de soplo de aire a los bigotes contralaterales, se observaron cambios de fluorescencia. (D) Se trazó el curso temporal del cambio de fluorescencia en la corteza somatosensorial (cuadrado rojo en C). Las barras rojas y azules indican el tiempo de inhalación de aire y el tiempo "antes", "durante" y "después" en (C), respectivamente. (E) El campo de visión (FOV 1 en C) de imágenes de calcio de dos fotones. Debido a que GCaMP6f se expresó para localizarse en la membrana, las regiones de interés (cuadrados blancos) se colocaron manualmente para detectar la respuesta local en los procesos de astrocitos. (F) Se trazan los cambios de fluorescencia en los cuadrados coloreados en (E). (G) Se representan los cambios de fluorescencia en todos los cuadrados de (E). Los ejes horizontal y vertical indican el tiempo y el número de celdas, respectivamente. (H-J) Se muestran los datos para FOV 2 (en la corteza visual) en (C). El FOV 2 fue fotografiado después de la imagen en el FOV 1. (K) GECI rojo, XCaMP-R, se expresó en neuronas por el método de fibroína-AAV en el ratón de tipo salvaje. (L) Fotografía capturada dos semanas después de la cirugía en la que se creó la ventana utilizando la película de fibroína. (M) Se realizaron imágenes de calcio de campo amplio en este ratón. (N) El cambio de fluorescencia evocado por la estimulación de los bigotes se trazó desde el sitio más prominente (corteza somatosensorial, cuadrado rojo en (M)). Las líneas rojas y azules indican el tiempo de inhalación de aire y el tiempo "antes" y "durante" en (M), respectivamente. (O) Campo de visión (corteza somatosensorial, FOV 1 in (M)) de imágenes de calcio de dos fotones a 300 μm de profundidad. Los ROI se colocaron manualmente en el somata neuronal. (P) Se trazan los cambios de fluorescencia en los cuadrados coloreados en (O). (Q) Los cambios de fluorescencia en todos los cuadrados de (O) se trazan en color. (R-T) Se muestran los datos para FOV 2 en (M) ubicado en la corteza parietal. Haga clic aquí para ver una versión más grande de esta figura.
Figura complementaria 1: Consejos para bisturís. La punta del nuevo bisturí (arriba) en comparación con el bisturí utilizado para cortar el cráneo con una punta roma (abajo). Haga clic aquí para descargar este archivo.
Figura complementaria 2: Validación de la nueva ventana craneal y del método de expresión de fibroína-VAA. (A) Perfil de intensidad de fluorescencia de las perlas fluorescentes de 0,1 μm en agar. La fila superior muestra datos de una condición en la que solo se colocó vidrio de cubierta sobre perlas fluorescentes mezcladas en agar, y la fila inferior muestra datos de una condición en la que se colocaron envoltura, silicona transparente y vidrio de cubierta. Las trazas grises muestran el ajuste gaussiano al perfil de intensidad de fluorescencia para cada cuenta, y las trazas rojas muestran sus valores promedio (n = 7). (B) Resumen de los datos en (A). Cada gráfico muestra el ancho completo a la mitad máximo (FWHM) de la función de dispersión de puntos en el eje XYZ. El gráfico gris muestra los datos de cada cuenta, y el rojo muestra su error medio y estándar. (C) A partir de los 2.000 fotogramas (60 s de grabación) de datos de imágenes in vivo , se seleccionó una pequeña partícula fluorescente y se examinó cuánto se movió la imagen durante los años 60. La imagen fluorescente en el centro representa el promedio de 2.000 cuadros. Las imágenes se proyectaron promediando en las direcciones de los ejes X e Y. Los histogramas muestran la distribución del centroide en cada fotograma. Las desviaciones estándar del centroide fueron X: 0,36 e Y: 0,315 μm. (D) Ejemplo de expresión de GECI por el método fibroína-AAV. Izquierda: Una porción de la corteza cerebral aplicó el método de expresión de fibroína-AAV. El rojo y el azul indican fluorescencia de XCaMP-R y DAPI, respectivamente; XCaMP-R se expresó no solo en células de capa 2/3 sino también en células de capa 5. Centro y derecha. Vistas ampliadas de las capas 2/3 y 5 en la figura de la izquierda (cuadrados cian), respectivamente. Haga clic aquí para descargar este archivo.
Archivo complementario 1: (A) Eficiencia de expresión de la envoltura con el método de película fibroína-AAV y (B) Evaluación de la función de dispersión puntual durante la obtención de imágenes de dos fotones. Haga clic aquí para descargar este archivo.
Discusión
Este artículo presenta un método económico para crear una ventana craneal grande utilizando una envoltura de plástico PVDC, silicona transparente y vidrio de cubierta. Usando este método, demostramos que las imágenes de calcio de campo amplio podrían realizarse en un área amplia de la corteza cerebral. Las imágenes de calcio de dos fotones se pueden realizar desde varias regiones corticales diferentes en el mismo ratón que se ha sometido a imágenes de campo amplio. Además, se ha demostrado que una película de fibroína-AAV en la envoltura de plástico utilizada para la ventana podría expresar GECI en una amplia área de la corteza.
Pasos críticos
Es importante evitar infecciones y daños en el cerebro al hacer ventanas craneales con envoltura de plástico. En estas condiciones, no se puede observar la actividad neuronal y glial, y las imágenes de áreas más profundas son imposibles. La lesión de los vasos sanguíneos también resulta en sangrado, lo que hace que las imágenes sean imposibles debido a la sangre. Para evitar la infección, hacer que la superficie del cerebro y la envoltura se adhieran lo más apretada posible es fundamental succionando el ACSF. La administración de manitol es importante para evitar el daño cerebral y de los vasos sanguíneos mediante la prevención del aumento de la presión cerebral durante la cirugía. Esto mantiene el espacio entre la superficie del cerebro y la duramadre y evita que el cerebro y los vasos sanguíneos se toquen durante la extirpación del cráneo y la duramadre. Un microscopio estereoscópico con gran aumento y pinzas con puntas afiladas también son eficaces para una cirugía precisa.
En el método fibroína-AAV, es esencial usar capullos de gusanos de seda de carne, no congelar la solución de fibroína, secar suficientemente la solución de fibroína-AAV y aplicar suficiente volumen de solución (5 μL por 3 mm de diámetro). Cuando se utilizaron capullos más antiguos, la eficiencia de expresión fue menor. Esto se debe a que la fibroína de los capullos viejos puede desnaturalizarse fácilmente. Cuando la solución de fibroína se congeló a -80 °C y se descongeló en el momento del uso, la eficiencia de expresión fue pobre. Esto puede deberse a la desnaturalización de la proteína debido a la congelación y descongelación. Dado que las soluciones de fibroína almacenadas a 4 °C se pueden utilizar eficazmente hasta la gelificación, se recomienda que las soluciones de fibroína se mantengan refrigeradas y purificadas de los capullos de nuevo después de la gelificación. La solución de fibroína-AAV debe secarse durante al menos 3 h, ya que la expresión es pobre después de menos de 3 h. Finalmente, el área de expresión depende de la cantidad de solución de fibroína-AAV utilizada. En el ejemplo de la Figura 3M, la cantidad era pequeña (5 μL); por lo tanto, la película de fibroína-AAV solo cubrió la mitad superior de la ventana, lo que resultó en una expresión no uniforme sobre la ventana. Si se utiliza una cantidad suficiente de fibroína-AAV, la expresión será uniforme en toda la ventana.
Modificaciones de la técnica
La novedosa técnica de ventana craneal permite examinar la actividad macroscópica de los circuitos corticales y su actividad subyacente a nivel de una sola célula en el mismo ratón. Por lo tanto, el método se puede aplicar a una variedad de estudios de neurociencia. Por ejemplo, se puede utilizar para observar la actividad cortical durante las tareas de toma de decisiones, el aprendizaje motor y en modelos de ratón de lesión cerebral y enfermedad. También creemos que el método se puede aplicar no solo a roedores sino también a primates no humanos.
Este documento demuestra que la gran ventana craneal es efectiva para obtener imágenes de ratones transgénicos y ratones inyectados con proteínas funcionales que expresan AAV. En particular, se muestra que la película de fibroína-AAV en la envoltura es mucho más fácil que un método de inyección de AAV convencional para expresar GECI a través de la amplia área de la corteza. Usando una mezcla de dos AAVs que codifican GECIs de diferentes colores41, la correlación entre la actividad neuronal y de las células gliales puede ser fotografiada simultáneamente en una amplia área de la corteza. Además, el método de película de fibroína-AAV también se puede aplicar a otros biosensores codificados genéticamente 42,43,44,45,46,47.
La ventana craneal más grande, que puede obtener imágenes de ambos hemisferios, también es posible. Recientemente se han desarrollado microscopios de dos fotones con un campo de visión mucho más amplio (~25 mm2) 25,26,27,28,29. La combinación de esta técnica de imagen de dos fotones con imágenes de campo amplio de un fotón utilizando la amplia ventana craneal descrita aquí nos permitirá examinar la relación entre la actividad de la población y la actividad unicelular desde escalas sin precedentes.
Limitaciones
La envoltura de alimentos no permite el paso de ninguna sustancia. Esto hace que el método sea difícil de utilizar para experimentos farmacológicos. También es difícil quitar la envoltura, lo que hace imposible insertar una pipeta o electrodo de vidrio. Por lo tanto, es difícil implementar experimentos combinados con otros métodos, como imágenes simultáneas de calcio y registros electrofisiológicos, y la administración local de medicamentos utilizando una pipeta de vidrio. Una posible solución para estas limitaciones es usar la envoltura y la ventana de vidrio con un agujero. Esto permite el acceso al cerebro a través de una pipeta de vidrio o un electrodo de registro mientras mantiene la ventana craneal estéril durante un largo período48.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por la Subvención en Ayuda para Áreas de Investigación Transformadora (A) 'Decodificación Glial' (JP21H05621 a SM), JSPS KAKENHI (JP19K06883 a SM, 15KK0340 a ES, JP22H00432, JP22H05160, JP17H06312 a HB y JP17H06313 a KK), Subvención en ayuda para mapeo cerebral por neurotecnologías integradas para estudios de enfermedades (Cerebro / MENTES) (JP19dm0207079h0002 a SM, JP19dm0207079 a HB y JP19dm0207080 a KK), Narishige Neuroscience Research Foundation (a SM), Beca para jóvenes investigadores de la prefectura de Yamanashi (a SM) y Takeda Science Foundation (a SM) y parcialmente apoyada por The Frontier Brain Research Grant de la Universidad Yamanashi.
Agradecemos a N. Yaguchi y K. Okazaki por el cuidado de los animales y la asistencia técnica y a los miembros del laboratorio Kitamura por las útiles discusiones.
Materiales
| Name | Company | Catalog Number | Comments |
| 4% paraformaldehyde phosphate buffer solution | NACALAI TESQUE, Kyoto, Japan | TritonX | Expression efficiency of the wrap with the fibroin-AAV film method |
| 50 mL beaker | |||
| Acquisition software | Brain vision | BV_Ana | For wide-field calcium imaging of GCaMP6f |
| Acquisition software | Hamamatsu photonics | High speed recording software: HSR | For wide-field calcium imaging of XCaMP-R |
| Acquisition software | Vibrio Technologies | scanImage | For two-photon calcium imaging |
| ACSF (artificial cerebrospinal fluid) | 150 mM NaCl, 2.5 mM KCl, 10 mM HEPES, 2 mM CaCl2, 1 mM MgCl2, pH = 7.4 with 1M NaOH | ||
| ACSF aspiration needle | |||
| Adeno-associated virus | VectorBuilder | custom-made | AAV-DJ/8-Syn1-XCaMP-R |
| Adhesives for biological use | Daiichi Sankyo | Aron Alpha-A | |
| Anesthesia machine | Shinano seisakusho | SN-487 | |
| Anesthetic | Kyoritsu Seiyaku Corporation | pentobarbital | Expression efficiency of the wrap with the fibroin-AAV film method |
| Auxiliary ear bar | Narishige | EB-5N | |
| CCD camera | Brain vision | MiCAM02-HR | For wide-field calcium imaging of GCaMP6f |
| Clear vinyl polysiloxane | GC | Exaclear | |
| CMOS camera | Hamamatsu photonics | ORCA-spark | For wide-field calcium imaging of XCaMP-R |
| Cotton swab | |||
| Cover glass | Matsunami | 18 x 18 NO.1 | Size: 18 x 18 mm, Thickness: 0.13-0.17 mm, Borosilicate glass |
| DAPI | Thermo Fisher | D1306 | Expression efficiency of the wrap with the fibroin-AAV film method |
| Ddialysis cassette | 3.5K MWCO, Slide-A-Lyzer | ThermoFisher | |
| Dental adhesive resin cement | SUN MEDICAL | Super-Bond | |
| Dental drill | Nakanishi | VOLVERE Vmax | |
| Digital scale | Dretec | KS-243 | |
| Filters | Brain vision | EM: BP466/40-25, DM: DM506, EX: BP520/36-50 | |
| Filters | Olympus | U-MRFPHQ, EM: BP535-555HQ, DM: DM565HQ, Ex: BA570-625HQ | |
| Fluorescence microscope | Keyence | BZ-X810 | Expression efficiency of the wrap with the fibroin-AAV film method |
| Fluorescent beads | Fluoresbrite YG Carboxylate Microspheres | 0.1 µm | Evaluation of the point spread function under the conventional and the new cranial windows in two-photon imaging |
| Forceps | FST | No. 11252-20 | thin-tipped, for removal of dura mater |
| Forceps | KFI | K-7, No.J 18-8 | for general use |
| Gelatin for hemostasis | Johnson & Johnson | Spongostan | |
| Gentamicin sulfate | Iwaki seiyaku | ||
| Glass pipette | custom-made | ||
| Hair remover | Reckitt Japan | Veet | |
| Head fixing device | custom-made | Craniotomy for Cortical Voltage-sensitive Dye Imaging in Mice. Suzuki, T., and Murayama, M. Bio-protocol 2016 6:e1722. | |
| Head plate | custom-made | aluminum or resin, size: 40 x 25 mm, thickness: 1.5 mm or 2 mm, hole in the center: 15 x 10 mm (head_plate_06 v3.f3d) | |
| Heating pad | |||
| Image processing software (for calcium imaging data analysis) | ImageJ | https://imagej.net | |
| Isoflurane | Pfizer | ||
| Light source | Hayashi-repic | LA-HDF108AA | |
| Light source | Brain vision | LEX2-LZ4-B | For wide-field calcium imaging of GCaMP6f |
| Light source | Olympus | U-HGLGPS | For wide-field calcium imaging of XCaMP-R |
| Mannitol solution (15% with saline) | Sigma-Aldrich (Merck) | M4125 | |
| Micro curette | FST | No. 10080-05 | |
| Microscope | Brain vision | For wide-field calcium imaging of GCaMP6f | |
| Microscope | Olympus | MVX10 | For wide-field calcium imaging of XCaMP-R |
| Microscope | Sutter Instruments | MOM | For two-photon calcium imaging |
| Microslicer | Dosaka EM | DTK-1000N | Expression efficiency of the wrap with the fibroin-AAV film method |
| Mixing tip | GC | ||
| Needle (30 G) | |||
| Polyethylens spoids | AS ONE | 1-4656-01 | |
| Polyvinylidene chloride (PVDC) film | Asahi Kasei | Asahi Wrap (or Saran Wrap) | |
| Povidone-iodine | Mundipharma | Isodine | |
| Python libralies | NumPy | package for scientific computing, https://numpy.org/doc/stable/index.html# | |
| Matplotlib | library for visualizations, https://matplotlib.org/stable/index.html# | ||
| pandas | data analysis and manipulation tool, https://pandas.pydata.org | ||
| Scalpel | Kai | No. 11 | |
| Shaver for animal | |||
| Silicone dispensers | GC | ||
| Silkworm cocoon | Satoyama Craft News | https://sato-yama.jp/ | |
| Stereomicroscope | LEICA | MZ6 | objective lens: 0.63x, eyepiece: 25x |
| Surfactant | NACALAI TESQUE | TritonX | Expression efficiency of the wrap with the fibroin-AAV film method |
| Surgical Scissors | FST | No. 91460-11 | |
| Syringe for mannitol injection | Terumo | 1mL | |
| Transdermal anesthetic | AstraZeneca | Lidocaine | |
| Transgenic mice used for calcium imaging of astrocytes | The mice were obtained by the following method. AldH1l1-CreERT2 mice: B6N.FVB-Tg(Aldh1l1-cre/ERT2)1Khakh/J (The Jackson laboratory, strain #: 031008) Tamoxifen-inducible Cre recombinase expression directed at high levels to the vast majority of astrocytes Flx-Lck-GCaMP6f mice: C57BL/6N-Gt(ROSA)26Sor[tm1(CAG-GCaMP6f)Khak]/J (The Jackson laboratory, strain #: 029626) Cre-dependent expression of a plasma membrane-targeted GCaMP6f. A mouse born from crossbreeding these mice were treated with tamoxifen (20 mg/mL) for 5 days (0.05 mL/10g bw, i.p.) to express GCaMP6f. | ||
| Tunable ultrafast lasers | Spectra-Physics | InSight X3 | For two-photon calcium imaging |
| Waterproof film | Nichiban | BFR5 | |
| Wild-type mice | Japan SLC | C57BL/6J | Male and femalek, >4 weeks old |
Referencias
- Ren, C., Komiyama, T. Wide-field calcium imaging of cortex-wide activity in awake, head-fixed mice. STAR Protocols. 2 (4), 100973 (2021).
- Couto, J., et al. Chronic, cortex-wide imaging of specific cell populations during behavior. Nature Protocols. 16 (7), 3241-3263 (2021).
- Kauvar, I. V., et al. Cortical Observation by Synchronous Multifocal Optical Sampling Reveals Widespread Population Encoding of Actions. Neuron. 107 (2), 351-367 (2020).
- Clancy, K. B., Orsolic, I., Mrsic-Flogel, T. D. Locomotion-dependent remapping of distributed cortical networks. Nature Neuroscience. 22 (5), 778-786 (2019).
- MacDowell, C. J., Buschman, T. J. Low-dimensional spatiotemporal dynamics underlie cortex-wide neural activity. Current Biology. 30 (14), 2665-2680 (2020).
- Makino, H., et al. Transformation of cortex-wide emergent properties during motor learning. Neuron. 94 (4), 880-890 (2017).
- Murphy, T. H., et al. Automated task training and longitudinal monitoring of mouse mesoscale cortical circuits using home cages. eLife. 9, 559654 (2020).
- Rynes, M. L., et al. Miniaturized head-mounted microscope for whole-cortex mesoscale imaging in freely behaving mice. Nature Methods. 18 (4), 417-425 (2021).
- Cardin, J. A., Crair, M. C., Higley, M. J. Mesoscopic imaging: Shining a wide light on large-scale neural dynamics. Neuron. 108 (1), 33-43 (2020).
- Ren, C., Komiyama, T. Characterizing cortex-wide dynamics with wide-field calcium imaging. The Journal of Neuroscience. 41 (19), 4160-4168 (2021).
- Hamodi, A. S., Martinez Sabino, A., Fitzgerald, N. D., Moschou, D., Crair, M. C. Transverse sinus injections drive robust whole-brain expression of transgenes. eLife. 9, 53639 (2020).
- Michelson, N. J., Vanni, M. P., Murphy, T. H. Comparison between transgenic and AAV-PHP.eB-mediated expression of GCaMP6s using in vivo wide-field functional imaging of brain activity. Neurophotonics. 6 (2), 025014 (2019).
- Oomoto, I., et al. Protocol for cortical-wide field-of-view two-photon imaging with quick neonatal adeno-associated virus injection. STAR Protocols. 2 (4), 101007 (2021).
- Fan, J. T., et al. Video-rate imaging of biological dynamics at centimetre scale and micrometre resolution. Nature Photonics. 13 (11), 809-816 (2019).
- Stuart, G. J., Spruston, N. Dendritic integration: 60 years of progress. Nature Neuroscience. 18 (12), 1713-1721 (2015).
- Grienberger, C., Chen, X., Konnerth, A. Dendritic function in vivo. Trends in Neurosciences. 38 (1), 45-54 (2015).
- Takahashi, N., et al. Locally synchronized synaptic inputs. Science. 335 (6066), 353-356 (2012).
- Kitamura, K., Hausser, M. Dendritic calcium signaling triggered by spontaneous and sensory-evoked climbing fiber input to cerebellar Purkinje cells in vivo. The Journal of Neuroscience. 31 (30), 10847-10858 (2011).
- Manita, S., et al. A top-down cortical circuit for accurate sensory perception. Neuron. 86 (5), 1304-1316 (2015).
- Stobart, J. L., et al. Cortical circuit activity evokes rapid astrocyte calcium signals on a similar timescale to neurons. Neuron. 98 (4), 726-735 (2018).
- Srinivasan, R., et al. Ca(2+) signaling in astrocytes from Ip3r2(-/-) mice in brain slices and during startle responses in vivo. Nature Neuroscience. 18 (5), 708-717 (2015).
- Shigetomi, E., Patel, S., Khakh, B. S. Probing the complexities of astrocyte calcium signaling. Trends in Cell Biology. 26 (4), 300-312 (2016).
- Tischbirek, C., Birkner, A., Jia, H., Sakmann, B., Konnerth, A. Deep two-photon brain imaging with a red-shifted fluorometric Ca2+ indicator. Proceedings of the National Academy of Sciences of the United States of America. 112 (36), 11377-11382 (2015).
- Kondo, M., Kobayashi, K., Ohkura, M., Nakai, J., Matsuzaki, M. Two-photon calcium imaging of the medial prefrontal cortex and hippocampus without cortical invasion. eLife. 6, 26839 (2017).
- Demas, J., et al. cortex-wide volumetric recording of neuroactivity at cellular resolution using light beads microscopy. Nature Methods. 18 (9), 1103-1111 (2021).
- Ota, K., et al. cell-resolution, contiguous-wide two-photon imaging to reveal functional network architectures across multi-modal cortical areas. Neuron. 109 (11), 1810-1824 (2021).
- Sofroniew, N. J., Flickinger, D., King, J., Svoboda, K. A large field of view two-photon mesoscope with subcellular resolution for in vivo imaging. eLife. 5, 14472 (2016).
- Stirman, J. N., Smith, I. T., Kudenov, M. W., Smith, S. L. Wide field-of-view, multi-region, two-photon imaging of neuronal activity in the mammalian brain. Nature Biotechnology. 34 (8), 857-862 (2016).
- Yu, C. H., Stirman, J. N., Yu, Y., Hira, R., Smith, S. L. Diesel2p mesoscope with dual independent scan engines for flexible capture of dynamics in distributed neural circuitry. Nature Communications. 12 (1), 6639 (2021).
- Barson, D., et al. Simultaneous mesoscopic and two-photon imaging of neuronal activity in cortical circuits. Nature Methods. 17 (1), 107-113 (2020).
- Wekselblatt, J. B., Flister, E. D., Piscopo, D. M., Niell, C. M. Large-scale imaging of cortical dynamics during sensory perception and behavior. Journal of Neurophysiology. 115 (6), 2852-2866 (2016).
- Kim, T. H., et al. Long-term optical access to an estimated one million neurons in the live mouse cortex. Cell Reports. 17 (12), 3385-3394 (2016).
- Ghanbari, L., et al. Cortex-wide neural interfacing via transparent polymer skulls. Nature Communications. 10 (1), 1500 (2019).
- Takahashi, T., Zhang, H., Otomo, K., Okamura, Y., Nemoto, T. Protocol for constructing an extensive cranial window utilizing a PEO-CYTOP nanosheet for in vivo wide-field imaging of the mouse brain. STAR Protocols. 2 (2), 100542 (2021).
- Suzuki, T., Murayama, M. Craniotomy for cortical voltage-sensitive dye imaging in mice. Bio-Protocol. 6 (3), 1722 (2016).
- Jackman, S. L., et al. Silk fibroin films facilitate single-step targeted expression of optogenetic proteins. Cell Reports. 22 (12), 3351-3361 (2018).
- Rockwood, D. N., et al. Materials fabrication from Bombyx mori silk fibroin. Nature Protocols. 6 (10), 1612-1631 (2011).
- Jia, H., Rochefort, N. L., Chen, X., Konnerth, A. In vivo two-photon imaging of sensory-evoked dendritic calcium signals in cortical neurons. Nature Protocols. 6 (1), 28-35 (2011).
- Pachitariu, M., et al. Suite2p: beyond 10,000 neurons with standard two-photon microscopy. bioRxiv. , 061507 (2017).
- Srinivasan, R., et al. New transgenic mouse lines for selectively targeting astrocytes and studying calcium signals in astrocyte processes in situ and in vivo. Neuron. 92 (6), 1181-1195 (2016).
- Inoue, M., et al. Rational engineering of XCaMPs, a multicolor GECI suite for in vivo imaging of complex brain circuit dynamics. Cell. 177 (5), 1346-1360 (2019).
- Patriarchi, T., et al. Ultrafast neuronal imaging of dopamine dynamics with designed genetically encoded sensors. Science. 360 (6396), (2018).
- Sun, F., et al. A genetically encoded fluorescent sensor enables rapid and specific detection of dopamine in flies, fish, and mice. Cell. 174 (2), 481-496 (2018).
- Marvin, J. S., et al. An optimized fluorescent probe for visualizing glutamate neurotransmission. Nature Methods. 10 (2), 162-170 (2013).
- Feng, J., et al. A genetically encoded fluorescent sensor for rapid and specific in vivo detection of norepinephrine. Neuron. 102 (4), 745-761 (2019).
- Piatkevich, K. D., et al. Population imaging of neural activity in awake behaving mice. Nature. 574 (7778), 413-417 (2019).
- Sabatini, B. L., Tian, L. Imaging neurotransmitter and neuromodulator dynamics in vivo with genetically encoded indicators. Neuron. 108 (1), 17-32 (2020).
- Roome, C. J., Kuhn, B. Chronic cranial window with access port for repeated cellular manipulations, drug application, and electrophysiology. Frontiers in Cellular Neuroscience. 8, 379 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados