Method Article
אין ויוו הדמיית סידן בשדה רחב ושני פוטונים מעכבר באמצעות חלון גולגולתי גדול
In This Article
Summary
הפרוטוקול הנוכחי מתאר יצירת חלון גולגולתי גדול (6 x 3 מ"מ2) באמצעות עטיפת מזון, סיליקון שקוף וזכוכית כיסוי. חלון גולגולתי זה מאפשר ניסויים בהדמיית סידן בשדה רחב ובשני פוטונים באותו עכבר.
Abstract
הדמיית סידן בשדה רחב מהניאוקורטקס של העכבר מאפשרת לצפות בפעילות עצבית כלל-קליפתית הקשורה לתפקודי מוח שונים. מצד שני, הדמיה של שני פוטונים יכולה לפתור את הפעילות של מעגלים עצביים מקומיים ברמת התא הבודד. זה קריטי ליצור חלון גולגולתי גדול לביצוע ניתוח בקנה מידה רב באמצעות שתי טכניקות ההדמיה באותו עכבר. כדי להשיג זאת, יש להסיר חלק גדול של הגולגולת ולכסות את משטח קליפת המוח החשוף בחומרים שקופים. בעבר, גולגולות זכוכית וחלונות גולגולתיים מבוססי פולימר פותחו למטרה זו, אך חומרים אלה אינם מפוברקים בקלות. הפרוטוקול הנוכחי מתאר שיטה פשוטה ליצירת חלון גולגולתי גדול המורכב מסרט עטיפה פוליווינילידן כלוריד (PVDC) זמין מסחרית, תקע סיליקון שקוף וזכוכית כיסוי. להדמיה של המשטח הגבי של חצי כדור שלם, גודל החלון היה בערך 6 x 3 מ"מ2. תנודות מוחיות חמורות לא נצפו ללא קשר לחלון כה גדול. חשוב לציין שמצב פני השטח של המוח לא הידרדר במשך יותר מחודש. הדמיה בשדה רחב של עכבר המבטא מחוון סידן מקודד גנטית (GECI), GCaMP6f, במיוחד באסטרוציטים, חשפה תגובות מסונכרנות בכמה מילימטרים. הדמיה של שני פוטונים של אותו עכבר הראתה תגובות סידן בולטות באסטרוציטים בודדים במשך מספר שניות. יתר על כן, שכבה דקה של נגיף הקשור לאדנו הוחלה על סרט ה-PVDC וביטאה בהצלחה GECI בתאי עצב בקליפת המוח מעל חלון הגולגולת. טכניקה זו אמינה וחסכונית ליצירת חלון גולגולתי גדול ומקלה על חקירת הדינמיקה העצבית והגלילית והאינטראקציות שלהם במהלך התנהגות ברמה המאקרוסקופית והמיקרוסקופית.
Introduction
הדמיית סידן בשדה רחב חוקרת ביעילות את דפוס הפעילות המרחבית-טמפורלית על פני שטח גדול במוח החיה 1,2,3. נעשה שימוש נרחב בהדמיה בשדה רחב כדי לצפות בכל פני השטח של מכרסמים מאחר שקליפת המוח שלהם שטוחה יחסית 2,3,4,5,6,7,8,9,10. עכברים מהונדסים או עכברים שהוזרק להם נגיף הקשור לאדנו (AAV), אשר מבטאים באופן ספציפי GECIs בתאים שונים כגון נוירונים ותאי גלייה, יכולים לשמש להדמיית סידןבשדה רחב 11,12,13. עם זאת, הרזולוציה המרחבית של טכניקה זו היא בדרך כלל לא מספיק כדי לפתור את הפעילות של תאים בודדים in vivo14. הוא גם אינו מתאים לתאי הדמיה הממוקמים בשכבות עמוקות יותר.
מאידך גיסא, הדמיית סידן דו-פוטונית יכולה לצפות בפעילותם של תאים מרובים בו זמנית ברזולוציה מרחבית תת-תאית, ומאפשרת תצפית על פעילותם של תאים בודדים גם בדנדריטים עצביים ובתהליכי גליה 15,16,17,18,19,20,21,22. הוא יכול גם לצפות בתאים בשכבות עמוקות יותר של קליפת המוח23,24. למרות שההתקדמות הטכנולוגית האחרונה במיקרוסקופיה של שני פוטונים מאפשרת הדמיה מאזורים קליפתיים ברוחב מילימטר 25,26,27,28,29, עדיין קשה לצפות באזור הדומה להדמיה בשדה רחב על ידי הדמיה של שני פוטונים.
כדי להבין את הרלוונטיות הפיזיולוגית של פעילות המוח מתא בודד למוח שלם, חיוני לגשר על הפער בין הפעילות של אזורים בקליפת המוח כולה לבין זו שברזולוציה של תא בודד במעגלים עצביים מקומיים. לכן, שילוב של הדמיית סידן בשדה רחב ושני פוטונים המבוצעת באותו עכבר יעילה במיוחד. כדי לממש זאת, יש ליצור חלון גולגולתי רחב ויציב, באופן אידיאלי לאורך תקופה ארוכה.
בעבר פותחו מספר טכניקות ליצירת חלונות גולגולתיים כדי לאפשר הדמיה בשדה רחב ובשני פוטונים באותו עכבר30,31. חלונות זכוכית מכוסים בצורת טרפז (גולגולת קריסטל), אשר מעוצבים בצורת משטח קליפת המוח כדי להחליף את העצם שהוסרה, מאפשרים גישה אופטית על פני כל קליפת המוח32. לחלופין, ניתן לייצר חלונות גולגולתיים מבוססי פולימר עם פוליאתילן טרפתלט (PET)33 או עם פלואורופולימרים אמורפיים מצופים תחמוצת פוליאתילן ננו-גיליון34. כל שיטה הוכחה כשומרת על חלון יציב במשך יותר מחודש. עם זאת, ייצור חלונות אלה אינו קל, ואת החומרים והציוד המשמשים הם לעתים קרובות יקר.
המחקר הנוכחי מתאר שיטה חדשה ליצירת חלון גולגולתי גדול באמצעות סרט PVDC (ניילון נצמד מזון) (איור 1). באמצעות חלון זה, ניתן לבצע ניסויי הדמיה בשדה רחב ובשני פוטונים באותם עכברים. כמו כן, הוכח כי GECIs יכולים לבוא לידי ביטוי בתאי עצב על פני שטח רחב של קליפת המוח של עכברים על ידי יצירת שכבה דקה של סרט המכיל חלקיקי AAV על העטיפה.
Protocol
הליכי הניסוי אושרו על ידי ועדת הניסויים בבעלי חיים של אוניברסיטת יאמאנאשי. במחקר זה נעשה שימוש בעכברים מסוג בר (C57BL/6J, Japan SLC) ובעכברים מהונדסים המבטאים GECI מעוגן בקרום (Lck-GCaMP6f) באסטרוציטים. העכברים המהונדסים התקבלו על ידי חציית עכברי AldH1l1-CreERT2 [B6N]. עכברי FVB-Tg(Aldh1l1-cre/ERT2)1Khakh/J, שהושגו באופן מסחרי, ראו טבלת חומרים] ועכברי Flx-Lck-GCaMP6f [C57BL/6N-Gt(ROSA)26Sor/J, שהושגו באופן מסחרי]. העכברים המהונדסים טופלו בטמוקסיפן (20 מ"ג/מ"ל) במשך 5 ימים (0.05 מ"ל/10 גרם bw, כלומר) כדי לבטא את GCaMP6f. כל העכברים שהשתמשו בהם היו זכרים ונקבות בני 4 שבועות לפחות. הסכימה של החלון מוצגת באיור 1A, וההליך הכירורגי מסוכם באיור 1B.
1. הכנה לניתוח חלון גולגולתי
- הרדמת עכברים עם איזופלוראן (אינדוקציה: 3%, ניתוח: 1%-1.5%, קצב זרימה: 0.2-0.3 ליטר/דקה). אשר את עומק ההרדמה על ידי אובדן זנב או רפלקס צביטה בבוהן. שמרו על טמפרטורת הגוף באמצעות כרית חימום (36-38 מעלות צלזיוס). יש למרוח משחת עיניים עם צמר גפן כדי למנוע מעיניהם של עכברים להתייבש תחת הרדמה.
- להזריק תמיסת מניטול 15% (ראו טבלת חומרים) באופן תוך-צפקי (3 מ"ל/100 גרם משקל גוף). תקן את ראש העכבר על מסגרת סטריאוטקסית עם פסי אוזניים. הסר שיער מראש העכבר באמצעות מכונת גילוח וקרם להסרת שיער.
- לחטא את פני העור עם פובידון-יוד ואלכוהול שלוש פעמים. החל לידוקאין מקומי כדי לספק משכך כאבים מראש. הסר את העור מעל אזור העניין עם מספריים כירורגיים לחשוף את הגולגולת (גודל: 15 x 15 מ"מ). אם קיים דימום, השתמש בצמר גפן כדי לעצור את הדימום.
הערה: במחקר זה, העור הוסר כדי לצפות בקליפת המוח הקדם-מצחית לקליפת המוח הראייתית. - הסר את הפריוסטאום מעל הגולגולת החשופה באמצעות מיקרו-קורט וייבש את משטח הגולגולת כדי לחבר בחוזקה את לוחית הראש לגולגולת באמצעות מלט דנטלי (ראו טבלת חומרים) (איור 2B).
הערה: לוחית הראש המותאמת אישית נוצרת באמצעות מדפסת תלת-ממד. קובץ העיצוב מופקד למאגר Github (https://github.com/Satoshi-Manita/Head-plates). - חברו את לוחית הראש באמצעות מלט דנטלי (איור 2C). המתן לפחות 20 דקות עד שהמלט יתקשה. אבטחו את צלחת הראש עם מחזיק צלחת הראש35.
2. ביצוע חלון הגולגולת
- הסר את המלט הנוסף מעל הגולגולת באמצעות מקדחה דנטלית (ראה טבלת חומרים). היזהרו לא לקדוח דרך העצם ולפגוע במוח על ידי קידוח.
- סמן את האזור לחתוך עם עט לחתוך לתוך העצם עם אזמל. הקהו את קצה האזמל כדי להבטיח שהקצה לא יחדור לגולגולת (איור משלים 1). התייחסו לאטלס המוח כדי לקבוע היכן ליצור את החלון.
הערה: עבור המחקר הנוכחי, נוצר חלון בין -2 מ"מ ל +4 מ"מ מברגמה בציר האנטרופוסטריור ומתפר סגיטלי ל +3 מ"מ בציר הבינוני, כולל קליפת המוח המוטורית, הסומטוסנסורית והחזותית. - מגרדים את העצם שוב ושוב עם אזמל כדי להעמיק את החריץ עד שהעצם באזור שיש לחתוך נעה היטב כאשר נוגעים קלות.
- הסר את העצם החתוכה עם פינצטה עדינה. אל תדחפו את דש העצם לתוך המוח, מה שעלול להזיק למוח (איור 1Ba).
הערה: אם נצפה דימום לאחר הסרת העצם, יש למרוח מיד ולשאוף נוזל מוחי מלאכותי (ACSF, ראו טבלת חומרים) ולחזור על תהליך זה עד להפסקת הדימום. לחלופין, הניחו ספוג ג'לטין המוסטטי (כ-3 מ"מ קוביות מרובעות) ספוג ב-ACSF על נקודת הדימום. - אם הדורה לא הוסרה, המשך לשלב 2.7.
- הסר את הדורה מאטר בהתאם לשלבים הבאים.
- הסר את הדורה, למשל, במצבים הבאים; טרנספקציה בשיטת סרט פיברואין-AAV36 ותצפית על מבנים קטנים כגון קוצים דנדריטיים.
- חותכים את הדורה באמצעות פיפטה זכוכית משוכה עם קצה מחודד של כ -10 מיקרומטר. כדי להרחיב חתך זה על פני כל החלון, השתמש במחט בצורת U.
- הגדר את הזום הסטריאומיקרוסקופי ל-60-100x והסר את הדורה מאטר הכרות עם פינצטה דקה במיוחד. אם הסרת הדורה מאטר גורמת לדימום, יש לשטוף עם ACSF או להשתמש בספוג ג'לטין כדי לעצור את הדימום.
- גזרו את עטיפת ה-PVDC.
- יש לעקר חתיכה גדולה (לדוגמה, 10 x 15 מ"מ) של עטיפת PVDC (כ-11 מיקרומטר, ראו טבלת חומרים, איור 2Aa) על-ידי אוטוקלאבינג ועם 70% אתנול.
- תחת סטריאומיקרוסקופ, השתמש בפינצטה ובאזמל כדי לגזור עטיפה בגודל הנדרש.
הערה: גודל העטיפה צריך להיות גדול בכ-10 מ"מ מגודל חלון הגולגולת אך קטן יותר מפתח צלחת הראש. עבור חלון גולגולתי בגודל 6 x 3 מ"מ 2, הכן עטיפהבגודל 15 x 10 מ"מ2 .
- מקם את העטיפה במדויק לפי השלבים הבאים.
- מניחים את העטיפה על פני המוח, ומשאירים את ה-ACSF על פני השטח. מצצו את ה-ACSF מקצה העטיפה, ואפשרו לעטיפה להידבק בחוזקה לפני השטח של המוח (איור 1Bb,c).
הערה: העטיפה שבה נעשה שימוש עמידה בפני קמטים, כך שעצם הנחתה על פני המוח כמעט ואינה יוצרת קמטים. - חתוך את העטיפה בעזרת אזמל ופינצטה כך שיהיה מרווח של כ-1 מ"מ בין קצה חלון הגולגולת לעטיפה (איור 1Bd).
- לאחר שהעטיפה נמצאת במקומה, הדביקו את קצה העטיפה לגולגולת באמצעות דבק ביולוגי (ראו טבלת חומרים, איור 2D). תנו לדבק להתייבש במשך כ-30 דקות.
- מניחים את העטיפה על פני המוח, ומשאירים את ה-ACSF על פני השטח. מצצו את ה-ACSF מקצה העטיפה, ואפשרו לעטיפה להידבק בחוזקה לפני השטח של המוח (איור 1Bb,c).
- מרחו את אלסטומר הסיליקון השקוף.
- מרחו את אלסטומר הסיליקון השקוף הזמין מסחרית (ראו טבלת חומרים) על גבי העטיפה באמצעות מתקן עם קצה ערבוב (איור 1B e, 2Ab-d) והניחו את זכוכית הכיסוי (עובי 0.12-0.17 מ"מ) מעליה (איור 2E).
- אטמו את היקף הזכוכית המכוסה באמצעות סרט עמיד למים, דבק-על או מלט דנטלי (איור 1Bf).
- לאחר הניתוח, עקוב אחר העכבר עד שהוא חוזר להכרה כדי לשמור על שכיבה סטרנלית. לאחר מכן, שמרו על העכברים בנפרד, ואפשרו להם להתאושש בכלוב הביתי שלהם למשך 7 ימים לפחות.
- כדי להפחית מתח וכאב, לתת חומרים אנטי דלקתיים ומשככי כאבים (למשל, dexamethasone ו ketoprofen, 5 מ"ג / ק"ג כל אחד, i.p.).
- עקוב אחר העכברים באופן קבוע לאיתור זיהום. אם זיהום מאושר, יש לתת תרופה אנטי-מיקרוביאלית (למשל, 10% אנרופלוקסצין, 1.7 μL/mL) במי השתייה עד לחיסול הזיהום (בדרך כלל פחות מ-4 שבועות).
3. הכנת סרט AAV על ניילון נצמד באמצעות תמיסת פיברואין
הערה: שלב 3 הוא אופציונלי.
- הכינו תמיסת פיברואין מפקעות תולעי משי בשיטהשפורסמה בעבר 37.
- בקצרה, מרתיחים פקעות רגילות של תולעי משי זמינות מסחרית (5 גרם, ראו טבלת חומרים) בתמיסת נתרן פחמתי (0.02 מ', 2 ליטר). שוטפים את הפקעות במים אולטרה-טהורים ומייבשים למשך הלילה.
- ממיסים את הפקעות המיובשות בתמיסת ליתיום ברומיד (9.3 מ', 20% עם פיברואין) תוך חימום בתנור בטמפרטורה של 60 מעלות צלזיוס למשך 4 שעות. דיאליזה של תמיסת הגולם המומס, צנטריפוגה (פעמיים ב-12,700 x גרם, ב-4 מעלות צלזיוס למשך 20 דקות)37, ואסוף את הסופר-נטנט.
- הכינו את סרט הפיברואין-AAV לפי השלבים הבאים.
- מערבבים תמיסות פיברואין ו-AAV20 ביחס של 1:4 בצינור דגימה קטן באמצעות מיקרופיפט. יש לזרוק אליקוט של תמיסת הפיברואין-AAV המעורבת על ניילון נצמד לחלון הגולגולת, ולייבש אותו במשך 3 שעות לפחות.
הערה: לביטוי בשטח של 3 מ"מ קוטר, יש למרוח טיפה של 5 μL של תמיסת פיברואין-AAV. יחס זה קובע את כמות התמיסה עבור שטח נתון. - לאחר הייבוש, חותכים את הניילון הנצמד לגודל הנדרש לחלון (לדוגמה, 10 x 15 מ"מ) ומניחים אותו על פני המוח. לאחר מכן, בצע את השיטה שהוזכרה לעיל משלב 2.8.1 ואילך.
הערה: לפני הנחת העטיפה על פני המוח, הסר את ה-ACSF על פני המוח ככל האפשר. הסיבה לכך היא שה-ACSF צפוי להמיס את יריעת הפיברואין-AAV ולהפחית את ריכוז חלקיקי ה-AAV. - יש להמתין כ-2-4 שבועות לאחר יצירת החלון המטופל ב-AAV עד שה-GECIs יבואו לידי ביטוי מספיק. במהלך תהליך זה, בדוק את מצב העכברים והחלונות באופן קבוע.
- מערבבים תמיסות פיברואין ו-AAV20 ביחס של 1:4 בצינור דגימה קטן באמצעות מיקרופיפט. יש לזרוק אליקוט של תמיסת הפיברואין-AAV המעורבת על ניילון נצמד לחלון הגולגולת, ולייבש אותו במשך 3 שעות לפחות.
4. הדמיה וניתוח סידן
הערה: לקבלת פרטים על ההדמיה והניתוח, ראה דוחות שפורסמו בעבר 1,2,38.
- בצע הדמיה בשדה רחב בהתאם לשלבים הבאים.
- שיתוק העכבר באמצעות התקן קיבוע מקרוסקופ פלואורסצנטי של עדשת טנדם (ראו טבלת חומרים).
- האר את קליפת המוח של עכברים עם אור עירור ממקור אור LED בגודל 465 ננומטר דרך מסנן עירור, מראה דיכרואית ועדשה אובייקטיבית.
- אסוף את התמונות הפלואורסצנטיות של קליפת המוח על ידי מצלמת CCD דרך עדשה אובייקטיבית (1.0x), מראה דיכרונית, מסנן פליטה ועדשת הדמיה (2.0x). השילוב של עדשות אלה נותן הגדלה כוללת של כ 0.5x.
- קבל תמונות בתדר דגימה של 50 הרץ. לאחר איסוף הנתונים, נתח את התמונות באמצעות תוכנת ImageJ. בחר את אזור העניין (ROI) באופן ידני. חשב את השינוי הפלואורסצנטי בכל ROI כ- ΔF/F = (Ft - F0) / F0, כאשר Ft הוא הערך הפלואורסצנטי הגולמי של כל מסגרת ו- F0 הוא הערך הפלואורסצנטי הממוצע המתקבל מתמונה ממוצעת של כל המסגרות.
הערה: תוכנית מאקרו עבור ImageJ מופקדת ב- GitHub (https://github.com/Satoshi-Manita/ImageJ-macro), המחשבת תמונות ΔF/F מנתוני הדמיית סידן.
- בצע הדמיה של שני פוטונים בהתאם לשלבים הבאים.
- לשתק את העכבר תחת מיקרוסקופ של שני פוטונים באמצעות מכשיר קיבוע ראש. זהה את האזור שיש לצלם באמצעות המיקרוסקופ במצב שדה בהיר עם עדשה אובייקטיבית בהגדלה נמוכה (5x).
- מעבר להדמיה של שני פוטונים. השתמש בעדשה עם מטרת הגדלה גבוהה (16x או 25x) והאיר את הלייזר לקבלת עירור של שני פוטונים.
הערה: ירוק Lck-GCaMP6f22 ו- XCaMP-R36 אדום התרגשו מלייזר מהיר במיוחד באורכי גל עירור של 920 ננומטר ו-1070 ננומטר, בהתאמה. - רכשו תמונות פלואורסצנטיות ב-30 הרץ. לאחר רכישת נתונים, תוצרי תנועה נכונים על ידי פונקציית הרישום של תוכנת suite2p39. השג ROI ו- ΔF/F מתמונות באותה שיטה להדמיה בשדה רחב.
- התווה את הנתונים באמצעות python עם הספריות הבאות: NumPy, Matplotlib ו- Pandas (ראה טבלת חומרים).
תוצאות
הערכה של חלון גולגולתי גדול שנעשתה בשיטות עטיפת PVDC
מיד לאחר הניתוח, הצלחה או כישלון ניתן לבדוק במבט חטוף על ידי מצב של משטח קליפת המוח, כגון דימום ושינוי צבע עקב נזק או איסכמיה. זמן רב לאחר הניתוח, משטח קליפת המוח עשוי להיות מכוסה בקרום לבן אטום עקב זיהום, או שדם עשוי לכסות את החלון עקב דימום (איור 2G). במקרים אלה, קליפת המוח עשויה שלא להיות במצב בריא, והדמיה עשויה שלא להיות אפשרית. אלה יכולים להיגרם על ידי עטיפות מנותקות חלקית או קיבוע לא מספיק של העטיפה על ידי הדבק. אם הזיהום נצפה שוב ושוב, זה עשוי להיות יעיל ליישם אנטיביוטיקה, למשל, gentamicin סולפט (10 μL, 50 מ"ג / מ"ל), על פני המוח במיקום החלון. התחדשות של קרום המוח או העצמות נראית גם כאשר המרווח האנכי בין משטח קליפת המוח לבין העטיפה גדול. כדי למנוע זאת, מריחת העטיפה בצורה הדוקה ככל האפשר על פני המוח במהלך הכנת החלון היא חיונית. ניתן להשיג זאת על ידי הנחת ניילון נצמד על פני המוח ומציצת כמה שיותר ACSF. בהיעדר ACSF, זה יכול להיעשות פשוט על ידי הצבת ניילון נצמד על פני המוח. המוח וכלי הדם נקבעים כבלתי פגומים על ידי העובדה שצבע המוח אינו דהוי וכלי הדם אינם מנותקים.
אורך החיים של החלון תלוי במידה רבה באיכות הניתוח. כאשר המצב טוב, אין שום סימן לזיהום, דימום או התחדשות יותר מחודש לאחר הניתוח (איור 2F ואיור 3B). ב-8 מתוך 10 עכברים, ניתן היה לשמור על החלון נקי עד 10 שבועות או יותר. חלונות בשניים מהעכברים לא יכלו להיות מתוחזקים כראוי עקב זיהום או דימום. למרות שהחלון הגדול עשוי להיות מועד ללחץ מכני או להשפעה, חלונות שבורים או סדוקים לא נצפו.
כדי להעריך את איכות ההדמיה של חלון הגולגולת החדש עם העטיפה, הסיליקון והזכוכית, פונקציית ההתפשטות הנקודתית הושוותה מתחת לחלון החדש לזו שמתחת לחלון הזכוכית הקונבנציונלי על ידי הדמיה של חרוזים פלואורסצנטיים של 0.1 מיקרומטר באגר (ראה קובץ משלים 1). התוצאות לא הראו הבדל ברוחב המלא בחצי מקסימום (FWHM) עבור שני המצבים. [ציר X (μm): זכוכית בלבד, 1.99 ± 0.07, עטיפה, 1.76 ± 0.13, ציר Y (μm): זכוכית בלבד, 2.11 ± 0.27, עטיפה, 1.90 ± 0.15, ציר Z (μm): זכוכית בלבד, 25.29 ± 0.71, עטיפה, 26.64 ± 1.02, N = 7 חרוזים, p > 0.05, מבחן Mann-Whitney U, איור משלים 2A,B]. לכן, האלמנטים החדשים שנוספו (עטיפה וסיליקון) לא פגעו באיכות ההדמיה.
ממצאי רטט הנגרמים על ידי נשימה, פעימות לב ותנועת גוף נמצאים בהדמיה של שדה רחב ושני פוטונים. כדי לקבוע עד כמה חלון הגולגולת החדש רוטט, נבחר חלקיק פלואורסצנטי קטן מתוך נתוני ההדמיה של שני פוטונים in vivo ובחן כמה התמונה שלו זזה במהלך 60 שניות. נמצא כי סטיית התקן של הצנטרואיד של אותו חלקיק פלואורסצנטי הייתה בערך 0.3 מיקרומטר, שהיא דומה לזו שמתחת לחלון זכוכית רגיל (איור משלים 2C). זה מצביע על כך שמכיוון שהמוח הוחזק על ידי תקע סיליקון שקוף וזכוכית כיסוי, התנודות היו דומות לאלה שנצפו בחלונות קטנים יותר רגילים, ורישום תמונה לא מקוון היה מספיק כדי למנוע תוצרי רטט.
בהדמיית סידן בשדה רחב, ניתן היה לראות את פעילות קליפת המוח מתפשטת על פני קליפת המוח המושרה על-ידי גירוי חושי (איור 3A-D,K-N). הדמיה של שני פוטונים אפשרה תצפית על תמונות פלואורסצנטיות חד-תאיות ספציפיות לנוירונים ולתאי גליה (איור 3E,O). ניתן היה לצפות בשינויים פלואורסצנטיים המושרים על-ידי גירוי חושי בתאים בודדים (איור 3E-J,O-T).
ביטוי של מחווני סידן מקודדים גנטית (GECIs) באזור רחב של קליפת המוח באמצעות עטיפת PVDC ו-AAV
ניתן ליישם את עטיפת ה-PVDC של החלון כדי לבטא חלבונים פונקציונליים באזור רחב של קליפת המוח. זה מושג באמצעות AAV ופיברואין, חלבון מרכיב של פקעות תולעי משי אשר יושמו באופן נרחב כמו biomaterials37. מחקר קודם הראה כי ניתן לערבב פיברואין עם AAVs, וליצור סרטים המושתלים במוח כדי לבטא חלבונים פונקציונליים כגון אופסינים פוטו-אקטיביים או GECIs36. במחקר הנוכחי, AAV המבטא GECI ופיברואין עורבבו ויובשו על העטיפה, ועטיפה מצופה AAV שימשה לחלון הגולגולת. זה הביא לביטוי של GECI על פני האזור הרחב של קליפת המוח 2-4 שבועות לאחר הניתוח (איור 3K-M). מאחר שהחלון היה גדול, ניתן לדמיין אזורים שונים בקליפת המוח של אותו עכבר (איור 3M-T).
כדי לאשר את יעילות הביטוי של שיטה זו, מספר התאים המבטאים GECI נספר במוח הקבוע (איור משלים 2D). נמצא כי האסטרטגיה הנוכחית באמצעות עטיפה עם פיברואין-AAV הביאה לביטוי של GECI ביעילות של כ-20% הן בשכבות שטחיות והן בשכבות עמוקות יותר (L2/3: 20.78%, תא ביטוי XCaMP-R: 32 תאים, DAPI: 154 מיקומים, L5: 20.08%, תא המבטא XCaMP-R: 51 תאים, DAPI: 254 מיקומים). לפיכך, שיטה זו ביטאה GECIs בתאים לא רק בשכבות פני השטח אלא גם בשכבות עמוקות יותר.
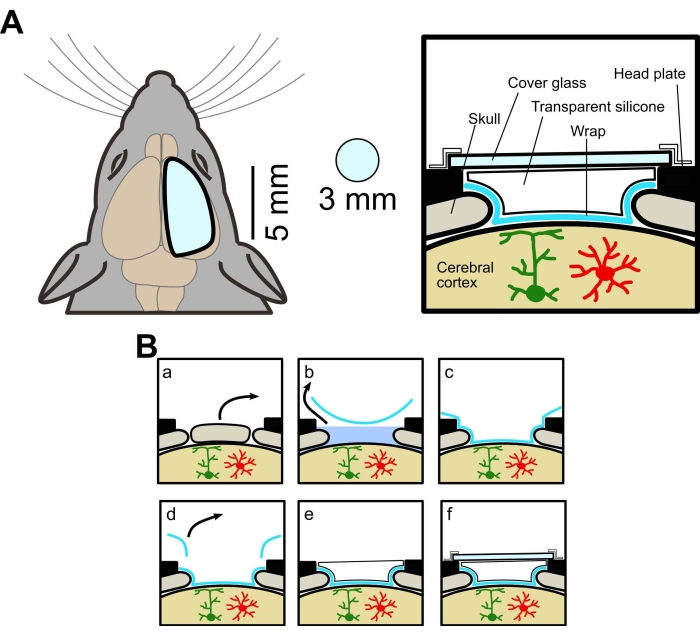
איור 1: דיאגרמה מושגית של חלון הגולגולת הגדול . (A) ציור שמאלי, סכמטי, של חלון הגולגולת החדש. הוא גדול יותר מהחלון הרגיל (קוטר 3 מ"מ). מבט מימין, חתך רוחב. השיטה ליצירת חלון גולגולתי גדול משתמשת בעטיפת מזון, אלסטומר סיליקון שקוף וזכוכית כיסוי, ומאפשרת הדמיה של שדה רחב ושני פוטונים מאותו עכבר. (B) הליך ייצור חלון גולגולתי: (א) הסרת עצם. (ב) הסרת ACSF מתחת לעטיפה. (ג) הדבקת העטיפה בפני השטח של המוח על ידי הסרת ACSF. (ד) חיתוך העטיפה העודפת. (ה) מריחת סיליקון שקוף. (ו) הדבקת כיסוי זכוכית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
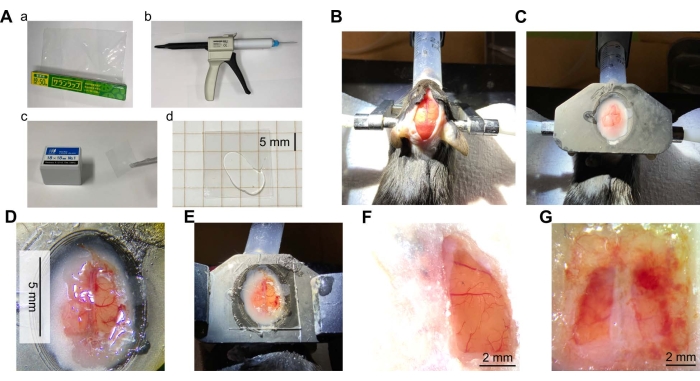
איור 2: סקירה כללית של ניתוח חלון גולגולתי . (A) חומרים וציוד הדרושים לחלון הגולגולת. (א) סרט עטיפה פוליווינילידן כלוריד (PVDC). (ב) מתקן של אלסטומר סיליקון שקוף עם קצה ערבוב. (ג) כיסוי זכוכית. (ד) סיליקון שקוף המונח בין שתי חתיכות של זכוכית הכיסוי. (B) תצלום של עור ראש עכבר שנחשף כדי לחשוף את הגולגולת. העכבר היה מורדם, וראש העכבר היה משותק באמצעות מוטות אוזניים. לאחר מכן הוטבע הראש, טופל במשכך כאבים מקומי, והעור היה נטוי. (C) צילום לאחר התקנת לוחית ראש. צלחת ראש (עשויה שרף ממדפסת תלת מימד) הוצמדה לראש העכבר במלט דנטלי. (D) תצלום של חלון גולגולתי. חלון הגולגולת נוצר בקליפת המוח של ההמיספרה הימנית של מוח העכבר. הדורה מאטר הוסר, והעטיפה הודבקה במקומה. (E) תמונה של החלון עשוי העטיפה עם הסיליקון השקוף וזכוכית הכיסוי למעלה. (F) דוגמה טיפוסית לחלון מוצלח (חצי הכדור הימני, 7 שבועות לאחר הניתוח). (G) דוגמה לחלון כושל (שתי ההמיספרות, 5 שבועות לאחר הניתוח). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
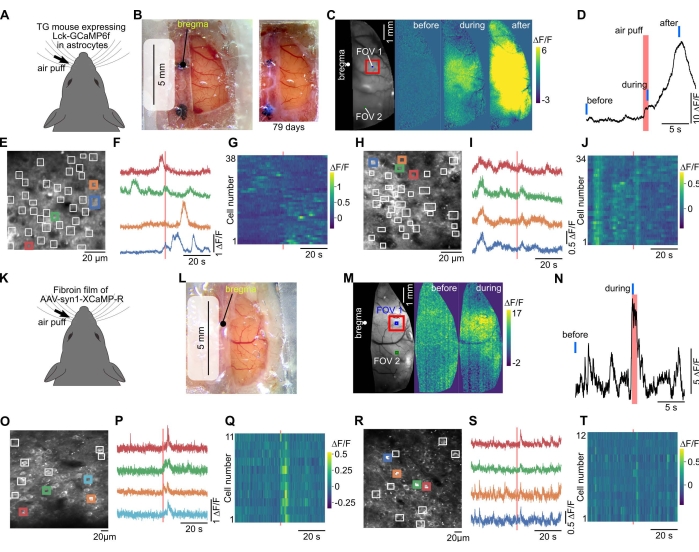
איור 3: החלון הגדול מאפשר הדמיית סידן בשדה רחב ובשני פוטונים מאותו עכבר. (A) הדמיית סידן בוצעה בעכבר מהונדס המבטא GECI מעוגן ממברנה (Lck-GCaMP6f) באסטרוציטים40. (B) משמאל, נוצר חלון גדול עם ניילון נצמד, סיליקון שקוף וזכוכית כיסוי. הדמיה בשדה רחב בוצעה דרך חלון זה. מימין, תמונה צולמה 79 ימים לאחר התקנת חלון הגולגולת. (C) כאשר הוחל גירוי אוויר-נפיחות על השפם הנגדי, נצפו שינויים פלואורסצנטיים. (D) התווה את מהלך הזמן של השינוי הפלואורסצנטי בקליפת המוח הסומטוסנסורית (ריבוע אדום ב-C). פסים אדומים וכחולים מציינים תזמון נפיחות אוויר ותזמון "לפני", "במהלך" ו"אחרי" ב-(C), בהתאמה. (E) שדה הראייה (FOV 1 ב-C) של הדמיית סידן דו-פוטונים. מכיוון ש-GCaMP6f בא לידי ביטוי כדי להתמקם לממברנה, אזורי העניין (ריבועים לבנים) הוצבו ידנית כדי לזהות את התגובה המקומית בתהליכי אסטרוציטים. (F) השינויים הפלואורסצנטיים בריבועים הצבעוניים ב-(E) משורטטים. (G) השינויים הפלואורסצנטיים בכל הריבועים של (E) משורטטים. צירים אופקיים ואנכיים מציינים זמן ומספר תא, בהתאמה. (ח-י) נתונים עבור FOV 2 (בקליפת המוח הראייתית) ב- (C) מוצגים. ה- FOV 2 צולם לאחר ההדמיה ב- FOV 1. (K) GECI אדום, XCaMP-R, התבטא בתאי עצב בשיטת פיברואין-AAV בעכבר מסוג בר. (L) תצלום שצולם שבועיים לאחר הניתוח שבו נוצר החלון באמצעות סרט פיברואין. (M) הדמיית סידן בשדה רחב בוצעה על עכבר זה. (N) השינוי הפלואורסצנטי שמעורר גירוי השפם התווה מהאתר הבולט ביותר (קליפת המוח הסומטוסנסורית, ריבוע אדום ב-(M)). קווים אדומים וכחולים מציינים תזמון נפיחות אוויר ותזמון "לפני" ו"במהלך" ב-(M), בהתאמה. (O) שדה ראייה (קליפת המוח הסומטוסנסורית, FOV 1 אינץ' (M)) של הדמיית סידן דו-פוטונית בעומק 300 מיקרומטר. ROIs הוצבו באופן ידני בסומאטה העצבית. (P) השינויים הפלואורסצנטיים בריבועים הצבעוניים ב-(O) משורטטים. (Q) השינויים הפלואורסצנטיים בכל הריבועים של (O) משורטטים בצבע. (ר-ט) מוצגים נתונים עבור FOV 2 אינץ' (M) הממוקם בקליפת המוח הקודקודית. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
איור משלים 1: טיפים לאזמלים. קצה האזמל החדש (למעלה) לעומת האזמל המשמש לחיתוך הגולגולת עם קצה קהה (למטה). אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים 2: אימות חלון הגולגולת החדש ושיטת הביטוי פיברואין-AAV. (A) פרופיל עוצמת פלואורסצנטיות של חרוזים פלואורסצנטיים בקוטר 0.1 מיקרומטר באגר. השורה העליונה מציגה נתונים ממצב שבו רק זכוכית כיסוי הונחה מעל חרוזי פלואורסצנט מעורבבים באגר, והשורה התחתונה מציגה נתונים ממצב שבו הונחו עטיפה, סיליקון שקוף וזכוכית כיסוי. העקבות האפורים מראים את ההתאמה של גאוס לפרופיל העוצמה הפלואורסצנטי של כל חרוז, והעקבות האדומים מראים את הערכים הממוצעים שלהם (n = 7). (ב) סיכום הנתונים ב-(א). כל גרף מציג את הרוחב המלא בחצי מקסימום (FWHM) של פונקציית פריסת הנקודות בציר XYZ. התרשים האפור מציג את הנתונים עבור כל חרוז, והאדום מציג את הממוצע ואת שגיאת התקן שלהם. (C) מתוך 2,000 פריימים (הקלטה של 60 שניות) של נתוני הדמיה in vivo , נבחר חלקיק פלואורסצנטי קטן ובחן כמה התמונה זזה במהלך 60 שניות. התמונה הפלואורסצנטית במרכז מייצגת בממוצע 2,000 פריימים. התמונות הוקרנו על ידי ממוצע בכיווני ציר X ו-Y. ההיסטוגרמות מציגות את התפלגות הצנטרואיד בכל מסגרת. סטיות התקן של הצנטרואיד היו X: 0.36 ו- Y: 0.315 μm. (D) דוגמה לביטוי GECI בשיטת פיברואין-AAV. משמאל: פרוסה של קליפת המוח יישמה את שיטת הביטוי פיברואין-AAV. אדום וכחול מציינים פלואורסצנטיות מ- XCaMP-R ו- DAPI, בהתאמה; XCaMP-R התבטאה לא רק בתאי שכבה 2/3 אלא גם בתאי שכבה 5. מרכז וימין. תצוגות מוגדלות של השכבות 2/3 ו- 5 באיור השמאלי (ריבועי ציאן), בהתאמה. אנא לחץ כאן כדי להוריד קובץ זה.
קובץ משלים 1: (A) יעילות הביטוי של העטיפה בשיטת סרט פיברואין-AAV ו-(B) הערכת פונקציית התפשטות הנקודה במהלך הדמיה של שני פוטונים. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
מאמר זה מציג שיטה זולה ליצירת חלון גולגולתי גדול באמצעות ניילון נצמד PVDC, סיליקון שקוף וזכוכית כיסוי. באמצעות שיטה זו, הראינו כי ניתן לבצע הדמיית סידן בשדה רחב על פני שטח רחב של קליפת המוח. הדמיית סידן דו-פוטונית יכולה להתבצע מכמה אזורים שונים בקליפת המוח באותו עכבר שעבר הדמיה בשדה רחב. יתר על כן, הוכח כי סרט פיברואין-AAV על ניילון נצמד המשמש לחלון יכול לבטא GECI על פני שטח רחב של קליפת המוח.
שלבים קריטיים
חשוב למנוע זיהום ונזק למוח בעת ביצוע חלונות גולגולתיים באמצעות ניילון נצמד. בתנאים אלה לא ניתן לצפות בפעילות עצבית וגליתית, והדמיה של אזורים עמוקים יותר אינה אפשרית. פגיעה בכלי הדם גורמת גם לדימום, מה שהופך את ההדמיה לבלתי אפשרית בגלל הדם. כדי למנוע זיהום, חשוב מאוד ליצור את פני השטח של המוח ואת העטיפה המחוברת בצורה הדוקה ככל האפשר על-ידי מציצת ה-ACSF. מתן מניטול חשוב כדי למנוע נזק למוח ולכלי הדם על ידי מניעת לחץ מוחי מוגבר במהלך הניתוח. זה שומר על המרווח בין פני השטח של המוח לבין הדורה מאטר ומונע מגע במוח ובכלי הדם במהלך הסרת הגולגולת והדורה מאטר. מיקרוסקופ סטריאו עם הגדלה גבוהה ופינצטה עם קצוות חדים יעילים גם לניתוח מדויק.
בשיטת פיברואין-AAV חיוני להשתמש בפקעות של תולעי משי בשריות, לא להקפיא תמיסת פיברין, לייבש את תמיסת הפיברואין-AAV במידה מספקת, וליישם מספיק נפח של תמיסה (5 μL לכל קוטר 3 מ"מ). כאשר נעשה שימוש בפקעות ישנות יותר, יעילות הביטוי הייתה נמוכה יותר. הסיבה לכך היא כי פיברואין מפקעות ישנות עשוי להיות denatured בקלות. כאשר תמיסת פיברואין הוקפאה בטמפרטורה של -80 מעלות צלזיוס והופשרת בזמן השימוש, יעילות הביטוי הייתה ירודה. זה יכול להיות בגלל denaturation של החלבון עקב הקפאה והפשרה. מכיוון שתמיסות פיברואין המאוחסנות בטמפרטורה של 4 מעלות צלזיוס יכולות לשמש ביעילות עד לג'לציה, מומלץ לשמור את תמיסות הפיברואין בקירור ולטהר אותן שוב מהפקעות לאחר הג'לציה. יש לייבש את תמיסת הפיברואין-AAV במשך 3 שעות לפחות, שכן הביטוי גרוע לאחר פחות מ-3 שעות. לבסוף, אזור הביטוי תלוי בכמות של תמיסת פיברואין-AAV בשימוש. בדוגמה באיור 3M, הכמות הייתה קטנה (5 μL); לפיכך, סרט הפיברואין-AAV כיסה רק את חציו העליון של החלון, וכתוצאה מכך ביטוי לא אחיד מעל החלון. אם נעשה שימוש בכמות מספקת של פיברואין-AAV, הביטוי יהיה אחיד על פני כל החלון.
שינויים בטכניקה
טכניקת חלון הגולגולת החדשנית מאפשרת לבחון את הפעילות המקרוסקופית של מעגלים קליפתיים ואת הפעילות הבסיסית שלהם ברמת התא הבודד באותו עכבר. לפיכך, השיטה יכולה להיות מיושמת על מגוון רחב של מחקרים במדעי המוח. לדוגמה, ניתן להשתמש בו כדי לבחון פעילות קליפת המוח במהלך משימות קבלת החלטות, למידה מוטורית, ובמודלים של עכברים של פגיעה מוחית ומחלות. אנו גם מאמינים שניתן ליישם את השיטה לא רק על מכרסמים אלא גם על פרימטים שאינם בני אדם.
מאמר זה מדגים כי חלון הגולגולת הגדול יעיל להדמיה של עכברים ועכברים מהונדסים שהוזרקו להם AAV המבטאים חלבונים פונקציונליים. בפרט, הוכח כי סרט הפיברואין-AAV על העטיפה הוא הרבה יותר קל מאשר שיטת הזרקת AAV קונבנציונלית לבטא GECIs על פני השטח הרחב של קליפת המוח. באמצעות תערובת של שני AAVs המקודדים GECIs בצבעים שונים41, ניתן לדמיין בו-זמנית את המתאם בין פעילות תאי העצב לפעילות תאי הגליה על פני שטח רחב בקליפת המוח. יתר על כן, ניתן ליישם את שיטת הסרט פיברואין-AAV גם על ביוסנסורים אחרים המקודדים גנטית 42,43,44,45,46,47.
חלון הגולגולת הגדול יותר, שיכול לדמיין את שתי ההמיספרות, אפשרי גם הוא. מיקרוסקופים דו-פוטונים עם שדה ראייה רחב בהרבה (~25 מ"מ2) פותחו לאחרונה 25,26,27,28,29. שילוב טכניקת הדמיה זו של שני פוטונים עם הדמיה בשדה רחב של פוטון אחד באמצעות חלון הגולגולת הרחב המתואר כאן יאפשר לנו לבחון את הקשר בין פעילות האוכלוסייה לפעילות התא הבודד מתוך קני מידה חסרי תקדים.
מגבלות
עטיפת המזון אינה מאפשרת מעבר של חומרים כלשהם. זה מקשה על השימוש בשיטה לניסויים פרמקולוגיים. זה גם קשה להסיר את העטיפה, מה שהופך את זה בלתי אפשרי להכניס פיפטה זכוכית או אלקטרודה. לכן, קשה ליישם ניסויים בשילוב עם שיטות אחרות כגון הדמיית סידן בו זמנית והקלטות אלקטרופיזיולוגיות, ומתן מקומי של תרופות באמצעות פיפטה זכוכית. פתרון אפשרי למגבלות אלה הוא להשתמש בחלון העטיפה והזכוכית עם חור. זה מאפשר גישה למוח באמצעות פיפטה זכוכית או אלקטרודת הקלטה תוך שמירה על חלון הגולגולת סטרילי במשך תקופה ארוכה48.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי מענק סיוע לתחומי מחקר טרנספורמטיביים (A) 'פענוח גליה' (JP21H05621 ל- SM), JSPS KAKENHI (JP19K06883 ל- SM, 15KK0340 ל- ES, JP22H00432, JP22H05160, JP17H06312 ל- HB, ו- JP17H06313 ל- KK), מענק סיוע למיפוי המוח על ידי נוירוטכנולוגיות משולבות למחקרי מחלות (מוח/מוחות) (JP19dm0207079h0002 ל- SM, JP19dm0207079 ל- HB, ו- JP19dm0207080 ל- KK), קרן המחקר למדעי המוח של Narishige (ל- SM), מענק לחוקרים צעירים ממחוז יאמאנאשי (ל-SM) וקרן המדע טקדה (ל-SM) ונתמך חלקית על ידי מענק מחקר המוח של אוניברסיטת יאמאנאשי.
אנו מודים לנ' יאגוצ'י וק' אוקזאקי על הטיפול בבעלי חיים והסיוע הטכני ולחברי מעבדת קיטמורה על דיונים מועילים.
Materials
| Name | Company | Catalog Number | Comments |
| 4% paraformaldehyde phosphate buffer solution | NACALAI TESQUE, Kyoto, Japan | TritonX | Expression efficiency of the wrap with the fibroin-AAV film method |
| 50 mL beaker | |||
| Acquisition software | Brain vision | BV_Ana | For wide-field calcium imaging of GCaMP6f |
| Acquisition software | Hamamatsu photonics | High speed recording software: HSR | For wide-field calcium imaging of XCaMP-R |
| Acquisition software | Vibrio Technologies | scanImage | For two-photon calcium imaging |
| ACSF (artificial cerebrospinal fluid) | 150 mM NaCl, 2.5 mM KCl, 10 mM HEPES, 2 mM CaCl2, 1 mM MgCl2, pH = 7.4 with 1M NaOH | ||
| ACSF aspiration needle | |||
| Adeno-associated virus | VectorBuilder | custom-made | AAV-DJ/8-Syn1-XCaMP-R |
| Adhesives for biological use | Daiichi Sankyo | Aron Alpha-A | |
| Anesthesia machine | Shinano seisakusho | SN-487 | |
| Anesthetic | Kyoritsu Seiyaku Corporation | pentobarbital | Expression efficiency of the wrap with the fibroin-AAV film method |
| Auxiliary ear bar | Narishige | EB-5N | |
| CCD camera | Brain vision | MiCAM02-HR | For wide-field calcium imaging of GCaMP6f |
| Clear vinyl polysiloxane | GC | Exaclear | |
| CMOS camera | Hamamatsu photonics | ORCA-spark | For wide-field calcium imaging of XCaMP-R |
| Cotton swab | |||
| Cover glass | Matsunami | 18 x 18 NO.1 | Size: 18 x 18 mm, Thickness: 0.13-0.17 mm, Borosilicate glass |
| DAPI | Thermo Fisher | D1306 | Expression efficiency of the wrap with the fibroin-AAV film method |
| Ddialysis cassette | 3.5K MWCO, Slide-A-Lyzer | ThermoFisher | |
| Dental adhesive resin cement | SUN MEDICAL | Super-Bond | |
| Dental drill | Nakanishi | VOLVERE Vmax | |
| Digital scale | Dretec | KS-243 | |
| Filters | Brain vision | EM: BP466/40-25, DM: DM506, EX: BP520/36-50 | |
| Filters | Olympus | U-MRFPHQ, EM: BP535-555HQ, DM: DM565HQ, Ex: BA570-625HQ | |
| Fluorescence microscope | Keyence | BZ-X810 | Expression efficiency of the wrap with the fibroin-AAV film method |
| Fluorescent beads | Fluoresbrite YG Carboxylate Microspheres | 0.1 µm | Evaluation of the point spread function under the conventional and the new cranial windows in two-photon imaging |
| Forceps | FST | No. 11252-20 | thin-tipped, for removal of dura mater |
| Forceps | KFI | K-7, No.J 18-8 | for general use |
| Gelatin for hemostasis | Johnson & Johnson | Spongostan | |
| Gentamicin sulfate | Iwaki seiyaku | ||
| Glass pipette | custom-made | ||
| Hair remover | Reckitt Japan | Veet | |
| Head fixing device | custom-made | Craniotomy for Cortical Voltage-sensitive Dye Imaging in Mice. Suzuki, T., and Murayama, M. Bio-protocol 2016 6:e1722. | |
| Head plate | custom-made | aluminum or resin, size: 40 x 25 mm, thickness: 1.5 mm or 2 mm, hole in the center: 15 x 10 mm (head_plate_06 v3.f3d) | |
| Heating pad | |||
| Image processing software (for calcium imaging data analysis) | ImageJ | https://imagej.net | |
| Isoflurane | Pfizer | ||
| Light source | Hayashi-repic | LA-HDF108AA | |
| Light source | Brain vision | LEX2-LZ4-B | For wide-field calcium imaging of GCaMP6f |
| Light source | Olympus | U-HGLGPS | For wide-field calcium imaging of XCaMP-R |
| Mannitol solution (15% with saline) | Sigma-Aldrich (Merck) | M4125 | |
| Micro curette | FST | No. 10080-05 | |
| Microscope | Brain vision | For wide-field calcium imaging of GCaMP6f | |
| Microscope | Olympus | MVX10 | For wide-field calcium imaging of XCaMP-R |
| Microscope | Sutter Instruments | MOM | For two-photon calcium imaging |
| Microslicer | Dosaka EM | DTK-1000N | Expression efficiency of the wrap with the fibroin-AAV film method |
| Mixing tip | GC | ||
| Needle (30 G) | |||
| Polyethylens spoids | AS ONE | 1-4656-01 | |
| Polyvinylidene chloride (PVDC) film | Asahi Kasei | Asahi Wrap (or Saran Wrap) | |
| Povidone-iodine | Mundipharma | Isodine | |
| Python libralies | NumPy | package for scientific computing, https://numpy.org/doc/stable/index.html# | |
| Matplotlib | library for visualizations, https://matplotlib.org/stable/index.html# | ||
| pandas | data analysis and manipulation tool, https://pandas.pydata.org | ||
| Scalpel | Kai | No. 11 | |
| Shaver for animal | |||
| Silicone dispensers | GC | ||
| Silkworm cocoon | Satoyama Craft News | https://sato-yama.jp/ | |
| Stereomicroscope | LEICA | MZ6 | objective lens: 0.63x, eyepiece: 25x |
| Surfactant | NACALAI TESQUE | TritonX | Expression efficiency of the wrap with the fibroin-AAV film method |
| Surgical Scissors | FST | No. 91460-11 | |
| Syringe for mannitol injection | Terumo | 1mL | |
| Transdermal anesthetic | AstraZeneca | Lidocaine | |
| Transgenic mice used for calcium imaging of astrocytes | The mice were obtained by the following method. AldH1l1-CreERT2 mice: B6N.FVB-Tg(Aldh1l1-cre/ERT2)1Khakh/J (The Jackson laboratory, strain #: 031008) Tamoxifen-inducible Cre recombinase expression directed at high levels to the vast majority of astrocytes Flx-Lck-GCaMP6f mice: C57BL/6N-Gt(ROSA)26Sor[tm1(CAG-GCaMP6f)Khak]/J (The Jackson laboratory, strain #: 029626) Cre-dependent expression of a plasma membrane-targeted GCaMP6f. A mouse born from crossbreeding these mice were treated with tamoxifen (20 mg/mL) for 5 days (0.05 mL/10g bw, i.p.) to express GCaMP6f. | ||
| Tunable ultrafast lasers | Spectra-Physics | InSight X3 | For two-photon calcium imaging |
| Waterproof film | Nichiban | BFR5 | |
| Wild-type mice | Japan SLC | C57BL/6J | Male and femalek, >4 weeks old |
References
- Ren, C., Komiyama, T. Wide-field calcium imaging of cortex-wide activity in awake, head-fixed mice. STAR Protocols. 2 (4), 100973(2021).
- Couto, J., et al. Chronic, cortex-wide imaging of specific cell populations during behavior. Nature Protocols. 16 (7), 3241-3263 (2021).
- Kauvar, I. V., et al. Cortical Observation by Synchronous Multifocal Optical Sampling Reveals Widespread Population Encoding of Actions. Neuron. 107 (2), 351-367 (2020).
- Clancy, K. B., Orsolic, I., Mrsic-Flogel, T. D. Locomotion-dependent remapping of distributed cortical networks. Nature Neuroscience. 22 (5), 778-786 (2019).
- MacDowell, C. J., Buschman, T. J. Low-dimensional spatiotemporal dynamics underlie cortex-wide neural activity. Current Biology. 30 (14), 2665-2680 (2020).
- Makino, H., et al. Transformation of cortex-wide emergent properties during motor learning. Neuron. 94 (4), 880-890 (2017).
- Murphy, T. H., et al. Automated task training and longitudinal monitoring of mouse mesoscale cortical circuits using home cages. eLife. 9, 559654(2020).
- Rynes, M. L., et al. Miniaturized head-mounted microscope for whole-cortex mesoscale imaging in freely behaving mice. Nature Methods. 18 (4), 417-425 (2021).
- Cardin, J. A., Crair, M. C., Higley, M. J. Mesoscopic imaging: Shining a wide light on large-scale neural dynamics. Neuron. 108 (1), 33-43 (2020).
- Ren, C., Komiyama, T. Characterizing cortex-wide dynamics with wide-field calcium imaging. The Journal of Neuroscience. 41 (19), 4160-4168 (2021).
- Hamodi, A. S., Martinez Sabino, A., Fitzgerald, N. D., Moschou, D., Crair, M. C. Transverse sinus injections drive robust whole-brain expression of transgenes. eLife. 9, 53639(2020).
- Michelson, N. J., Vanni, M. P., Murphy, T. H. Comparison between transgenic and AAV-PHP.eB-mediated expression of GCaMP6s using in vivo wide-field functional imaging of brain activity. Neurophotonics. 6 (2), 025014(2019).
- Oomoto, I., et al. Protocol for cortical-wide field-of-view two-photon imaging with quick neonatal adeno-associated virus injection. STAR Protocols. 2 (4), 101007(2021).
- Fan, J. T., et al. Video-rate imaging of biological dynamics at centimetre scale and micrometre resolution. Nature Photonics. 13 (11), 809-816 (2019).
- Stuart, G. J., Spruston, N. Dendritic integration: 60 years of progress. Nature Neuroscience. 18 (12), 1713-1721 (2015).
- Grienberger, C., Chen, X., Konnerth, A. Dendritic function in vivo. Trends in Neurosciences. 38 (1), 45-54 (2015).
- Takahashi, N., et al. Locally synchronized synaptic inputs. Science. 335 (6066), 353-356 (2012).
- Kitamura, K., Hausser, M. Dendritic calcium signaling triggered by spontaneous and sensory-evoked climbing fiber input to cerebellar Purkinje cells in vivo. The Journal of Neuroscience. 31 (30), 10847-10858 (2011).
- Manita, S., et al. A top-down cortical circuit for accurate sensory perception. Neuron. 86 (5), 1304-1316 (2015).
- Stobart, J. L., et al. Cortical circuit activity evokes rapid astrocyte calcium signals on a similar timescale to neurons. Neuron. 98 (4), 726-735 (2018).
- Srinivasan, R., et al. Ca(2+) signaling in astrocytes from Ip3r2(-/-) mice in brain slices and during startle responses in vivo. Nature Neuroscience. 18 (5), 708-717 (2015).
- Shigetomi, E., Patel, S., Khakh, B. S. Probing the complexities of astrocyte calcium signaling. Trends in Cell Biology. 26 (4), 300-312 (2016).
- Tischbirek, C., Birkner, A., Jia, H., Sakmann, B., Konnerth, A. Deep two-photon brain imaging with a red-shifted fluorometric Ca2+ indicator. Proceedings of the National Academy of Sciences of the United States of America. 112 (36), 11377-11382 (2015).
- Kondo, M., Kobayashi, K., Ohkura, M., Nakai, J., Matsuzaki, M. Two-photon calcium imaging of the medial prefrontal cortex and hippocampus without cortical invasion. eLife. 6, 26839(2017).
- Demas, J., et al. cortex-wide volumetric recording of neuroactivity at cellular resolution using light beads microscopy. Nature Methods. 18 (9), 1103-1111 (2021).
- Ota, K., et al. cell-resolution, contiguous-wide two-photon imaging to reveal functional network architectures across multi-modal cortical areas. Neuron. 109 (11), 1810-1824 (2021).
- Sofroniew, N. J., Flickinger, D., King, J., Svoboda, K. A large field of view two-photon mesoscope with subcellular resolution for in vivo imaging. eLife. 5, 14472(2016).
- Stirman, J. N., Smith, I. T., Kudenov, M. W., Smith, S. L. Wide field-of-view, multi-region, two-photon imaging of neuronal activity in the mammalian brain. Nature Biotechnology. 34 (8), 857-862 (2016).
- Yu, C. H., Stirman, J. N., Yu, Y., Hira, R., Smith, S. L. Diesel2p mesoscope with dual independent scan engines for flexible capture of dynamics in distributed neural circuitry. Nature Communications. 12 (1), 6639(2021).
- Barson, D., et al. Simultaneous mesoscopic and two-photon imaging of neuronal activity in cortical circuits. Nature Methods. 17 (1), 107-113 (2020).
- Wekselblatt, J. B., Flister, E. D., Piscopo, D. M., Niell, C. M. Large-scale imaging of cortical dynamics during sensory perception and behavior. Journal of Neurophysiology. 115 (6), 2852-2866 (2016).
- Kim, T. H., et al. Long-term optical access to an estimated one million neurons in the live mouse cortex. Cell Reports. 17 (12), 3385-3394 (2016).
- Ghanbari, L., et al. Cortex-wide neural interfacing via transparent polymer skulls. Nature Communications. 10 (1), 1500(2019).
- Takahashi, T., Zhang, H., Otomo, K., Okamura, Y., Nemoto, T. Protocol for constructing an extensive cranial window utilizing a PEO-CYTOP nanosheet for in vivo wide-field imaging of the mouse brain. STAR Protocols. 2 (2), 100542(2021).
- Suzuki, T., Murayama, M. Craniotomy for cortical voltage-sensitive dye imaging in mice. Bio-Protocol. 6 (3), 1722(2016).
- Jackman, S. L., et al. Silk fibroin films facilitate single-step targeted expression of optogenetic proteins. Cell Reports. 22 (12), 3351-3361 (2018).
- Rockwood, D. N., et al. Materials fabrication from Bombyx mori silk fibroin. Nature Protocols. 6 (10), 1612-1631 (2011).
- Jia, H., Rochefort, N. L., Chen, X., Konnerth, A. In vivo two-photon imaging of sensory-evoked dendritic calcium signals in cortical neurons. Nature Protocols. 6 (1), 28-35 (2011).
- Pachitariu, M., et al. Suite2p: beyond 10,000 neurons with standard two-photon microscopy. bioRxiv. , 061507(2017).
- Srinivasan, R., et al. New transgenic mouse lines for selectively targeting astrocytes and studying calcium signals in astrocyte processes in situ and in vivo. Neuron. 92 (6), 1181-1195 (2016).
- Inoue, M., et al. Rational engineering of XCaMPs, a multicolor GECI suite for in vivo imaging of complex brain circuit dynamics. Cell. 177 (5), 1346-1360 (2019).
- Patriarchi, T., et al. Ultrafast neuronal imaging of dopamine dynamics with designed genetically encoded sensors. Science. 360 (6396), (2018).
- Sun, F., et al. A genetically encoded fluorescent sensor enables rapid and specific detection of dopamine in flies, fish, and mice. Cell. 174 (2), 481-496 (2018).
- Marvin, J. S., et al. An optimized fluorescent probe for visualizing glutamate neurotransmission. Nature Methods. 10 (2), 162-170 (2013).
- Feng, J., et al. A genetically encoded fluorescent sensor for rapid and specific in vivo detection of norepinephrine. Neuron. 102 (4), 745-761 (2019).
- Piatkevich, K. D., et al. Population imaging of neural activity in awake behaving mice. Nature. 574 (7778), 413-417 (2019).
- Sabatini, B. L., Tian, L. Imaging neurotransmitter and neuromodulator dynamics in vivo with genetically encoded indicators. Neuron. 108 (1), 17-32 (2020).
- Roome, C. J., Kuhn, B. Chronic cranial window with access port for repeated cellular manipulations, drug application, and electrophysiology. Frontiers in Cellular Neuroscience. 8, 379(2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved