Method Article
インビボ 大きな頭蓋窓を用いたマウスからの広視野および2光子カルシウムイメージング
要約
本プロトコルは、フードラップ、透明シリコーン、およびカバーガラスを使用して、大きな(6 x 3 mm2)頭蓋窓を作成することについて説明しています。この頭蓋窓は、同じマウスでの in vivo 広視野および2光子カルシウムイメージング実験を可能にします。
要約
マウスの新皮質からの広視野カルシウムイメージングにより、さまざまな脳機能に関連する皮質全体の神経活動を観察することができます。一方、2光子イメージングは、局所神経回路の活動を1細胞レベルで解決することができます。同じマウスで両方のイメージング技術を使用して複数のスケール分析を実行するには、大きな頭蓋窓を作成することが重要です。これを達成するためには、頭蓋骨の大部分を取り除き、露出した皮質表面を透明な材料で覆わなければならない。これまで、この目的のためにガラスの頭蓋骨やポリマーベースの頭蓋窓が開発されてきましたが、これらの材料は簡単には製造できません。本プロトコルは、市販のポリ塩化ビニリデン(PVDC)ラッピングフィルム、透明シリコンプラグ、およびカバーガラスからなる大きな頭蓋窓を作製するための簡単な方法を記載する。半球全体の背側表面を画像化するために、窓のサイズは約6 x 3 mm2でした。このような大きな窓にもかかわらず、激しい脳の振動は観察されませんでした。重要なことに、脳表面の状態は1ヶ月以上悪化しませんでした。遺伝子にコードされたカルシウムインジケーター(GECI)GCaMP6fを発現するマウスの広視野イメージングは、特に星状細胞で、数ミリメートルで同期応答を明らかにしました。同じマウスの2光子イメージングは、数秒にわたって個々の星状細胞で顕著なカルシウム応答を示しました。さらに、アデノ随伴ウイルスの薄層をPVDCフィルムに適用し、頭蓋窓上の皮質ニューロンでGECIを発現させることに成功した。この技術は、大きな頭蓋窓を作るための信頼性が高く費用効果が高く、巨視的および微視的レベルでの行動中の神経およびグリアダイナミクスおよびそれらの相互作用の調査を容易にします。
概要
広視野カルシウムイメージングは、動物の脳の広い領域にわたる時空間活動パターンを効果的に調査する1、2、3。広視野イメージングは、皮質が比較的平坦であるため、げっ歯類の皮質表面全体を観察するために広く使用されています2,3,4,5,6,7,8,9,10。トランスジェニックマウスまたは、ニューロンおよびグリア細胞などの様々な細胞においてGECIを特異的に発現するアデノ随伴ウイルス(AAV)を注射したマウスは、広視野カルシウムイメージングに使用することができる11、12、13。しかしながら、この技術の空間分解能は、通常、インビボ14における個々の細胞の活性を分解するのに十分ではない。また、より深い層に位置する細胞のイメージングにも適していません。
一方、二光子カルシウムイメージングは、細胞内空間分解能で複数の細胞の活動を同時に観察することができ、神経細胞樹状突起やグリア突起においても個々の細胞の活性を観察することができる15,16,17,18,19,20,21,22。また、大脳皮質のより深い層の細胞を観察することもできます23,24。近年の2光子顕微鏡の技術進歩により、ミリ幅の皮質領域25,26,27,28,29からのイメージングが可能となりましたが、2光子イメージングによる広視野イメージングに匹敵する領域を観察することは依然として困難です。
単一細胞から全脳への脳活動の生理学的関連性を理解するためには、皮質全体の皮質領域の活動と局所神経回路の単一細胞分解能での活動との間のギャップを埋めることが重要です。したがって、同じマウスで行われた広視野カルシウムイメージングと2光子カルシウムイメージングの組み合わせが特に効果的です。これを実現するには、理想的には長期間にわたって、広く安定した頭蓋窓を作成する必要があります。
これまで、同じマウス内で広視野および2光子イメージングを実行することを可能にするために、頭蓋窓を作製するためのいくつかの技術が開発されてきた30,31。除去された骨を置き換えるために皮質表面の形状に成形された台形のカバーガラス窓(水晶頭蓋骨)は、皮質32全体にわたる光学的アクセスを可能にする。あるいは、ポリマーベースの頭蓋窓は、ポリエチレンテレフタレート(PET)33またはポリエチレンオキシド被覆非晶性フルオロポリマーナノシート34を用いて作製することができる。各方法は、1か月以上安定したウィンドウを維持することが示されています。ただし、これらの窓の製造は容易ではなく、使用される材料や機器はしばしば高価です。
本研究では、PVDCフィルム(プラスチック食品ラップ)を用いた大きな頭蓋窓を作製する新しい方法について述べる(図1)。このウィンドウを使用して、 in vivo 広視野および2光子イメージング実験を同じマウスで実行できます。また、GECIは、ラップ上にAAV粒子を含むフィルムの薄層を形成することにより、マウスの皮質の広い領域のニューロンで発現できることも示されています。
プロトコル
実験手順は、山梨大学動物実験委員会によって承認されました。本研究では、アストロサイトで膜アンカー型GECI(Lck-GCaMP6f)を発現する野生型(C57BL/6J、日本SLC)およびトランスジェニックマウスを使用しました。トランスジェニックマウスは、AldH1l1-CreERT2マウス[B6N.FVB-Tg(Aldh1l1-cre/ERT2)1Khakh/J、商業的に入手した、 材料の表を参照]およびFlx-Lck-GCaMP6fマウス[C57BL/6N-Gt(ROSA)26Sor/J、商業的に入手]マウス。トランスジェニックマウスをタモキシフェン(20 mg/mL)で5日間(0.05 mL/10 g bw、i.p.)処理してGCaMP6fを発現させた。使用した全てのマウスは、少なくとも4週齢の雄および雌であった。ウィンドウの概略図を図 1Aに示し、外科的処置を 図1Bに要約します。
1.頭蓋窓手術の準備
- マウスをイソフルランで麻酔します(誘導:3%、手術:1%-1.5%、流量:0.2-0.3 L / min)。尾またはつま先のピンチ反射の喪失による麻酔の深さを確認します。加熱パッド(36-38°C)を使用して体温を維持します。マウスの目が麻酔下で乾くのを防ぐために、綿棒で目の軟膏を塗ります。
- 15%マンニトール溶液( 材料の表を参照)を腹腔内(3 mL / 100 g体重)に注入します。.マウスの頭をイヤーバー付きの定位固定装置フレームに固定します。シェーバーと脱毛クリームを使用してマウスの頭から髪を取り除きます。
- 皮膚表面をポビドンヨードとアルコールで3回消毒します。リドカインを局所的に塗布して、先制鎮痛を提供します。.外科用ハサミで対象領域の皮膚を取り除き、頭蓋骨(サイズ:15 x 15 mm)を露出させます。出血がある場合は、綿棒を使用して出血を止めます。
注:この研究では、前頭前野から視覚野を観察するために皮膚を切除しました。 - マイクロキュレットを使用して露出した頭蓋骨の骨膜を取り除き、頭蓋骨の表面を乾燥させて、ヘッドプレートを歯科用セメントで頭蓋骨にしっかりと取り付けます( 材料の表を参照)(図2B)。
注:カスタムメイドのヘッドプレートは、3Dプリンターを使用して作成されます。デザインファイルはGithubリポジトリ(https://github.com/Satoshi-Manita/Head-plates)に預けられます。 - 歯科用セメントを使用してヘッドプレートを取り付けます(図2C)。セメントが固まるまで少なくとも20分待ちます。ヘッドプレートホルダー35でヘッドプレートを固定する。
2.頭蓋窓を作る
- 歯科用ドリルで頭蓋骨の余分なセメントを取り除きます( 材料の表を参照)。骨をドリルで開けたり、ドリルで脳を傷つけたりしないように注意してください。
- ペンで切る部分に印を付け、メスで骨に切ります。メスの先端を鈍くして、先端が頭蓋骨を貫通しないようにします(補足図1)。脳アトラスを参照して、ウィンドウを作成する場所を決定します。
注:本研究では、前後軸のブレグマから-2mmから+4mmの間に窓を作成し、矢状縫合糸から運動皮質、体性感覚、視覚野を含む中外側軸の+3mmまでを作成しました。 - 軽く触れるとトリミングする部位の骨がよく動くまでメスで骨を繰り返しこすり、溝を深くします。
- 切開した骨を細かいピンセットで取り除きます。脳に損傷を与える可能性のある骨弁を脳に押し込まないでください(図1Ba)。
注意: 骨を摘出した後に出血が観察された場合は、すぐに人工脳脊髄液(ACSF、 材料表を参照)を塗布して吸引し、出血が止まるまでこのプロセスを繰り返します。あるいは、ACSFに浸した止血ゼラチンスポンジ(約3mm角の立方体)を出血点に置きます。 - 硬膜が除去されない場合は、手順2.7に進みます。
- 以下の手順に従って硬膜を取り外します。
- たとえば、次のような状況では硬膜を取り外します。フィブロイン-AAV膜法36 を用いたトランスフェクション、樹状突起棘などの微小構造の観察。
- 約10μmのテーパーチップを有するプルドガラスピペットを使用して硬膜を切断する。このカットをウィンドウ全体に拡大するには、U字型の針を使用します。
- 実体顕微鏡ズームを60〜100倍に設定し、切断された硬膜を極細ピンセットで取り除きます。硬膜を除去すると出血する場合は、ACSFですすぐか、ゼラチンスポンジを使用して出血を止めてください。
- PVDCラップを切り取ります。
- 大型(10 x 15 mmなど)のPVDCラップ(約11 μm、 材料表、 図2Aaを参照)をオートクレーブ滅菌し、70%エタノールで滅菌します。
- 実体顕微鏡下で、ピンセットとメスを使用して、必要なサイズのラップを切り取ります。
注意: ラップサイズは、頭蓋窓のサイズよりも約10 mm大きく、ヘッドプレートの開口部よりも小さくする必要があります。6 x 3 mm 2の頭蓋窓の場合は、15 x 10 mm2のラップを準備します。
- 以下の手順に従って、ラップを正確に配置します。
- ACSFを表面に残して、脳の表面にラップを置きます。ラップの端からACSFを吸い出し、ラップが脳表面にしっかりとくっつくようにします(図1Bb、c)。
注:使用されているラップはしわになりにくいので、脳の表面に置くだけでしわはほとんどありません。 - 頭蓋窓の端とラップの間に約1 mmのマージンがあるように、メスとピンセットでラップをトリミングします(図1Bd)。
- ラップが所定の位置に配置されたら、ラップの端を生物学的接着剤で頭蓋骨に接着します( 材料表、 図2Dを参照)。接着剤を約30分間乾燥させます。
- ACSFを表面に残して、脳の表面にラップを置きます。ラップの端からACSFを吸い出し、ラップが脳表面にしっかりとくっつくようにします(図1Bb、c)。
- 透明なシリコーンエラストマーを塗布します。
- ミキシングチップ付きのディスペンサーを使用して、市販の透明シリコーンエラストマー(材料表を参照)をラップの上に塗布し(図1Be、2A b-d)、カバーガラス(厚さ0.12〜0.17 mm)を上に置きます(図2E)。
- カバーガラスの周囲を防水フィルム、接着剤、または歯科用セメントでシールします(図1Bf)。
- 手術後、マウスが意識を取り戻すまでマウスを監視し、胸骨横臥を維持します。その後、マウスを個別に飼い、少なくとも7日間はホームケージで回復させます。
- ストレスと痛みを軽減するために、抗炎症剤と鎮痛剤を投与します(例:.、デキサメタゾンとケトプロフェン、それぞれ5 mg / kg、i.p.)。.
- マウスの感染を定期的に監視します。感染が確認された場合は、抗菌薬(例:.、10%エンロフロキサシン、1.7 μL / mL)を感染が解消されるまで(通常は4週間未満)飲料水に投与します。.
3.フィブロイン溶液を用いたラップへのAAVフィルム作製
メモ: 手順 3 はオプションです。
- 以前に公開された方法37に従ってカイコの繭からフィブロイン溶液を調製する。
- 簡単に言うと、市販の通常のカイコの繭(5 g、 材料の表を参照)を炭酸ナトリウム溶液(0.02 M、2 L)で沸騰させます。繭を超純水で洗い、一晩乾かします。
- 乾燥した繭を臭化リチウム溶液(9.3 M、20%w/vフィブロイン)に溶解し、60°Cのオーブンで4時間加熱します。溶解した繭液を透析し、遠心分離機(12,700 x gで2回、4°Cで20分間)37、上清を回収する。
- 以下の手順に従ってフィブロイン-AAVフィルムを調製します。
- マイクロピペットを使用して、フィブロインとAAV溶液20 を小さなサンプルチューブ内で1:4の比率で混合します。混合フィブロイン-AAV溶液のアリコートを頭蓋窓のラップに落とし、少なくとも3時間乾燥させます。
注:直径3 mmの領域で発現させるには、5 μL滴のフィブロイン-AAV溶液を塗布します。この比率は、特定の領域の解の量を決定します。 - 乾燥後、ラップを窓に必要なサイズ(たとえば、10 x 15 mm)にカットし、脳の表面に置きます。次に、手順2.8.1以降の上記の方法に従います。
注意: ラップを脳表面に置く前に、脳表面のACSFをできるだけ取り外してください。これは、ACSFがフィブロイン-AAV膜を溶解し、AAV粒子の濃度を低下させることが期待されるためです。 - AAV処理ウィンドウを作成してから、GECIが十分に発現するまで約2〜4週間待ちます。このプロセス中は、マウスとウィンドウの状態を定期的に確認してください。
- マイクロピペットを使用して、フィブロインとAAV溶液20 を小さなサンプルチューブ内で1:4の比率で混合します。混合フィブロイン-AAV溶液のアリコートを頭蓋窓のラップに落とし、少なくとも3時間乾燥させます。
4. カルシウムのイメージングと分析
注:イメージングと分析の詳細については、以前に公開されたレポート1、2、38を参照してください。
- 以下の手順に従って広視野イメージングを実行します。
- タンデムレンズ蛍光マクロスコープの下で頭部固定装置を使用してマウスを固定します( 材料の表を参照)。
- 励起フィルター、ダイクロイックミラー、対物レンズを通して、465nmのLED光源からの励起光でマウスの大脳皮質を照らします。
- CCDカメラで対物レンズ(1.0倍)、ダイクロイックミラー、発光フィルター、撮像レンズ(2.0倍)を通して大脳皮質の蛍光画像を撮影します。これらのレンズの組み合わせにより、合計倍率は約0.5倍になります。
- 50Hzのサンプリング周波数で画像を集録します。データ取得後、ImageJソフトウェアを使用して画像を解析します。関心領域 (ROI) を手動で選択します。各ROIの蛍光変化をΔF/F =(Ft - F0)/ F0として計算し、Ftは各フレームの生の蛍光値、F0はすべてのフレームの平均画像から得られた平均蛍光値です。
注:ImageJのマクロプログラムはGitHub(https://github.com/Satoshi-Manita/ImageJ-macro)に寄託されており、カルシウムイメージングデータからΔF/F画像が計算されます。
- 以下の手順に従って2光子イメージングを実行します。
- 頭部固定装置を用いて2光子顕微鏡下でマウスを固定する。低倍率(5倍)の対物レンズを使用した明視野モードで顕微鏡を使用して、画像化する領域を特定します。
- 2光子イメージングに切り替えます。高倍率の対物レンズ(16倍または25倍)を使用し、2光子励起のためにレーザーを照らします。
注:緑色のLck-GCaMP6f22 と赤色のXCaMP-R36 は、それぞれ920 nmと1070 nmの励起波長で超高速レーザーによって励起されました。 - 30 Hzで蛍光画像を取得します。データ取得後、suite2pソフトウェア39の登録機能によりモーションアーチファクトを修正する。広視野イメージングと同じ方法を使用して、画像からROIとΔF / Fを取得します。
- NumPy、Matplotlib、およびPandasのライブラリを含むPythonを使用してデータをプロットします(材料表を参照)。
結果
PVDCラップ法を用いた大型頭蓋窓の評価
手術直後は、損傷や虚血による出血や色の変化など、皮質表面の状態によって一目で成否を確認することができます。手術後長期間、感染により皮質表面が不透明な白い膜で覆われたり、出血により血液が窓を覆ったりすることがあります(図2G)。これらの場合、皮質は健康な状態ではない可能性があり、イメージングは不可能である可能性があります。これらは、部分的に切断されたラップまたは接着剤によるラップの不十分な固定によって引き起こされる可能性があります。感染が繰り返し観察される場合は、抗生物質、例えば硫酸ゲンタマイシン(10μL、50mg/mL)を窓の配置時に脳表面に塗布することが効果的である可能性がある。髄膜または骨の再生は、皮質表面とラップとの間の垂直方向のギャップが大きい場合にも見られる。これを防ぐには、ウィンドウの準備中にラップを脳表面にできるだけしっかりと適用することが重要です。これは、脳の表面にラップを置き、できるだけ多くのACSFを吸い出すことで実現できます。ACSFがない場合は、ラップを脳表面に置くだけで実行できます。脳と血管は、脳の色が変色せず、血管が切断されていないという事実によって損傷を受けていないと判断されます。
窓の寿命は手術の質に大きく依存します。状態が良好な場合、手術後1か月以上感染、出血、または再生の兆候はありません(図2F および 図3B)。10匹中8匹のマウスでは、ウィンドウは10週間以上クリアに維持できました。.2匹のマウスの窓は、感染または出血のために適切に維持できなかった。大きな窓は機械的ストレスや衝撃を受けやすいかもしれませんが、窓の破損やひび割れは観察されませんでした。
ラップ、シリコーン、ガラスを用いた新しい頭蓋窓のイメージング品質を評価するために、寒天中の0.1 μm蛍光ビーズをイメージングすることにより、新しい窓の下での点像分布関数と従来のガラス窓の下の点像分布関数を比較しました( 補足ファイル1を参照)。結果は、両方の条件で半値全幅(FWHM)に差がないことを示しました。[X軸(μm):ガラスのみ、1.99 ± 0.07、ラップ、1.76 ± 0.13、Y軸(μm):ガラスのみ、2.11 ± 0.27、ラップ、1.90 ± 0.15、Z軸(μm):ガラスのみ、25.29 ± 0.71、ラップ、26.64 ± 1.02、N = 7ビーズ、p > 0.05、マン・ホイットニーU検定、 補足図2A、B]。 したがって、添加された新しい元素(ラップおよびシリコーン)は、画像品質を低下させなかった。
呼吸、心拍、および体の動きによって引き起こされる振動アーチファクトは、広視野および2光子イメージングに存在します。新しい頭蓋窓がどれだけ振動するかを決定するために、 in vivo の2光子イメージングデータから小さな蛍光粒子を選択し、その画像が60秒間にどれだけ移動するかを調べました。その結果、その蛍光粒子の重心の標準偏差は約0.3μmであり、従来のガラス窓下と同等であることがわかりました(補足図2C)。これは、脳が透明なシリコンプラグとカバーガラスで押さえられていたため、振動は従来の小さな窓で観察されたものに匹敵し、オフライン画像登録は振動アーチファクトを排除するのに十分であったことを示しています。
広視野カルシウムイメージングでは、感覚刺激によって誘導される皮質を横切って皮質活動が伝播するのを観察することができました(図3A-D、K-N)。二光子イメージングにより、神経細胞とグリア細胞に特異的な単一細胞蛍光画像の観察が可能になりました(図3E、O)。感覚刺激によって誘導される蛍光変化は、個々の細胞で観察することができた(図3E-J、O-T)。
PVDCラップとAAVを用いた大脳皮質の広域における遺伝子コードカルシウム指標(GECI)の発現
窓のPVDCラップは、皮質の広い領域で機能タンパク質を発現するために適用することができます。これは、生体材料として広く応用されているカイコの繭の構成タンパク質であるAAVおよびフィブロインを用いて達成される37。以前の研究では、フィブロインをAAVと混合して、脳に埋め込まれた膜を形成して、光活性化可能なオプシンやGECIなどの機能タンパク質を発現できることが示されました36。本研究では、GECIとフィブロインを発現するAAVをラップ上で混合して乾燥させ、頭蓋窓にAAVコーティングラップを使用しました。これにより、手術後2〜4週間で皮質の広い領域にわたってGECIが発現しました(図3K-M)。ウィンドウが大きかったので、同じマウスの異なる皮質領域を画像化することができる(図3M-T)。
この方法の発現効率を確認するため、固定脳においてGECIを発現する細胞の数を計数した(補足図2D)。フィブロイン-AAVでラップを用いた本戦略は、表層と深層の両方で約20%の効率でGECIを発現させることがわかりました(L2/3:20.78%、XCaMP-R発現細胞:32細胞、DAPI:154箇所、L5:20.08%、XCaMP-R発現細胞:51細胞、DAPI:254箇所)。したがって、この方法は、表層だけでなくより深い層でも細胞内でGECIを発現させた。
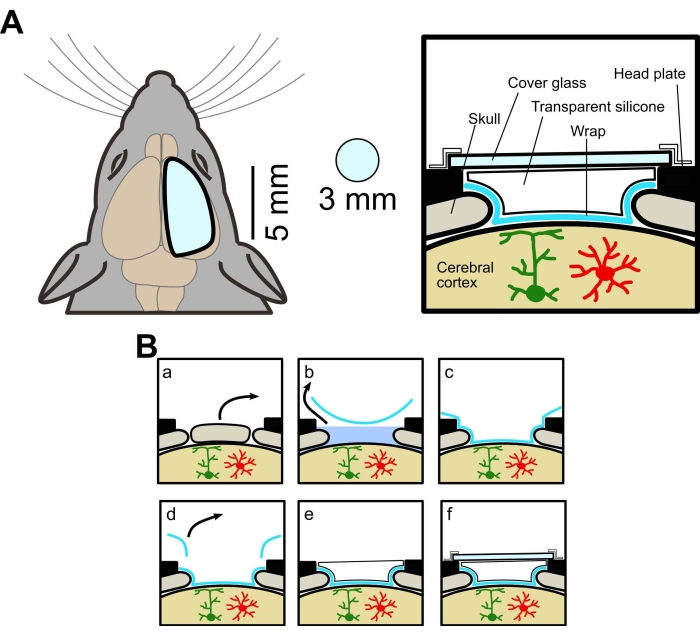
図1:大きな頭蓋窓の概念図。 (A)左、新しい頭蓋窓の概略図。従来の窓(直径3mm)よりも大きくなっています。右、断面図。大きな頭蓋窓を作る方法は、フードラップ、透明なシリコーンエラストマー、およびカバーガラスを使用して、同じマウスからの広視野および2光子イメージングを可能にします。(B)頭蓋窓の作製手順:(a)骨の除去。(b)ラップの下でのACSFの削除。(c)ACSFを除去することによる脳表面へのラップの付着。(d)余分なラップを切り取ります。(e)透明シリコーンを塗布する。(f)カバーガラスを貼る。この図の拡大版を表示するには、ここをクリックしてください。
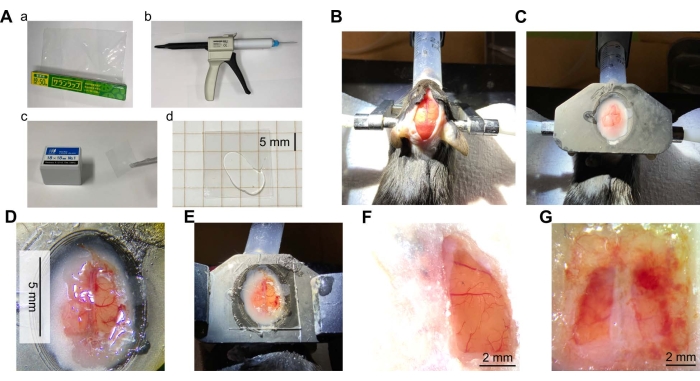
図2:頭蓋窓手術の概要 。 (A)頭蓋窓に必要な材料と機器。(a)ポリ塩化ビニリデン(PVDC)ラッピングフィルム。(b)ミキシングチップを備えた透明シリコーンエラストマーのディスペンサー。(c)カバーガラス。(d)カバーガラスの2つの部分の間に置かれた透明なシリコーン。(B)頭蓋骨を露出させるために切開されたマウスの頭部皮膚の写真。マウスを麻酔し、マウスの頭部を耳バーを用いて固定した。その後、頭部を脱毛し、局所鎮痛剤で治療し、皮膚を切開した。(C)ヘッドプレート取り付け後の写真。ヘッドプレート(3Dプリンターの樹脂製)を歯科用セメントでマウスの頭部に取り付けた。(D)頭蓋窓の写真。頭蓋窓は、マウス脳の右半球の皮質に作成されました。硬膜を取り除き、ラップを所定の位置に接着しました。(E)透明なシリコンとカバーガラスを上にしたラップで作られた窓の写真。(F)成功したウィンドウの典型的な例(右半球、手術後7週間)。(G)失敗したウィンドウの例(両方の半球、手術後5週間)。 この図の拡大版を表示するには、ここをクリックしてください。
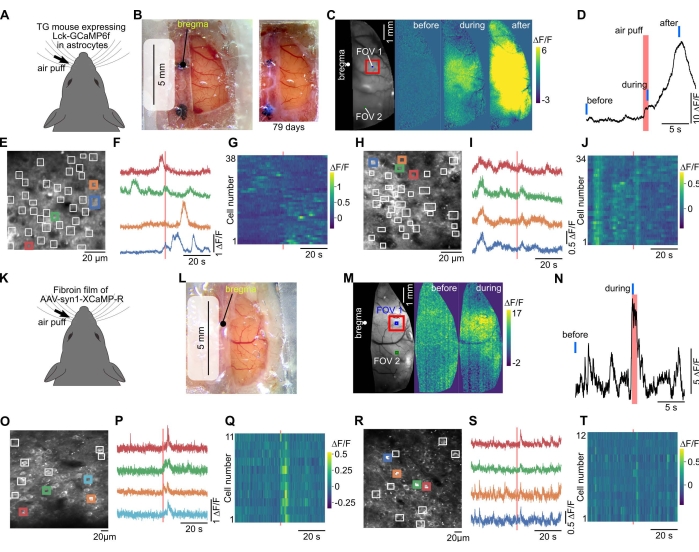
図3:大きなウィンドウにより、同じマウスから広視野および2光子のカルシウムイメージングが可能です。 (A)カルシウムイメージングは、アストロサイト40において膜アンカーGECI(Lck-GCaMP6f)を発現するトランスジェニックマウスにおいて行った。(B)左は、ラップ、透明シリコン、カバーガラスで大きな窓を作成しました。広視野イメージングはこのウィンドウを通して行われた。右、写真は頭蓋窓の設置から79日後に撮影されました。(C)対側ウィスカーにエアパフ刺激を加えると、蛍光変化が認められた。(D)体性感覚皮質(Cの赤四角)における蛍光変化の経時変化をプロットした。赤と青のバーは、エアパフのタイミングと、(C)の「前」、「最中」、「後」のタイミングをそれぞれ示します。(E)2光子カルシウムイメージングの視野(CのFOV1)。GCaMP6fは膜に局在するように発現していたため、関心領域(白い四角)を手動で配置して、星状細胞プロセスにおける局所応答を検出しました。(F)(E)における色付きの四角の蛍光変化をプロットする。(G)(E)のすべての正方形における蛍光変化がプロットされる。横軸と縦軸はそれぞれ時間とセル数を示します。(H-J)(C)におけるFOV2(視覚野内)についてのデータが示されている。FOV2をFOV1で撮像した後に撮像した。(k)赤色GECI、XCaMP-Rを、野生型マウスにおいてフィブロイン-AAV法によりニューロンに発現させた。(L)フィブロイン膜を用いて窓を作成した術後2週間の写真。(m)このマウスで広視野カルシウムイメージングを行った。(N)ウィスカー刺激によって誘発される蛍光変化を、最も顕著な部位(体性感覚皮質、(M)の赤い四角)からプロットした。赤と青の線は、エアパフのタイミングと(M)の「前」と「最中」のタイミングをそれぞれ示しています。(O)深さ300μmでの2光子カルシウムイメージングの視野(体性感覚皮質、FOV1(M))。ROIは手動でニューロン体細胞に配置されました。(P)(O)における色付きの四角形の蛍光変化をプロットする。(Q)(O)のすべての正方形の蛍光変化をカラーでプロットします。(R-T)頭頂皮質に位置するFOV2in(M)についてのデータが示されている。この図の拡大版を表示するには、ここをクリックしてください。
補足図1:メスのヒント。 新しいメスの先端(上)と、鈍い先端(下)で頭蓋骨を切断するために使用されたメスと比較します。 このファイルをダウンロードするには、ここをクリックしてください。
補足図2:新しい頭蓋窓とフィブロイン-AAV発現法の検証。 (A)寒天中の0.1 μm蛍光ビーズの蛍光強度プロファイル。上段は寒天に混合した蛍光ビーズの上にカバーガラスのみを置いた条件のデータ、下段はラップ、透明シリコーン、カバーガラスを載置した条件のデータです。灰色のトレースは各ビーズの蛍光強度プロファイルに対するガウスフィットを示し、赤色のトレースはそれらの平均値(n = 7)を示します。(B)(A)のデータの概要。各グラフは、XYZ軸上の点像分布関数の半値幅(FWHM)を示しています。灰色のプロットは各ビーズのデータを示し、赤色のプロットはそれらの平均誤差と標準誤差を示します。(C)2,000フレーム(60秒記録)の in vivo イメージングデータから、小さな蛍光粒子を選択し、60秒間に画像がどれだけ動いたかを調べた。中央の蛍光画像は平均2,000フレームを表しています。画像は、X軸方向とY軸方向に平均化することによって投影されました。ヒストグラムは、各フレームの重心の分布を示します。重心の標準偏差はX:0.36およびY:0.315μmであった。 (d)フィブロイン-AAV法によるGECI発現の例。左:フィブロイン-AAV発現法を適用した大脳皮質のスライス。赤と青はそれぞれXCaMP-RとDAPIからの蛍光を示します。XCaMP-Rは、第2/3層細胞だけでなく、第5層細胞でも発現していた。中央と右。左図のレイヤー2/3と5の拡大図(シアンの正方形)。 このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル1:(A)フィブロイン-AAVフィルム法によるラップの発現効率、(B)2光子イメージング時の点像分布関数の評価。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
この記事では、PVDCプラスチックラップ、透明シリコン、およびカバーガラスを使用して大きな頭蓋窓を作成する安価な方法を紹介します。この方法を用いて、大脳皮質の広い範囲にわたって広視野カルシウムイメージングを行うことができることを示しました。2光子カルシウムイメージングは、広視野イメージングを受けた同じマウスのいくつかの異なる皮質領域から実行できます。さらに、窓に使用したラップ上のフィブロインAAVフィルムは、皮質の広い範囲にわたってGECIを発現できることが示されています。
重要な手順
ラップを使用して頭蓋窓を作るときは、感染や脳への損傷を避けることが重要です。これらの条件では、神経およびグリア活動を観察することができず、より深い領域のイメージングは不可能です。血管の損傷も出血を引き起こし、血液のためにイメージングが不可能になります。感染を避けるためには、ACSFを吸い出して脳表面とラップをできるだけしっかりと取り付けることが重要です。マンニトール投与は、手術中の脳圧の上昇を防ぐことにより、脳および血管の損傷を回避するために重要です。これにより、脳の表面と硬膜の間の空間が維持され、頭蓋骨と硬膜の除去中に脳と血管が触れるのを防ぎます。高倍率の実体顕微鏡や先端が尖ったピンセットも正確な手術に有効です。
フィブロイン-AAV法では、フィブロイン溶液を凍結させず、フィブロイン-AAV溶液を十分に乾燥させ、十分な量の溶液(直径3mmあたり5μL)を適用するために、肉蚕の繭を使用することが不可欠である。古い繭を使用した場合、発現効率は低かった。これは、古い繭からのフィブロインが変性しやすい可能性があるためです。フィブロイン溶液を-80°Cで凍結し、使用時に解凍したところ、発現効率が悪かった。これは、凍結融解によるタンパク質の変性が原因である可能性があります。フィブロイン溶液は4°Cで保存するとゲル化するまで有効に使用できるため、フィブロイン溶液は冷蔵保存し、ゲル化後再び繭から精製することをお勧めします。フィブロイン-AAV溶液は、3時間未満後に発現が悪くなるため、少なくとも3時間乾燥する必要があります。最後に、発現領域は、使用されるフィブロイン-AAV溶液の量に依存する。 図3Mの例では、量は少なかった(5μL)。したがって、フィブロイン-AAVフィルムは窓の上半分のみを覆い、窓上で不均一な発現をもたらした。十分な量のフィブロイン-AAVを使用すると、発現はウィンドウ全体にわたって均一になります。
テクニックの変更
新しい頭蓋窓技術により、皮質回路の巨視的活動とその根底にある単一細胞レベルの活性を同じマウスで調べることができます。したがって、この方法は、様々な神経科学研究に適用することができる。例えば、意思決定課題、運動学習、および脳損傷および疾患のマウスモデルにおける皮質活動を観察するために使用することができる。また、げっ歯類だけでなく、ヒト以外の霊長類にも適用できると考えています。
この論文は、大きな頭蓋窓がトランスジェニックマウスおよび機能タンパク質を発現するAAVを注射したマウスのイメージングに有効であることを実証しています。特に、ラップ上のフィブロイン-AAVフィルムは、皮質の広い領域にわたってGECIを発現させるために、従来のAAV注射法よりもはるかに簡単であることが示されています。異なる色のGECIをコードする2つのAAVの混合物を使用して41、ニューロンとグリア細胞活動との間の相関を皮質の広い領域にわたって同時に画像化することができる。さらに、フィブロイン−AAV膜法は、他の遺伝子コードバイオセンサ42、43、44、45、46、47にも適用することができる。
両方の半球を画像化できるより大きな頭蓋窓も可能です。はるかに広い視野(~25 mm 2)の2光子顕微鏡が最近開発されました25,26,27,28,29。この2光子イメージング技術と、ここで紹介した広い頭蓋窓を用いた1光子広視野イメージングを組み合わせることで、集団活動と1細胞活動の関係をこれまでにないスケールで検討することができます。
制限
フードラップは物質を通過させません。このため、薬理学的実験に使用することが困難になります。ラップを取り外すことも困難であり、ガラスピペットまたは電極を挿入することが不可能である。そのため、カルシウムイメージングや電気生理学的記録の同時投与、ガラスピペットを用いた薬物の局所投与など、他の方法と組み合わせて実験を行うことは困難である。これらの制限の可能な解決策は、穴のあるラップとガラス窓を使用することです。これにより、頭蓋窓を長期間無菌状態に保ちながら、ガラスピペットまたは記録電極 を介した 脳へのアクセスが可能になります48。
開示事項
著者は開示するものは何もありません。
謝辞
本研究は、科研費学術変革領域研究(A)「グリアデコード」(JP21H05621〜SM)、JSPS科研費(JP19K06883〜SM、15KK0340〜ES、JP22H00432、JP22H05160、JP17H06312〜HB、JP17H06313〜KK)、科研費 統合ニューロテクノロジーによる脳マッピング研究(Brain/MINDS)(JP19dm0207079H0002〜SM、JP19dm0207079〜HB、JP19dm0207080〜KK)、成重神経科学研究財団(SMへ) 山梨県若手研究者助成(SMへ)、武田科学振興財団(SMへ)、山梨大学フロンティア脳研究助成の一部支援
動物の世話と技術支援をしてくれた矢口さんと岡崎さん、そして有益な議論をしてくださった北村研究室のメンバーに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 4% paraformaldehyde phosphate buffer solution | NACALAI TESQUE, Kyoto, Japan | TritonX | Expression efficiency of the wrap with the fibroin-AAV film method |
| 50 mL beaker | |||
| Acquisition software | Brain vision | BV_Ana | For wide-field calcium imaging of GCaMP6f |
| Acquisition software | Hamamatsu photonics | High speed recording software: HSR | For wide-field calcium imaging of XCaMP-R |
| Acquisition software | Vibrio Technologies | scanImage | For two-photon calcium imaging |
| ACSF (artificial cerebrospinal fluid) | 150 mM NaCl, 2.5 mM KCl, 10 mM HEPES, 2 mM CaCl2, 1 mM MgCl2, pH = 7.4 with 1M NaOH | ||
| ACSF aspiration needle | |||
| Adeno-associated virus | VectorBuilder | custom-made | AAV-DJ/8-Syn1-XCaMP-R |
| Adhesives for biological use | Daiichi Sankyo | Aron Alpha-A | |
| Anesthesia machine | Shinano seisakusho | SN-487 | |
| Anesthetic | Kyoritsu Seiyaku Corporation | pentobarbital | Expression efficiency of the wrap with the fibroin-AAV film method |
| Auxiliary ear bar | Narishige | EB-5N | |
| CCD camera | Brain vision | MiCAM02-HR | For wide-field calcium imaging of GCaMP6f |
| Clear vinyl polysiloxane | GC | Exaclear | |
| CMOS camera | Hamamatsu photonics | ORCA-spark | For wide-field calcium imaging of XCaMP-R |
| Cotton swab | |||
| Cover glass | Matsunami | 18 x 18 NO.1 | Size: 18 x 18 mm, Thickness: 0.13-0.17 mm, Borosilicate glass |
| DAPI | Thermo Fisher | D1306 | Expression efficiency of the wrap with the fibroin-AAV film method |
| Ddialysis cassette | 3.5K MWCO, Slide-A-Lyzer | ThermoFisher | |
| Dental adhesive resin cement | SUN MEDICAL | Super-Bond | |
| Dental drill | Nakanishi | VOLVERE Vmax | |
| Digital scale | Dretec | KS-243 | |
| Filters | Brain vision | EM: BP466/40-25, DM: DM506, EX: BP520/36-50 | |
| Filters | Olympus | U-MRFPHQ, EM: BP535-555HQ, DM: DM565HQ, Ex: BA570-625HQ | |
| Fluorescence microscope | Keyence | BZ-X810 | Expression efficiency of the wrap with the fibroin-AAV film method |
| Fluorescent beads | Fluoresbrite YG Carboxylate Microspheres | 0.1 µm | Evaluation of the point spread function under the conventional and the new cranial windows in two-photon imaging |
| Forceps | FST | No. 11252-20 | thin-tipped, for removal of dura mater |
| Forceps | KFI | K-7, No.J 18-8 | for general use |
| Gelatin for hemostasis | Johnson & Johnson | Spongostan | |
| Gentamicin sulfate | Iwaki seiyaku | ||
| Glass pipette | custom-made | ||
| Hair remover | Reckitt Japan | Veet | |
| Head fixing device | custom-made | Craniotomy for Cortical Voltage-sensitive Dye Imaging in Mice. Suzuki, T., and Murayama, M. Bio-protocol 2016 6:e1722. | |
| Head plate | custom-made | aluminum or resin, size: 40 x 25 mm, thickness: 1.5 mm or 2 mm, hole in the center: 15 x 10 mm (head_plate_06 v3.f3d) | |
| Heating pad | |||
| Image processing software (for calcium imaging data analysis) | ImageJ | https://imagej.net | |
| Isoflurane | Pfizer | ||
| Light source | Hayashi-repic | LA-HDF108AA | |
| Light source | Brain vision | LEX2-LZ4-B | For wide-field calcium imaging of GCaMP6f |
| Light source | Olympus | U-HGLGPS | For wide-field calcium imaging of XCaMP-R |
| Mannitol solution (15% with saline) | Sigma-Aldrich (Merck) | M4125 | |
| Micro curette | FST | No. 10080-05 | |
| Microscope | Brain vision | For wide-field calcium imaging of GCaMP6f | |
| Microscope | Olympus | MVX10 | For wide-field calcium imaging of XCaMP-R |
| Microscope | Sutter Instruments | MOM | For two-photon calcium imaging |
| Microslicer | Dosaka EM | DTK-1000N | Expression efficiency of the wrap with the fibroin-AAV film method |
| Mixing tip | GC | ||
| Needle (30 G) | |||
| Polyethylens spoids | AS ONE | 1-4656-01 | |
| Polyvinylidene chloride (PVDC) film | Asahi Kasei | Asahi Wrap (or Saran Wrap) | |
| Povidone-iodine | Mundipharma | Isodine | |
| Python libralies | NumPy | package for scientific computing, https://numpy.org/doc/stable/index.html# | |
| Matplotlib | library for visualizations, https://matplotlib.org/stable/index.html# | ||
| pandas | data analysis and manipulation tool, https://pandas.pydata.org | ||
| Scalpel | Kai | No. 11 | |
| Shaver for animal | |||
| Silicone dispensers | GC | ||
| Silkworm cocoon | Satoyama Craft News | https://sato-yama.jp/ | |
| Stereomicroscope | LEICA | MZ6 | objective lens: 0.63x, eyepiece: 25x |
| Surfactant | NACALAI TESQUE | TritonX | Expression efficiency of the wrap with the fibroin-AAV film method |
| Surgical Scissors | FST | No. 91460-11 | |
| Syringe for mannitol injection | Terumo | 1mL | |
| Transdermal anesthetic | AstraZeneca | Lidocaine | |
| Transgenic mice used for calcium imaging of astrocytes | The mice were obtained by the following method. AldH1l1-CreERT2 mice: B6N.FVB-Tg(Aldh1l1-cre/ERT2)1Khakh/J (The Jackson laboratory, strain #: 031008) Tamoxifen-inducible Cre recombinase expression directed at high levels to the vast majority of astrocytes Flx-Lck-GCaMP6f mice: C57BL/6N-Gt(ROSA)26Sor[tm1(CAG-GCaMP6f)Khak]/J (The Jackson laboratory, strain #: 029626) Cre-dependent expression of a plasma membrane-targeted GCaMP6f. A mouse born from crossbreeding these mice were treated with tamoxifen (20 mg/mL) for 5 days (0.05 mL/10g bw, i.p.) to express GCaMP6f. | ||
| Tunable ultrafast lasers | Spectra-Physics | InSight X3 | For two-photon calcium imaging |
| Waterproof film | Nichiban | BFR5 | |
| Wild-type mice | Japan SLC | C57BL/6J | Male and femalek, >4 weeks old |
参考文献
- Ren, C., Komiyama, T. Wide-field calcium imaging of cortex-wide activity in awake, head-fixed mice. STAR Protocols. 2 (4), 100973(2021).
- Couto, J., et al. Chronic, cortex-wide imaging of specific cell populations during behavior. Nature Protocols. 16 (7), 3241-3263 (2021).
- Kauvar, I. V., et al. Cortical Observation by Synchronous Multifocal Optical Sampling Reveals Widespread Population Encoding of Actions. Neuron. 107 (2), 351-367 (2020).
- Clancy, K. B., Orsolic, I., Mrsic-Flogel, T. D. Locomotion-dependent remapping of distributed cortical networks. Nature Neuroscience. 22 (5), 778-786 (2019).
- MacDowell, C. J., Buschman, T. J. Low-dimensional spatiotemporal dynamics underlie cortex-wide neural activity. Current Biology. 30 (14), 2665-2680 (2020).
- Makino, H., et al. Transformation of cortex-wide emergent properties during motor learning. Neuron. 94 (4), 880-890 (2017).
- Murphy, T. H., et al. Automated task training and longitudinal monitoring of mouse mesoscale cortical circuits using home cages. eLife. 9, 559654(2020).
- Rynes, M. L., et al. Miniaturized head-mounted microscope for whole-cortex mesoscale imaging in freely behaving mice. Nature Methods. 18 (4), 417-425 (2021).
- Cardin, J. A., Crair, M. C., Higley, M. J. Mesoscopic imaging: Shining a wide light on large-scale neural dynamics. Neuron. 108 (1), 33-43 (2020).
- Ren, C., Komiyama, T. Characterizing cortex-wide dynamics with wide-field calcium imaging. The Journal of Neuroscience. 41 (19), 4160-4168 (2021).
- Hamodi, A. S., Martinez Sabino, A., Fitzgerald, N. D., Moschou, D., Crair, M. C. Transverse sinus injections drive robust whole-brain expression of transgenes. eLife. 9, 53639(2020).
- Michelson, N. J., Vanni, M. P., Murphy, T. H. Comparison between transgenic and AAV-PHP.eB-mediated expression of GCaMP6s using in vivo wide-field functional imaging of brain activity. Neurophotonics. 6 (2), 025014(2019).
- Oomoto, I., et al. Protocol for cortical-wide field-of-view two-photon imaging with quick neonatal adeno-associated virus injection. STAR Protocols. 2 (4), 101007(2021).
- Fan, J. T., et al. Video-rate imaging of biological dynamics at centimetre scale and micrometre resolution. Nature Photonics. 13 (11), 809-816 (2019).
- Stuart, G. J., Spruston, N. Dendritic integration: 60 years of progress. Nature Neuroscience. 18 (12), 1713-1721 (2015).
- Grienberger, C., Chen, X., Konnerth, A. Dendritic function in vivo. Trends in Neurosciences. 38 (1), 45-54 (2015).
- Takahashi, N., et al. Locally synchronized synaptic inputs. Science. 335 (6066), 353-356 (2012).
- Kitamura, K., Hausser, M. Dendritic calcium signaling triggered by spontaneous and sensory-evoked climbing fiber input to cerebellar Purkinje cells in vivo. The Journal of Neuroscience. 31 (30), 10847-10858 (2011).
- Manita, S., et al. A top-down cortical circuit for accurate sensory perception. Neuron. 86 (5), 1304-1316 (2015).
- Stobart, J. L., et al. Cortical circuit activity evokes rapid astrocyte calcium signals on a similar timescale to neurons. Neuron. 98 (4), 726-735 (2018).
- Srinivasan, R., et al. Ca(2+) signaling in astrocytes from Ip3r2(-/-) mice in brain slices and during startle responses in vivo. Nature Neuroscience. 18 (5), 708-717 (2015).
- Shigetomi, E., Patel, S., Khakh, B. S. Probing the complexities of astrocyte calcium signaling. Trends in Cell Biology. 26 (4), 300-312 (2016).
- Tischbirek, C., Birkner, A., Jia, H., Sakmann, B., Konnerth, A. Deep two-photon brain imaging with a red-shifted fluorometric Ca2+ indicator. Proceedings of the National Academy of Sciences of the United States of America. 112 (36), 11377-11382 (2015).
- Kondo, M., Kobayashi, K., Ohkura, M., Nakai, J., Matsuzaki, M. Two-photon calcium imaging of the medial prefrontal cortex and hippocampus without cortical invasion. eLife. 6, 26839(2017).
- Demas, J., et al. cortex-wide volumetric recording of neuroactivity at cellular resolution using light beads microscopy. Nature Methods. 18 (9), 1103-1111 (2021).
- Ota, K., et al. cell-resolution, contiguous-wide two-photon imaging to reveal functional network architectures across multi-modal cortical areas. Neuron. 109 (11), 1810-1824 (2021).
- Sofroniew, N. J., Flickinger, D., King, J., Svoboda, K. A large field of view two-photon mesoscope with subcellular resolution for in vivo imaging. eLife. 5, 14472(2016).
- Stirman, J. N., Smith, I. T., Kudenov, M. W., Smith, S. L. Wide field-of-view, multi-region, two-photon imaging of neuronal activity in the mammalian brain. Nature Biotechnology. 34 (8), 857-862 (2016).
- Yu, C. H., Stirman, J. N., Yu, Y., Hira, R., Smith, S. L. Diesel2p mesoscope with dual independent scan engines for flexible capture of dynamics in distributed neural circuitry. Nature Communications. 12 (1), 6639(2021).
- Barson, D., et al. Simultaneous mesoscopic and two-photon imaging of neuronal activity in cortical circuits. Nature Methods. 17 (1), 107-113 (2020).
- Wekselblatt, J. B., Flister, E. D., Piscopo, D. M., Niell, C. M. Large-scale imaging of cortical dynamics during sensory perception and behavior. Journal of Neurophysiology. 115 (6), 2852-2866 (2016).
- Kim, T. H., et al. Long-term optical access to an estimated one million neurons in the live mouse cortex. Cell Reports. 17 (12), 3385-3394 (2016).
- Ghanbari, L., et al. Cortex-wide neural interfacing via transparent polymer skulls. Nature Communications. 10 (1), 1500(2019).
- Takahashi, T., Zhang, H., Otomo, K., Okamura, Y., Nemoto, T. Protocol for constructing an extensive cranial window utilizing a PEO-CYTOP nanosheet for in vivo wide-field imaging of the mouse brain. STAR Protocols. 2 (2), 100542(2021).
- Suzuki, T., Murayama, M. Craniotomy for cortical voltage-sensitive dye imaging in mice. Bio-Protocol. 6 (3), 1722(2016).
- Jackman, S. L., et al. Silk fibroin films facilitate single-step targeted expression of optogenetic proteins. Cell Reports. 22 (12), 3351-3361 (2018).
- Rockwood, D. N., et al. Materials fabrication from Bombyx mori silk fibroin. Nature Protocols. 6 (10), 1612-1631 (2011).
- Jia, H., Rochefort, N. L., Chen, X., Konnerth, A. In vivo two-photon imaging of sensory-evoked dendritic calcium signals in cortical neurons. Nature Protocols. 6 (1), 28-35 (2011).
- Pachitariu, M., et al. Suite2p: beyond 10,000 neurons with standard two-photon microscopy. bioRxiv. , 061507(2017).
- Srinivasan, R., et al. New transgenic mouse lines for selectively targeting astrocytes and studying calcium signals in astrocyte processes in situ and in vivo. Neuron. 92 (6), 1181-1195 (2016).
- Inoue, M., et al. Rational engineering of XCaMPs, a multicolor GECI suite for in vivo imaging of complex brain circuit dynamics. Cell. 177 (5), 1346-1360 (2019).
- Patriarchi, T., et al. Ultrafast neuronal imaging of dopamine dynamics with designed genetically encoded sensors. Science. 360 (6396), (2018).
- Sun, F., et al. A genetically encoded fluorescent sensor enables rapid and specific detection of dopamine in flies, fish, and mice. Cell. 174 (2), 481-496 (2018).
- Marvin, J. S., et al. An optimized fluorescent probe for visualizing glutamate neurotransmission. Nature Methods. 10 (2), 162-170 (2013).
- Feng, J., et al. A genetically encoded fluorescent sensor for rapid and specific in vivo detection of norepinephrine. Neuron. 102 (4), 745-761 (2019).
- Piatkevich, K. D., et al. Population imaging of neural activity in awake behaving mice. Nature. 574 (7778), 413-417 (2019).
- Sabatini, B. L., Tian, L. Imaging neurotransmitter and neuromodulator dynamics in vivo with genetically encoded indicators. Neuron. 108 (1), 17-32 (2020).
- Roome, C. J., Kuhn, B. Chronic cranial window with access port for repeated cellular manipulations, drug application, and electrophysiology. Frontiers in Cellular Neuroscience. 8, 379(2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved