Method Article
İn Vivo Büyük Bir Kraniyal Pencere Kullanarak Bir Fareden Geniş Alan ve İki Foton Kalsiyum Görüntüleme
Bu Makalede
Özet
Mevcut protokol, gıda sargısı, şeffaf silikon ve kapak camı kullanarak büyük (6 x 3 mm2) bir kafatası penceresi yapmayı açıklamaktadır. Bu kafatası penceresi, aynı farede in vivo geniş alan ve iki fotonlu kalsiyum görüntüleme deneylerine izin verir.
Özet
Farenin neokorteksinden geniş alan kalsiyum görüntüleme, çeşitli beyin fonksiyonlarıyla ilgili korteks çapında nöral aktiviteyi gözlemlemeyi sağlar. Öte yandan, iki fotonlu görüntüleme, yerel sinir devrelerinin aktivitesini tek hücre seviyesinde çözebilir. Aynı farede her iki görüntüleme tekniğini kullanarak çok ölçekli analiz yapmak için büyük bir kafatası penceresi yapmak çok önemlidir. Bunu başarmak için, kafatasının büyük bir bölümünü çıkarmalı ve maruz kalan kortikal yüzeyi şeffaf malzemelerle örtmelidir. Daha önce, cam kafatasları ve polimer bazlı kafatası pencereleri bu amaçla geliştirilmiştir, ancak bu malzemeler kolayca üretilmemektedir. Mevcut protokol, ticari olarak temin edilebilen poliviniliden klorür (PVDC) sarma filmi, şeffaf bir silikon tapa ve bir kapak camından oluşan büyük bir kafatası penceresi yapmak için basit bir yöntemi açıklamaktadır. Tüm yarımkürenin dorsal yüzeyini görüntülemek için, pencere boyutu yaklaşık 6 x 3mm2 idi. Bu kadar büyük bir pencereden bağımsız olarak şiddetli beyin titreşimleri gözlenmedi. Önemli olarak, beyin yüzeyinin durumu bir aydan fazla bir süre bozulmadı. Genetik olarak kodlanmış bir kalsiyum göstergesini (GECI) ifade eden bir farenin geniş alan görüntülemesi, GCaMP6f, özellikle astrositlerde, birkaç milimetrede senkronize tepkiler ortaya çıkardı. Aynı farenin iki fotonlu görüntülemesi, birkaç saniye içinde bireysel astrositlerde belirgin kalsiyum tepkileri gösterdi. Ayrıca, PVDC filmine adeno ilişkili bir virüsün ince bir tabakası uygulandı ve GECI'yi kraniyal pencere üzerindeki kortikal nöronlarda başarıyla ifade etti. Bu teknik, büyük bir kraniyal pencere yapmak için güvenilir ve uygun maliyetlidir ve nöral ve glial dinamiklerin ve bunların makroskobik ve mikroskobik seviyelerde davranış sırasındaki etkileşimlerinin araştırılmasını kolaylaştırır.
Giriş
Geniş alan kalsiyum görüntüleme, hayvan beyninin geniş bir alanı üzerindeki uzaysal zamansal aktivite paternini etkili bir şekilde araştırır 1,2,3. Geniş alan görüntüleme, kemirgenlerin tüm kortikal yüzeyini gözlemlemek için yaygın olarak kullanılmıştır, çünkü korteksleri nispeten düz 2,3,4,5,6,7,8,9,10'dur. Transgenik fareler veya nöronlar ve glial hücreler gibi çeşitli hücrelerde GECI'leri spesifik olarak eksprese eden adeno ilişkili virüs (AAV) enjekte edilen fareler, geniş alan kalsiyum görüntülemeiçin kullanılabilir 11,12,13. Bununla birlikte, bu tekniğin uzamsal çözünürlüğü genellikle in vivo14 bireysel hücrelerin aktivitesini çözmek için yeterli değildir. Daha derin katmanlarda bulunan hücreleri görüntülemek için de uygun değildir.
Öte yandan, iki fotonlu kalsiyum görüntüleme, hücre altı uzamsal çözünürlükle aynı anda birden fazla hücrenin aktivitesini gözlemleyebilir ve nöronal dendritlerde ve glial süreçlerde bile bireysel hücrelerin aktivitesinin gözlemlenmesine izin verir 15,16,17,18,19,20,21,22. Ayrıca serebral korteks23,24'ün daha derin katmanlarındaki hücreleri de gözlemleyebilir. İki foton mikroskobundaki son teknolojik gelişmeler, milimetre genişliğindeki kortikal bölgelerden25,26,27,28,29 görüntülemeyi mümkün kılsa da, iki fotonlu görüntüleme ile geniş alan görüntüleme ile karşılaştırılabilir bir alanı gözlemlemek hala zordur.
Beyin aktivitesinin tek hücreden tüm beyne fizyolojik uygunluğunu anlamak için, kortikal bölgelerin tüm korteks üzerindeki aktivitesi ile yerel sinir devrelerindeki tek hücreli çözünürlükteki aktivite arasındaki boşluğu kapatmak çok önemlidir. Bu nedenle, aynı farede gerçekleştirilen geniş alan ve iki fotonlu kalsiyum görüntülemenin bir kombinasyonu özellikle etkilidir. Bunu gerçekleştirmek için, ideal olarak uzun bir süre boyunca geniş ve istikrarlı bir kafatası penceresi oluşturulmalıdır.
Daha önce, geniş alan ve iki foton görüntülemenin aynı farede gerçekleştirilmesine izin vermek için kafatası pencereleri yapmak için çeşitli teknikler geliştirilmiştir30,31. Çıkarılan kemiğin yerini almak için kortikal yüzey şeklinde kalıplanmış yamuk şekilli kapak cam pencereleri (kristal kafatası), tüm korteks32 üzerinde optik erişime izin verir. Alternatif olarak, polimer bazlı kraniyal pencereler polietilen tereftalat (PET)33 veya polietilen-oksit kaplı amorf floropolimerler nanosheet34 ile yapılabilir. Her yöntemin 1 aydan fazla bir süre boyunca sabit bir pencere tuttuğu gösterilmiştir. Bununla birlikte, bu pencereleri üretmek kolay değildir ve kullanılan malzemeler ve ekipmanlar genellikle pahalıdır.
Bu çalışmada, PVDC filmi (plastik gıda ambalajı) kullanarak büyük bir kafatası penceresi yapmak için yeni bir yöntem açıklanmaktadır (Şekil 1). Bu pencereyi kullanarak, aynı farelerde in vivo geniş alan ve iki foton görüntüleme deneyleri yapılabilir. Ayrıca, GECI'lerin, sargı üzerinde AAV parçacıkları içeren ince bir film tabakası oluşturarak farelerin korteksinin geniş bir alanı üzerindeki nöronlarda eksprese edilebileceği gösterilmiştir.
Protokol
Deneysel prosedürler Yamanashi Üniversitesi Hayvan Deney Komitesi tarafından onaylandı. Bu çalışmada astrositlerde vahşi tip (C57BL/6J, Japonya SLC) ve membrana implante GECI (Lck-GCaMP6f) eksprese eden transgenik fareler kullanılmıştır. Transgenik fareler AldH1l1-CreERT2 farelerini geçerek elde edildi [B6N. FVB-Tg(Aldh1l1-cre/ERT2)1Khakh/J, ticari olarak elde edilen, bkz. Malzeme Tablosu] ve Flx-Lck-GCaMP6f fareler [C57BL/6N-Gt(ROSA)26Sor/J, ticari olarak elde edilen] fareler. Transgenik fareler, GCaMP6f'yi eksprese etmek için 5 gün boyunca (0.05 mL / 10 g bw, i.p.) tamoksifen (20 mg / mL) ile tedavi edildi. Kullanılan tüm fareler en az 4 haftalık erkek ve dişilerdi. Pencerenin şeması Şekil 1A'da, cerrahi prosedür ise Şekil 1B'de gösterilmiştir.
1. Kraniyal pencere cerrahisi için hazırlık
- İzofluran ile fareleri anestezik hale getirin (indüksiyon: %3, cerrahi: %1-%1.5, akış hızı: 0.2-0.3 L/dak). Anestezi derinliğini kuyruk veya ayak parmağı sıkışma refleksi kaybı ile onaylayın. Bir ısıtma yastığı (36-38 ° C) kullanarak vücut ısısını koruyun. Farelerin gözlerinin anestezi altında kurumasını önlemek için pamuklu çubukla göz merhemi uygulayın.
- İntraperitoneal olarak% 15 mannitol çözeltisi (bakınız Malzeme Tablosu) enjekte edin (3 mL / 100 g vücut ağırlığı). Farenin kafasını kulak çubuklarıyla stereotaksik bir çerçeveye sabitleyin. Bir tıraş makinesi ve epilasyon kremi kullanarak farenin kafasındaki tüyleri çıkarın.
- Cilt yüzeyini povidon-iyot ve alkol ile üç kez dezenfekte edin. Önleyici analjezi sağlamak için Lidokaini topikal olarak uygulayın. Cerrahi makasla ilgilenilen bölgedeki cildi çıkarın ve kafatasını ortaya çıkarın (boyut: 15 x 15 mm). Kanama varsa, kanamayı durdurmak için pamuklu çubukla kullanın.
NOT: Bu çalışmada, prefrontal korteksi görsel kortekse gözlemlemek için deri çıkarıldı. - Bir mikro küret kullanarak açıkta kalan kafatasının üzerindeki periostu çıkarın ve kafa plakasını diş çimentosu ile kafatasına sıkıca tutturmak için kafatası yüzeyini kurutun (bkz.
NOT: Özel yapım kafa plakası bir 3D yazıcı kullanılarak oluşturulur. Tasarım dosyası Github deposuna (https://github.com/Satoshi-Manita/Head-plates) depolanır. - Kafa plakasını diş çimentosu kullanarak takın (Şekil 2C). Çimentonun sertleşmesi için en az 20 dakika bekleyin. Kafa plakasını kafa plakası tutucusu35 ile sabitleyin.
2. Kraniyal pencerenin yapılması
- Kafatasının üzerindeki ekstra çimentoyu bir diş matkabı ile çıkarın (bkz. Kemiği delmemeye ve delme yaparak beyne zarar vermemeye dikkat edin.
- Kesilecek alanı kalemle işaretleyin ve neşterle kemiğe kesin. Ucun kafatasına nüfuz etmemesini sağlamak için neşterin ucunu köreltin (Ek Şekil 1). Pencerenin nerede yapılacağını belirlemek için beyin atlasına başvurun.
NOT: Bu çalışmada anteroposterior eksende bregmadan -2 mm ile +4 mm arasında ve mediolateral eksende sagital sütürden +3 mm'ye kadar motor, somatosensoriyel ve görsel korteksler dahil olmak üzere bir pencere oluşturulmuştur. - Kesilecek bölgedeki kemik hafifçe dokunulduğunda iyi hareket edene kadar oluğu derinleştirmek için kemiği tekrar tekrar bir neşterle kazıyın.
- Kesilmiş kemiği ince cımbızla çıkarın. Beyne zarar verebilecek kemik kapağını beyne itmeyin (Şekil 1Ba).
NOT: Kemiği çıkardıktan sonra kanama gözlenirse, derhal yapay beyin omurilik sıvısını (ACSF, bakınız Malzeme Tablosu) uygulayın ve aspire edin ve kanama durana kadar bu işlemi tekrarlayın. Alternatif olarak, kanama noktasına ACSF'ye batırılmış hemostatik jelatin süngeri (yaklaşık 3 mm kare küpler) yerleştirin. - Dura kaldırılmazsa, adım 2.7'ye geçin.
- Aşağıdaki adımları izleyerek dura mater'i çıkarın.
- Dura'yı, örneğin, aşağıdaki durumlarda çıkarın; fibroin-AAV film yöntemi36 kullanılarak transfeksiyon ve dendritik dikenler gibi küçük yapıların gözlemlenmesi.
- Dura'yı, yaklaşık 10 μm'lik konik bir ucu olan çekilmiş bir cam pipet kullanarak kesin. Bu kesimi tüm pencereye genişletmek için, U şeklinde bir iğne kullanın.
- Stereomikroskop yakınlaştırmasını 60-100x'e ayarlayın ve kesilmiş dura mater'i ultra ince cımbızla çıkarın. Dura materin çıkarılması kanamaya neden oluyorsa, ACSF ile durulayın veya kanamayı durdurmak için jelatin sünger kullanın.
- PVDC sargısını kesin.
- Büyük (örneğin, 10 x 15 mm) PVDC sargı parçasını (yaklaşık 11 μm, bakınız Malzeme Tablosu, Şekil 2Aa) otoklavlama ve% 70 etanol ile sterilize edin.
- Bir stereomikroskop altında, gerekli boyutta bir sargıyı kesmek için cımbız ve neşter kullanın.
NOT: Sargı boyutunun, kafatası penceresinin boyutundan yaklaşık 10 mm daha büyük, ancak kafa plakasının açıklığından daha küçük olması gerekir. 6 x 3 mm2 kafatası penceresi için 15 x 10mm2'lik bir sargı hazırlayın.
- Aşağıdaki adımları izleyerek ambalajı doğru bir şekilde yerleştirin.
- Sargıyı beyin yüzeyine yerleştirin ve ACSF'yi yüzeyde bırakın. ACSF'yi sargının kenarından emerek sargının beyin yüzeyine sıkıca yapışmasını sağlayın (Şekil 1Bb,c).
NOT: Kullanılan sargı kırışıklığa dayanıklıdır, bu nedenle sadece beynin yüzeyine yerleştirmek neredeyse hiç kırışıklık üretmez. - Sargıyı bir neşter ve cımbızla kesin, böylece kafatası penceresinin kenarı ile sargı arasında yaklaşık 1 mm'lik bir boşluk kalır (Şekil 1Bd).
- Sargı yerine oturduğunda, sargının kenarını biyolojik bir yapıştırıcı ile kafatasına yapıştırın (bkz. Yapıştırıcının yaklaşık 30 dakika kurumasını bekleyin.
- Sargıyı beyin yüzeyine yerleştirin ve ACSF'yi yüzeyde bırakın. ACSF'yi sargının kenarından emerek sargının beyin yüzeyine sıkıca yapışmasını sağlayın (Şekil 1Bb,c).
- Şeffaf silikon elastomeri uygulayın.
- Ticari olarak temin edilebilen şeffaf silikon elastomeri (bkz. Malzeme Tablosu) karıştırma uçlu bir dağıtıcı kullanarak (Şekil 1Be, 2A b-d) ambalajın üzerine uygulayın ve kapak camını (0,12-0,17 mm kalınlıkta) üstüne yerleştirin (Şekil 2E).
- Kapak camının çevresini su geçirmez film, süper yapıştırıcı veya diş çimentosu ile kapatın (Şekil 1Bf).
- Ameliyattan sonra, sternal yatışmayı korumak için bilinci yeniden kazanana kadar fareyi izleyin. Bundan sonra, fareleri ayrı ayrı tutun ve en az 7 gün boyunca ev kafeslerinde iyileşmelerine izin verin.
- Stres ve ağrıyı azaltmak için, anti-enflamatuar ve analjezik ajanlar uygulayın (örneğin, deksametazon ve ketoprofen, her biri 5 mg / kg, yani ).
- Fareleri enfeksiyon için düzenli olarak izleyin. Bir enfeksiyon doğrulanırsa, enfeksiyon ortadan kalkana kadar (tipik olarak 4 haftadan az) içme suyunda bir antimikrobiyal ilaç (örneğin% 10 enrofloksasin, 1.7 μL / mL) uygulayın.
3. Fibroin çözeltisi kullanarak plastik ambalaj üzerine AAV filmi yapmak
NOT: Adım 3 isteğe bağlıdır.
- Daha önce yayınlanmış bir yöntemi izleyerek ipekböceği kozalarından fibroin çözeltisi hazırlayın37.
- Kısacası, piyasada bulunan normal ipekböceği kozalarını (5 g, bakınız Malzeme Tablosu) sodyum karbonat çözeltisinde (0.02 M, 2 L) kaynatın. Kozaları ultra saf suda yıkayın ve gece boyunca kurutun.
- Kurutulmuş kozaları lityum bromür çözeltisi (9.3 M, v fibroin ile% 20) içinde çözün ve fırında 60 ° C'de 4 saat boyunca ısıtın. Çözünmüş koza çözeltisini, santrifüjü (12.700 x g'de iki kez, 20 dakika boyunca 4 ° C'de)37 diyalize edin ve süpernatanı toplayın.
- Aşağıdaki adımları izleyerek fibroin-AAV filmini hazırlayın.
- Fibroin ve AAV çözeltileri20'yi mikropipet kullanarak küçük bir numune tüpünde 1:4 oranında karıştırın. Karışık fibroin-AAV çözeltisinin bir aliquot'unu kraniyal pencere için plastik sargı üzerine bırakın ve en az 3 saat kurulayın.
NOT: 3 mm çapında bir alanda ifade için, 5 μL'lik bir damla fibroin-AAV çözeltisi uygulayın. Bu oran, belirli bir alan için çözelti miktarını belirler. - Kuruduktan sonra, plastik ambalajı pencere için gerekli boyuta (örneğin, 10 x 15 mm) kesin ve beyin yüzeyine yerleştirin. Ardından, yukarıda belirtilen yöntemi adım 2.8.1'den itibaren izleyin.
NOT: Sargıyı beyin yüzeyine yerleştirmeden önce, ACSF'yi beyin yüzeyinden mümkün olduğunca çıkarın. Bunun nedeni, ACSF'nin fibroin-AAV filmini çözmesi ve AAV parçacıklarının konsantrasyonunu azaltması beklenmesidir. - AAV ile tedavi edilen pencereyi oluşturduktan sonra, GECI'ler yeterince ifade edilene kadar yaklaşık 2-4 hafta bekleyin. Bu işlem sırasında, farelerin ve pencerelerin durumunu düzenli olarak kontrol edin.
- Fibroin ve AAV çözeltileri20'yi mikropipet kullanarak küçük bir numune tüpünde 1:4 oranında karıştırın. Karışık fibroin-AAV çözeltisinin bir aliquot'unu kraniyal pencere için plastik sargı üzerine bırakın ve en az 3 saat kurulayın.
4. Kalsiyum görüntüleme ve analizi
NOT: Görüntüleme ve analiz ile ilgili ayrıntılar için lütfen daha önce yayınlanmış 1,2,38 numaralı raporlara bakınız.
- Aşağıdaki adımları izleyerek geniş alan görüntülemesi gerçekleştirin.
- Tandem lensli floresan makroskobun altında bir kafa sabitleme cihazı kullanarak fareyi hareketsiz hale getirin (bkz.
- Farelerin serebral korteksini, bir uyarma filtresi, dikroik ayna ve objektif lens aracılığıyla 465 nm LED ışık kaynağından gelen uyarma ışığıyla aydınlatın.
- Serebral korteksin floresan görüntülerini objektif bir lens (1.0x), dikroik ayna, emisyon filtresi ve görüntüleme lensi (2.0x) aracılığıyla bir CCD kamera ile toplayın. Bu lenslerin kombinasyonu yaklaşık 0.5x toplam büyütme sağlar.
- 50 Hz örnekleme frekansında görüntüler elde edin. Veri topladıktan sonra, ImageJ yazılımını kullanarak görüntüleri analiz edin. İlgilenilen bölgeyi (ROI) manuel olarak seçin. Her ROI'deki floresan değişimini ΔF / F = (Ft - F0) / F0 olarak hesaplayın, burada Ft, her karenin ham floresan değeridir ve F0, tüm karelerin ortalama görüntüsünden elde edilen ortalama floresan değeridir.
NOT: ImageJ için bir makro programı, kalsiyum görüntüleme verilerinden ΔF/F görüntülerini hesaplayan GitHub'a (https://github.com/Satoshi-Manita/ImageJ-macro) depolanır.
- Aşağıdaki adımları izleyerek iki fotonlu görüntüleme gerçekleştirin.
- Bir kafa sabitleme cihazı kullanarak fareyi iki fotonlu mikroskop altında hareketsiz hale getirin. Düşük büyütmeli (5x) objektif lensle parlak alan modunda mikroskop kullanarak görüntülenecek alanı tanımlayın.
- İki fotonlu görüntülemeye geçin. Yüksek büyütmeli objektif lens (16x veya 25x) kullanın ve iki foton uyarımı için lazeri aydınlatın.
NOT: Yeşil Lck-GCaMP6f22 ve kırmızı XCaMP-R36 , sırasıyla 920 nm ve 1070 nm uyarma dalga boylarında ultra hızlı bir lazer tarafından uyarıldı. - 30 Hz'de floresan görüntüler elde edin. Veri toplamadan sonra, suite2p yazılımı39'un kayıt işleviyle hareket yapıtlarını düzeltin. Geniş alan görüntüleme için aynı yöntemi kullanarak görüntülerden ROI ve ΔF/F elde edin.
- Python kullanarak verileri aşağıdaki kitaplıklarla çizin: NumPy, Matplotlib ve Pandas (bkz.
Sonuçlar
PVDC sargı yöntemleri kullanılarak yapılan büyük bir kafatası penceresinin değerlendirilmesi
Ameliyattan hemen sonra, hasar veya iskemiye bağlı kanama ve renk değişikliği gibi kortikal yüzeyin durumuna göre başarı veya başarısızlık bir bakışta kontrol edilebilir. Ameliyattan uzun bir süre sonra, kortikal yüzey enfeksiyon nedeniyle opak beyaz bir zarla kaplanabilir veya kanama nedeniyle pencereyi kan kaplayabilir (Şekil 2G). Bu durumlarda, korteks sağlıklı durumda olmayabilir ve görüntüleme mümkün olmayabilir. Bunlar, kısmen kopmuş sargılardan veya sargının yapıştırıcı tarafından yetersiz sabitlenmesinden kaynaklanabilir. Enfeksiyon tekrar tekrar gözlenirse, pencere yerleşiminde beyin yüzeyine gentamisin sülfat (10 μL, 50 mg / mL) gibi antibiyotiklerin uygulanması etkili olabilir. Meninkslerin veya kemiklerin yenilenmesi, kortikal yüzey ile sargı arasındaki dikey boşluk büyük olduğunda da görülür. Bunu önlemek için, pencere hazırlığı sırasında sargıyı beyin yüzeyine mümkün olduğunca sıkı bir şekilde uygulamak çok önemlidir. Bu, beyin yüzeyine plastik sargı yerleştirerek ve mümkün olduğunca fazla ACSF'yi emerek elde edilebilir. ACSF'nin yokluğunda, plastik ambalajı beyin yüzeyine yerleştirerek yapılabilir. Beyin renginin solmaması ve kan damarlarının kopmaması nedeniyle beyin ve kan damarlarının zarar görmediği belirlenir.
Pencerenin uzun ömürlülüğü büyük ölçüde ameliyatın kalitesine bağlıdır. Durum iyi olduğunda, ameliyattan 1 aydan fazla bir süre sonra enfeksiyon, kanama veya rejenerasyon belirtisi yoktur (Şekil 2F ve Şekil 3B). 10 farenin 8'inde, pencere 10 hafta veya daha uzun süre açık tutulabilir. Farelerin ikisinde pencereler enfeksiyon veya kanama nedeniyle düzgün bir şekilde muhafaza edilememiştir. Büyük pencere mekanik gerilmeye veya darbeye eğilimli olsa da, kırık veya çatlak pencereler gözlenmemiştir.
Sargı, silikon ve cam ile yeni kafatası penceresinin görüntüleme kalitesini değerlendirmek için, nokta yayılma fonksiyonu, agar içinde 0.1 μm floresan boncuklar görüntülenerek yeni pencerenin altındaki nokta yayılma fonksiyonu ile geleneksel cam pencerenin altındakiyle karşılaştırıldı (bakınız Ek Dosya 1). Sonuçlar, her iki koşul için de maksimum yarıda (FWHM) tam genişlikte bir fark göstermedi. [X ekseni (μm): yalnızca cam, 1,99 ± 0,07, sargı, 1,76 ± 0,13, Y ekseni (μm): yalnızca cam, 2,11 ± 0,27, sargı, 1,90 ± 0,15, Z ekseni (μm): yalnızca cam, 25,29 ± 0,71, sargı, 26,64 ± 1,02, N = 7 boncuk, p > 0,05, Ek Şekil 2A,B]. Bu nedenle, eklenen yeni elemanlar (sarma ve silikon) görüntüleme kalitesini bozmamıştır.
Solunum, kalp atışı ve vücut hareketinin neden olduğu titreşim artefaktları geniş alan ve iki fotonlu görüntülemede bulunur. Yeni kafatası penceresinin ne kadar titreştiğini belirlemek için, in vivo iki fotonlu görüntüleme verilerinden küçük bir floresan parçacık seçildi ve görüntüsünün 60'lı yıllarda ne kadar hareket ettiği incelendi. Bu floresan parçacığın sentroidinin standart sapmasının yaklaşık 0.3 μm olduğu ve bunun geleneksel bir cam pencere altındakiyle karşılaştırılabilir olduğu bulunmuştur (Ek Şekil 2C). Bu, beynin şeffaf bir silikon fiş ve kapak camı tarafından tutulduğu için, titreşimlerin geleneksel küçük pencerelerde gözlemlenenlerle karşılaştırılabilir olduğunu ve çevrimdışı görüntü kaydının titreşim artefaktlarını ortadan kaldırmak için yeterli olduğunu göstermektedir.
Geniş alan kalsiyum görüntülemede, kortikal aktivitenin duyusal stimülasyonun neden olduğu korteks boyunca yayıldığı gözlemlenebilir (Şekil 3A-D, K-N). İki fotonlu görüntüleme, nöronlara ve glial hücrelere özgü tek hücreli floresan görüntülerin gözlemlenmesine olanak sağlamıştır (Şekil 3E,O). Duyusal stimülasyonun neden olduğu floresan değişiklikleri bireysel hücrelerde gözlenebilir (Şekil 3E-J, O-T).
PVDC sargısı ve AAV kullanılarak serebral korteksin geniş bir alanında genetik olarak kodlanmış kalsiyum göstergelerinin (GECI'ler) ekspresyonu
Pencere için PVDC sargısı, korteksin geniş bir alanındaki fonksiyonel proteinleri eksprese etmek için uygulanabilir. Bu, biyomalzemeler olarak yaygın olarak uygulanan ipekböceği kozalarının bir bileşen proteini olan AAV ve fibroin kullanılarak elde edilir37. Önceki bir çalışma, fibroinin AAV'lerle karıştırılabileceğini ve fotoaktif opsinler veya GECI'ler36 gibi fonksiyonel proteinleri ifade etmek için beyne implante edilen filmler oluşturabileceğini göstermiştir. Bu çalışmada AAV eksprese eden GECI ve fibroin sargı üzerine karıştırılarak kurutulmuş, kraniyal pencere için AAV kaplı sargı kullanılmıştır. Bu, ameliyattan 2-4 hafta sonra korteksin geniş alanı üzerinde GECI ekspresyonuna neden oldu (Şekil 3K-M). Pencere büyük olduğundan, aynı farenin farklı kortikal alanları görüntülenebilir (Şekil 3M-T).
Bu yöntemin ekspresyon verimliliğini doğrulamak için, GECI'yi eksprese eden hücrelerin sayısı sabit beyinde sayıldı (Ek Şekil 2D). Fibroin-AAV ile sargıyı kullanan mevcut stratejinin, hem yüzeysel hem de daha derin katmanlarda yaklaşık% 20'lik bir verimlilikle GECI'nin ekspresyonuyla sonuçlandığı bulunmuştur (L2/3: %20.78, XCaMP-R eksprese eden hücre: 32 hücre, DAPI: 154 lokasyon, L5: 20.08%, XCaMP-R eksprese eden hücre: 51 hücre, DAPI: 254 lokasyon). Böylece, bu yöntem GECI'leri hücrelerde sadece yüzey katmanlarında değil, aynı zamanda daha derin katmanlarda da ifade etti.
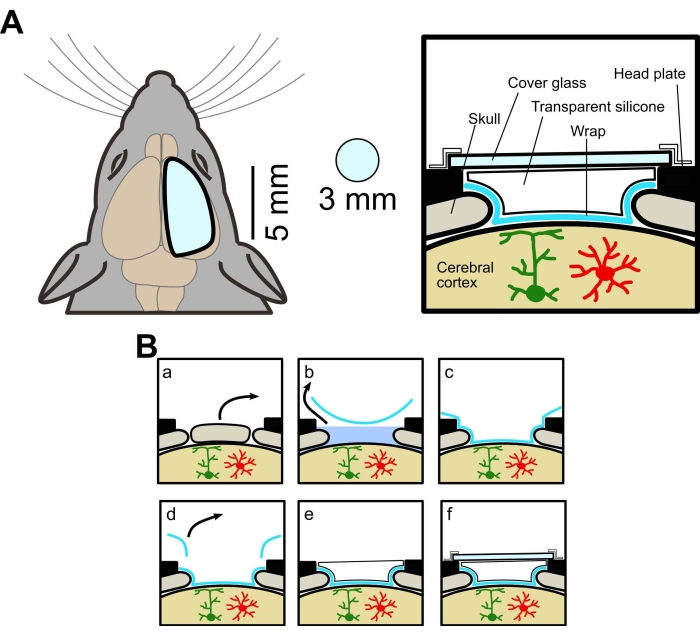
Şekil 1: Büyük kafatası penceresinin kavramsal diyagramı. (A) Sol, yeni kafatası penceresinin şematik çizimi. Geleneksel pencereden daha büyüktür (3 mm çapında). Sağ, Kesitsel görünüm. Büyük bir kafatası penceresi yapma yöntemi, aynı fareden geniş alan ve iki foton görüntülemeye izin veren gıda sargısı, şeffaf silikon elastomer ve kapak camı kullanır. (B) Kraniyal pencere imalat prosedürü: (a) Kemik çıkarma. (b) ACSF'nin sargı altında çıkarılması. (c) ACSF'yi çıkararak sargının beyin yüzeyine yapışması. (d) Fazla sargıyı kesmek. (e) Şeffaf silikon uygulamak. (f) Kapak camının yapıştırılması. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
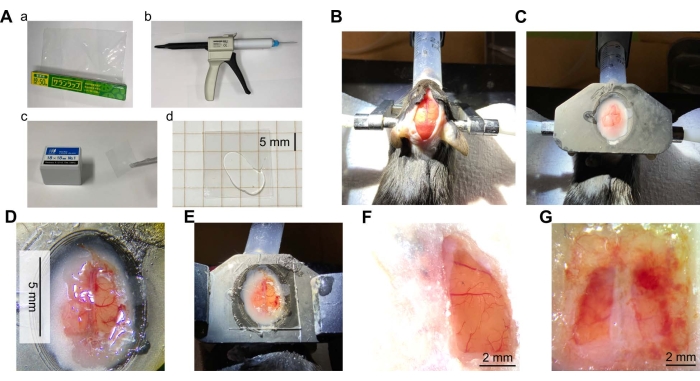
Şekil 2: Kraniyal pencere cerrahisine genel bakış . (A) Kraniyal pencere için gerekli malzeme ve ekipmanlar. (a) Poliviniliden klorür (PVDC) sarma filmi. (b) Karıştırma uçlu şeffaf silikon elastomer dağıtıcısı. (c) Kapak camı. (d) Kapak camının iki parçası arasına yerleştirilmiş şeffaf silikon. (B) Kafatasını ortaya çıkarmak için kesilmiş fare başı derisinin fotoğrafı. Fare uyuşturuldu ve farenin başı kulak çubukları kullanılarak hareketsiz hale getirildi. Baş daha sonra saçları kesildi, lokal analjezi ile tedavi edildi ve cilt kesildi. (C) Bir kafa plakasının montajından sonra fotoğraf. Bir kafa plakası (bir 3D yazıcıdan reçineden yapılmış) farenin kafasına diş çimentosu ile tutturulmuştur. (D) Bir kafatası penceresinin fotoğrafı. Kraniyal pencere, fare beyninin sağ yarımküresinin korteksinde yaratıldı. Dura mater çıkarıldı ve sargı yerine yapıştırıldı. (E) Üstte şeffaf silikon ve kapak camı bulunan sargıdan yapılmış pencerenin fotoğrafı. (F) Başarılı bir pencerenin tipik bir örneği (sağ yarımküre, ameliyattan 7 hafta sonra). (G) Başarısız pencere örneği (her iki yarımküre, ameliyattan 5 hafta sonra). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
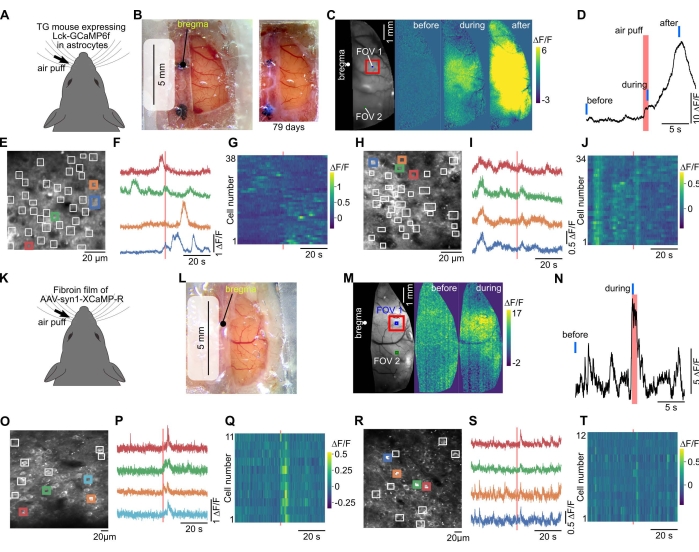
Şekil 3: Büyük pencere, aynı fareden geniş alan ve iki fotonlu kalsiyum görüntülemeye izin verir. (A) Kalsiyum görüntüleme, astrositler40'ta membrana implante GECI'yi (Lck-GCaMP6f) eksprese eden transgenik bir farede gerçekleştirildi. (B) Solda, plastik sargı, şeffaf silikon ve kapak camı ile büyük bir pencere oluşturuldu. Bu pencereden geniş alan görüntüleme yapıldı. Sağda, kafatası penceresinin kurulumundan 79 gün sonra bir fotoğraf çekildi. (C) Kontralateral bıyıklara hava puf stimülasyonu uygulandığında, floresan değişiklikleri gözlendi. (D) Somatosensoriyel korteksteki floresan değişiminin zaman seyri (C'de kırmızı kare) çizildi. Kırmızı ve mavi çubuklar hava puf zamanlamasını ve sırasıyla (C) cinsinden "önce", "sırasında" ve "sonrasında" zamanlamasını gösterir. (E) İki fotonlu kalsiyum görüntülemenin görüş alanı (C'de FOV 1). GCaMP6f'ın membrana lokalize olduğu ifade edildiğinden, astrosit süreçlerinde yerel tepkiyi tespit etmek için ilgi alanları (beyaz kareler) manuel olarak yerleştirildi. (F) (E)'deki renkli karelerdeki floresan değişiklikleri çizilir. (G) (E)'nin tüm karelerindeki floresan değişiklikleri çizilir. Yatay ve dikey eksenler sırasıyla zamanı ve hücre numarasını gösterir. (H-J) (C) içindeki FOV 2 (görsel kortekste) verileri gösterilmiştir. FOV 2, FOV 1'deki görüntülemeden sonra görüntülendi. (K) Kırmızı GECI, XCaMP-R, vahşi tip farede fibroin-AAV yöntemiyle nöronlarda eksprese edildi. (L) Ameliyattan iki hafta sonra çekilen ve pencerenin fibroin filmi kullanılarak oluşturulduğu fotoğraf. (M) Bu fare üzerinde geniş alan kalsiyum görüntüleme yapıldı. (N) Bıyık stimülasyonu ile uyarılan floresan değişimi en belirgin bölgeden (somatosensoriyel korteks, (M) kırmızı kare) çizilmiştir. Kırmızı ve mavi çizgiler hava puf zamanlamasını ve sırasıyla (M) cinsinden "önce" ve "sırasında" zamanlamayı gösterir. (O) 300 μm derinlikte iki fotonlu kalsiyum görüntülemenin görüş alanı (somatosensoriyel korteks, FOV 1 in (M)). ROI'ler nöronal somataya manuel olarak yerleştirildi. (P) (O)'daki renkli karelerdeki floresan değişiklikleri çizilir. (S) (O)'nun tüm karelerindeki floresan değişiklikleri renkli olarak çizilir. (R-T) Parietal kortekste bulunan FOV 2 in (M) verileri gösterilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: Neşterler için ipuçları. Yeni neşterin ucu (üstte), kafatasını körelmiş bir uçla (altta) kesmek için kullanılan neşterle karşılaştırıldığında. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Şekil 2: Yeni kraniyal pencerenin ve fibroin-AAV ekspresyon yönteminin doğrulanması. (A) Agardaki 0.1 μm floresan boncukların floresan yoğunluk profili. Üst satır, agar içinde karıştırılmış floresan boncukların üzerine yalnızca kapak camının yerleştirildiği bir durumdan gelen verileri gösterir ve alt satır, sargı, şeffaf silikon ve kapak camının yerleştirildiği bir durumdan gelen verileri gösterir. Gri izler, Gauss'un her boncuk için floresan yoğunluk profiline uyduğunu ve kırmızı izlerin ortalama değerlerini (n = 7) gösterdiğini göstermektedir. (B) (A)'daki verilerin özeti. Her grafik, XYZ eksenindeki nokta yayılma işlevinin tam genişliğini maksimum yarıda (FWHM) gösterir. Gri grafik her boncuk için verileri gösterir ve kırmızı ortalama ve standart hatalarını gösterir. (C) İn vivo görüntüleme verilerinin 2.000 karesinden (60 s kayıt) küçük bir floresan parçacık seçildi ve görüntünün 60'lı yıllarda ne kadar hareket ettiği incelendi. Merkezdeki floresan görüntü ortalama 2.000 kareyi temsil ediyor. Görüntüler X ve Y ekseni yönlerinde ortalama alınarak yansıtıldı. Histogramlar merkezin her karedeki dağılımını gösterir. Sentroidin standart sapmaları X: 0.36 ve Y: 0.315 μm idi. (D) Fibroin-AAV yöntemi ile GECI ekspresyonu örneği. Solda: Bir dilim serebral korteks fibroin-AAV ekspresyon yöntemini uyguladı. Kırmızı ve mavi, sırasıyla XCaMP-R ve DAPI'den floresan gösterir; XCaMP-R sadece katman 2/3 hücrelerinde değil, aynı zamanda katman 5 hücrelerinde de eksprese edildi. Merkez ve sağ. Sol şekildeki 2/3 ve 5 katmanlarının büyütülmüş görünümleri (camgöbeği kareleri) sırasıyla. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Dosya 1: (A) Fibroin-AAV film yöntemi ile sargının ekspresyon etkinliği ve (B) İki fotonlu görüntüleme sırasında nokta yayılma fonksiyonunun değerlendirilmesi. Bu Dosyayı indirmek için lütfen tıklayınız.
Tartışmalar
Bu makalede, PVDC plastik sargı, şeffaf silikon ve kapak camı kullanarak büyük bir kafatası penceresi oluşturmak için ucuz bir yöntem sunulmaktadır. Bu yöntemi kullanarak, geniş alan kalsiyum görüntülemenin serebral korteksin geniş bir alanı üzerinde yapılabileceğini gösterdik. İki fotonlu kalsiyum görüntüleme, geniş alan görüntülemeye tabi tutulan aynı faredeki birkaç farklı kortikal bölgeden gerçekleştirilebilir. Ayrıca, pencere için kullanılan plastik sargı üzerindeki bir fibroin-AAV filminin, korteksin geniş bir alanı üzerinde GECI'yi ifade edebileceği gösterilmiştir.
Kritik adımlar
Plastik sargı kullanarak kafatası pencereleri yaparken enfeksiyondan ve beyne zarar vermekten kaçınmak önemlidir. Bu koşullarda, nöral ve glial aktivite gözlenemez ve daha derin alanların görüntülenmesi imkansızdır. Kan damarlarının yaralanması da kanamaya neden olur ve kan nedeniyle görüntülemeyi imkansız hale getirir. Enfeksiyondan kaçınmak için, beyin yüzeyini ve sargıyı mümkün olduğunca sıkı bir şekilde tutturulmuş hale getirmek, ACSF'yi emerek kritik öneme sahiptir. Mannitol uygulaması, ameliyat sırasında artan beyin basıncını önleyerek beyin ve kan damarı hasarını önlemek için önemlidir. Bu, beynin yüzeyi ile dura mater arasındaki boşluğu korur ve kafatası ve dura mater çıkarılması sırasında beyin ve kan damarlarına dokunulmasını önler. Yüksek büyütmeli stereo mikroskop ve keskin uçlu cımbız da doğru ameliyat için etkilidir.
Fibroin-AAV yönteminde, et ipekböceği kozalarının kullanılması, fibroin çözeltisinin dondurulmaması, fibroin-AAV çözeltisinin yeterince kurutulması ve yeterli miktarda çözelti (3 mm çap başına 5 μL) uygulanması esastır. Eski kozalar kullanıldığında, ifade verimliliği daha düşüktü. Bunun nedeni, eski kozalardan gelen fibroinin kolayca denatüre edilebilmesidir. Fibroin çözeltisi -80 ° C'de dondurulduğunda ve kullanım sırasında çözüldüğünde, ekspresyon verimliliği zayıftı. Bu, donma ve çözülme nedeniyle proteinin denatürasyonundan kaynaklanıyor olabilir. 4 °C'de depolanan fibroin çözeltileri jelasyona kadar etkili bir şekilde kullanılabildiğinden, fibroin çözeltilerinin soğutulmuş halde tutulması ve jelasyondan sonra tekrar kozalardan arındırılması önerilir. Fibroin-AAV çözeltisi en az 3 saat kurutulmalıdır, çünkü ifade 3 saatten az bir süre sonra zayıftır. Son olarak, ekspresyon alanı kullanılan fibroin-AAV çözeltisinin miktarına bağlıdır. Şekil 3M'deki örnekte, miktar küçüktü (5 μL); Böylece, fibroin-AAV filmi sadece pencerenin üst yarısını kapladı ve pencere üzerinde düzgün olmayan bir ifadeye neden oldu. Yeterli miktarda fibroin-AAV kullanılırsa, ifade tüm pencere boyunca eşit olacaktır.
Tekniğin modifikasyonları
Yeni kafatası penceresi tekniği, kortikal devrelerin makroskopik aktivitesini ve bunların altında yatan tek hücre seviyesindeki aktivitelerini aynı farede incelemeye izin verir. Böylece, yöntem çeşitli sinirbilim çalışmalarına uygulanabilir. Örneğin, karar verme görevleri, motor öğrenme ve beyin hasarı ve hastalığının fare modellerinde kortikal aktiviteyi gözlemlemek için kullanılabilir. Ayrıca yöntemin sadece kemirgenlere değil, aynı zamanda insan olmayan primatlara da uygulanabileceğine inanıyoruz.
Bu makale, büyük kafatası penceresinin transgenik fareleri ve fonksiyonel proteinleri eksprese eden AAV enjekte edilen fareleri görüntülemede etkili olduğunu göstermektedir. Özellikle, sargı üzerindeki fibroin-AAV filminin, korteksin geniş alanı boyunca GECI'leri eksprese etmek için geleneksel bir AAV enjeksiyon yönteminden çok daha kolay olduğu gösterilmiştir. Farklı renkteki GECI'leri kodlayan iki AAV'nin bir karışımı kullanılarak41, nöron ve glial hücre aktivitesi arasındaki korelasyon, korteksin geniş bir alanı üzerinde aynı anda görüntülenebilir. Ayrıca, fibroin-AAV film yöntemi, genetik olarak kodlanmış diğer biyosensörlere de uygulanabilir42,43,44,45,46,47.
Her iki yarım küreyi de görüntüleyebilen daha büyük kafatası penceresi de mümkündür. Çok daha geniş bir görüş alanına (~ 25mm2) sahip iki foton mikroskopları yakın zamanda 25,26,27,28,29 geliştirilmiştir. Bu iki fotonlu görüntüleme tekniğini, burada açıklanan geniş kafatası penceresini kullanarak tek fotonlu geniş alan görüntüleme ile birleştirmek, popülasyon aktivitesi ile tek hücreli aktivite arasındaki ilişkiyi benzeri görülmemiş ölçeklerden incelememizi sağlayacaktır.
Sınırlama
Gıda ambalajı herhangi bir maddenin geçmesine izin vermez. Bu, yöntemin farmakolojik deneyler için kullanılmasını zorlaştırır. Sargıyı çıkarmak da zordur, bu da cam pipet veya elektrot takmayı imkansız hale getirir. Bu nedenle, eşzamanlı kalsiyum görüntüleme ve elektrofizyolojik kayıtlar ve cam pipet kullanılarak ilaçların lokal olarak uygulanması gibi diğer yöntemlerle birlikte deneylerin uygulanması zordur. Bu sınırlamalar için olası bir çözüm, sargı ve cam pencereyi delikli kullanmaktır. Bu, bir cam pipet veya kayıt elektrodu aracılığıyla beyne erişim sağlarken, kafatası penceresini uzun süre steril tutar48.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Bu çalışma, Grant-in-Aid for Transformative Research Areas (A) 'Glial Decoding' (JP21H05621 to SM), JSPS KAKENHI (JP19K06883 to SM, 15KK0340 to ES, JP22H00432, JP22H05160, JP17H06312 to HB ve JP17H06313 to KK), Grant-in-Aid for Brain Mapping by Integrated Neurotechnologies for Disease Studies (Brain/MINDS) (JP19dm0207079h0002 to SM, JP19dm0207079 to HB ve JP19dm0207080 to KK), Narishige Neuroscience Research Foundation (SM'ye), Yamanashi Vilayeti'nden (SM'ye) ve Takeda Bilim Vakfı'ndan (SM'ye) Genç Araştırmacı için Hibe, kısmen Univ. Yamanashi'den The Frontier Brain Research Grant tarafından desteklenmektedir.
Hayvan bakımı ve teknik yardım için N. Yaguchi ve K. Okazaki'ye ve yararlı tartışmalar için Kitamura laboratuvarı üyelerine teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 4% paraformaldehyde phosphate buffer solution | NACALAI TESQUE, Kyoto, Japan | TritonX | Expression efficiency of the wrap with the fibroin-AAV film method |
| 50 mL beaker | |||
| Acquisition software | Brain vision | BV_Ana | For wide-field calcium imaging of GCaMP6f |
| Acquisition software | Hamamatsu photonics | High speed recording software: HSR | For wide-field calcium imaging of XCaMP-R |
| Acquisition software | Vibrio Technologies | scanImage | For two-photon calcium imaging |
| ACSF (artificial cerebrospinal fluid) | 150 mM NaCl, 2.5 mM KCl, 10 mM HEPES, 2 mM CaCl2, 1 mM MgCl2, pH = 7.4 with 1M NaOH | ||
| ACSF aspiration needle | |||
| Adeno-associated virus | VectorBuilder | custom-made | AAV-DJ/8-Syn1-XCaMP-R |
| Adhesives for biological use | Daiichi Sankyo | Aron Alpha-A | |
| Anesthesia machine | Shinano seisakusho | SN-487 | |
| Anesthetic | Kyoritsu Seiyaku Corporation | pentobarbital | Expression efficiency of the wrap with the fibroin-AAV film method |
| Auxiliary ear bar | Narishige | EB-5N | |
| CCD camera | Brain vision | MiCAM02-HR | For wide-field calcium imaging of GCaMP6f |
| Clear vinyl polysiloxane | GC | Exaclear | |
| CMOS camera | Hamamatsu photonics | ORCA-spark | For wide-field calcium imaging of XCaMP-R |
| Cotton swab | |||
| Cover glass | Matsunami | 18 x 18 NO.1 | Size: 18 x 18 mm, Thickness: 0.13-0.17 mm, Borosilicate glass |
| DAPI | Thermo Fisher | D1306 | Expression efficiency of the wrap with the fibroin-AAV film method |
| Ddialysis cassette | 3.5K MWCO, Slide-A-Lyzer | ThermoFisher | |
| Dental adhesive resin cement | SUN MEDICAL | Super-Bond | |
| Dental drill | Nakanishi | VOLVERE Vmax | |
| Digital scale | Dretec | KS-243 | |
| Filters | Brain vision | EM: BP466/40-25, DM: DM506, EX: BP520/36-50 | |
| Filters | Olympus | U-MRFPHQ, EM: BP535-555HQ, DM: DM565HQ, Ex: BA570-625HQ | |
| Fluorescence microscope | Keyence | BZ-X810 | Expression efficiency of the wrap with the fibroin-AAV film method |
| Fluorescent beads | Fluoresbrite YG Carboxylate Microspheres | 0.1 µm | Evaluation of the point spread function under the conventional and the new cranial windows in two-photon imaging |
| Forceps | FST | No. 11252-20 | thin-tipped, for removal of dura mater |
| Forceps | KFI | K-7, No.J 18-8 | for general use |
| Gelatin for hemostasis | Johnson & Johnson | Spongostan | |
| Gentamicin sulfate | Iwaki seiyaku | ||
| Glass pipette | custom-made | ||
| Hair remover | Reckitt Japan | Veet | |
| Head fixing device | custom-made | Craniotomy for Cortical Voltage-sensitive Dye Imaging in Mice. Suzuki, T., and Murayama, M. Bio-protocol 2016 6:e1722. | |
| Head plate | custom-made | aluminum or resin, size: 40 x 25 mm, thickness: 1.5 mm or 2 mm, hole in the center: 15 x 10 mm (head_plate_06 v3.f3d) | |
| Heating pad | |||
| Image processing software (for calcium imaging data analysis) | ImageJ | https://imagej.net | |
| Isoflurane | Pfizer | ||
| Light source | Hayashi-repic | LA-HDF108AA | |
| Light source | Brain vision | LEX2-LZ4-B | For wide-field calcium imaging of GCaMP6f |
| Light source | Olympus | U-HGLGPS | For wide-field calcium imaging of XCaMP-R |
| Mannitol solution (15% with saline) | Sigma-Aldrich (Merck) | M4125 | |
| Micro curette | FST | No. 10080-05 | |
| Microscope | Brain vision | For wide-field calcium imaging of GCaMP6f | |
| Microscope | Olympus | MVX10 | For wide-field calcium imaging of XCaMP-R |
| Microscope | Sutter Instruments | MOM | For two-photon calcium imaging |
| Microslicer | Dosaka EM | DTK-1000N | Expression efficiency of the wrap with the fibroin-AAV film method |
| Mixing tip | GC | ||
| Needle (30 G) | |||
| Polyethylens spoids | AS ONE | 1-4656-01 | |
| Polyvinylidene chloride (PVDC) film | Asahi Kasei | Asahi Wrap (or Saran Wrap) | |
| Povidone-iodine | Mundipharma | Isodine | |
| Python libralies | NumPy | package for scientific computing, https://numpy.org/doc/stable/index.html# | |
| Matplotlib | library for visualizations, https://matplotlib.org/stable/index.html# | ||
| pandas | data analysis and manipulation tool, https://pandas.pydata.org | ||
| Scalpel | Kai | No. 11 | |
| Shaver for animal | |||
| Silicone dispensers | GC | ||
| Silkworm cocoon | Satoyama Craft News | https://sato-yama.jp/ | |
| Stereomicroscope | LEICA | MZ6 | objective lens: 0.63x, eyepiece: 25x |
| Surfactant | NACALAI TESQUE | TritonX | Expression efficiency of the wrap with the fibroin-AAV film method |
| Surgical Scissors | FST | No. 91460-11 | |
| Syringe for mannitol injection | Terumo | 1mL | |
| Transdermal anesthetic | AstraZeneca | Lidocaine | |
| Transgenic mice used for calcium imaging of astrocytes | The mice were obtained by the following method. AldH1l1-CreERT2 mice: B6N.FVB-Tg(Aldh1l1-cre/ERT2)1Khakh/J (The Jackson laboratory, strain #: 031008) Tamoxifen-inducible Cre recombinase expression directed at high levels to the vast majority of astrocytes Flx-Lck-GCaMP6f mice: C57BL/6N-Gt(ROSA)26Sor[tm1(CAG-GCaMP6f)Khak]/J (The Jackson laboratory, strain #: 029626) Cre-dependent expression of a plasma membrane-targeted GCaMP6f. A mouse born from crossbreeding these mice were treated with tamoxifen (20 mg/mL) for 5 days (0.05 mL/10g bw, i.p.) to express GCaMP6f. | ||
| Tunable ultrafast lasers | Spectra-Physics | InSight X3 | For two-photon calcium imaging |
| Waterproof film | Nichiban | BFR5 | |
| Wild-type mice | Japan SLC | C57BL/6J | Male and femalek, >4 weeks old |
Referanslar
- Ren, C., Komiyama, T. Wide-field calcium imaging of cortex-wide activity in awake, head-fixed mice. STAR Protocols. 2 (4), 100973 (2021).
- Couto, J., et al. Chronic, cortex-wide imaging of specific cell populations during behavior. Nature Protocols. 16 (7), 3241-3263 (2021).
- Kauvar, I. V., et al. Cortical Observation by Synchronous Multifocal Optical Sampling Reveals Widespread Population Encoding of Actions. Neuron. 107 (2), 351-367 (2020).
- Clancy, K. B., Orsolic, I., Mrsic-Flogel, T. D. Locomotion-dependent remapping of distributed cortical networks. Nature Neuroscience. 22 (5), 778-786 (2019).
- MacDowell, C. J., Buschman, T. J. Low-dimensional spatiotemporal dynamics underlie cortex-wide neural activity. Current Biology. 30 (14), 2665-2680 (2020).
- Makino, H., et al. Transformation of cortex-wide emergent properties during motor learning. Neuron. 94 (4), 880-890 (2017).
- Murphy, T. H., et al. Automated task training and longitudinal monitoring of mouse mesoscale cortical circuits using home cages. eLife. 9, 559654 (2020).
- Rynes, M. L., et al. Miniaturized head-mounted microscope for whole-cortex mesoscale imaging in freely behaving mice. Nature Methods. 18 (4), 417-425 (2021).
- Cardin, J. A., Crair, M. C., Higley, M. J. Mesoscopic imaging: Shining a wide light on large-scale neural dynamics. Neuron. 108 (1), 33-43 (2020).
- Ren, C., Komiyama, T. Characterizing cortex-wide dynamics with wide-field calcium imaging. The Journal of Neuroscience. 41 (19), 4160-4168 (2021).
- Hamodi, A. S., Martinez Sabino, A., Fitzgerald, N. D., Moschou, D., Crair, M. C. Transverse sinus injections drive robust whole-brain expression of transgenes. eLife. 9, 53639 (2020).
- Michelson, N. J., Vanni, M. P., Murphy, T. H. Comparison between transgenic and AAV-PHP.eB-mediated expression of GCaMP6s using in vivo wide-field functional imaging of brain activity. Neurophotonics. 6 (2), 025014 (2019).
- Oomoto, I., et al. Protocol for cortical-wide field-of-view two-photon imaging with quick neonatal adeno-associated virus injection. STAR Protocols. 2 (4), 101007 (2021).
- Fan, J. T., et al. Video-rate imaging of biological dynamics at centimetre scale and micrometre resolution. Nature Photonics. 13 (11), 809-816 (2019).
- Stuart, G. J., Spruston, N. Dendritic integration: 60 years of progress. Nature Neuroscience. 18 (12), 1713-1721 (2015).
- Grienberger, C., Chen, X., Konnerth, A. Dendritic function in vivo. Trends in Neurosciences. 38 (1), 45-54 (2015).
- Takahashi, N., et al. Locally synchronized synaptic inputs. Science. 335 (6066), 353-356 (2012).
- Kitamura, K., Hausser, M. Dendritic calcium signaling triggered by spontaneous and sensory-evoked climbing fiber input to cerebellar Purkinje cells in vivo. The Journal of Neuroscience. 31 (30), 10847-10858 (2011).
- Manita, S., et al. A top-down cortical circuit for accurate sensory perception. Neuron. 86 (5), 1304-1316 (2015).
- Stobart, J. L., et al. Cortical circuit activity evokes rapid astrocyte calcium signals on a similar timescale to neurons. Neuron. 98 (4), 726-735 (2018).
- Srinivasan, R., et al. Ca(2+) signaling in astrocytes from Ip3r2(-/-) mice in brain slices and during startle responses in vivo. Nature Neuroscience. 18 (5), 708-717 (2015).
- Shigetomi, E., Patel, S., Khakh, B. S. Probing the complexities of astrocyte calcium signaling. Trends in Cell Biology. 26 (4), 300-312 (2016).
- Tischbirek, C., Birkner, A., Jia, H., Sakmann, B., Konnerth, A. Deep two-photon brain imaging with a red-shifted fluorometric Ca2+ indicator. Proceedings of the National Academy of Sciences of the United States of America. 112 (36), 11377-11382 (2015).
- Kondo, M., Kobayashi, K., Ohkura, M., Nakai, J., Matsuzaki, M. Two-photon calcium imaging of the medial prefrontal cortex and hippocampus without cortical invasion. eLife. 6, 26839 (2017).
- Demas, J., et al. cortex-wide volumetric recording of neuroactivity at cellular resolution using light beads microscopy. Nature Methods. 18 (9), 1103-1111 (2021).
- Ota, K., et al. cell-resolution, contiguous-wide two-photon imaging to reveal functional network architectures across multi-modal cortical areas. Neuron. 109 (11), 1810-1824 (2021).
- Sofroniew, N. J., Flickinger, D., King, J., Svoboda, K. A large field of view two-photon mesoscope with subcellular resolution for in vivo imaging. eLife. 5, 14472 (2016).
- Stirman, J. N., Smith, I. T., Kudenov, M. W., Smith, S. L. Wide field-of-view, multi-region, two-photon imaging of neuronal activity in the mammalian brain. Nature Biotechnology. 34 (8), 857-862 (2016).
- Yu, C. H., Stirman, J. N., Yu, Y., Hira, R., Smith, S. L. Diesel2p mesoscope with dual independent scan engines for flexible capture of dynamics in distributed neural circuitry. Nature Communications. 12 (1), 6639 (2021).
- Barson, D., et al. Simultaneous mesoscopic and two-photon imaging of neuronal activity in cortical circuits. Nature Methods. 17 (1), 107-113 (2020).
- Wekselblatt, J. B., Flister, E. D., Piscopo, D. M., Niell, C. M. Large-scale imaging of cortical dynamics during sensory perception and behavior. Journal of Neurophysiology. 115 (6), 2852-2866 (2016).
- Kim, T. H., et al. Long-term optical access to an estimated one million neurons in the live mouse cortex. Cell Reports. 17 (12), 3385-3394 (2016).
- Ghanbari, L., et al. Cortex-wide neural interfacing via transparent polymer skulls. Nature Communications. 10 (1), 1500 (2019).
- Takahashi, T., Zhang, H., Otomo, K., Okamura, Y., Nemoto, T. Protocol for constructing an extensive cranial window utilizing a PEO-CYTOP nanosheet for in vivo wide-field imaging of the mouse brain. STAR Protocols. 2 (2), 100542 (2021).
- Suzuki, T., Murayama, M. Craniotomy for cortical voltage-sensitive dye imaging in mice. Bio-Protocol. 6 (3), 1722 (2016).
- Jackman, S. L., et al. Silk fibroin films facilitate single-step targeted expression of optogenetic proteins. Cell Reports. 22 (12), 3351-3361 (2018).
- Rockwood, D. N., et al. Materials fabrication from Bombyx mori silk fibroin. Nature Protocols. 6 (10), 1612-1631 (2011).
- Jia, H., Rochefort, N. L., Chen, X., Konnerth, A. In vivo two-photon imaging of sensory-evoked dendritic calcium signals in cortical neurons. Nature Protocols. 6 (1), 28-35 (2011).
- Pachitariu, M., et al. Suite2p: beyond 10,000 neurons with standard two-photon microscopy. bioRxiv. , 061507 (2017).
- Srinivasan, R., et al. New transgenic mouse lines for selectively targeting astrocytes and studying calcium signals in astrocyte processes in situ and in vivo. Neuron. 92 (6), 1181-1195 (2016).
- Inoue, M., et al. Rational engineering of XCaMPs, a multicolor GECI suite for in vivo imaging of complex brain circuit dynamics. Cell. 177 (5), 1346-1360 (2019).
- Patriarchi, T., et al. Ultrafast neuronal imaging of dopamine dynamics with designed genetically encoded sensors. Science. 360 (6396), (2018).
- Sun, F., et al. A genetically encoded fluorescent sensor enables rapid and specific detection of dopamine in flies, fish, and mice. Cell. 174 (2), 481-496 (2018).
- Marvin, J. S., et al. An optimized fluorescent probe for visualizing glutamate neurotransmission. Nature Methods. 10 (2), 162-170 (2013).
- Feng, J., et al. A genetically encoded fluorescent sensor for rapid and specific in vivo detection of norepinephrine. Neuron. 102 (4), 745-761 (2019).
- Piatkevich, K. D., et al. Population imaging of neural activity in awake behaving mice. Nature. 574 (7778), 413-417 (2019).
- Sabatini, B. L., Tian, L. Imaging neurotransmitter and neuromodulator dynamics in vivo with genetically encoded indicators. Neuron. 108 (1), 17-32 (2020).
- Roome, C. J., Kuhn, B. Chronic cranial window with access port for repeated cellular manipulations, drug application, and electrophysiology. Frontiers in Cellular Neuroscience. 8, 379 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır