Method Article
Control mecánico de la relajación con trabéculas cardíacas intactas
En este artículo
Resumen
La relajación miocárdica y cardíaca rápida es esencial para la fisiología normal. Ahora se sabe que los mecanismos de relajación mecánica dependen de la velocidad de deformación. Este protocolo proporciona una visión general de la adquisición y el análisis de experimentos para estudiar más a fondo el control mecánico de la relajación.
Resumen
La disfunción diastólica es un fenotipo común en las presentaciones de enfermedades cardiovasculares. Además de la rigidez cardíaca elevada (presión diastólica final del ventrículo izquierdo elevada), la relajación cardíaca alterada es un indicador diagnóstico clave de la disfunción diastólica. Si bien la relajación requiere la eliminación del calcio citosólico y la desactivación de los filamentos delgados sarcoméricos, la orientación de tales mecanismos aún no ha proporcionado tratamientos efectivos. Se ha teorizado que los mecanismos mecánicos, como la presión arterial (es decir, la poscarga), modifican la relajación. Recientemente, demostramos que modificar la velocidad de deformación de un estiramiento, no la poscarga, era necesaria y suficiente para modificar la tasa de relajación posterior del tejido miocárdico. La dependencia de la relajación de la velocidad de deformación, llamada control mecánico de la relajación (MCR), se puede evaluar utilizando trabéculas cardíacas intactas. Este protocolo describe la preparación de un modelo de animal pequeño, sistema experimental y cámara, aislamiento del corazón y posterior aislamiento de una trabécula, preparación de la cámara experimental y protocolos experimentales y de análisis. La evidencia de alargamiento de las cepas en el corazón intacto sugiere que la MCR podría proporcionar nuevos ámbitos para una mejor caracterización de los tratamientos farmacológicos, junto con un método para evaluar la cinética de miofilamentos en músculos intactos. Por lo tanto, el estudio de la MCR puede dilucidar un camino hacia nuevos enfoques y nuevas fronteras en el tratamiento de la insuficiencia cardíaca.
Introducción
La relajación cardíaca se ve afectada en casi todas las formas de insuficiencia cardíaca (incluida la insuficiencia cardíaca con fracción de eyección reducida) y en muchas enfermedades cardiovasculares. Además de numerosos métodos para evaluar la función cardíaca en músculos permeabilizados, la evaluación de los músculos cardíacos intactos está ganando interés. Dichos tejidos se evalúan descargados (extremos libres de contraerse) o cargados (longitud o fuerza controlada). Históricamente, los miocitos aislados intactos se han evaluado en una condición descargada, donde el cuerpo celular es libre de acortarse durante la contracción. Las trabéculas cardíacas intactas a menudo se evalúan en condiciones isométricas, donde no se permite que la longitud cambie, pero se genera estrés (fuerza por área de sección transversal). Tanto los métodos de miocitos intactos como los de trabéculas están comenzando a converger con modificaciones de la carga 1,2.
Los protocolos para sujetar la carga de un músculo (es decir, controlar la tensión desarrollada de un músculo a un valor específico que simula poscargas fisiológicas) se han desarrollado durante varias décadas 3,4,5. En tejidos cardíacos intactos, las pinzas de carga permiten a los investigadores imitar más de cerca el ciclo cardíaco in vivo utilizando poscargas isotónicas o similares a Windkessel 6,7,8,9. El objetivo de este protocolo es obtener datos utilizados para cuantificar la MCR (es decir, la dependencia de la velocidad de deformación de la tasa de relajación)8,9.
Si bien el protocolo MCR se ha adaptado de trabajos anteriores, el enfoque de este protocolo (en comparación con protocolos similares que utilizan tejidos cardíacos intactos) está en los mecanismos biomecánicos que modifican la relajación. Existen varios protocolos que utilizan sujeción de carga 3,4,5,7,10 y protocolos que se centran en los modelos de Windkessel 1,2,11, pero este protocolo describe específicamente cómo el estiramiento antes de la relajación modifica la tasa de relajación. Hemos demostrado que este control ocurre durante un período proto-diastólico8, una fase originalmente descrita por Wiggers12. En corazones sanos normales, el miocardio sufre una tensión de alargamiento durante la eyección antes del cierre de la válvula aórtica (es decir, antes de la relajación isovolumétrica)13. Esto se imita prolongando la duración del control de la poscarga hasta que el músculo comienza a estirarse. La evidencia clínica sugiere que este alargamiento puede atenuarse o perderse en estados de enfermedad14, y las implicaciones y mecanismos de las tasas de deformación sistólica final alteradas no se han dilucidado completamente. Dadas las escasas opciones de tratamiento para las enfermedades diastólicas y la insuficiencia cardíaca con una fracción de eyección preservada, postulamos que la MCR puede proporcionar información sobre los nuevos mecanismos subyacentes a la relajación deteriorada.
Mientras que la disección macroscópica descrita aquí se centra en roedores, el aislamiento de trabécula se puede realizar desde cualquier corazón intacto, y se ha utilizado previamente con una trabécula cardíaca humana8. Del mismo modo, la adquisición y el análisis de datos también se pueden aplicar a cardiomiocitos u otros tipos musculares aislados 1,10. La discusión incluye comentarios sobre posibles alteraciones y adaptaciones al método, junto con limitaciones, como la precaución contra la utilización de músculos papilares debido a las propiedades mecánicas de las cuerdas9.
Protocolo
El siguiente protocolo ha sido aprobado por el Comité Institucional de Cuidado y Uso de Animales de la Universidad Estatal de Wayne. El protocolo aquí describe los pasos para utilizar sujetos experimentales con roedores, pero puede adaptarse para su uso en otros organismos modelo.
1. Preparación
- Obtenga el sujeto experimental y permítale aclimatarse al laboratorio.
- Preparar 250 ml de solución de perfusión y 250 ml de solución de Tyrode modificada (Tabla 1), oxigenando cada uno a 10-20 ppm deO2, con pH 7,3.
- Prepare una jeringa de 5 ml con una cánula conectada. Llene la jeringa con solución de perfusión. Use cánulas que sean 23 G para un ratón y 18 o 16 G para una rata pequeña o grande, respectivamente. Deslice un tubo de polietileno (PE) de 1 mm de longitud en el extremo de una aguja roma (Tabla de materiales), para ayudar a evitar que la aorta se deslice de la cánula después de ser atada.
- Preparación completa del área de disección y canulación (Figura 1)
- Llene dos botes de pesaje limpios al menos hasta la mitad con solución de perfusión. Sumerja la punta de la cánula en solución de perfusión con al menos una sutura de doble bucle colocada alrededor de la cánula. Sostenga la jeringa en su lugar con una abrazadera de barra.
- Coloque tijeras quirúrgicas, un hemostático, pinzas para iris, un par de tijeras curvas pequeñas y dos pinzas # 3 para facilitar el acceso.
- Preparar el sistema experimental (Figura 2) cebando y haciendo circular la solución de Tyrode modificada por todo el sistema experimental. Asegúrese de que la cámara esté completamente llena y estable.
- Encienda todas las cajas de adquisición de datos, incluido el transductor de fuerza, el motor de longitud, el sistema de marcapasos, el sistema de control de temperatura y la computadora de adquisición de datos.
- Copie y cambie el nombre de una carpeta de plantilla que contenga los archivos *.dap y puntero necesarios para hacer referencia al experimento actual. Abra el software de adquisición de datos.
- Preparar las herramientas de aislamiento de trabécula (tijeras Vannas, pinzas #5 o #55, sonda de vidrio) sumergiendo sus puntas en albúmina sérica bovina (BSA) al 10% (p/v) en agua ultrapura o solución de perfusión, para recubrir el metal con proteína (Figura 2B).
NOTA: Todo el sistema experimental debe estar preparado antes de la disección.
2. Disección macroscópica y canulación
- Registre la identificación, el peso corporal y otra información relevante del sujeto animal.
- Opcionalmente, inyectar 1.000 U/kg de heparina en solución salina estéril al roedor mediante inyección intraperitoneal al menos 10 min antes de la eutanasia, para minimizar los riesgos de coagulación antes de la perfusión coronaria.
- Coloque al animal en una cámara de inducción e induzca anestesia general utilizando isoflurano al 3% -5% vaporizado en oxígeno al 100%, de acuerdo con el procedimiento estándar.
NOTA: Encienda cualquier eliminador externo, mesas de tiro hacia abajo o campanas extractoras utilizadas para minimizar la exposición al isoflurano. - Una vez que el roedor pierde su reflejo de enderezamiento y la frecuencia respiratoria ha disminuido:
- (Para una rata) retire al animal de la cámara de inducción y colóquelo en decúbito supino sobre una almohadilla de disección, con anestesia continua a través de un cono nasal.
- (Para un ratón) realizar la luxación cervical inmediatamente después de retirar al animal de la cámara de inducción. El cono de la nariz no es necesario. Gira el vaporizador de isoflurano al 0%.
- Si es necesario, fije las extremidades superiores del roedor a la almohadilla de disección lejos de la pared torácica con cinta adhesiva sostenida por alfileres, teniendo cuidado de no perforar al animal. Verifique la profundidad adecuada de la anestesia (falta de respuesta de pellizco del dedo del pie) antes de proceder a la disección.
- Usando tijeras quirúrgicas (Mayo para ratas, Metzenbaum para ratones), justo debajo del proceso xifoide, cortó la piel transversal a través de todo el ancho del abdomen del roedor en el espacio peritoneal.
- Usando tijeras quirúrgicas, haga dos cortes verticales parasagitales (hasta los lados de la pared torácica) en los lados izquierdo y derecho de la pared torácica desde el corte transversal. Luego, corte a través del diafragma, conectando los cortes parasagitales y liberando el espacio torácico.
- Sujete y levante el proceso xifoide usando un hemostático hacia la cabeza del roedor, para mover el esternón y la pared torácica hacia la cabeza del roedor, exponiendo el espacio torácico y el corazón. Si es necesario, extienda rápidamente los cortes parasagitales hasta cerca del segundo espacio vertebral, para exponer completamente el corazón y / o romper la membrana pericárdica.
- Usando pinzas curvas del iris, levante cuidadosamente el corazón para visualizar los grandes vasos. Coloque los fórceps entre el miocardio y la columna vertebral del roedor, sujete los vasos mayores y levante el corazón, teniendo cuidado de no sujetar las aurículas o los segmentos ventriculares.
- Mientras levanta ligeramente el corazón, coloque rápidamente las tijeras curvas del iris (cóncavas hacia arriba) entre las pinzas curvas del iris y la columna vertebral del roedor, y corte los grandes vasos y pulmones lejos del corazón. Mueva rápidamente el corazón a un bote de pesaje o vaso de precipitados que contenga solución de perfusión fresca y agítelo para ayudar a eliminar la sangre del corazón.
- Gire el vaporizador de isoflurano al 0%, si aún no lo ha hecho. Si grandes segmentos de pulmón, pericardio u otros tejidos permanecen adheridos al corazón, córtelos con cuidado y deséchelos en este momento para minimizar la interferencia con la canulación .
- Usando las pinzas curvas del iris, mueva el corazón a un bote de pesaje limpio o vaso de precipitados, con la cánula preparada sumergida. Canular la aorta, asegurar la aorta apretando la sutura de seda en bucle y enjuagar con hasta 5 ml de solución de perfusión.
- Retire el corazón de la cánula y colóquelo en un plato de pesaje recubierto de elastómero de silicona para prepararse para el aislamiento de la trabécula.
3. Aislamiento y equilibrio de la trabécula
- Coloque el corazón en el plato recubierto de elastómero de silicona bajo un microscopio estereoscópico e ilumínelo.
- Localice el tracto de salida del ventrículo derecho. Fije la aurícula izquierda y el ápice ventricular al elastómero de silicona en el plato.
- Usando tijeras Vannas largas, corte desde el tracto de salida del ventrículo derecho hasta el ápice a lo largo del tabique. Corte desde el tracto de salida del ventrículo derecho hasta la aurícula derecha cerca de la aorta, luego corte a través de la aurícula derecha (Figura 3B).
- Usando fórceps, abra con cuidado la pared libre del ventrículo derecho (VD) del tracto de salida, teniendo cuidado de no estirar el tejido.
NOTA: Los experimentadores pueden encontrar hebras delgadas y blancas de tejido conectivo, que se pueden cortar sin preocupación. Las hebras más grandes, de color rosa (tejido) deben evaluarse con cuidado, ya que pueden ser trabéculas que se pueden aislar. - Fije la pared libre del triángulo del ventrículo derecho al plato, para exponer el ventrículo derecho (Figura 3C).
- Usando una pipeta de vidrio que ha sido fundida y formada con un extremo delgado (<500 μm de diámetro) pero no afilado, busque trabéculas independientes en el endocardio expuesto (Figura 3C).
NOTA: Una trabécula independiente es una tira de músculo que uno puede sondear completamente debajo. Use trabéculas que tengan lados paralelos (ancho constante), evitando los músculos papilares triangulares. Tenga cuidado durante este proceso y la disección posterior, ya que la aplicación de tensión en la trabécula puede causar daños, reduciendo la fuerza desarrollada. - Disecciona la trabécula con unas tijeras Vannas pequeñas. Deje un pedazo de tejido cúbico de ≥1 mm en cada extremo de la trabécula para permitir la fijación. No estire la trabécula siempre que sea posible y minimice el contacto de las herramientas metálicas, ya que ambas también pueden causar daño al músculo. Reubique los clavos que sostienen el corazón según sea necesario para minimizar la tensión en el músculo cerca de las trabéculas identificadas.
- Corte ~ 2 pulgadas del extremo de una pipeta de transferencia de 7 ml, extraiga lentamente la trabécula en la pipeta y transfiérala a un nuevo plato de pesaje que contenga 50% de solución de perfusión y 50% de solución de Tyrode modificada. Permita que el músculo se equilibre con el aumento de calcio extracelular dentro de la solución mezclada durante varios minutos.
- Repita los pasos 3.7-3.8 para diseccionar trabecula adicional en este momento, para obtener trabecula adicional como copia de seguridad.
- Apague la bomba que suministra superfusión y/o succión a la cámara experimental. Utilizando la pipeta de transferencia de gran calibre, mueva la trabécula a la cámara experimental llena con la solución de Tyrode.
- Fije un trozo de tejido cúbico de >1 mm al final de la trabécula a un gancho en el transductor de fuerza, luego fije el segundo cubo al motor.
NOTA: Separe el motor y el transductor de fuerza cuando monte el primer lado para un mejor acceso al transductor, luego mueva los ganchos lo más cerca posible cuando monte el segundo cubo de tejido mientras la trabécula permanece floja. - Reinicie la superfusión y comience a marcar el ritmo del músculo para determinar el voltaje umbral. Camine a un 20% por encima del voltaje umbral durante aproximadamente 1 h para permitir que la trabécula se equilibre.
- Al final de este período de equilibrio, estire lentamente el músculo usando el micrómetro conectado al motor hasta que se logre una generación óptima de estrés desarrollado, observando la tensión desarrollada (mínimo a pico). Deje de aumentar la longitud muscular cuando la tensión diastólica pasiva aumenta más rápido que la tensión máxima, lo que indica que se ha superado la longitud óptima.
- Apague la iluminación del microscopio transmitido e ilumine la trabécula con un iluminador de cuello de cisne en un ángulo pronunciado. Usando una cámara conectada a través de la óptica del microscopio que ha sido previamente calibrada, capture una imagen de la trabécula durante la diástole en la carpeta experimental. Si la trabécula es más ancha que el campo de visión de la cámara, tome varias imágenes a través del músculo.
- Abra la(s) imagen(es) en un software de imágenes que informe distancias de píxeles.
- Mida la distancia en píxeles del diámetro muscular cuatro veces a lo largo de su longitud. Mida la longitud del músculo (trabécula) en píxeles, excluyendo el cubo grande de tejido.
- Si la longitud del músculo es más larga que el campo de visión, use puntos de referencia a lo largo del músculo para medir toda la longitud.
- Usando la plantilla en la carpeta experimental, promedie las medidas de diámetro y convierta el diámetro y las longitudes de píxeles a mm utilizando una calibración obtenida previamente. Calcule el área de la sección transversal como π* diámetro 2/4 en mm2, y la longitud del músculo en μm.
4. Adquisición de datos
- Una vez que el músculo esté equilibrado, abra el software de adquisición de datos, seleccione Experimentos | Control de longitud e introduzca la longitud de la trabécula calibrada (FL) y el área de la sección transversal (área [m2]) en el cuadro Calibración.
- En la carpeta de plantillas (paso 1.7), asegúrese de que el freeform_file.txt apunta a la carpeta correcta y abra el archivo freeform.dap en un editor de texto. Establezca el nivel isotónico (isotón) en 32.000 en el archivo *.dap.
- En el cuadro Control de longitud, seleccione la ficha Forma libre y busque el archivo de lista de forma libre adecuado. Asegúrese de que la ruta de presentación de datos también sea la carpeta correcta para guardar los datos. Comience a adquirir datos de contracciones totalmente isométricas presionando Run Experiment, antes de adquirir datos de abrazadera de carga utilizando un control de retroalimentación con parámetros de ganancia proporcionales y de integración.
- Adquiera datos sujetos a carga definiendo la poscarga (isoton) en el archivo *.dap e itere los valores de los parámetros de ganancia proporcional (propgain) e integración (Ki) guardando el archivo en el editor de texto. Pulse Ejecutar experimento en la interfaz del software de adquisición de datos.
- Asegúrese de que la abrazadera incluya volver a alargar a su longitud original (a veces denominada carga de relajación5) durante esta iteración para alcanzar el rango máximo de velocidades de deformación, ajustando el modo (flswitch) desde uno y aumentando el umbral para finalizar la abrazadera de carga (flthreshold) desde cero.
- Controle el extremo de la abrazadera de carga cambiando el modo (flswitch) de uno a cero. Repita la adquisición mientras cambia el extremo de la abrazadera de carga de cero alargamiento a completo de realargamiento a la longitud inicial.
- Para aumentar la longitud, aumente gradualmente el umbral para terminar la pinza de carga (flthreshold) desde cero hasta que el músculo casi se vuelva a alargar a su longitud original.
- Restablezca el modo (flswitch = 1) y el umbral (flthreshold = 0) y ejecute una adquisición de datos final.
- Si lo desea, modifique la poscarga en el estudio repitiendo los pasos 4.4-4.6. Esta adquisición puede hacerse inmediatamente.
- Si lo desea, modifique la precarga estirando o acortando el músculo, o trate el músculo agregando compuestos a la solución de Tyrode. Si altera la precarga o añade compuestos, espere un mínimo de 20 minutos para asegurarse de que la respuesta de fuerza lenta 9,15 se haya estabilizado y/o para que el compuesto penetre completamente en el músculo.
- Una vez completada la adquisición de datos, retire la trabécula. Si es necesario, congele o fije la trabécula para análisis bioquímicos o histológicos.
- Limpie las áreas de trabajo y el sistema experimental, enjuague todos los tubos con agua y apague todos los componentes.
5. Análisis de datos
- Abra los archivos de datos utilizando un programa de análisis cuantitativo dirigiendo el programa a la ruta de archivo adecuada.
- Cuantifique la relajación asegurándose de que el programa de análisis de datos analice el latido de sujeción y que el programa adquiera correctamente el inicio de la abrazadera de carga.
- Asegúrese de que se identifica el extremo de la abrazadera de carga, de modo que la tasa de relajación (1/τ) se cuantifique a partir de la derivada negativa máxima de la tensión durante una relajación isométrica.
- Utilice el método de Glantz16 para determinar esta constante de tiempo exponencial, u otra cuantificación apropiada de relajación (derivada mínima de estrés, constante de tiempo logístico 17 o modelo cinemático18).
- Asegúrese de que el programa de análisis de datos calcula la velocidad de deformación tomando la derivada temporal de la deformación, donde la deformación se calcula como la longitud en función del tiempo dividido por la longitud en la contracción óptima.
- Repita los pasos anteriores para todos los rastros de una condición determinada.
- Trazar la relación entre la tasa de relajación y la velocidad de deformación, limitando los datos máximos a una tasa de deformación fisiológica inferior a 1 s-1. Excluir los datos a bajas tasas de deformación (Figura 4C), ya que la fase de relajación puede no reflejar el decaimiento exponencial17,18.
- Obtenga la pendiente de la línea entre la tasa de relajación y la velocidad de deformación, y registre la pendiente como el índice de MCR.
- Repita el análisis anterior para cada condición interrogada.
Resultados
En la Figura 4 se muestra un conjunto de datos representativos, y se pueden encontrar resultados adicionales en publicaciones anteriores 8,9. Brevemente, la velocidad de deformación se calcula a partir de la derivada de la deformación, justo antes de la relajación isométrica. La tensión es la longitud en función del tiempo dividida por la longitud del músculo a la longitud óptima. La tasa de relajación se calcula como 1/τ, donde τ es la constante de tiempo exponencial16. Se requieren múltiples velocidades de deformación y sus tasas de relajación resultantes para determinar el control mecánico de la relajación (MCR). Estos datos se representan en un gráfico de tasa de relajación frente a velocidad de deformación. La pendiente de la línea proporciona el índice MCR.
Tenga en cuenta que no es probable que las tasas de deformación sistólica y diastólica final excedan 1 s-1. Por lo tanto, la pendiente solo debe incluir tasas de deformación < 1 s-1. La tasa de relajación a bajas tasas de deformación puede confundirse por cambios en el tiempo mínimo derivado del estrés (dStress/dtmin), y en estos casos, los datos de tramos inferiores a aproximadamente 0,15 s-1 pueden ser ignorados.

Figura 1: Configuración de la disección macroscópica y el área de canulación cardíaca. De derecha a izquierda: a. La cámara de inducción de anestesia para el animal se encuentra cerca del área de disección. b. Un snorkel para el eliminador de gases volátiles opcional. c. Una almohadilla de disección, donde el animal se colocará en posición supina, está flanqueada por (en el sentido de las agujas del reloj) d. una nariz, para proporcionar anestesia continua al roedor, e. hemostáticos, f. tijeras quirúrgicas, g. tijeras finas curvadas colocadas para facilitar el acceso con la mano dominante (cortante), h. pinzas de iris curvadas colocadas para facilitar el acceso con la mano no dominante. Las extremidades superiores del roedor se pueden fijar a la almohadilla de disección con cinta adhesiva, e i. se debe colocar un plato de disección (o vaso pequeño) con solución de perfusión cerca para enjuagar el corazón. j. Un área preparada para la canulación debe colocarse cerca. Una jeringa con una cánula apropiada está montada en un soporte de anillo. k. (Recuadro) Una imagen más cercana de una cánula de 16 G, con 1 mm de tubo PE205 unido y una sutura ligeramente anudada. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Área experimental y herramientas. (A) Área experimental. La cámara experimental y el sistema de adquisición de datos se preparan en un microscopio invertido cercano (izquierda). El aislamiento y montaje de la trabécula se produce bajo un estereoscopio (derecha). (B) Las puntas de dos pinzas, tijeras Vannas grandes y pequeñas, y una sonda de vidrio personalizada se preparan empapando en una solución BSA al 10%. (C) Herramientas de disección adicionales. Un plato chapado en elastómero de silicona permite montar el corazón durante la disección fina. Una pipeta de transferencia de 7 ml con el corte final se muestra debajo del plato y la sonda de vidrio. La punta cortada de la pipeta de transferencia se descarta y se utiliza un orificio agrandado para transferir el músculo, con un riesgo mínimo de estiramiento o deshidratación. (D) Imagen ampliada del extremo de una pipeta de vidrio, que mide aproximadamente 2 mm de largo y 0,25-0,5 mm de diámetro. Haga clic aquí para ver una versión más grande de esta figura.
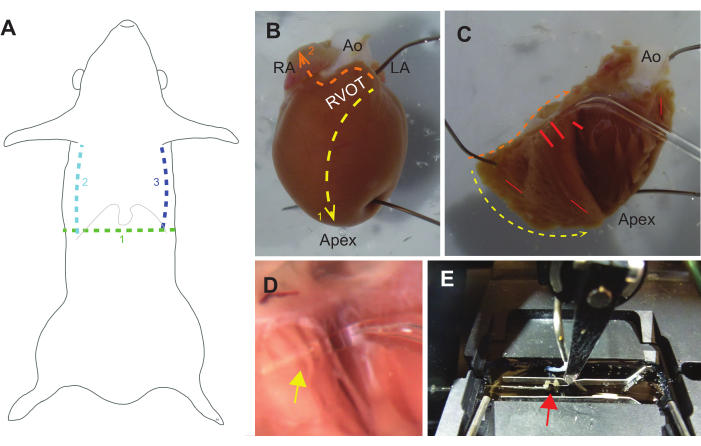
Figura 3: Guía para la disección. (A) La disección macroscópica debe comenzar con un corte transversal (1. verde) a través de la piel hacia la cavidad peritoneal debajo del proceso xifoide (las costillas inferiores y xifoides se indican con una línea gris delgada). Los cortes parasagitales desde la cavidad peritoneal hasta la caja torácica deben seguir (2. verde azulado y 3. líneas azules), después de lo cual se debe cortar el diafragma. Luego se puede usar un hemostático para sujetar el proceso xifoide y elevar la pared torácica hacia la cabeza. (B) Un corazón de rata intacto fijado a una placa de elastómero de silicio, orientado con una vista del tracto de salida del ventrículo derecho (RVOT), la aurícula derecha (AR), la aorta (Ao) y la aurícula izquierda (LA). El primer conjunto de cortes debe ser desde el RVOT hasta el ápice a lo largo del tabique (1. Línea amarilla). Un segundo conjunto de cortes debe ser desde el RVOT a lo largo de la base del corazón y luego a través de la aurícula derecha (2. línea naranja). (C) El RVOT se puede separar cuidadosamente de la aorta para abrir el corazón y fijarlo hacia atrás. Las líneas amarillas y naranjas corresponden a los cortes descritos en B. Las trabéculas independientes a menudo se encuentran cerca de la base de la pared libre de RV y cerca del tabique, pero pueden ocurrir en cualquier lugar (las líneas rojas indican ubicaciones comunes). (D) Vista ampliada de la sonda de vidrio debajo de una trabécula (la flecha amarilla indica la intersección de la trabécula y la sonda). (E) Una trabécula (flecha roja) está montada en el sistema experimental entre un transductor de fuerza (izquierda) y un motor (centro-derecha), y está flanqueada por dos conductores de ritmo (horizontal por encima y por debajo de la trabécula). Haga clic aquí para ver una versión más grande de esta figura.
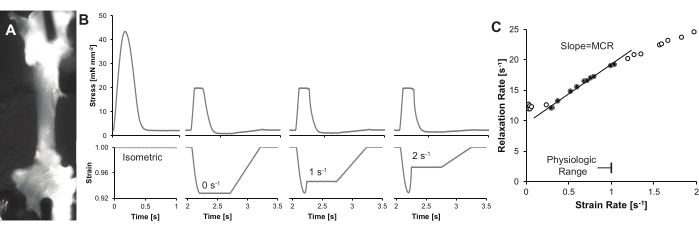
Figura 4: Trazas y resultados representativos . (A) Una sola trabécula cardíaca iluminada con una luz LED de cuello de cisne en un ángulo pronunciado (~ 75 °) desde el eje de la lente del microscopio, lo que mejora el contraste de la trabécula. En este ejemplo, dos imágenes están en mosaico para mostrar la longitud completa de la trabécula. (B) Curvas de tiempo de estrés (arriba) y tiempo de deformación (abajo) para la misma trabécula. Se muestra una contracción isométrica, junto con tres contracciones de la abrazadera de carga a tasas de deformación sistólica final crecientes. (C) Cálculo representativo de MCR. MCR se define como la pendiente de la línea entre la tasa de relajación y la velocidad de deformación. Como se señaló en la discusión, las tasas de deformación pueden restringirse para proporcionar un MCR cuantitativo y reproducible. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Soluciones. Haga clic aquí para descargar esta tabla.
Discusión
El control mecánico de relajación (MCR) cuantifica la dependencia de la tasa de relajación miocárdica de la tasa de deformación de la relajación muscular procediendo 8,9. La velocidad de deformación, en lugar de la poscarga, es necesaria y suficiente para modificar la tasa de relajación8. Como no se ha demostrado que las intervenciones para modificar la tasa de calcio mejoren sustancialmente la relajación cardíaca, la intervención mecánica puede proporcionar nuevos conocimientos sobre el mecanismo y proporcionar un nuevo tratamiento para la disfunción diastólica.
El protocolo para modificar la velocidad de deformación miocárdica descrito aquí utiliza una pinza de carga isotónica 8,9. Una fortaleza de la abrazadera de carga isotónica es el control cuantitativo de la tensión de poscarga. Los protocolos similares a Windkessel podrían usarse para investigar aún más los cambios en la poscarga, la precarga y el trabajo cardíaco 2,6,7. También se podría usar una rampa no controlada por la abrazadera de carga para aislar mejor el cambio en la tensión de la velocidad de deformación. En cualquier caso, la poscarga en sí misma no parece ser un fuerte modificador de la tasa de relajación8.
El protocolo también se puede adaptar para abordar condiciones más fisiológicas para la temperatura y la velocidad de estimulación. Los detalles del protocolo actual se utilizaron para mostrar la presencia del MCR. Generalmente se recomienda realizar experimentos en condiciones fisiológicas, dependiendo de la pregunta experimental. Sin embargo, los experimentos realizados a 37 ° C, o a altas tasas de ritmo, pueden inducir más rápidamente el desgaste (daño) del músculo. Puede ser necesaria una solución con una mejor capacidad de transporte de oxígeno. Además, la adquisición de datos debe ser capaz de muestrear la longitud y la fuerza lo suficientemente rápido como para resolver las contracciones rápidas y proporcionar control de retroalimentación.
El protocolo actual no describe la medición del calcio ni la medición y el control de las longitudes del sarcómero. Las mediciones de calcio se han abordado en otros protocolos11, mientras que la medición de la longitud del sarcómero se puede agregar con el equipo apropiado. El control de la longitud del sarcómero no se utiliza en los estudios actuales de MCR, ya que la longitud muscular es el parámetro más correlativo a la condición clínica19. Un mayor control de la longitud del sarcómero (frente al control de la longitud muscular) proporcionaría respuestas específicas a las preguntas cinéticas, pero es poco probable que aumente el conocimiento traslacional debido a la variación entre sarcómeros y la comprensión mínima de los cambios en la longitud del sarcómero in vivo.
Aquí se destacan tres consideraciones experimentales para aumentar la reproducibilidad de los datos.
En primer lugar, las trabéculas cardíacas independientes pueden ser difíciles de encontrar en algunos animales (resultados y comunicaciones no publicados). Si bien se pueden encontrar espasmos musculares en la mayoría de las ratas, una tasa de éxito razonable para obtener datos de la trabécula en ratas es de uno de cada tres. El éxito de Trabecula puede ser mayor con ratas Brown Norway x Lewis F1, que también se han utilizado históricamente20 y se ha informado que tienen más trabéculas (comunicaciones no publicadas). Para los ratones, es probable que las tasas de éxito sean más bajas, con menos de uno de cada 10 esperados para ratones de un fondo BL/6; sin embargo, se espera una tasa más alta para ratones de fondo FVBN (comunicaciones y observaciones no publicadas).
En segundo lugar, el daño a los músculos puede reducir la producción. Si las fuerzas desarrolladas son inferiores a 10 mN mm-2 a 25 °C y una estimulación de 0,5 Hz, es posible que los investigadores deban realizar la resolución de problemas para evaluar si se está produciendo un estiramiento inadvertido o un contacto entre las pinzas metálicas y el músculo, si las soluciones no se preparan adecuadamente o si el equipo experimental o de estimulación funciona correctamente. Otros protocolos que utilizan trabécula intacta han sugerido el uso de jeringas Luer-lock como recipientes de transferencia11. Si bien esto es posible, especialmente si el usuario controla un caudal muy lento o un segmento muscular más pequeño, el protocolo actual utiliza una pipeta de transferencia de diámetro mucho más grande para minimizar el posible daño. Otro paso donde puede ocurrir daño isquémico es durante la disección. La aorta debe ser canulada y enjuagada con solución de perfusión dentro de los 3 min del primer corte abdominal (rata) o luxación cervical (ratón), similar a los límites enumerados en los protocolos de aislamiento de cardiomiocitos21,22. Esto minimiza el tiempo en que el tejido cardíaco no está expuesto a la solución de perfusión similar a la cardioplejia. Además, las disecciones que duran más de 30 minutos generalmente no producen espasmos en la trabécula. Por lo tanto, los operadores deben practicar una disección rápida pero cuidadosa para minimizar el daño. Un área transversal por encima de 0,2 mm 2 (2 x 10-7 m2) puede sufrir isquemia20 central.
En tercer lugar, se debe considerar la forma en que los músculos están unidos al transductor motor y de fuerza. Este protocolo se centra actualmente en los anzuelos y las trabéculas independientes. La velocidad de deformación a veces rápida del estiramiento antes de la relajación puede hacer que un músculo se deslice si no se fija correctamente, por lo que el protocolo actual no utiliza "cestas" para sostener la trabécula23,24. También se pueden considerar y validar métodos de montaje alternativos (adhesivos, clips, etc.25,26). El protocolo descrito aquí utiliza trabéculas y no músculos papilares. Las cuerdas del músculo papilar inducen una elasticidad en serie que puede inhibir los cambios en la MCR9. Sin embargo, es poco probable que la colocación exacta de las uniones en el músculo afecte las medidas, porque la longitud (y el diámetro) de la trabécula varían sustancialmente.
Una limitación de perforar los extremos musculares con ganchos es que el punto de montaje en sí también puede dañarse. El posible desgarro del tejido muscular fijado con contracciones frecuentes (dependiendo de su fuerza) puede cambiar la elasticidad de la longitud o la serie. Esta tasa de desgarro es difícil de controlar. Del mismo modo, el daño al tejido y al gancho puede exacerbarse durante el estiramiento, lo que también puede causar problemas. La inspección visual y los valores de fuerza desarrollados restantes >80% de la fuerza isométrica equilibrada deben utilizarse para evaluar si el preparado está dañado y debe excluirse.
Otra limitación o consideración afecta qué preguntas experimentales pueden ser respondidas por el método. Por ejemplo, considere el uso de 2,3-butanodiona monoxima (BDM) en la solución de perfusión. BDM es una fosfatasa, que puede alterar la función del músculo. Además, el largo período de descarga y la falta de estimulación significan que el estado de fosforilación latente probablemente ha cambiado. Por lo tanto, se debe tener precaución cuando se trata de evaluar directamente la contractilidad muscular de un animal (frente a las diferencias entre genotipos o tratamientos), ya que el estado contráctil probablemente ha cambiado. Sin embargo, el impacto de la fosforilación puede evaluarse farmacológicamente mediante la adición de un agonista o antagonista de la vía.
En resumen, MCR proporciona información sobre cómo la relajación está regulada por el movimiento muscular (tasa de esfuerzo). La MCR puede ayudar a proporcionar una mejor comprensión del diagnóstico y la monitorización de la enfermedad diastólica, junto con los objetivos para la intervención farmacológica, como la modificación de la cinética de la miosina. El protocolo y el asesoramiento descritos aquí exponen el conocimiento desarrollado durante varios años de ensayos, y deben ser aplicables a otros sistemas y modelos de enfermedad cardíaca.
Divulgaciones
Ninguno.
Agradecimientos
Este trabajo cuenta con el apoyo de los Institutos Nacionales de Salud (1R01HL151738) y la Asociación Americana del Corazón (18TPA34170169).
Materiales
| Name | Company | Catalog Number | Comments |
| 18 or 16 gauge blunted needle/canula | for cannulation of rat aorta, use 1mm of PE160 or PE205 tubing as stop | ||
| 2,3-Butanedione Monoxime | Sigma-Aldrich | B0753-25G | |
| 23 gauge blunted needle/canula | for cannulation of mouse aorta, use 1mm of PE50 tubing as stop | ||
| 5 mL syringe | BD Luer-Lock | 309646 | |
| 95% Oxygen/5% CO2 | AirGas | Z02OX9522000043 | |
| Anethesia system | EZ Systems | EZ-SA800 | Can use any appropriate anethesia method/system |
| Bovine Serum Albumin | Fisher BioReagents | BP-1600 | to coat tips of fine forcepts, scissors |
| Calcium Chloride Dihydrate | Fisher Chemical | C79-500 | |
| Containers/dissection dishes | FisherBrand | 08-732-113 | Weigh dishes for creating dissection plates |
| Crile Hemostat | Fine Science Tools | 13005-14 | for mouse gross dissection |
| D-(+)-Glucose | Sigma-Aldrich | G8270-1KG | |
| Data acquisition software | SLControl | ||
| Data acquisition system | MicrostarLabs | DAP5216a | Can use any DAQ. This is a PCI based data acqusition for use with SLControl; must have a PC with a PCI slot |
| Data analysis software | Mathworks | Matlab | Custom Script |
| Dumont #3 Forceps | Fine Science Tools | 11231-30 | 2x for cannulation of aorta |
| Dumont #5 Forceps | Fine Science Tools | 11254-20 | 2x for trabecula isolation |
| Experimental system | Aurora Scientific | 801C | Can use any appropriate experimental chamber with force and length control |
| Fine Scissors, curved | Fine Science Tools | 14061-09 | for removal of heart |
| Gooseneck Piggyback Illuminator | AmScope | LED-6WA | |
| HEPES | Sigma-Aldrich | H3375-250G | |
| Imaging software | IrfanView | ||
| Iris Forceps | World Precision Instruments | 15915 | for removal of heart |
| Isoflurane | VetOne | 502017 | |
| Magnesium Chloride Hexahydrate | Sigma-Aldrich | M2670-100G | |
| Magnesium Sulfate | Sigma-Aldrich | M7506-500G | |
| Mayo Scissors | Fine Science Tools | 14110-15 | for rat gross dissection |
| Metzenbaum Scissors | Fine Science Tools | 14116-14 | for mouse gross dissection |
| Microscope connected camera | Flir | BFS-U3-27S5M-C | Includes acquisition software |
| Microscope/digital imaging system | Olympus | IX-73 | Can use any appropriate microscope. Needed to measure muscle length, cross sectional area |
| Mounting Pin/Needle | BD PrecisionGlide | 305136 | For holding heart to dish. 27 G x 1-1/4 |
| Mounting Pin/Needle | Fine Science Tools | 26000-40 | For holding heart to dish. 0.4mm diameter insect pin (Alt to 27G needle) |
| Oxygen (O2) | AirGas | OX USP300 | |
| Peristaltic Pump | Rainin | Rabbit | Can be any means to create flow in experimental chamber |
| pH and Oxygen sensor | Mettler Toledo | SevenGo pH and DO | |
| Potassium Bicarbonate | Sigma-Aldrich | 237205-100G | |
| Potassium Chloride | Fisher Chemical | P217-500 | |
| Potassium Phosphate Monobasic | Sigma-Aldrich | 795488-500G | |
| Rochester-pean Hemostat | World Precision Instruments | 501708 | for rat gross dissection |
| Silk Suture, Size: 4/0 | Fine Science Tools | 18020-40 | cut to ~1.5 inch pieces, soaked in water |
| Sodium Bicarbonate | Sigma-Aldrich | S6297-250G | |
| Sodium Chloride | Sigma-Aldrich | S9888-1KG | |
| Sodium Hydroxide | Sigma-Aldrich | S8045-500G | |
| Sodium Phosphate Dibasic | Sigma-Aldrich | S7907-100G | |
| Stereomicroscope | AmScope | SM-1TX | |
| Student Vannas Spring Scissors | Fine Science Tools | 91500-09 | for opening of the RV |
| SYLGARD 184 Silicone Elastomer Base | Dow Corning | 3097358-1004 | For creating dissection plates |
| Syringe Holder | Harbor Frieght | Helping Hands 60501 | Can be used as alternate for ring stand |
| Taurine | Sigma-Aldrich | T0625-1KG | |
| Transfer Pipette | FisherBrand | 13-711-7M | cut ~1" from tip to widen bore |
| Vannas Spring Scissors | Fine Science Tools | 15000-00 | for trabecula isolation |
Referencias
- Iribe, G., Helmes, M., Kohl, P. Force-length relations in isolated intact cardiomyocytes subjected to dynamic changes in mechanical load. American Journal of Physiology. Heart and Circulatory Physiology. 292 (3), 1487-1497 (2007).
- Dowrick, J. M., et al. Work-loop contractions reveal that the afterload-dependent time course of cardiac Ca(2+) transients is modulated by preload. Journal of Applied Physiology. 133 (3), 663-675 (2022).
- ter Keurs, H. E., Rijnsburger, W. H., van Heuningen, R., Nagelsmit, M. J. Tension development and sarcomere length in rat cardiac trabeculae. Evidence of length-dependent activation. Circulation Research. 46 (5), 703-714 (1980).
- Sonnenblick, E. H. Force-velocity relations in mammalian heart muscle. The American Journal of Physiology. 202, 931-939 (1962).
- Brutsaert, D. L., Rademakers, F. E., Sys, S. U. Triple control of relaxation: implications in cardiac disease. Circulation. 69 (1), 190-196 (1984).
- Taberner, A. J., Han, J. C., Loiselle, D. S., Nielsen, P. M. F. An innovative work-loop calorimeter for in vitro measurement of the mechanics and energetics of working cardiac trabeculae. Journal of Applied Physiology. 111 (6), 1798-1803 (2011).
- De Tombe, P. P., Little, W. C. Inotropic effects of ejection are myocardial properties. Am J Physiol. 266, 1202-1213 (1994).
- Chung, C. S., Hoopes, C. W., Campbell, K. S. Myocardial relaxation is accelerated by fast stretch, not reduced afterload. Journal of Molecular and Cellular Cardiology. 103, 65-73 (2017).
- Schick, B. M., et al. Reduced preload increases Mechanical Control (strain-rate dependence) of Relaxation by modifying myosin kinetics. Archives of Biochemistry and Biophysics. 707, 108909(2021).
- Parikh, S. S., Zou, S. Z., Tung, L. Contraction and relaxation of isolated cardiac myocytes of the frog under varying mechanical loads. Circulation Research. 72 (2), 297-311 (1993).
- Dowrick, J. M., et al. Simultaneous brightfield, fluorescence, and optical coherence tomographic imaging of contracting cardiac trabeculae ex vivo. Journal of Visualized Experiments. (176), e62799(2021).
- Wiggers, C. J. Studies on the consecutive phases of the cardiac cycle I. The duration of the consecutive phases of the cardiac cycle and the criteria for their precise determination. American Journal of Physiology-Legacy Content. 56 (3), 415-438 (1921).
- Rosen, B. D., et al. Late systolic onset of regional LV relaxation demonstrated in three-dimensional space by MRI tissue tagging. American Journal of Physiology. Heart and Circulatory Physiology. 287 (4), 1740-1746 (2004).
- Saito, M., et al. The differences in left ventricular torsional behavior between patients with hypertrophic cardiomyopathy and hypertensive heart disease. International Journal of Cardiology. 150 (3), 301-306 (2011).
- Monasky, M. M., Biesiadecki, B. J., Janssen, P. M. L. Increased phosphorylation of tropomyosin, troponin I, and myosin light chain-2 after stretch in rabbit ventricular myocardium under physiological conditions. Journal of Molecular and Cellular Cardiology. 48 (5), 1023-1028 (2010).
- Raff, G. L., Glantz, S. A. Volume loading slows left ventricular isovolumic relaxation rate. Evidence of load-dependent relaxation in the intact dog heart. Circulation Research. 48, 813-824 (1981).
- Matsubara, H., Takaki, M., Yasuhara, S., Araki, J., Suga, H. Logistic time constant of isovolumic relaxation pressure-time curve in the canine left ventricle. Better alternative to exponential time constant. Circulation. 92 (8), 2318-2326 (1995).
- Chung, C. S., Kovacs, S. J. Physical determinants of left ventricular isovolumic pressure decline: model prediction with in vivo validation. American Journal of Physiology. Heart and Circulatory Physiology. 294 (4), 1589-1596 (2008).
- Campbell, K. B., Kirkpatrick, R. D., Tobias, A. H., Taheri, H., Shroff, S. G. Series coupled non-contractile elements are functionally unimportant in the isolated heart. Cardiovascular Research. 28 (2), 242-251 (1994).
- Raman, S., Kelley, M. A., Janssen, P. M. Effect of muscle dimensions on trabecular contractile performance under physiological conditions. Pflugers Archiv: European Journal of Physiology. 451 (5), 625-630 (2006).
- Czeiszperger, T. L., Wang, M. P., Chung, C. S. Membrane stabilizer Poloxamer 188 improves yield of primary isolated rat cardiomyocytes without impairing function. Physiol Rep. 8 (4), 14382(2020).
- Louch, W. E., Sheehan, K. A., Wolska, B. M. Methods in cardiomyocyte isolation, culture, and gene transfer. Journal of Molecular and Cellular Cardiology. 51 (3), 288-298 (2011).
- Loiselle, D. S., Johnston, C. M., Han, J. C., Nielsen, P. M. F., Taberner, A. J. Muscle heat: a window into the thermodynamics of a molecular machine. American Journal of Physiology. Heart and Circulatory Physiology. 310 (3), 311-325 (2016).
- de Tombe, P. P., ter Keurs, H. E. Force and velocity of sarcomere shortening in trabeculae from rat heart. Effects of temperature. Circulation Research. 66 (5), 1239-1254 (1990).
- Palmer, B. M., Bell, S. P. Preparing excitable cardiac papillary muscle and cardiac slices for functional analyses. Frontiers in Physiology. 13, 817205(2022).
- Brunello, E., et al. Myosin filament-based regulation of the dynamics of contraction in heart muscle. Proceedings of the National Academy of Sciences. 117 (14), 8177-8186 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados