Method Article
בקרה מכנית של הרפיה באמצעות trabeculae לב שלם
In This Article
Summary
הרפיה מהירה של שריר הלב והלב חיונית לפיזיולוגיה תקינה. מנגנוני הרפיה מכניים ידועים כיום כתלויים בקצב המאמץ. פרוטוקול זה מספק סקירה כללית של רכישה וניתוח של ניסויים כדי להמשיך לחקור את הבקרה המכנית של הרפיה.
Abstract
תפקוד לקוי של דיאסטולי הוא פנוטיפ נפוץ במצגות של מחלות לב וכלי דם. בנוסף לנוקשות לבבית מוגברת (לחץ דיאסטולי מוגבר בקצה החדר השמאלי), הרפיה לבבית לקויה היא אינדיקטור אבחוני מרכזי לתפקוד לקוי של דיאסטולי. בעוד הרפיה דורשת הסרה של סידן ציטוסולי ונטרול של חוטים דקים סרקומריים, התמקדות במנגנונים כאלה עדיין לא סיפקה טיפולים יעילים. מנגנונים מכניים, כגון לחץ דם (כלומר, עומס אחר), כבר תיאוריה לשנות הרפיה. לאחרונה, הראינו כי שינוי קצב המאמץ של מתיחה, לא עומס אחר, היה הכרחי ומספיק כדי לשנות את קצב ההרפיה הבא של רקמת שריר הלב. ניתן להעריך את התלות בקצב המאמץ של הרפיה, הנקראת בקרה מכנית של הרפיה (MCR), באמצעות טרבקולה לבבית שלמה. פרוטוקול זה מתאר הכנת מודל של בעלי חיים קטנים, מערכת ניסוי וחדר, בידוד הלב ובידוד לאחר מכן של טרבקולה, הכנת חדר הניסוי ופרוטוקולי ניסוי וניתוח. ראיות להארכת המתח בלב השלם מצביעות על כך ש-MCR עשוי לספק זירות חדשות לאפיון טוב יותר של טיפולים תרופתיים, יחד עם שיטה להערכת קינטיקה של מיופילמנט בשרירים שלמים. לכן, לימוד ה-MCR עשוי לסלול דרך לגישות חדשות ולגבולות חדשים בטיפול באי ספיקת לב.
Introduction
הרפיה לבבית נפגעת כמעט בכל צורות אי ספיקת הלב (כולל אי ספיקת לב עם מקטע פליטה מופחת) ובמחלות לב וכלי דם רבות. בנוסף לשיטות רבות להערכת תפקוד הלב בשרירים חדירים, הערכת שרירי הלב השלמים צוברת עניין. רקמות כאלה מוערכות פרוקות (קצוות חופשיים להתכווץ) או טעונות (אורך או כוח נשלט). מבחינה היסטורית, מיוציטים מבודדים שלמים הוערכו במצב פרוק, שבו גוף התא חופשי להתקצר במהלך התכווצות. טרבקולה לבבית שלמה מוערכת לעתים קרובות בתנאים איזומטריים, שבהם האורך אינו מורשה להשתנות, אך נוצר מתח (כוח לכל שטח חתך). שתי שיטות מיוציטים שלמים ו trabeculae מתחילים להתכנס עם שינויים של עומס 1,2.
פרוטוקולים להידוק עומס על שריר (כלומר, שליטה במאמץ המפותח של שריר בערך מוגדר המדמה עומסים פיזיולוגיים) פותחו במשך כמה עשורים 3,4,5. ברקמות לב שלמות, מהדקי עומס מאפשרים לחוקרים לחקות בצורה קרובה יותר את מחזור הלב in vivo באמצעות עומסים איזוטוניים או דמויי Windkessel 6,7,8,9. מטרת פרוטוקול זה היא להשיג נתונים המשמשים לכימות ה-MCR (כלומר, התלות בקצב המאמץ של קצב ההרפיה)8,9.
בעוד פרוטוקול MCR הותאם מעבודות קודמות, ההתמקדות של פרוטוקול זה (בהשוואה לפרוטוקולים דומים המשתמשים ברקמות לב שלמות) היא על מנגנונים ביומכניים המשנים הרפיה. ישנם מספר פרוטוקולים המשתמשים בהידוק עומס 3,4,5,7,10 ופרוטוקולים המתמקדים בדגמי Windkessel 1,2,11, אך פרוטוקול זה מתאר באופן ספציפי כיצד מתיחה לפני הרפיה משנה את קצב ההרפיה. הראינו שבקרה זו מתרחשת במהלך תקופה פרוטו-דיאסטולית8, שלב שתואר במקור על ידי וויגרס12. בלבבות בריאים תקינים, שריר הלב עובר מאמץ מתארך במהלך הפליטה לפני סגירת המסתם האאורטלי (כלומר, לפני הרפיה איזובולומית)13. זה מחקה על ידי הארכת משך השליטה בעומס עד שהשריר מתחיל להימתח. ראיות קליניות מצביעות על כך שהתארכות זו עשויה להיחלש או ללכת לאיבוד במצבי מחלה14, וההשלכות והמנגנונים של שינוי שיעורי הזן הסיסטולי הסופי לא הובהרו במלואם. בהתחשב באפשרויות הטיפול הדלילות במחלות דיאסטוליות ואי ספיקת לב עם מקטע פליטה שמור, אנו מניחים כי MCR עשוי לספק תובנה לגבי מנגנונים חדשים העומדים בבסיס הרפיה לקויה.
בעוד שהדיסקציה הגסה המתוארת כאן מתמקדת במכרסמים, בידוד טרבקולה יכול להתבצע מכל לב שלם, ובעבר נעשה בו שימוש עם טרבקולה לבבית אנושית8. באופן דומה, רכישת הנתונים וניתוחם יכולים להיות מיושמים גם על קרדיומיוציטים או סוגי שרירים מבודדים אחרים 1,10. הדיון כולל הערות על שינויים והתאמות אפשריים לשיטה, לצד מגבלות, כגון זהירות מפני שימוש בשרירי פפילרי בגלל התכונות המכניות של האקורד9.
Protocol
הפרוטוקול הבא אושר על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים של אוניברסיטת וויין סטייט. הפרוטוקול כאן מתאר צעדים לשימוש בנבדקי ניסוי מכרסמים, אך ניתן להתאים אותו לשימוש ביצורי מודל אחרים.
1. הכנה
- להשיג את נושא הניסוי ולאפשר לו להתאקלם במעבדה.
- הכינו 250 מ"ל של תמיסת זילוח ו-250 מ"ל של תמיסת טיירוד שונה (טבלה 1), על ידי חמצון כל אחד מהם ל-10-20 חל"מ של O2, עם pH 7.3.
- מכינים מזרק 5 מ"ל עם צינורית מחוברת. ממלאים את המזרק בתמיסת זילוח. השתמש צינוריות כי הם 23 G עבור עכבר, ו 18 או 16 G עבור חולדה קטנה או גדולה, בהתאמה. החלק צינור פוליאתילן (PE) באורך 1 מ"מ על קצה מחט קהה (טבלה של חומרים), כדי לסייע במניעת החלקת אבי העורקים מהצינורית לאחר הקשירה.
- הכנה מלאה של אזור הדיסקציה והקנולציה (איור 1)
- מלאו שתי סירות שקילה נקיות לפחות באמצע הדרך בתמיסת זילוח. יש לטבול את קצה הצינורית בתמיסת זילוח עם לפחות תפר אחד בעל לולאה כפולה הממוקם סביב הצינורית. החזק את המזרק במקומו עם מהדק בר.
- הניחו מספריים כירורגיים, המוסטט, מלקחיים קשתית, זוג מספריים מעוקלים קטנים ושני מלקחיים #3 לגישה נוחה.
- הכינו את מערכת הניסוי (איור 2) על-ידי הכנה והפצה של פתרון הטיירוד שעבר שינוי בכל מערכת הניסוי. ודא כי החדר מלא לחלוטין ויציב.
- הפעל את כל תיבות איסוף הנתונים, כולל מתמר הכוח, מנוע האורך, מערכת הקצב, מערכת בקרת הטמפרטורה ומחשב איסוף הנתונים.
- העתק ושנה שם של תיקיית תבנית הכוללת את קובצי ה- *.dap והמצביע הדרושים כדי להפנות לניסוי הנוכחי. פתח את תוכנת רכישת הנתונים.
- הכינו את כלי בידוד הטרבקולה (מספריים של Vannas, מלקחיים #5 או #55, גשושית זכוכית) על-ידי טבילת הקצוות שלהם באלבומין בסרום בקר (BSA) של 10% (w/v) במים טהורים במיוחד או בתמיסת זילוח, כדי לצפות את המתכת בחלבון (איור 2B).
הערה: יש להכין את כל מערכת הניסוי לפני הנתיחה.
2. דיסקציה גסה וקנולציה
- רשום את הזיהוי, משקל הגוף ומידע רלוונטי אחר של נושא החיה.
- לחלופין, הזריקו 1,000 U/kg של הפרין במי מלח סטריליים למכרסם באמצעות הזרקה תוך צפקית לפחות 10 דקות לפני המתת חסד, כדי למזער את סיכוני הקרישה לפני זילוח כלילי.
- הכניסו את בעל החיים לתא זירוז וגרמו להרדמה כללית באמצעות 3%-5% איזופלורן שהתאדה ב-100% חמצן, על פי הנוהל הסטנדרטי.
הערה: הפעל נבלות חיצוניות, טבלאות טיוטה למטה או מנדפים המשמשים למזעור החשיפה לאיזופלורן. - ברגע שהמכרסם מאבד את רפלקס הימין שלו וקצב הנשימה הואט:
- (עבור חולדה) הוציאו את בעל החיים מתא האינדוקציה והניחו אותו בשכיבה על כרית דיסקציה, עם המשך הרדמה דרך חרוט באף.
- (עבור עכבר) לבצע נקע צוואר הרחם מיד לאחר הוצאת בעל החיים מתא הזירוז. חרוט האף אינו הכרחי. הפוך את אידוי isoflurane ל 0%.
- במידת הצורך, הצמידו את הגפיים העליונות של המכרסם לכרית הדיסקציה הרחק מקיר החזה באמצעות סרט הדבקה הנתמך בסיכות, תוך הקפדה שלא לחדור לחיה. בדוק עומק הרדמה תקין (חוסר תגובה של צביטת בוהן) לפני שתמשיך לדיסקציה.
- בעזרת מספריים כירורגיים (מאיו לחולדות, מצנבאום לעכברים), ממש מתחת לתהליך הקסיפואידים, חותכים את העור לרוחב מלא של בטנו של המכרסם לתוך חלל הצפק.
- באמצעות מספריים כירורגיים, לבצע שני חתכים אנכיים parasagittal (במעלה הצדדים של קיר החזה) הן בצד שמאל וימין של קיר החזה מן החתך הרוחבי. לאחר מכן, לחתוך על פני הסרעפת, חיבור חתכים parasagittal, ולשחרר את החלל החזי.
- הדקו והרימו את תהליך הקסיפואיד באמצעות המוסאט לכיוון ראשו של המכרסם, כדי להזיז את עצם החזה ואת דופן החזה כלפי מעלה לכיוון ראשו של המכרסם, ולחשוף את חלל בית החזה ואת הלב. במידת הצורך, הרחיבו במהירות את החתכים הפאראסגיטליים עד קרוב לחלל החוליה השני, כדי לחשוף את הלב במלואו ו/או לשבור את קרום הלב.
- באמצעות מלקחיים קשתית מעוקלת, בזהירות להרים את הלב כדי לדמיין את כלי הדם הגדולים. מניחים את המלקחיים בין שריר הלב לעמוד השדרה של המכרסם, מהדקים את כלי הדם הגדולים יותר, ומרימים את הלב, תוך הקפדה לא להדק את האטריה או קטעי החדרים.
- תוך כדי הרמה קלה של הלב, הניחו במהירות את מספריים הקשתית המעוקלות (קעורות כלפי מעלה) בין מלקחיים הקשתית המעוקלת לעמוד השדרה של המכרסם, וחתכו את כלי הדם והריאות הגדולים הרחק מהלב. העבירו במהירות את הלב לסירת שקילה או לכוס המכילה תמיסת זילוח טרייה, ונערו כדי לעזור לנקות דם מהלב.
- הפוך את אידוי isoflurane ל 0%, אם עדיין לא נעשה. אם חלקים גדולים של ריאות, פריקרדיאל או רקמות אחרות נשארים מחוברים ללב, חתכו בזהירות והשליכו אותם בשלב זה כדי למזער את ההפרעה לקנולציה.
- בעזרת מלקחיים הקשתית המעוקלת, מעבירים את הלב לסירת שקילה נקייה או לכוסית, כאשר הצינורית המוכנה שקועה במים. מקננים את אבי העורקים, מאבטחים את אבי העורקים על ידי הידוק תפר המשי הלולאה, וסומקים עם עד 5 מ"ל של תמיסת זילוח.
- מוציאים את הלב מהצינורית ומניחים אותו בכלי שקילה מצופה אלסטומר סיליקון כדי להתכונן לבידוד הטרבקולה.
3. בידוד ושיווי משקל של trabecula
- הניחו את הלב בכלי מצופה אלסטומר סיליקון מתחת לסטריאומיקרוסקופ והאירו אותו.
- אתר את מערכת זרימת החדר הימנית. הצמידו את האטריום השמאלי ואת קודקוד החדר לאלסטומר הסיליקון בצלחת.
- בעזרת מספריים ארוכות של Vannas, חותכים ממערכת זרימת החדר הימני אל הקודקוד לאורך המחיצה. חתכו ממערכת זרימת החדר הימני לאטריום הימני ליד אבי העורקים, ואז חתכו דרך האטריום הימני (איור 3B).
- באמצעות מלקחיים, בזהירות למשוך לפתוח את החדר הימני (RV) קיר חופשי מן דרכי היציאה, נזהר לא למתוח את הרקמה.
הערה: נסיינים עשויים למצוא גדילי רקמת חיבור דקים ולבנים, שניתן לחתוך ללא חשש. גדילים גדולים יותר, ורודים (רקמות) יש להעריך בזהירות, כפי שהם עשויים להיות trabeculae כי ניתן לבודד. - הצמידו את הדופן החופשית של משולש החדר הימני לצלחת, כדי לחשוף את החדר הימני (איור 3C).
- בעזרת פיפטת זכוכית שהומסה ונוצרה עם קצה דק (<500 מיקרומטר) אך לא חד, חפשו באנדוקרדיום החשוף טרבקולה עצמאית (איור 3C).
הערה: טרבקולה עצמאית היא רצועת שריר שניתן לבחון במלואה מתחתיה. השתמש trabeculae כי יש צדדים מקבילים (רוחב קבוע), הימנעות שרירי פפילרי משולש. היזהר במהלך תהליך זה ולאחר מכן, כמו הפעלת מתח על trabecula יכול לגרום נזק, הפחתת הכוח המפותח. - לנתח את trabecula באמצעות מספריים Vannas קטן. השאירו חתיכת רקמה קובייתית בקוטר ≥1 מ"מ בכל קצה של הטרבקולה כדי לאפשר היצמדות. אין למתוח את קנה הנשימה במידת האפשר, ולמזער מגע של כלי מתכת, שכן שניהם יכולים גם לגרום נזק לשריר. מקמו מחדש את הסיכות המחזיקות את הלב לפי הצורך כדי למזער את העומס על השריר ליד קנה הנשימה שזוהה.
- חותכים ~ 2 אינץ 'מהקצה של פיפטת העברה 7 מ"ל, מושכים לאט את הטרבקולה לתוך הפיפטה, ומעבירים אותה לצלחת שקילה חדשה המכילה 50% תמיסת זילוח ו -50% שונה התמיסה של טירוד. אפשרו לשריר להתאזן לעלייה בסידן החוץ תאי בתוך התמיסה המעורבת למשך מספר דקות.
- חזור על שלבים 3.7-3.8 כדי לנתח טרבקולה נוספת בשלב זה, כדי להשיג טרבקולה נוספת כגיבוי.
- כבו את המשאבה המספקת עירוי ו/או יניקה לתא הניסוי. בעזרת פיפטת ההעברה הגדולה מעבירים את הטרבקולה לתא הניסוי המלא בתמיסה של טירוד.
- הצמד פיסת רקמה אחת בקובייה >1 מ"מ בקצה הטרבקולה לוו על מתמר הכוח, ולאחר מכן הצמד את הקובייה השנייה למנוע.
הערה: הפרד את מתמר המנוע והכוח בעת הרכבת הצד הראשון לקבלת גישה טובה יותר למתמר, ולאחר מכן הזז את הווים קרוב ככל האפשר זה לזה בעת הרכבת קוביית הרקמה השנייה כאשר הטרבקולה נשארת רפה. - הפעל מחדש את העירוי והתחל לקצב את השריר כדי לקבוע את מתח הסף. קצב של 20% מעל מתח הסף למשך כשעה כדי לאפשר לטרבקולה להתאזן.
- בתום תקופת שיווי משקל זו, מתחו באיטיות את השריר באמצעות המיקרומטר המחובר למנוע עד להשגת יצירת מתח מפותח אופטימלי, על ידי התבוננות במתח המפותח (מינימום עד שיא). הפסיקו להגדיל את אורך השריר כאשר המתח הדיאסטולי הפסיבי עולה מהר יותר ממתח השיא, מה שמעיד על כך שהאורך האופטימלי עבר.
- כבו את תאורת המיקרוסקופ המשודר, והאירו את הטרבקולה באמצעות מאיר צוואר אווז בזווית תלולה. באמצעות מצלמה המחוברת דרך אופטיקת המיקרוסקופ שכויל בעבר, ללכוד תמונה של trabecula במהלך diastole לתוך תיקיית הניסוי. אם הטרבקולה רחבה יותר משדה הראייה של המצלמה, צלם מספר תמונות על פני השריר.
- פתחו את התמונות בתוכנת הדמיה המדווחת על מרחקי פיקסלים.
- מדדו את מרחק הפיקסלים של קוטר השריר ארבע פעמים לאורכו. מדדו את אורך השריר (טרבקולה) בפיקסלים, למעט קוביית הרקמה הגדולה.
- אם אורך השריר ארוך יותר משדה הראייה, השתמש בנקודות ייחוס לאורך השריר כדי למדוד את האורך כולו.
- באמצעות התבנית בתיקיית הניסוי, בצע ממוצע של מידות הקוטר והמיר את הקוטר והאורך מפיקסלים למ"מ באמצעות כיול שהתקבל בעבר. חשב את שטח החתך כ- π * קוטר 2/4 במ"מ2, ואת אורך השריר במיקרומטר.
4. איסוף נתונים
- לאחר איזון השריר, פתח את תוכנת רכישת הנתונים, בחר ניסויים | בקרת אורך, והזן את אורך הטרבקולה המכויל (FL) ואת שטח החתך (שטח [m2]) בתיבה כיול.
- מתיקיית התבנית (שלב 1.7), ודא שה freeform_file.txt מצביע על התיקיה הנכונה ופתח את הקובץ freeform.dap בעורך טקסט. הגדר את הרמה האיזוטונית (איזוטון) ל- 32,000 בקובץ *.dap.
- בתיבה בקרת אורך, בחר בכרטיסיה צורה חופשית ואתר את קובץ הרשימה המתאים. ודא שהנתיב Data Filing הוא גם התיקיה הנכונה לשמירת נתונים. התחל לקבל נתונים מעוויתות איזומטריות לחלוטין על ידי לחיצה על Run Experiment, לפני קבלת נתוני מהדק עומס באמצעות פקד משוב עם פרמטרים של רווח פרופורציונלי ואינטגרציה.
- קבל נתונים מהודקת עומס על-ידי הגדרת העומס העוקב (איזוטון) בקובץ *.dap, וחזור על ערכים של פרמטרים של רווח יחסי (propgain) ואינטגרציה (Ki) על-ידי שמירת הקובץ בעורך הטקסט. לחץ על הפעל ניסוי בממשק התוכנה לרכישת נתונים.
- ודא שהמהדק כולל הארכה חזרה לאורכו המקורי (המכונה לעתים העמסת הרפיה5) במהלך איטרציה זו כדי להשיג את הטווח המרבי של קצבי מאמץ, על ידי הגדרת מצב (flswitch) מאחד והגדלת הסף לסיום מהדק העומס (flthreshold) מאפס.
- שלוט בקצה מהדק העומס על ידי שינוי המצב (flswitch) מאחד לאפס. חזור על הרכישה תוך שינוי קצה מהדק העומס מאפס הארכה מחדש להארכה מלאה חזרה לאורך ההתחלה.
- כדי להגדיל את האורך, הגדילו בהדרגה את הסף לסיום מהדק העומס (flthreshold) מאפס עד שהשריר כמעט מתארך חזרה לאורכו המקורי.
- אפס את המצב (flswitch = 1) ואת הסף (flthreshold = 0), והפעל רכישת נתונים סופית אחת.
- אם תרצה, שנה את עומס הלוואי במחקר על ידי חזרה על שלבים 4.4-4.6. רכישה זו עשויה להיעשות באופן מיידי.
- אם תרצה, שנה את העומס מראש על ידי מתיחה או קיצור של השריר, או טפל בשריר על ידי הוספת תרכובות לתמיסת הטירוד. אם אתם משנים את העומס המוקדם או מוסיפים תרכובות, המתינו לפחות 20 דקות כדי לוודא שתגובת הכוח האיטי 9,15 התייצבה ו/או שהתרכובת תחדור באופן מלא לשריר.
- לאחר השלמת איסוף הנתונים, הסר את הטרבקולה. במידת הצורך, להקפיא או לתקן את trabecula לניתוח ביוכימי או היסטולוגי.
- נקו את פינות העבודה ואת מערכת הניסויים, שטפו את כל הצינורות במים וכבו את כל הרכיבים.
5. ניתוח נתונים
- פתח את קבצי הנתונים באמצעות תוכנית ניתוח כמותי על-ידי הפניית התוכנית לנתיב הקובץ המתאים.
- כמת הרפיה על ידי הבטחת כי תוכנית ניתוח הנתונים מנתחת את הפעימה המהודקת, וכי התוכנית רוכשת כראוי את תחילת מהדק העומס.
- ודא שקצה מהדק העומס מזוהה, כך שקצב ההרפיה (1/τ) מכומת מהנגזרת השלילית הגבוהה ביותר של מתח במהלך הרפיה איזומטרית.
- השתמש בשיטת גלנץ16 כדי לקבוע קבוע זמן מעריכי זה, או כימות מתאים אחר של הרפיה (נגזרת מינימלית של מתח, קבוע זמן לוגיסטי 17, או מודל קינמטי18).
- ודא שתוכנית ניתוח הנתונים מחשבת את קצב המאמץ על ידי לקיחת נגזרת הזמן של המתח, כאשר המאמץ מחושב כאורך כפונקציה של הזמן חלקי אורך בהתכווצות אופטימלית.
- חזור על השלבים לעיל עבור כל העקבות של מצב נתון.
- שרטט את הקשר בין קצב ההרפיה לקצב המאמץ, תוך הגבלת הנתונים המרביים לקצב מאמץ פיזיולוגי של פחות מ- 1 s-1. אל תכלול נתונים בשיעורי מאמץ נמוכים (איור 4C), מכיוון ששלב ההרפיה עשוי שלא לשקף את הדעיכה המעריכית17,18.
- קבל את שיפוע הקו בין קצב ההרפיה לקצב המאמץ, ורשום את השיפוע כמדד MCR.
- חזור על הניתוח לעיל עבור כל מצב שנחקר.
תוצאות
מערך נתונים מייצג מוצג באיור 4, ותוצאות נוספות ניתן למצוא בפרסומים קודמים 8,9. בקצרה, קצב המאמץ מחושב מהנגזרת של המתח, ממש לפני הרפיה איזומטרית. מאמץ הוא האורך כפונקציה של הזמן חלקי אורך השריר באורך אופטימלי. קצב ההרפיה מחושב כ- 1/τ, כאשר τ הוא קבוע הזמן המעריכי16. קצבי מאמץ מרובים ושיעורי ההרפיה הנובעים מהם נדרשים כדי לקבוע את הבקרה המכנית של הרפיה (MCR). נתונים אלה משורטטים על גרף קצב הרפיה לעומת קצב מאמץ. שיפוע הקו מספק את מדד MCR.
שים לב ששיעורי הזנים הסיסטוליים והדיאסטוליים הסופיים אינם צפויים לעלות על 1 s-1. לכן, השיפוע צריך לכלול רק שיעורי מאמץ < 1 s-1. ניתן לבלבל את קצב ההרפיה בשיעורי מאמץ נמוכים על ידי שינויים בנגזרת הזמן המינימלית של מתח (dStress/dtmin), ובמקרים אלה, ניתן להתעלם מנתונים ממתיחות הנמוכות מ- 0.15 s-1 בקירוב.

איור 1: הגדרת אזור דיסקציה גסה וקנולציית לב. מימין לשמאל: א. תא השראת ההרדמה של בעל החיים ממוקם בסמוך לאזור הנתיחה. b. שנורקל עבור נבלות גז נדיף אופציונלי. ג. כרית דיסקציה, שבה יונח בעל החיים על גבי עמוד השדרה, מוקפת (בכיוון השעון) ד. חרוט אף, כדי לספק המשך הרדמה למכרסם, א. המוסטטים, ו. מספריים כירורגיים, ז. מספריים עדינים מעוקלים המונחים לגישה נוחה עם היד הדומיננטית (החיתוך), ח. מלקחיים קשתית מעוקלים המונחים לגישה נוחה עם היד הלא דומיננטית. ניתן להדביק את הגפיים העליונות של המכרסם על כרית הדיסקציה באמצעות נייר דבק, ו-i. יש להניח בקרבת מקום צלחת דיסקציה (או כד קטן) עם תמיסת זילוח לשטיפת הלב. j. בקרבת מקום יש להציב אזור מבוים לשימורים. מזרק עם צינורית מתאימה מותקן על מעמד טבעת. k. (כניסה) תמונה קרובה יותר של צינורית 16 G, עם 1 מ"מ של צינורות PE205 מחוברים ותפר קשור באופן רופף. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: אזור ניסוי וכלים. (A) אזור ניסוי. תא הניסוי ומערכת איסוף הנתונים מוכנים על מיקרוסקופ הפוך סמוך (משמאל). בידוד והרכבה של טרבקולה מתרחשים תחת סטריאוסקופ (מימין). (B) קצוות של שני מלקחיים, מספריים גדולים וקטנים של Vannas, וגשושית זכוכית בהתאמה אישית מוכנים על ידי השריה בתמיסת 10% BSA. (ג) כלי דיסקציה נוספים. צלחת מצופה אלסטומר סיליקון מאפשרת הרכבה של הלב במהלך דיסקציה עדינה. פיפטה העברה של 7 מ"ל עם חתך הקצה מוצגת מתחת לצלחת ובדיקת זכוכית. קצה החיתוך של פיפטת ההעברה מושלך, ובור מוגדל משמש להעברת השריר, עם סיכון מינימלי למתיחה או להתייבשות. (D) תמונה מוגדלת של קצה פיפטת זכוכית, שאורכה כ-2 מ"מ וקוטרה 0.25-0.5 מ"מ. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
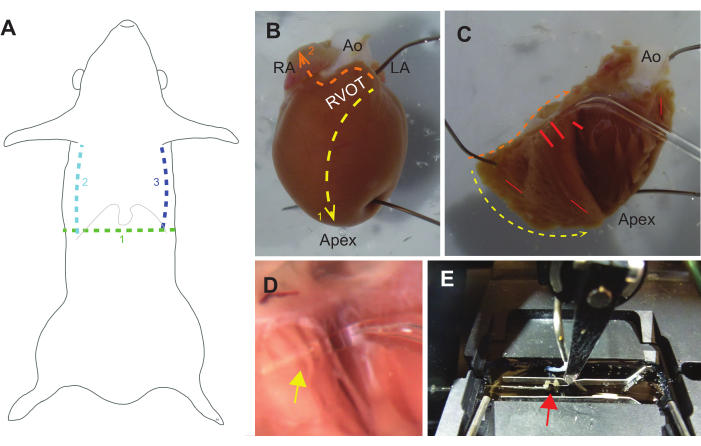
איור 3: מדריך לנתיחה . (A) דיסקציה גסה צריכה להתחיל בחתך רוחבי (1. ירוק) דרך העור לתוך חלל הצפק מתחת לתהליך הקסיפואיד (צלעות תחתונות וקסיפואיד מסומנות בקו אפור דק). חתכים Parasagittal מחלל הצפק במעלה כלוב הצלעות צריך לעקוב (2. teal ו 3. קווים כחולים), ולאחר מכן הסרעפת צריך להיות חתוך. לאחר מכן ניתן להשתמש בהמוסטאט כדי להדק את תהליך הקסיפואיד ולהרים את דופן החזה לכיוון הראש. (B) לב חולדה שלם המוצמד לצלחת סיליקון-אלסטומר, בכיוון של מערכת זרימת החדר הימני (RVOT), אטריום ימני (RA), אבי העורקים (Ao) ואטריום שמאלי (LA). קבוצת החתכים הראשונה צריכה להיות מה-RVOT לקודקוד לאורך המחיצה (1. קו צהוב). קבוצה שנייה של חתכים צריכה להיות מה-RVOT לאורך בסיס הלב ואז מעבר לאטריום הימני (2. קו כתום). (C) ניתן למשוך בזהירות את RVOT מאבי העורקים כדי לפתוח את הלב ולהצמיד אותו בחזרה. קווים צהובים וכתומים מקבילים לחתכים המתוארים ב-B. טרבקולה עומדת מצויה לעיתים קרובות בסמוך לבסיס הדופן החופשית של הקרוואנים וליד המחיצה, אך יכולה להתרחש בכל מקום (קווים אדומים מציינים מיקומים משותפים). (D) תצוגה מוגדלת של גשושית הזכוכית מתחת לטרבקולה (חץ צהוב מציין הצטלבות של טרבקולה ובדיקה). (E) טרבקולה (חץ אדום) מורכבת למערכת הניסוי בין מתמר כוח (שמאל) למנוע (מרכז-ימין), ומשני צדדיה שני מוליכי קצב (אופקיים מעל ומתחת לטרבקולה). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
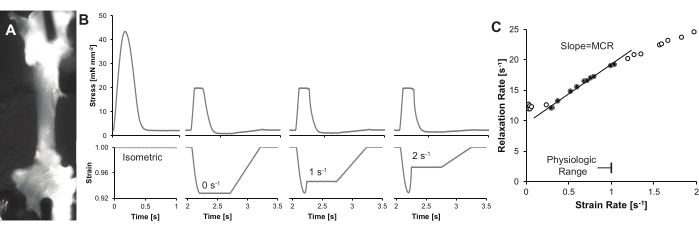
איור 4: עקבות ותוצאות מייצגות . (A) טרבקולה לבבית יחידה המוארת באמצעות נורית LED של צוואר אווז בזווית תלולה (~75°) מציר עדשת המיקרוסקופ, המגבירה את הניגודיות של הטרבקולה. בדוגמה זו, שתי תמונות מוצגות באריחים כדי להציג את האורך המלא של הטרבקולה. (B) עקומות זמן מאמץ (למעלה) וזמן מאמץ (למטה) עבור אותה טרבקולה. עווית איזומטרית, יחד עם שלוש עוויתות מהדק עומס בקצב מאמץ סיסטולי הולך וגדל מוצגים. (ג) חישוב MCR מייצג. MCR מוגדר כשיפוע הגבול בין קצב ההרפיה לקצב המאמץ. כפי שצוין בדיון, שיעורי הזנים עשויים להיות מוגבלים כדי לספק MCR כמותי הניתן לשחזור. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: פתרונות. אנא לחץ כאן כדי להוריד טבלה זו.
Discussion
בקרה מכנית של הרפיה (MCR) מכמתת את התלות של קצב הרפיית שריר הלב בקצב המאמץ של השריר המתקדם להרפיה 8,9. קצב המאמץ, ולא העומס, הוא הכרחי ומספיק כדי לשנות את קצב ההרפיה8. מכיוון שהתערבויות לשינוי קצב הסידן לא הוכחו כמשפרות באופן משמעותי את הרפיית הלב, התערבות מכנית עשויה לספק תובנות חדשות לגבי המנגנון ולספק טיפול חדש לתפקוד דיאסטולי.
הפרוטוקול לשינוי קצב המאמץ של שריר הלב המתואר כאן משתמש במהדק עומס איזוטוני 8,9. חוזק של מהדק העומס האיזוטוני הוא הבקרה הכמותית של לחץ העומס שלאחר מכן. פרוטוקולים דמויי Windkessel יכולים לשמש לבדיקה נוספת של שינויים בעומס לאחר מכן, preload ועבודת לב 2,6,7. רמפה שאינה נשלטת על ידי מהדק העומס יכולה לשמש גם כדי לבודד טוב יותר את השינוי במאמץ מקצב המאמץ. בכל מקרה, העומס עצמו לא נראה כמשנה חזק של קצב ההרפיה8.
הפרוטוקול עשוי להיות מותאם גם כדי להתקרב לתנאים פיזיולוגיים יותר עבור טמפרטורה וקצב קצב. פרטי הפרוטוקול הנוכחי שימשו כדי להראות את נוכחותו של MCR. ביצוע ניסויים בתנאים פיזיולוגיים מומלץ בדרך כלל, בהתאם לשאלת הניסוי. עם זאת, ניסויים המבוצעים ב 37 ° C, או בקצב גבוה, יכול לגרום מהר יותר rundown (נזק) לשריר. ייתכן שיהיה צורך בתמיסה עם יכולת נשיאת חמצן משופרת. יתר על כן, רכישת הנתונים חייבת להיות מסוגלת לדגום את האורך ולאלץ מהר מספיק כדי לפתור את העוויתות המהירות ולספק בקרת משוב.
הפרוטוקול הנוכחי אינו מתאר את מדידת הסידן או מדידה ובקרה של אורכי סרקומר. מדידות סידן טופלו בפרוטוקולים אחרים11, בעוד שניתן להוסיף מדידת אורך סרקומר עם ציוד מתאים. בקרת אורך סרקומר אינה מנוצלת במחקרי MCR הנוכחיים, מכיוון שאורך השריר הוא הפרמטר המתקשר ביותר למצב הקליני19. בקרת אורך סרקומר נוספת (לעומת בקרת אורך שריר) תספק תשובות ספציפיות לשאלות קינטיות, אך לא סביר שתוסיף לידע התרגומי בשל השונות הבין-סרקומרית וההבנה המינימלית של שינויי אורך סרקומר ב-vivo.
שלושה שיקולים ניסיוניים מודגשים כאן כדי להגדיל את יכולת השחזור של הנתונים.
ראשית, טרבקולה לבבית עצמאית עשויה להיות קשה למצוא אצל בעלי חיים מסוימים (תוצאות ותקשורת שלא פורסמו). בעוד שרירי עוויתות ניתן למצוא ברוב החולדות, שיעור הצלחה סביר לקבלת נתונים מטרבקולה בחולדות הוא אחד מכל שלושה. ההצלחה של Trabecula עשויה להיות גבוהה יותר עם חולדות Brown Norway x Lewis F1, שגם בהן נעשה שימוש היסטורי20 ודווח שיש להן יותר trabeculae (תקשורת שלא פורסמה). עבור עכברים, שיעורי ההצלחה צפויים להיות נמוכים יותר, כאשר פחות מאחד מכל 10 צפוי עבור עכברים מרקע BL/6; עם זאת, שיעור גבוה יותר צפוי עבור עכברים מרקע FVBN (תקשורת ותצפיות שלא פורסמו).
שנית, נזק לשרירים יכול להפחית את התפוקה. אם הכוחות המפותחים הם פחות מ 10 mN mm-2 ב 25 ° C ו 0.5 Hz קצב, החוקרים עשויים להזדקק לבצע פתרון בעיות כדי להעריך אם מתיחה בשוגג או מגע בין מלקחיים מתכת שריר מתרחש, אם פתרונות אינם מוכנים כראוי, או אם קצב או ציוד ניסיוני מתפקד כראוי. פרוטוקולים אחרים המשתמשים בטרבקולה שלמה הציעו להשתמש במזרקי Luer-lock ככלי העברה11. בעוד שזה אפשרי, במיוחד אם המשתמש שולט בקצב זרימה איטי מאוד או בקטע שריר קטן יותר, הפרוטוקול הנוכחי משתמש בפיפטת העברת משעמם גדולה בהרבה כדי למזער נזק אפשרי. שלב נוסף שבו עלול להתרחש נזק איסכמי הוא במהלך דיסקציה. אבי העורקים צריך להיות משומר ושטוף עם פתרון זילוח בתוך 3 דקות של חתך הבטן הראשון (חולדה) או נקע צוואר הרחם (עכבר), בדומה לגבולות המפורטים בפרוטוקולי בידוד קרדיומיוציטים21,22. זה ממזער את הזמן שבו רקמת הלב אינה נחשפת לתמיסת זילוח דמוית קרדיופלגיה. יתר על כן, דיסקציות הנמשכות יותר מ -30 דקות בדרך כלל אינן מייצרות טרבקולה מעוותת. לכן, המפעילים צריכים לתרגל דיסקציה מהירה אך זהירה כדי למזער נזקים. שטח חתך מעל 0.2 מ"מ 2 (2 x 10-7 מ ') עלול לסבול מאיסכמיה ליבה20.
שלישית, יש לקחת בחשבון את האופן שבו השרירים מחוברים למתמר המנוע והכוח. פרוטוקול זה מתמקד כיום בווים ובטרבקולה העומדת בפני עצמה. קצב המאמץ המהיר לפעמים של המתיחה לפני הרפיה יכול לגרום לשריר להחליק אם לא מודבק כראוי, ולכן הפרוטוקול הנוכחי אינו משתמש ב"סלים" כדי להחזיק את הטרבקולה23,24. ניתן לשקול ולאמת גם שיטות הרכבה חלופיות (דבקים, קליפסים וכו '25,26). הפרוטוקול המתואר כאן משתמש בטרבקולה ולא בשרירי פפילרי. האקורדים של שריר הפפילרי גורמים לגמישות סדרתית שיכולה לעכב שינויים ב-MCR9. עם זאת, המיקום המדויק של החיבורים בשריר לא צפוי להשפיע על המדדים, מכיוון שאורך (וקוטר) הטרבקולה משתנים באופן משמעותי.
מגבלה של פירסינג בקצוות השריר עם ווים היא שגם נקודת ההרכבה עצמה יכולה להיפגע. קרע אפשרי של רקמת השריר המודבקת עם התכווצויות תכופות (בהתאם לחוזק שלהם) עשוי לשנות את אורך או גמישות הסדרה. קצב קריעה זה קשה לשליטה. באופן דומה, נזק לרקמה ולקרס יכול להחמיר במהלך המתיחה, גם הוא עלול לגרום לבעיות. יש להשתמש בבדיקה חזותית, ובערכי הכוח המפותח שנותרו >80% מהכוח האיזומטרי שיווי משקל, כדי להעריך אם התכשיר פגום ויש לשלול אותו.
מגבלה או שיקול נוסף משפיע על שאלות הניסוי שניתן לענות עליהן באמצעות השיטה. לדוגמה, שקול את השימוש של 2,3-butanedione monoxime (BDM) בתמיסת זילוח. BDM הוא phosphatase, אשר עשוי לשנות את תפקוד השריר. בנוסף, התקופה הארוכה של פריקה וחוסר קצב פירושה שמצב הזרחן הסמוי השתנה ככל הנראה. לכן, יש לנקוט משנה זהירות אם מנסים להעריך ישירות את התכווצות השרירים של בעל חיים (לעומת הבדלים בין גנוטיפים או טיפולים), שכן מצב ההתכווצות השתנה ככל הנראה. עם זאת, ההשפעה של זרחן ניתן להעריך פרמקולוגית על ידי הוספת אגוניסט או אנטגוניסט של המסלול.
לסיכום, MCR מספק תובנה כיצד הרפיה מווסתת על ידי תנועת שרירים (קצב מאמץ). MCR עשוי לעזור לספק תובנה טובה יותר לגבי אבחון וניטור של מחלות דיאסטוליות, יחד עם מטרות להתערבות פרמקולוגית, כגון שינוי קינטיקה מיוזין. הפרוטוקול והעצות המתוארים כאן פורסים ידע שפותח במשך מספר שנים של ניסויים, וצריכים להיות ישימים למערכות ומודלים אחרים של מחלות לב.
Disclosures
ללא.
Acknowledgements
עבודה זו נתמכת על ידי המכונים הלאומיים לבריאות (1R01HL151738) ואיגוד הלב האמריקאי (18TPA34170169).
Materials
| Name | Company | Catalog Number | Comments |
| 18 or 16 gauge blunted needle/canula | for cannulation of rat aorta, use 1mm of PE160 or PE205 tubing as stop | ||
| 2,3-Butanedione Monoxime | Sigma-Aldrich | B0753-25G | |
| 23 gauge blunted needle/canula | for cannulation of mouse aorta, use 1mm of PE50 tubing as stop | ||
| 5 mL syringe | BD Luer-Lock | 309646 | |
| 95% Oxygen/5% CO2 | AirGas | Z02OX9522000043 | |
| Anethesia system | EZ Systems | EZ-SA800 | Can use any appropriate anethesia method/system |
| Bovine Serum Albumin | Fisher BioReagents | BP-1600 | to coat tips of fine forcepts, scissors |
| Calcium Chloride Dihydrate | Fisher Chemical | C79-500 | |
| Containers/dissection dishes | FisherBrand | 08-732-113 | Weigh dishes for creating dissection plates |
| Crile Hemostat | Fine Science Tools | 13005-14 | for mouse gross dissection |
| D-(+)-Glucose | Sigma-Aldrich | G8270-1KG | |
| Data acquisition software | SLControl | ||
| Data acquisition system | MicrostarLabs | DAP5216a | Can use any DAQ. This is a PCI based data acqusition for use with SLControl; must have a PC with a PCI slot |
| Data analysis software | Mathworks | Matlab | Custom Script |
| Dumont #3 Forceps | Fine Science Tools | 11231-30 | 2x for cannulation of aorta |
| Dumont #5 Forceps | Fine Science Tools | 11254-20 | 2x for trabecula isolation |
| Experimental system | Aurora Scientific | 801C | Can use any appropriate experimental chamber with force and length control |
| Fine Scissors, curved | Fine Science Tools | 14061-09 | for removal of heart |
| Gooseneck Piggyback Illuminator | AmScope | LED-6WA | |
| HEPES | Sigma-Aldrich | H3375-250G | |
| Imaging software | IrfanView | ||
| Iris Forceps | World Precision Instruments | 15915 | for removal of heart |
| Isoflurane | VetOne | 502017 | |
| Magnesium Chloride Hexahydrate | Sigma-Aldrich | M2670-100G | |
| Magnesium Sulfate | Sigma-Aldrich | M7506-500G | |
| Mayo Scissors | Fine Science Tools | 14110-15 | for rat gross dissection |
| Metzenbaum Scissors | Fine Science Tools | 14116-14 | for mouse gross dissection |
| Microscope connected camera | Flir | BFS-U3-27S5M-C | Includes acquisition software |
| Microscope/digital imaging system | Olympus | IX-73 | Can use any appropriate microscope. Needed to measure muscle length, cross sectional area |
| Mounting Pin/Needle | BD PrecisionGlide | 305136 | For holding heart to dish. 27 G x 1-1/4 |
| Mounting Pin/Needle | Fine Science Tools | 26000-40 | For holding heart to dish. 0.4mm diameter insect pin (Alt to 27G needle) |
| Oxygen (O2) | AirGas | OX USP300 | |
| Peristaltic Pump | Rainin | Rabbit | Can be any means to create flow in experimental chamber |
| pH and Oxygen sensor | Mettler Toledo | SevenGo pH and DO | |
| Potassium Bicarbonate | Sigma-Aldrich | 237205-100G | |
| Potassium Chloride | Fisher Chemical | P217-500 | |
| Potassium Phosphate Monobasic | Sigma-Aldrich | 795488-500G | |
| Rochester-pean Hemostat | World Precision Instruments | 501708 | for rat gross dissection |
| Silk Suture, Size: 4/0 | Fine Science Tools | 18020-40 | cut to ~1.5 inch pieces, soaked in water |
| Sodium Bicarbonate | Sigma-Aldrich | S6297-250G | |
| Sodium Chloride | Sigma-Aldrich | S9888-1KG | |
| Sodium Hydroxide | Sigma-Aldrich | S8045-500G | |
| Sodium Phosphate Dibasic | Sigma-Aldrich | S7907-100G | |
| Stereomicroscope | AmScope | SM-1TX | |
| Student Vannas Spring Scissors | Fine Science Tools | 91500-09 | for opening of the RV |
| SYLGARD 184 Silicone Elastomer Base | Dow Corning | 3097358-1004 | For creating dissection plates |
| Syringe Holder | Harbor Frieght | Helping Hands 60501 | Can be used as alternate for ring stand |
| Taurine | Sigma-Aldrich | T0625-1KG | |
| Transfer Pipette | FisherBrand | 13-711-7M | cut ~1" from tip to widen bore |
| Vannas Spring Scissors | Fine Science Tools | 15000-00 | for trabecula isolation |
References
- Iribe, G., Helmes, M., Kohl, P. Force-length relations in isolated intact cardiomyocytes subjected to dynamic changes in mechanical load. American Journal of Physiology. Heart and Circulatory Physiology. 292 (3), 1487-1497 (2007).
- Dowrick, J. M., et al. Work-loop contractions reveal that the afterload-dependent time course of cardiac Ca(2+) transients is modulated by preload. Journal of Applied Physiology. 133 (3), 663-675 (2022).
- ter Keurs, H. E., Rijnsburger, W. H., van Heuningen, R., Nagelsmit, M. J. Tension development and sarcomere length in rat cardiac trabeculae. Evidence of length-dependent activation. Circulation Research. 46 (5), 703-714 (1980).
- Sonnenblick, E. H. Force-velocity relations in mammalian heart muscle. The American Journal of Physiology. 202, 931-939 (1962).
- Brutsaert, D. L., Rademakers, F. E., Sys, S. U. Triple control of relaxation: implications in cardiac disease. Circulation. 69 (1), 190-196 (1984).
- Taberner, A. J., Han, J. C., Loiselle, D. S., Nielsen, P. M. F. An innovative work-loop calorimeter for in vitro measurement of the mechanics and energetics of working cardiac trabeculae. Journal of Applied Physiology. 111 (6), 1798-1803 (2011).
- De Tombe, P. P., Little, W. C. Inotropic effects of ejection are myocardial properties. Am J Physiol. 266, 1202-1213 (1994).
- Chung, C. S., Hoopes, C. W., Campbell, K. S. Myocardial relaxation is accelerated by fast stretch, not reduced afterload. Journal of Molecular and Cellular Cardiology. 103, 65-73 (2017).
- Schick, B. M., et al. Reduced preload increases Mechanical Control (strain-rate dependence) of Relaxation by modifying myosin kinetics. Archives of Biochemistry and Biophysics. 707, 108909 (2021).
- Parikh, S. S., Zou, S. Z., Tung, L. Contraction and relaxation of isolated cardiac myocytes of the frog under varying mechanical loads. Circulation Research. 72 (2), 297-311 (1993).
- Dowrick, J. M., et al. Simultaneous brightfield, fluorescence, and optical coherence tomographic imaging of contracting cardiac trabeculae ex vivo. Journal of Visualized Experiments. (176), e62799 (2021).
- Wiggers, C. J. Studies on the consecutive phases of the cardiac cycle I. The duration of the consecutive phases of the cardiac cycle and the criteria for their precise determination. American Journal of Physiology-Legacy Content. 56 (3), 415-438 (1921).
- Rosen, B. D., et al. Late systolic onset of regional LV relaxation demonstrated in three-dimensional space by MRI tissue tagging. American Journal of Physiology. Heart and Circulatory Physiology. 287 (4), 1740-1746 (2004).
- Saito, M., et al. The differences in left ventricular torsional behavior between patients with hypertrophic cardiomyopathy and hypertensive heart disease. International Journal of Cardiology. 150 (3), 301-306 (2011).
- Monasky, M. M., Biesiadecki, B. J., Janssen, P. M. L. Increased phosphorylation of tropomyosin, troponin I, and myosin light chain-2 after stretch in rabbit ventricular myocardium under physiological conditions. Journal of Molecular and Cellular Cardiology. 48 (5), 1023-1028 (2010).
- Raff, G. L., Glantz, S. A. Volume loading slows left ventricular isovolumic relaxation rate. Evidence of load-dependent relaxation in the intact dog heart. Circulation Research. 48, 813-824 (1981).
- Matsubara, H., Takaki, M., Yasuhara, S., Araki, J., Suga, H. Logistic time constant of isovolumic relaxation pressure-time curve in the canine left ventricle. Better alternative to exponential time constant. Circulation. 92 (8), 2318-2326 (1995).
- Chung, C. S., Kovacs, S. J. Physical determinants of left ventricular isovolumic pressure decline: model prediction with in vivo validation. American Journal of Physiology. Heart and Circulatory Physiology. 294 (4), 1589-1596 (2008).
- Campbell, K. B., Kirkpatrick, R. D., Tobias, A. H., Taheri, H., Shroff, S. G. Series coupled non-contractile elements are functionally unimportant in the isolated heart. Cardiovascular Research. 28 (2), 242-251 (1994).
- Raman, S., Kelley, M. A., Janssen, P. M. Effect of muscle dimensions on trabecular contractile performance under physiological conditions. Pflugers Archiv: European Journal of Physiology. 451 (5), 625-630 (2006).
- Czeiszperger, T. L., Wang, M. P., Chung, C. S. Membrane stabilizer Poloxamer 188 improves yield of primary isolated rat cardiomyocytes without impairing function. Physiol Rep. 8 (4), 14382 (2020).
- Louch, W. E., Sheehan, K. A., Wolska, B. M. Methods in cardiomyocyte isolation, culture, and gene transfer. Journal of Molecular and Cellular Cardiology. 51 (3), 288-298 (2011).
- Loiselle, D. S., Johnston, C. M., Han, J. C., Nielsen, P. M. F., Taberner, A. J. Muscle heat: a window into the thermodynamics of a molecular machine. American Journal of Physiology. Heart and Circulatory Physiology. 310 (3), 311-325 (2016).
- de Tombe, P. P., ter Keurs, H. E. Force and velocity of sarcomere shortening in trabeculae from rat heart. Effects of temperature. Circulation Research. 66 (5), 1239-1254 (1990).
- Palmer, B. M., Bell, S. P. Preparing excitable cardiac papillary muscle and cardiac slices for functional analyses. Frontiers in Physiology. 13, 817205 (2022).
- Brunello, E., et al. Myosin filament-based regulation of the dynamics of contraction in heart muscle. Proceedings of the National Academy of Sciences. 117 (14), 8177-8186 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved