Method Article
Construcción de un olfatómetro para estudios de comportamiento olfativo de roedores
En este artículo
Resumen
Este protocolo describe la construcción de un olfatómetro para experimentos de comportamiento olfativo de pasa/no pasa. Se proporcionan instrucciones paso a paso, junto con imágenes, para garantizar la construcción exitosa del olfatómetro. También se incluye información para solucionar los problemas encontrados durante el proceso.
Resumen
El uso de olfatómetros para estudiar el comportamiento y la actividad cerebral de los roedores durante las tareas olfativas es crucial para comprender los circuitos cerebrales. Estos sofisticados dispositivos permiten a los investigadores controlar y administrar con precisión los estímulos de olor, lo que permite la investigación de procesos olfativos complejos en roedores. Aunque los olfatómetros disponibles en el mercado son convenientes, presentan desafíos cuando surgen problemas técnicos, que a menudo requieren asistencia costosa y pueden interrumpir los plazos de investigación. Este artículo detalla la construcción de un olfatómetro personalizado diseñado específicamente para experimentos de comportamiento olfativo con ratones, proporcionando una lista completa de partes e instrucciones paso a paso. El olfatómetro se controla a través de MATLAB, lo que ofrece una interfaz fácil de usar para los investigadores. Es importante destacar que el código abierto permite a los usuarios modificar y adaptar el sistema, adaptando las tareas de comportamiento para satisfacer necesidades experimentales específicas. La creación de un olfatómetro personalizado dota a los usuarios de los conocimientos y la capacidad necesarios para realizar un diseño experimental personalizado y solucionar problemas de forma independiente, lo que ahorra tiempo y recursos. Este enfoque no solo mejora la flexibilidad de la investigación, sino que también fomenta una comprensión más profunda de la funcionalidad del equipo, lo que en última instancia conduce a estudios olfativos más sólidos y confiables en roedores.
Introducción
Los intrincados mecanismos que subyacen a la toma de decisiones olfativas ofrecen una visión fascinante de la notable complejidad del sistema de procesamiento sensorial del cerebro 1,2,3. Dentro del bulbo olfativo de los ratones, una amplia gama de neuronas sensoriales olfativas convergen en aproximadamente 2.200 glomérulos, cada uno inervado por neuronas que expresan el mismo receptor olfativo4. Sorprendentemente, incluso los odorantes sintéticos individuales pueden estimular una parte sustancial de los aproximadamente 1.100 receptores olfativos en ratones 5,6. Sin embargo, el desafío va más allá de la detección inicial de odorantes. La dinámica temporal de la llegada del odorante, influenciada por el acto rítmico de olfatear, enriquece aún más el paisaje sensorial, añadiendo capas de información para que el cerebro la descifre. Agravado por la complejidad de los estímulos naturales, como la orina conespecífica, que contiene cientos de odorantes, el sistema olfativo se enfrenta a la formidable tarea de desentrañar los intrincados patrones de activación glomerular para diferenciar entre varios olores 7,8.
Para abordar este desafío, el cerebro orquesta la actividad neuronal en múltiples regiones, incluida la corteza piriforme, la corteza entorrinal lateral, el hipocampo, el tubérculo olfativo, la corteza prefrontal e incluso el cerebelo 9,10,11,12,13,14. Dentro de estos circuitos, las células piramidales de la corteza piriforme integran y modulan la información transmitida por las células mitrales, mientras que otras áreas del cerebro contribuyen con funciones únicas en la formación de la percepción olfativa 15,16,17. Además, el procesamiento de los estímulos olfativos por parte del cerebro está influenciado dinámicamente por factores contextuales, lo que subraya la adaptabilidad y sofisticación del proceso de toma de decisiones olfativas.
Este artículo describe la construcción de un olfatómetro personalizado que permite la evaluación controlada por computadora del rendimiento conductual de ratones que se mueven libremente y que participan en una tarea de pasa/no pasa. En esta tarea de aprendizaje asociativo, el ratón privado de agua inicia una prueba lamiendo un pico de suministro de agua ubicado dentro de un cono nasal de suministro de odorante. Uno de los dos odorantes se administra entre 1 y 1,5 s después de que el animal inicia el ensayo. Si el odorante es el odorante recompensado (S+), el ratón recibe una recompensa de agua si lame al menos una vez en cada una de las cuatro ventanas de tiempo de 0,5 s (un Hit). De lo contrario, el ratón no recibe ninguna recompensa (Miss). Si el animal recibe el odorante no recompensado (S-), no se entrega ninguna recompensa, y si el ratón lame en cada una de las cuatro ventanas de tiempo (Falsa Alarma, FA), se impone un retraso de tiempo antes del inicio de la siguiente prueba. Si el animal no logra lamer en una de las ventanas de tiempo, la prueba se cuenta como un rechazo correcto (RC) y no se aplica ningún retraso de tiempo. El porcentaje de rendimiento correcto se calcula como el porcentaje de pruebas en las que el ratón obtiene un Hit o CR en una ventana de veinte pruebas:
Porcentaje correcto = 100 ((Hit + CR) / 20)
Hay dos cuestiones clave para garantizar el correcto funcionamiento de los olfatómetros diseñados para evaluar el comportamiento olfativo de pasa/no pasa. En primer lugar, el olfatómetro debe monitorizar las respuestas del ratón en tiempo real para ofrecer recompensas de olor y agua en consecuencia. Este olfatómetro se logra mediante el monitoreo de lamidos, ya sea midiendo la resistencia entre la tromba marina y el piso de la cámara o detectando la capacitancia18. A continuación, un programa de MATLAB utiliza esta información para tomar decisiones sobre la entrega de odorante y la recompensa del agua. El segundo problema es la necesidad de un suministro de odorante fiable y reproducible. Este olfatómetro se logra accionando válvulas que equilibran el aire saturado de odorante con el aire portador, que luego se suministra a un cono de nariz. El aire se equilibra con el odorante burbujeándolo a través de una solución odorante diluida en aceite mineral. La concentración del odorante se mide con un detector de fotoionización y puede calcularse con base en la presión de vapor y el coeficiente de actividad, siguiendo los procedimientos descritos por Williams y Dewan18,19.
Protocolo
Todos los experimentos se llevaron a cabo de acuerdo con los protocolos aprobados por el Comité Institucional de Cuidado y Uso de Animales del Campus Médico Anschutz de la Universidad de Colorado. Los animales utilizados en este estudio fueron ratones machos CaMKIIα WT, de dos meses de edad en el momento de la implantación del tetrodo. Los detalles de los reactivos y equipos utilizados en este estudio se proporcionan en la Tabla de Materiales.
1. Placa y soldadura de pulsadores momentáneos unipolares y de un solo tiro (SPST)
- Obtenga el zócalo blanco hecho a medida con orificios para sujetar los bastidores para válvulas de olor, medidores de flujo, placa SSR48 y otros componentes que se muestran en la Figura 1A.
NOTA: El zócalo blanco utilizado en este estudio fue producido por el Taller de Máquinas del Centro de Neurotecnología en el Campus Médico de CU Anschutz (Figura 1A). Los archivos de diseño están disponibles en - Agregue tornillos de 1 pulgada y espaciadores de 3/4 de pulgada para colocar el SSR48-RACK. Los tornillos se encuentran en la parte superior derecha de la parte posterior de la pizarra (Figura 1A).
- Monte el SSR48-RACK. El SSR48-RACK se ubicará en la parte superior izquierda de la parte posterior de la pizarra (Figura 1C).
- Haga agujeros (0,4 cm) para colocar los bloques de regletas de terminales de tornillo en la parte posterior de la pizarra. Los bloques de regletas de terminales de tornillo se ubicarán en el centro derecho de la parte posterior de la pizarra (Figura 1D).
- De arriba a abajo: El primer bloque de regletas de terminales de 4 tornillos se utilizará para conectar cables de 24 V. El siguiente bloque de regletas de terminales de tornillo se utilizará para cables de 5 V. Deje vacío un bloque de regleta de terminales de tornillo y el último bloque de regleta de terminales de 4 tornillos se utilizará para conectar los cables de tierra.
- Taladre orificios (0,8 cm) en la caja de control para colocar los interruptores de botón momentáneos SPST. La caja de control se ubicará en la parte inferior delantera de la pizarra (Figura 1E).
- Configure los interruptores de botón pulsador momentáneos SPST. Suelde dos cables al interruptor de botón momentáneo SPST. Es preferible utilizar dos colores diferentes, como el rojo y el negro o el verde (Figura 1F).
- Conecte el interruptor de botón momentáneo SPST a la caja de control. Los botones pulsadores vienen con una tuerca que se utiliza para sujetarla a la caja negra de control (Figura 1G).
- Asegure los cables retorciéndolos o asegurándolos con cinta adhesiva para mantenerlos juntos y organizados.
NOTA: La alimentación de 24 V se utiliza para alimentar las válvulas de pellizco y las válvulas de olor, y la alimentación de 5 V se utiliza para el circuito de lamido. - Coloque las válvulas de olor en las ranuras del estante de la válvula de olor ubicadas en el centro de la pizarra blanca (Figura 2A).
- Pela los cables que salen de las válvulas y suelda un cable de cada válvula a un cable más grueso. Coloque un cable en el suelo en los bloques de regletas de terminales de tornillo en la parte posterior de la pizarra blanca y un segundo cable en el pin correspondiente en el SSR48-RACK. Por ejemplo, la válvula de olor 1 va al pin 1, la válvula de olor 2 va al pin 2, etc. (Figura 2B).
- Conecte los pines 1 a 8 del SSR48-RACK a dos válvulas de manguito cada uno (válvulas de entrada y salida para los viales de equilibrio de aceite mineral). Para cada válvula, conecte un cable de un botón pulsador a la alimentación de 24 V y el otro cable al pin del SSR48-RACK que está conectado a la válvula. El otro cable va desde la válvula hasta la tierra. Consulte la Figura 2B, C para colocar los cables en su lugar.
- Coloque la válvula de agua y la válvula final en las ranuras correspondientes de la placa de la válvula. La ranura se encuentra en el centro de la pizarra. Vea la placa de la válvula en la Figura 1 y la ubicación de las válvulas en la Figura 3A.
- Conecte la válvula de agua y la válvula final a tierra y a los pines 17 y 18, respectivamente, en el SSR48-RACK. Conecte los pulsadores a 24 V y a los pines 17 y 18 (Figura 2B).
2. Fuente de alimentación
- Compre una fuente de alimentación y un cable de extensión. La información sobre el tipo específico de fuente de alimentación se puede encontrar en la Tabla de materiales. La fuente de alimentación proporcionará salidas de 24 V (V3) y 5 V (V1) y conexión a tierra al olfatómetro.
- Corte el enchufe del cable de alimentación de la fuente de alimentación. En concreto, la parte hembra del cable de extensión. Una vez cortado, se pueden ver tres cables. El cable verde está conectado a G (tierra) en la fuente de alimentación, y los otros dos cables (blanco y negro) están conectados a L y N, respectivamente, de la entrada de CA de 120 V a la fuente de alimentación (Figura 3B).
PRECAUCIÓN: Los cables de alimentación de 120 V están expuestos y existe el riesgo de lesiones por descarga eléctrica. Lo mejor es cubrirlo con un aislante. - Corte un extremo del cable que alimenta el SSR48-RACK. Conecte uno de los cables al tornillo G de la fuente de alimentación y el segundo al V1 de la fuente de alimentación (Figura 3C).
- En la fuente de alimentación, conecte un cable de G2 a tierra en los bloques de regletas de terminales de tornillo (Figura 2C).
- En la fuente de alimentación, conecte un cable de V1 a los bloques de regletas de terminales de tornillo de 5 V (Figura 2C).
- En la fuente de alimentación, conecte un cable de V3 a los bloques de regletas de terminales de tornillo de 24 V (Figura 2C).
3. Placa de sensor Lick
- Obtenga una placa de pruebas de 400 puntos de conexión y coloque un cable que se conecte desde los puntos de conexión B7 a B15 (Figura 3D).
- Conecte un extremo de un cable al punto de conexión 6+ y el otro extremo al punto de conexión C22 de la placa de pruebas (Figura 3D).
- Conecte un extremo en D16 y el segundo extremo en G22 de la placa de pruebas (Figura 3D).
- Conecte un extremo de un cable a la ranura I22 y el segundo extremo a 29- de la placa de pruebas (Figura 3D).
- Conecte un extremo de un cable a la ranura 20A y el segundo extremo a 29A de la placa de pruebas (Figura 3D).
- Conecte un extremo de un cable al 21B y el segundo extremo al 28B de la placa de pruebas (Figura 3D).
- Conecte un extremo de un cable a la ranura 1+ de la placa de pruebas y el segundo extremo a los 5 V de los bloques de regletas de terminales de tornillo (Figura 3D).
- Conecte un extremo de un cable a la ranura 1- de la placa de pruebas y el segundo extremo a la tierra de los bloques de regletas de terminales de tornillo (Figura 3D).
- Conecte un extremo de un cable a la ranura C7 de la placa de pruebas y el segundo extremo al pin 27 del SSR-48RACK (Figura 3D).
- Conecte un extremo de un cable a la ranura 28C de la placa de pruebas, y el segundo extremo tendrá una pinza de cocodrilo adjunta que se conectará a la parte metálica de la tromba marina (Figura 3D).
- Conecte un extremo de un cable a la ranura 20B de la placa de pruebas y el otro extremo al terminal central del potenciómetro (Figura 3D). Los dos terminales conectados a los elementos de resistencia del potenciómetro están conectados a tierra y 5 V. El terminal central está conectado a la placa de pruebas.
- Obtener resistencias de 21 mΩ. Para el primero, conecte un extremo a 19A y el segundo extremo a 20D. Para el segundo, conecte un extremo a 22C y el otro extremo a 21D. Conéctelo al potenciómetro (Figura 3D).
- Obtenga una resistencia de kΩ. Conecte un extremo a 14C y el segundo extremo a 19C. Conéctelo al potenciómetro (Figura 3D).
- Obtenga una resistencia de 120 Ω. Conecte un extremo a 7D y el segundo extremo a 7H (Figura 3D).
- Obtén una luz LED. El color no importa. Conecte un cable LED a 7J y el segundo cable a 6- (Figura 3D).
- Obtener dos amplificadores operacionales (amplificadores operacionales). Las conexiones para el primero son E10 a E16, F10-F16 (Figura 3D).
4. Suministro de aire y agua
- Coloque dos caudalímetros (uno de 2 L/min y otro de 50 cc/min) en los soportes del caudalímetro. La Figura 4A muestra el sistema de flujo de aire general y la Figura 4B muestra la vista ampliada de los medidores de flujo.
- Obtenga una bomba de acuario para proporcionar un flujo de aire de 2 L / min. El modelo de bomba de acuario utilizado aquí tiene dos salidas (ver Tabla de Materiales). Conecte un pequeño trozo de tubo de cada una de las dos salidas de la bomba del acuario a las dos entradas de un conector en T (Figura 4B).
- Conecte un trozo de tubería desde la salida del conector T hasta la entrada de un filtro de carbón activo (Figura 4B).
- Conecte la tubería desde la salida del filtro de carbón a un conector en T y conecte las dos salidas del conector a una válvula de bola para ajustar el caudal de aire (Figura 4C).
- Conecte la salida de cada válvula de bola a la entrada de los medidores de flujo (Figura 4D).
- Conecte la salida del medidor de flujo de 50 cm/min al colector superior, proporcionando aire a los viales de equilibrio de olores de 40 mL con odorantes diluidos en aceite mineral (Figura 4E).
- Conecte la salida de cada vial de olor a la entrada correspondiente en el colector inferior.
- Los tubos que conectan los viales de olor a los colectores son tubos de válvula de pellizco que se abren mediante las dos válvulas de pellizco separadas. Coloque el tubo en las válvulas de apriete.
- Conecte la salida del caudalímetro de 2 L/min a la entrada de la entrada lateral del colector inferior.
- Conecte la salida del colector inferior a la entrada de la válvula final (de desvío) (Figura 4F).
- Conecte la salida de encendido predeterminada de la válvula final al tubo de suministro de olores en la cámara de paso / no salida. Conecte la salida de apagado predeterminada de la válvula final a un tubo de escape (Figura 4G). Esto da como resultado un flujo de aire continuo no odorizado de 2 L/min cuando la válvula final está cerrada.
- Para cada prueba, asegúrese de que la válvula final se abra cuando el animal lama, llevando el aire al escape, y simultáneamente se encienda la válvula de olor. Esto da como resultado el equilibrio del olor en el flujo de aire de fondo.
- Después de 1-1,5 s, asegúrese de que la válvula final se apague, desviando el aire de regreso a la cámara. Esto da como resultado un fuerte aumento en la concentración de odorante. Después de 2,5 s, la válvula de olor se apaga y la concentración de olor vuelve a 0.
- Conecte una aguja de 18 g a la punta de la jeringa de 5 ml que se utilizará para administrar la recompensa de agua (Figura 4H).
- Conecte un tubo (2 mm de diámetro) a la punta de la aguja (Figura 4H).
- Conecte el otro extremo del tubo a la entrada de la válvula de agua. Es posible que sea necesario cortar un tubo de un diámetro diferente para que se ajuste a la entrada de la válvula de agua (Figura 4I).
- Conecte el tubo desde la salida de la válvula de agua hasta la boquilla (Figura 5A).
5. Conexión del olfatómetro al ordenador e instalación del software
- Conecte el SSR48-RACK al DIO96H/50 con un conector hembra a hembra de 100 pines. Conecte el cable USB del DIO96/H50 al ordenador (Figura 5B).
- Descargue la última versión del software y los controladores mccdaq e InstaCal.
NOTA: InstaCal es el programa que prueba la comunicación entre el ordenador y el DIO96/H50. Descargue el software y los controladores más recientes aquí: https://www.mccdaq.com/software-downloads.aspx. - Ejecuta InstaCal. Asegúrese de que el "Bus Serial Universal" indique la placa # como el número correcto, generalmente #1 = Placa #1 USB-DIO96H/50.
- Descargue MATLAB.
- Descargue los programas de MATLAB para ejecutar el olfatómetro desde https://github.com/restrepd/dropc.
- Abra MATLAB como administrador y establezca la ruta para que MATLAB reconozca los programas. En la pestaña Inicio del entorno de MATLAB, haga clic en Establecer ruta en la sección Entorno. Se abrirá un cuadro de diálogo en el que puede añadir carpetas en la ruta de búsqueda.
- Ejecute daqregister('mcc'). Cambie el número de placa en dropcInitializePortsNow.m.
NOTA: handles.dio = digitalio('mcc',1); %(1 o 0 dependiendo del ordenador). - Pruebe dropcspm.m realizando un simulacro en el que el usuario "responde" a cada prueba conectando el bucle eléctrico entre la boquilla de lamida y el piso metálico de la cámara que está conectada a tierra.
NOTA: El olfatómetro ya está listo para usar. La información sobre cómo entrenar al ratón se encuentra en Nicole Arévalo et al.20.
6. Experimentos con animales
- Prepare cuidadosamente a los sujetos animales para comenzar el proceso experimental. Pese cada ratón individualmente con una báscula calibrada y registre el peso en un registro de laboratorio. Monitoree estos datos cruciales a lo largo del estudio para realizar un seguimiento de la salud de los animales y abordar cualquier cambio de peso con prontitud.
- Coloque los ratones suavemente en la cámara del ratón especialmente diseñada después de pesarlos. Activar los sensores y sistemas de entrega de estímulos para la tarea de discriminación olfativa. Asegúrese de que la cámara minimice el estrés en los animales mientras mantiene un control preciso de las condiciones experimentales.
- Asegúrese de que el animal esté cómodo en la cámara. Inicie el programa MATLAB para controlar parámetros experimentales como la entrega de estímulos de olor (2,5 s), la dispensación de agua y el registro de respuestas. Analice los datos en tiempo real para obtener información inmediata sobre el rendimiento del animal.
- Monitorizar y analizar el rendimiento del animal de forma continua. Observe la puntuación de competencia calculada en función del porcentaje de respuestas correctas. Trate de que cada animal alcance una puntuación de rendimiento de 80 o más, que marca el umbral para la competencia en la tarea.
- Comience la nueva fase del experimento una vez que el animal logre consistentemente una puntuación de competencia de 80 o más, lo que indica el dominio de la discriminación inicial del par de olores. Invierte el par de olores, dejando sin recompensa el aroma previamente recompensado y viceversa.
- Pruebe la flexibilidad cognitiva del animal y su capacidad para desaprender y volver a aprender asociaciones, obteniendo así información valiosa sobre la plasticidad del aprendizaje olfativo en ratones.
Resultados
Siguiendo el protocolo descrito aquí, se puede configurar un olfatómetro para probar el comportamiento de los ratones para diferenciar entre olores. La Figura 6A muestra el comportamiento de un ratón durante el primer día de entrenamiento en la tarea de pasa/no pasa, utilizando acetato de etilo como odorante S+ y una combinación de acetato de etilo y acetato de propilo como S-. El porcentaje de aciertos se calcula como el porcentaje de ensayos en los que el ratón anota un acierto o un rechazo correcto. Inicialmente, el ratón comenzó con un 50% de precisión porque lamía en respuesta a ambos odorantes. Sin embargo, después de varios intentos, aprendió a lamer solo para el S+ y dejó de lamer para el S-. La Figura 6B muestra el porcentaje correcto para el último día de la tarea de avance/no avance, donde el animal alcanzó la competencia con un rendimiento del 80% o más. En este punto, los odorantes se invirtieron (REV), con acetato de etilo como odorante S- y la combinación de acetato de etilo y acetato de propilo como S+. La figura 6C muestra el porcentaje de aciertos en el primer día de la tarea de pasa/no pasa en la dirección inversa, donde el rendimiento del mouse cayó al 10%. F muestra el rendimiento del ratón en el último día de reversión, donde volvió a alcanzar la competencia.

Figura 1: Parte frontal de la pizarra blanca del olfatómetro y cableado. (A) Las dimensiones del olfatómetro son 22" de ancho x 16" de alto x 8,5" de profundidad, mostradas sin cableado ni placas de interfaz/lamido, tal como se entregaron desde el taller de la máquina. Los orificios están preperforados para las válvulas de olor, los termómetros, las válvulas de agua y finales, la jeringa de agua, el estante de botellas de olor, el estante de válvulas de olor y la cámara del ratón. (B) El olfatómetro preparado con los 8 pernos necesarios para montar el SSR48-RACK en la parte posterior izquierda. (C) Uftometómetro con SSR48-RACK montado, incluidos los relés adjuntos. (D) Bloques de regletas de terminales de tornillo agregados al olfatómetro, con secciones designadas para 12 V, 5 V y tierra. (E) Caja negra de control con orificios perforados para interruptores de botón pulsador momentáneos SPST, con cinta adhesiva que etiqueta cada botón mediante control de válvula. (F) Interruptor de botón pulsador momentáneo SPST con dos cables de tubo retráctil codificados por colores soldados para proteger las áreas expuestas. (G) Interruptor de botón momentáneo SPST montado en la caja negra de control y asegurado con la tuerca hexagonal incluida. Haga clic aquí para ver una versión más grande de esta figura.
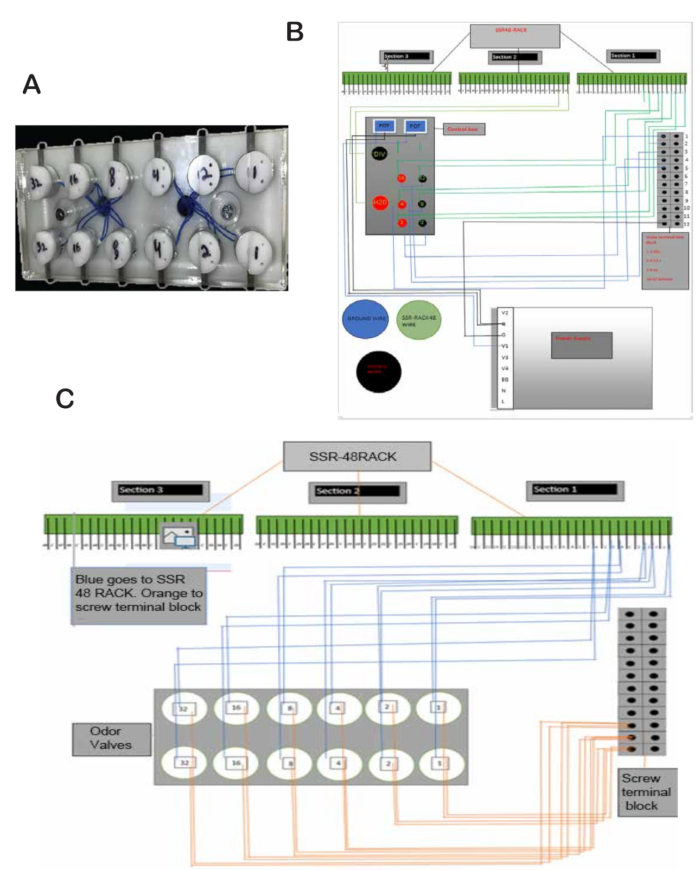
Figura 2: Válvulas de olor y esquemas. (A) Válvulas de olor colocadas de forma segura en ranuras y fijadas con tornillos. (B) Esquema del cableado de la válvula de olor a los bloques de regletas de terminales SSR48-RACK y tornillos. (C) Esquema de cableado de la caja negra de control, la fuente de alimentación, SSR48-RACK y los bloques de regletas de terminales de tornillo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Configuración de agua y válvula final con fuente de alimentación. (A) Agua y válvulas finales añadidas a las ranuras designadas en el olfatómetro y aseguradas con tornillos. (B) Cableado de la fuente de alimentación conectado para alimentar el olfatómetro. (C) Cableado de alimentación para el SSR48-RACK. (D) Sensor de lamida con componentes conectados, incluidas resistencias, cables, LED y amplificador operacional. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Sistema de suministro de aire con medidores de flujo y tubería. (A) Medidores de flujo unidos al bastidor con tornillos. (B) Bomba de acuario conectada a un tubo, unida con una junta en T. (C) Un filtro de carbón con tubería conectada a la salida, con conexiones a reguladores individuales. (D) Tubería de reguladores conectados a las entradas del medidor de flujo. (E) Tubería conectada a las salidas del medidor de flujo. (F) Tubería desde el colector hasta la entrada final de la válvula. (G) Válvula final con tubo conectado al puerto de olor del olfatómetro. (H) Jeringa de 5 mL llena de agua, tubo conectado a una aguja de 18 G. (I) Tubería conectada a la entrada de la válvula de agua. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Conexiones finales de válvulas de agua y descripción general del sistema. (A) Tubería desde la salida de la válvula de agua hasta el lixit en el olfatómetro. (B) Conexión del olfatómetro al DIO96H/50 mediante un cable hembra a hembra. Haga clic aquí para ver una versión más grande de esta figura.
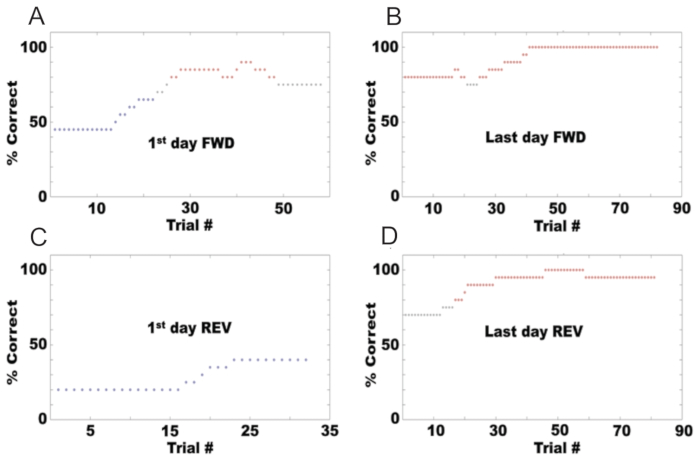
Figura 6: Ejemplo de rendimiento conductual en una tarea de pasa/no pasa para un mouse. El porcentaje de respuestas correctas en cada sesión se muestra para: (A) El primer día de acondicionamiento hacia adelante (S+: acetato de isoamilo al 1%, S-: aceite mineral). (B) El último día de acondicionamiento hacia adelante. (C) El primer día después de la reversión (S+: aceite mineral, S-: acetato de isoamilo al 1%). (D) El último día de condicionamiento revertido. Haga clic aquí para ver una versión más grande de esta figura.
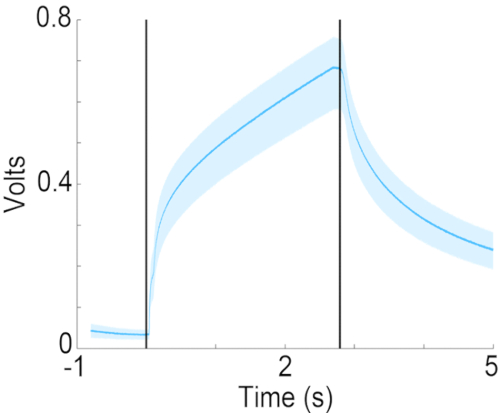
Figura 7: Curso del tiempo de concentración del acetato de isoamilo en el puerto de olor. Concentración medida de acetato de isoamilo al 10% (diluido en aceite mineral) en el puerto de olor, utilizando un dispositivo de fotoionización (PID). Las líneas verticales indican el inicio y el final de la entrega de olores. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
En la literatura se puede encontrar una guía completa paso a paso para construir un olfatómetro diseñado para tareas de asociación de olores. Los investigadores pueden encontrar varios desafíos durante el ensamblaje y el funcionamiento del dispositivo, pero afortunadamente, existen métodos de solución de problemas establecidos para abordar estos problemas. Una vez construido y calibrado correctamente, el olfatómetro sirve como una herramienta invaluable para los científicos que realizan experimentos relacionados con el olfato, lo que permite un control preciso y la entrega de estímulos de olor.
Pasos críticos
La versión de MATLAB descargada debe ser de 2015, ya que el código escrito es compatible con esta versión, y el uso de cualquier otra versión puede dar lugar a problemas. Es importante verificar que se haya seleccionado la tabla correcta en instacall. La instalación de mcc.dill se puede realizar ejecutando daqregister('mcc') mientras se ha iniciado sesión como administrador de MATLAB.
Solución de problemas
Al comienzo de cada semana de entrenamiento, ejecute el software de calibración (InstaCal) para asegurarse de que la PC y el olfatómetro estén interconectados correctamente. Abra este programa, haga clic en la placa y haga clic en Calibración digital. Es necesario comprobar el caudal de aire. El flujo de aire de fondo debe ser de 2 L/min y el flujo a los viales de equilibrio de olores debe ser de 50 mL/min. Es extremadamente importante verificar rutinariamente el caudal de aire a la salida del olfatómetro.
Antes de colocar un mouse, es importante asegurarse de que se prueben los siguientes parámetros: (1) Válvulas de olor: Las válvulas de olor deben presionarse al presionar el botón de la caja negra. El tubo de aire debe burbujear en el aceite mineral, sin que el aceite mineral quede atrapado en el tubo. (2) Tubo de olor: Si los olores no producen burbujas, el tubo puede estar bloqueado donde normalmente se aprieta cerca de la válvula. Es posible que sea necesario reemplazar la tubería. (3) Válvula final y válvula de agua: La válvula final debe abrirse correctamente, con la tubería revisada para su correcto funcionamiento. Para la válvula de agua, cualquier flujo de agua que bloquee el aire debe limpiarse, permitiendo que el agua fluya hacia el lixit. (4) Flujo de aire: Los medidores de flujo deben aparecer calibrados y colocados adecuadamente. (5) Luces de relé: Asegúrese de que las "luces" de los relés se activen correctamente durante el experimento. (6) Relé de recompensa de agua: Cuando se dispensa una recompensa de agua, el relé sobre el agua debe parpadear mientras dispensa la recompensa. (7) Relé de recompensa de olor y agua: Cuando un olor se combina con una recompensa de agua, el relé rojo sobre el número de válvula correspondiente debe parpadear en rojo durante la recompensa.
Limitaciones
La tarea de pasar/no pasar pone a prueba la capacidad del ratón para probar 2 olores. Para llevar a cabo la tarea, el animal debe pasar por varias sesiones. Esta no es una técnica de alto rendimiento para probar la discriminación de olores. El olfatómetro está diseñado para probar estímulos olfativos. No es un aparato de prueba multisensorial. Sin embargo, se pueden hacer modificaciones para probar otras entradas sensoriales.
Este artículo describe un olfatómetro de dilución líquida en el que el aire que burbujea a través del odorante diluido en aceite mineral a una velocidad de 50 mL/min se preequilibra con el flujo de aire de fondo a 2 L/min. Para este diseño de suministro de odorante, la cinética de dilución del olor en el flujo de aire portador determina la velocidad del aumento en la concentración del olor en el flujo de aire de fondo. Como se muestra en la Figura 7, mientras que la concentración aumenta dentro de los 200 ms a la mitad de la concentración final, la tasa de cambio de concentración se ralentiza más allá de medio segundo. Si bien esta configuración no produce un cambio de paso cuadrado en la concentración de olores, se ha utilizado con éxito para estudiar la discriminación y detección de olores21. Si el protocolo experimental requiere un cambio escalonado en la concentración de olores, el diseño para la entrega de odorantes debe modificarse a tres canales continuos de flujo de aire de fondo de 2 L/min donde los odorantes se suministran continuamente en el flujo de aire de fondo de dos de los canales de flujo de aire de fondo. El tercer canal de suministro suministraría aire equilibrado con aceite mineral. En este caso, se utilizarían válvulas de desvío para desviar uno de los dos odorantes o aire libre de olor hacia el puerto de olor. Esto resultaría en aumentos escalonados en la concentración de odorante en el puerto de olor (también reportes previos19,22). En cualquier caso, es clave documentar el curso temporal del cambio en la concentración de olores utilizando un detector de fotoionización.
El olfatómetro descrito aquí está diseñado para experimentos de comportamiento con ratones, sin embargo, este diseño se ha utilizado en el pasado para ratas. La principal diferencia es que es necesario aumentar el tamaño de la cámara para estudios con ratas23. Por último, este olfatómetro evalúa el comportamiento olfativo de un solo ratón. Se ha descrito un olfatómetro automatizado de alto rendimiento para probar múltiples ratones24.
Importancia
Este protocolo describe un olfatómetro hecho a medida, que reduce los costos en comparación con otros métodos disponibles.
Aplicaciones futuras
El olfatómetro está diseñado específicamente para su uso con ratones y requiere modificaciones para su uso con otros animales, como ratas. También se pueden incorporar características adicionales, como un sistema de registro de electrodos múltiples (por ejemplo, una placa de registro de electrodos múltiples), una placa Arduino Uno o una cámara.
Divulgaciones
Los autores no tienen nada que revelar y no hay intereses financieros contrapuestos.
Agradecimientos
Esta investigación fue financiada por subvenciones de los NIH K01 NS127850-01, R25 NS080685, R01 NS081248 y DC000566. Queremos agradecer a todos los miembros del laboratorio de Restrepo y Ramírez-Gordillo por su apoyo.
Materiales
| Name | Company | Catalog Number | Comments |
| 2 1/8’’ modular ic breadboard socket | found on: amazon.com | ASIN : B004MCSOQY | Powers the lights and lick censor |
| 500 piece assorted carbon film resistors 1/4 watt | Found on amazon.com Brand:bojack | Resisters will go on the BreadBoard socket | |
| 50k-ohm linear taper potentiometer | Brand:TWTADE Found on: Amazon.com | Allows to the components of the olfactometer Power supply: Ac 220v-6A Shift diameter: 6mm/0.2” Shaft length: 15mm/0.59” mounting thread. Knob size 15/17mm/0.6 x 0.67”(d*H) the adjustment of power | |
| 5mm red LED | Found on: Amazon.com Brand:EDGELEC | Pre-wired with built in Resistor; 5mm round top bulb and wired LED's-Easy Connection with 3-6V DC Drive it, 7.9 inch long wires. Wattage: 1 Watts | |
| 6 position dual row brrier strip | Found on: Digikey.com | Base Product Number 1546306 | Used for power and ground depending on how it is connected Voltage rating:300v Current rating (amps):20A Wire gauge:12-22 AWG |
| 96 high current 50 pin connector female to female | Found on: Amazon.com Brand: IIVVERR | Part Number:f5c953ee65a980d | Weight: 109G Pitch:2.54mm Total size: 50x6.4cm/2x2.5 inch |
| Aquarium pump -AAPA7.8L 125 GPH, 2 OUTLETS 3W | Found on:Amazon.com Brand: Hydrofarm store | This will connect to the double open end cold water housing and will be used to power the air on the machine | |
| Barbed Tee connector polyethylene 1/4” | Found on: Uplastic.com | Item number:62200 | Connects different air hoses to each other |
| Barbed Tee connector polyethylene 3/16” | Found on: Uplastic.com | Item number:62063 | Connects different air hoses to each other |
| BD general use precision glide hypodermic needle 18 G ½ | Found on: Medneedles.com | Item number: BD 305195 | Used for the water system |
| Black box/manual control box | Brand:Otdorpatio Found on: Amazon | n/a | Used as the control box Dimensions: 3.94x2.68x1.97 |
| Cable, pc power supply internal connections 10ft | Found on: Amazon.com | Connects to the power supply 40 watts | |
| Cflex tubing, white ¼” id x 3/8” OD | Found on:uplastic.com | Item number:54033 | Tubing used in the air system |
| custom-made white base board with holes to fasten the racks for odor valves, flow meters, SSR48 board | The Machine Shop of the Neurotechnology Center in the CU Anschutz Medical Campus | ||
| Diverter valve—miniature inert liquid valve, 3 way | Found on:Radwell.com | Part number:003-0258-900 | 1/8th BARB 24VDC UP TO 1500 SCCM 4.2W |
| Double open end cold water housing with blue sump | Found on:GRAINGER.COM BrandPENTAIR/PENTEK | Compatible Mfr. Model Number150295; 150578; 151117; 151118; 151120; 155003; 244043; 244686; 244687 | |
| Fisherbrand glass EPA vials | Found on: fishersci.com | Catalog no. 02-912-379 | Used for odors |
| Fitting reducer 1/4” x 1/8” | Found on: uplastic.com | Item number: 64370 | Adapter used in the air system hoses. |
| Hard Tubing, intramedic polyethylene, 0.045 (ID) 1 x 100 | |||
| High infrared LED | Found on amazon.com Brand: gikfun | Memory clock speed 1mhz | |
| Ic opamp gp 4 circuit 14dip | Found on: Amazon.com Brand:BOJACK | Operating Voltage 50 Volts Maximum Voltage 50 Volts | |
| Jumper wire kit | Found on: Amazon.com Brand:Elegoo | Item Dimensions LxWxH: 0.04 x 8.27 x 0.04 inches | |
| Mini spst momentary switch | Brand:Radioshack Found on: Amazon.com | B000TLWZM6 | Used for the odor valves Operating volage: 250V Current rating:1 Amps |
| Multimeter | Found on Amazon.com Brand:AstroAl | Accurately measures AC/DC Current, AC/DC Voltage, Capacitance, Frequency, Duty Cycle, Resistance, Diode, Continuity and Temperature | |
| Needle nose | Found on:amazon.com Brand:WorkPro | Will be used to bend wires | |
| Odor valves | Found on:Radwell.com | SKU: 192833415 Part number:225T031 | Pumps odors from odor vials. 30 PSIG 12 VDC |
| Phototransistor | Found on: Amazon.com Brand:HILETGO | Voltage: 1.3-1.5V Receive Range: (NM) 400-1000 Head Size: 5mm x 5mm / 0.2" x 0.2"(D*L) | |
| Phototransistor and LED as pair | |||
| Pipe adapter 3/4” x 1/4” | Found on: uplastic.com | Item number: 64807 | Adapter used in the air system hoses. |
| Pipe adapter for water housing pump- m ¾ x1/4” | Usplastic.com | Item number: 64807 | Temperature range -50f to 275F Maximum pressure: 150psi Weoght 0.0015 lbs |
| Power supply 12v 30A 360W | Found on: Amazon.com Brand:ALITOVE | the main power source of the machine. Input Voltage: 220 Volts Output: DC 12V 30A max. | |
| PTFE Tubing | Found on Amazon.com | ||
| RITEFLOW FLOWMETERS WITH PLAIN ENDS (UNMOUNTED) | Found on:Globalindustrial.com Model number:t9FB3075514 | Item number: H40407-0075 | Monitors air flow in the olfactometer 150mm Scale, Size 2 Manufacturers Part Number:H40407-0075 |
| Screw driver | Found on: Amazon.com Brand:Sharden | Used for screws on olfactometer | |
| Shrimk wrap/tubing(various sizes to fir 18-22 gauge wire | Found on: Amazon.com Brand:eventronic | Material:Made of Polyolefin, Shrinkage Ratio:2:1 (will shrink to 1/2 its supplied diameter) | |
| Silicone Tubing 0.030 x 0.065 | Found on:Amazon.com Brand:Scientific commodities | Tubing for the odor vials | |
| Solder- with lead | Found on:Uline.com | S-25294 | Will be used with the soldering iron |
| Soldering iron | Found on:Uline.com | Model NO. H-10799 | Will be used to solder the Bottons on the control box and other connections |
| Solid State Relay Module Quad Output – Red | Found on: https://www.sealevel.com/ | Part: OB5Q Model: DC Output QSSR Module | Capacitance: 8 pF Dimensions: 2.4" (L) x 1.1" (W) x 3.1" (H) # of I/O : 4 Outputs Max Line Voltage: 60 VDC Max On-State Current: 3A Minimum Line Voltage: 3 VDC Operating Temperature :-30°C to 80°C (-22°F to 176°F) Output Isolation: 4000 Vrms Storage Temperature: -40°C to 100°C (-40°F to 212°F) |
| SPST pushbutton switch | Brand:Apiele Found on: Amazon.com | n/a | Used inside of the control box control water valve and final valve. Operating voltage 250v Current rating: 1 Amps, 3 Amps |
| Ssr-rack 48 | Found on:Radwell.com | SKU: 83105002 | Processes all the connections of the olfactometer and works with quad-type sooid state relays. |
| Stainless steel feeding tubes | |||
| Tip tinner and cleaner | Found on: Amazon.com Brand:Thermaltronics | Model number: FBA-TMT-TC-2 | |
| Valve Ball PVC 1/4” barb buna | Found on: uplastic.com | Item number:62281 | |
| water valve | Found on: Ph.parker.com | Part #: 003-0257-900 | Pumps water into the chamber Maximum Flow Rate: 1500 sccm Voltage (VDC): 24 Maximum Operating Pressure:50 psi, 3.44 bar |
| Wire 22awg | Brand:tuofeng Found on: Amazon.com | N/a | Used to wire different components of the olfactometer Material:copper Gauge 30.0 |
| Wire snips | Found on:Amazon.com Brand:Billbotk | Will be used to snip wires | |
| As Brand: PTFE | Part #036663601452 | Use for delivering odorants. | |
| https://medschool.cuanschutz.edu/neurotechnologycenter/Cores/machine-shop |
Referencias
- Yeshurun, Y., Sobel, N. An odor is not worth a thousand words: from multidimensional odors to unidimensional odor objects. Annu Rev Psychol. 61, 219-241 (2010).
- Buck, L. B. Unraveling the sense of smell (Nobel lecture). Angew Chem Int Ed Engl. 44, 6128-6140 (2005).
- Spors, H., Wachowiak, M., Cohen, L. B., Friedrich, R. W. Temporal dynamics and latency patterns of receptor neuron input to the olfactory bulb. J Neurosci. 26 (4), 1247-1259 (2006).
- Feinstein, P., Bozza, T., Rodriguez, I., Vassalli, A., Mombaerts, P. Axon guidance of mouse olfactory sensory neurons by odorant receptors and the beta2 adrenergic receptor. Cell. 117 (6), 833-846 (2004).
- Soucy, E. R., Albeanu, D. F., Fantana, A. L., Murthy, V. N., Meister, M. Precision and diversity in an odor map on the olfactory bulb. Nat Neurosci. 12, 210-220 (2009).
- Spors, H., et al. Illuminating vertebrate olfactory processing. J Neurosci. 32, 14102-14108 (2012).
- Kwak, J., Willse, A., Preti, G., Yamazaki, K., Beauchamp, G. K. In search of the chemical basis for MHC odourtypes. Proc Biol Sci. 277 (1693), 2417-2425 (2010).
- Schaefer, M. L., Yamazaki, K., Osada, K., Restrepo, D., Beauchamp, G. K. Olfactory fingerprints for major histocompatibility complex-determined body odors II: relationship among odor maps, genetics, odor composition, and behavior. J Neurosci. 22 (21), 9513-9521 (2002).
- Li, Y., et al. A distinct entorhinal cortex to hippocampal CA1 direct circuit for olfactory associative learning. Nat Neurosci. 20 (4), 559-570 (2017).
- Gadziola, M. A., et al. A neural system that represents the association of odors with rewarded outcomes and promotes behavioral engagement. Cell Rep. 32 (3), 107919 (2020).
- Carlson, K. S., Gadziola, M. A., Dauster, E. S., Wesson, D. W. Selective attention controls olfactory decisions and the neural encoding of odors. Curr Biol. 28 (14), 2195-2205.e4 (2018).
- Moberly, A. H., et al. Olfactory inputs modulate respiration-related rhythmic activity in the prefrontal cortex and freezing behavior. Nat Commun. 9, 1528 (2018).
- Gire, D. H., et al. Information for decision-making and stimulus identification is multiplexed in sensory cortex. Nat Neurosci. 16 (8), 991-993 (2013).
- Ma, M., et al. Molecular layer interneurons in the cerebellum encode for valence in associative learning. Nat Commun. 11 (1), 4217 (2020).
- Bolding, K. A., et al. Robust odor coding across states in piriform cortex requires recurrent circuitry: evidence for pattern completion in an associative network. bioRxiv. , 694331 (2019).
- Bolding, K. A., Franks, K. M. Recurrent cortical circuits implement concentration-invariant odor coding. Science. 361 (6407), eaat6904 (2018).
- Bolding, K. A., Franks, K. M. Complementary codes for odor identity and intensity in olfactory cortex. Elife. 6, e22630 (2017).
- Slotnick, B., Restrepo, D. Olfactometry with mice. Curr Protoc Neurosci. Chapter 8 (Unit 8.20), (2005).
- Williams, E., Dewan, A. Olfactory detection thresholds for primary aliphatic alcohols in mice. Chem Senses. 45 (7), 513-521 (2020).
- Arevalo, N., et al. Open-source JL olfactometer for awake behaving recording of brain activity for mice engaged in olfactory tasks. Animal Models of Reproductive Behavior. Neuromethods. 200, (2023).
- Slotnick, B., Bodyak, N. Odor discrimination and odor quality perception in rats with disruption of connections between the olfactory epithelium and olfactory bulbs. J Neurosci. 22 (10), 4205-4216 (2002).
- Burton, S. D., et al. A novel olfactometer for efficient and flexible odorant delivery. Chem Senses. 44 (3), 173-188 (2019).
- Slotnick, B., Cockerham, R., Pickett, E. Olfaction in olfactory bulbectomized rats. J Neurosci. 24 (41), 9195-9200 (2004).
- Reinert, J. K., Schaefer, A. T., Kuner, T. High-throughput automated olfactory phenotyping of group-housed mice. Front Behav Neurosci. 13, 267 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados