Method Article
Construction d’un olfactomètre pour l’étude du comportement olfactif des rongeurs
Dans cet article
Résumé
Ce protocole décrit la construction d’un olfactomètre pour des expériences de comportement olfactif go/no-go. Des instructions étape par étape, accompagnées d’images, sont fournies pour assurer la réussite de la construction de l’olfactomètre. Des informations sur le dépannage des problèmes rencontrés au cours du processus sont également incluses.
Résumé
L’utilisation d’olfactomètres pour étudier le comportement des rongeurs et l’activité cérébrale pendant les tâches olfactives est cruciale pour comprendre les circuits cérébraux. Ces appareils sophistiqués permettent aux chercheurs de contrôler et de délivrer avec précision les stimuli olfactifs, ce qui permet d’étudier des processus olfactifs complexes chez les rongeurs. Bien que les olfactomètres disponibles dans le commerce soient pratiques, ils présentent des défis lorsque des problèmes techniques surviennent, nécessitant souvent une assistance coûteuse et perturbant potentiellement les délais de recherche. Cet article détaille la construction d’un olfactomètre personnalisé spécialement conçu pour les expériences de comportement olfactif chez la souris, en fournissant une liste complète de pièces et des instructions étape par étape. L’olfactomètre est contrôlé par MATLAB, offrant une interface conviviale pour les chercheurs. Il est important de noter que le code open source permet aux utilisateurs de modifier et d’adapter le système, en adaptant les tâches comportementales pour répondre à des besoins expérimentaux spécifiques. La construction d’un olfactomètre personnalisé permet aux utilisateurs d’acquérir les connaissances et la capacité d’effectuer une conception expérimentale et un dépannage personnalisés de manière indépendante, ce qui permet d’économiser du temps et des ressources. Cette approche permet non seulement d’accroître la flexibilité de la recherche, mais aussi de mieux comprendre la fonctionnalité de l’équipement, ce qui permet d’obtenir des études olfactives plus robustes et plus fiables chez les rongeurs.
Introduction
Les mécanismes complexes qui sous-tendent la prise de décision olfactive offrent des informations fascinantes sur la remarquable complexité du système de traitement sensoriel du cerveau 1,2,3. Dans le bulbe olfactif de la souris, un vaste éventail de neurones sensoriels olfactifs convergent vers environ 2 200 glomérules, chacun innervé par des neurones exprimant le même récepteur olfactif4. Remarquablement, même des odorisants synthétiques uniques peuvent stimuler une partie substantielle des quelque 1 100 récepteurs olfactifs chez la souris 5,6. Cependant, le défi va au-delà de la détection initiale d’un odorant. La dynamique temporelle de l’arrivée des odeurs, influencée par l’acte rythmique de renifler, enrichit encore le paysage sensoriel, ajoutant des couches d’informations que le cerveau peut déchiffrer. Aggravé par la complexité des stimuli naturels, tels que l’urine conspécifique, qui contient des centaines d’odorants, le système olfactif est confronté à la tâche formidable de démêler les motifs complexes d’activation glomérulaire pour différencier les différentes odeurs 7,8.
Pour relever ce défi, le cerveau orchestre l’activité neuronale dans plusieurs régions, notamment le cortex piriforme, le cortex entorhinal latéral, l’hippocampe, le tubercule olfactif, le cortex préfrontal et même le cervelet 9,10,11,12,13,14. Au sein de ces circuits, les cellules pyramidales du cortex piriforme intègrent et modulent l’information relayée par les cellules mitrales, tandis que d’autres zones du cerveau jouent un rôle unique dans la formation de la perception olfactive 15,16,17. De plus, le traitement des stimuli olfactifs par le cerveau est influencé dynamiquement par des facteurs contextuels, soulignant l’adaptabilité et la sophistication du processus de prise de décision olfactive.
Cet article décrit la construction d’un olfactomètre personnalisé qui permet d’évaluer par ordinateur les performances comportementales de souris se déplaçant librement et engagées dans une tâche go/no-go. Dans cette tâche d’apprentissage associatif, la souris privée d’eau lance un essai en léchant un bec de distribution d’eau situé dans un cône nasal de distribution d’odorant. L’un des deux odorisants est délivré 1 à 1,5 s après le début de l’essai par l’animal. Si l’odorisant est l’odorisant récompensé (S+), la souris reçoit une récompense d’eau si elle lèche au moins une fois dans chacune des quatre fenêtres temporelles de 0,5 s (un hit). Dans le cas contraire, la souris ne reçoit aucune récompense (Échec). Si l’animal reçoit l’odorant non récompensé (S-), aucune récompense n’est délivrée, et si la souris lèche dans chacune des quatre fenêtres de temps (Fausse Alerte, FA), un délai est imposé avant le début de la prochaine épreuve. Si l’animal ne parvient pas à lécher dans l’une des fenêtres de temps, l’essai est compté comme un rejet correct (CR), et aucun délai n’est appliqué. Le pourcentage de performances correctes est calculé comme le pourcentage d’essais au cours desquels la souris obtient un résultat positif ou un CR dans une fenêtre de vingt essais :
Pourcentage de correction = 100 ((Hit + CR) / 20)
Il y a deux enjeux clés pour assurer le bon fonctionnement des olfactomètres destinés à évaluer le comportement olfactif go/no-go. Tout d’abord, l’olfactomètre doit surveiller les réponses de la souris en temps réel pour fournir des récompenses en matière d’odorant et d’eau en conséquence. Cet olfactomètre est réalisé en surveillant les léchages soit en mesurant la résistance entre la trombe marine et le fond de la chambre, soit en détectant la capacité18. Un programme MATLAB utilise ensuite ces informations pour prendre des décisions sur la distribution d’odorant et la récompense en eau. Le deuxième problème est la nécessité d’une distribution fiable et reproductible des odorants. Cet olfactomètre est réalisé en actionnant des vannes qui équilibrent l’air saturé d’odorant avec l’air porteur, qui est ensuite acheminé vers un cône de nez. L’air est équilibré avec l’odorisant en le faisant bouillonner à travers une solution odorante diluée à l’huile minérale. La concentration de l’odorisant est mesurée à l’aide d’un détecteur à photoionisation et peut être calculée en fonction de la pression de vapeur et du coefficient d’activité, en suivant les procédures décrites par Williams et Dewan18,19.
Protocole
Toutes les expériences ont été menées conformément aux protocoles approuvés par le comité institutionnel de soins et d’utilisation des animaux du campus médical Anschutz de l’Université du Colorado. Les animaux utilisés dans cette étude étaient des souris mâles CaMKIIα WT, âgées de deux mois au moment de l’implantation de la tétrode. Des détails sur les réactifs et l’équipement utilisés dans cette étude sont fournis dans la table des matériaux.
1. Montage et soudure de boutons-poussoirs momentanés unipolaires unidirectionnels (SPST)
- Procurez-vous la plinthe blanche sur mesure avec des trous pour fixer les supports pour les vannes d’odeur, les débitmètres, la carte SSR48 et d’autres composants illustrés à la figure 1A.
REMARQUE : La plinthe blanche utilisée dans cette étude a été produite par l’atelier d’usinage du Centre de neurotechnologie du campus médical Anschutz de l’Université de Californie (Figure 1A). Les fichiers de conception sont disponibles à l’adresse suivante : - Ajoutez des vis de 1 pouce et des entretoises de 3/4 de pouce pour le placement du SSR48-RACK. Les vis se trouvent en haut à droite de l’arrière du tableau blanc (Figure 1A).
- Montez le SSR48-RACK. Le SSR48-RACK se trouve en haut à gauche à l’arrière du tableau blanc (Figure 1C).
- Faites des trous (0,4 cm) pour placer les borniers à vis à l’arrière du tableau blanc. Les borniers à vis se trouvent au milieu droit de l’arrière du tableau blanc (Figure 1D).
- De haut en bas : Le premier bornier à 4 vis sera utilisé pour connecter des fils de 24 V. Le bornier à vis suivant sera utilisé pour les fils de 5 V. Laissez un bornier à vis vide et le dernier bornier à 4 vis sera utilisé pour connecter les fils de terre.
- Percez des trous (0,8 cm) dans le boîtier de commande pour placer les interrupteurs à bouton-poussoir momentanés SPST. Le boîtier de commande se trouve à l’avant inférieur du tableau blanc (Figure 1E).
- Configurez les commutateurs à bouton-poussoir momentanés SPST. Soudez deux fils à l’interrupteur momentané à bouton-poussoir SPST. Il est préférable d’utiliser deux couleurs différentes, comme le rouge et le noir ou le vert (Figure 1F).
- Fixez l’interrupteur à bouton-poussoir momentané SPST au boîtier de commande. Les boutons-poussoirs sont équipés d’un écrou qui sert à fixer la boîte noire de commande (Figure 1G).
- Fixez les fils en les tordant ou en les fixant avec du ruban adhésif pour les garder ensemble et organisés.
REMARQUE : L’alimentation 24 V est utilisée pour alimenter les vannes à manchon et les vannes d’odeur, et l’alimentation 5 V est utilisée pour le circuit de léchage. - Placez les vannes d’odeur dans les fentes du support de la vanne d’odeur située au centre du tableau blanc (Figure 2A).
- Décollez les fils qui se détachent des vannes et soudez un fil de chaque vanne sur un fil plus épais. Placez un fil dans le sol sur les borniers à vis à l’arrière du tableau blanc et un deuxième fil dans la broche correspondante dans le SSR48-RACK. Par exemple, la soupape anti-odeurs 1 va à la broche 1, la vanne anti-odeurs 2 va à la broche 2, etc. (Figure 2B).
- Connectez les broches 1 à 8 du SSR48-RACK à deux vannes à manchon chacune (vannes d’entrée et de sortie pour les flacons d’équilibrage d’huile minérale). Pour chaque vanne, connectez un fil d’un bouton-poussoir à l’alimentation 24 V et l’autre fil à la broche du SSR48-RACK qui est connectée à la vanne. L’autre fil va de la vanne à la terre. Reportez-vous à la Figure 2B,C pour placer les fils à leur place.
- Placez la vanne d’eau et la vanne finale dans les fentes correspondantes de la plaque de la vanne. La fente est située au milieu du tableau blanc. Voir la plaque de soupape sur la figure 1 et l’emplacement des soupapes sur la figure 3A.
- Connectez la vanne d’eau et la vanne finale à la terre et aux broches 17 et 18, respectivement, dans le SSR48-RACK. Connectez les boutons-poussoirs à l’unité 24 V et aux broches 17 et 18 (Figure 2B).
2. Alimentation électrique
- Achetez une alimentation électrique et une rallonge. Vous trouverez des informations concernant le type spécifique d’alimentation dans le tableau des matériaux. L’alimentation fournira des sorties 24 V (V3) et 5 V (V1) et la masse à l’olfactomètre.
- Coupez la fiche du cordon d’alimentation de l’alimentation. Plus précisément, la partie femelle de la rallonge. Une fois coupé, on peut voir trois fils. Le fil vert est connecté à G (terre) sur le bloc d’alimentation, et les deux autres fils (blanc et noir) sont connectés à L et N, respectivement, de l’entrée 120 V CA du bloc d’alimentation (Figure 3B).
ATTENTION : Les fils d’alimentation 120 V sont exposés et il existe un risque de blessure par choc électrique. Il est préférable de le recouvrir d’un isolant. - Coupez une extrémité du fil alimentant le SSR48-RACK. Connectez l’un des fils à la vis G du bloc d’alimentation et le second à la vis V1 du bloc d’alimentation (Figure 3C).
- Sur l’alimentation, connectez un fil de G2 à la terre sur les borniers à vis (Figure 2C).
- Sur le bloc d’alimentation, connectez un fil de V1 aux borniers à vis 5 V (Figure 2C).
- Sur le bloc d’alimentation, connectez un fil de la V3 aux borniers à vis 24 V (Figure 2C).
3. Carte de capteur de léchage
- Procurez-vous une planche d’essai à 400 points d’attache et faites passer un fil qui relie les points d’attache B7 à B15 (Figure 3D).
- Connectez une extrémité d’un fil au point d’attache 6+ et l’autre extrémité au point d’attache C22 de la planche à pain (Figure 3D).
- Connectez une extrémité à D16 et la seconde extrémité à G22 de la plaque d’essai (Figure 3D).
- Connectez une extrémité d’un fil à la fente I22 et la seconde extrémité à 29- de la carte d’essai (Figure 3D).
- Connectez une extrémité d’un fil à la fente 20A et la seconde extrémité à 29A de la carte d’essai (Figure 3D).
- Connectez une extrémité d’un fil à 21B et la seconde extrémité à 28B de la carte d’essai (Figure 3D).
- Connectez une extrémité d’un fil à l’emplacement 1+ de la plaque d’essai et la seconde extrémité au 5 V des borniers à vis (Figure 3D).
- Connectez une extrémité d’un fil à la fente 1- de la plaque d’essai et la seconde extrémité à la terre des borniers à vis (Figure 3D).
- Connectez une extrémité d’un fil à la fente C7 de la plaque d’essai et la seconde extrémité à la broche 27 du SSR-48RACK (Figure 3D).
- Connectez l’une des extrémités d’un fil à la fente 28C de la planche à pain, et à la deuxième extrémité, une pince crocodile est fixée à la partie métallique de la trombe marine (figure 3D).
- Connectez une extrémité d’un fil à la fente 20B de la platine d’essai et l’autre extrémité à la borne centrale du potentiomètre (Figure 3D). Les deux bornes reliées aux éléments de résistance du potentiomètre sont reliées à la terre et à 5 V. La borne centrale est connectée à la planche d’essai.
- Obtenez des résistances de 21 mΩ. Pour le premier, connectez une extrémité à 19A et la seconde extrémité à 20D. Pour le second, connectez une extrémité à 22C et l’autre extrémité à 21D. Connectez-vous au potentiomètre (Figure 3D).
- Obtenez une résistance kΩ. Connectez une extrémité à 14C et la seconde extrémité à 19C. Connectez-vous au potentiomètre (Figure 3D).
- Procurez-vous une résistance de 120 Ω. Connectez une extrémité à 7D et la seconde extrémité à 7H (Figure 3D).
- Procurez-vous une lumière LED. La couleur n’a pas d’importance. Connectez un fil LED à 7J et le second fil à 6- (Figure 3D).
- Procurez-vous deux amplificateurs opérationnels (amplis opérationnels). Les connexions pour le premier sont E10 à E16, F10-F16 (Figure 3D).
4. Approvisionnement en air et en eau
- Placez deux débitmètres (un de 2 L/min et un de 50 cc/min) dans les supports de débitmètre. La figure 4A montre l’ensemble du système de circulation d’air, et la figure 4B montre la vue agrandie des débitmètres.
- Procurez-vous une pompe d’aquarium pour fournir un débit d’air de 2 L/min. Le modèle de pompe d’aquarium utilisé ici a deux sorties (voir tableau des matériaux). Connectez un petit morceau de tube de chacune des deux sorties de la pompe d’aquarium aux deux entrées d’un connecteur en T (Figure 4B).
- Connectez un morceau de tube de la sortie du connecteur en T à l’entrée d’un filtre à charbon actif (Figure 4B).
- Connectez le tube de la sortie du filtre à charbon à un connecteur en T et connectez les deux sorties du connecteur à un robinet à boisseau sphérique pour ajuster le débit d’air (Figure 4C).
- Connectez la sortie de chaque vanne à bille à l’entrée des débitmètres (Figure 4D).
- Connectez la sortie du débitmètre de 50 cm/min au collecteur supérieur, fournissant de l’air aux flacons d’équilibrage d’odeurs de 40 mL avec des odorisants dilués dans de l’huile minérale (Figure 4E).
- Connectez la sortie de chaque flacon d’odeur à l’entrée correspondante dans le collecteur inférieur.
- Les tubes reliant les flacons d’odeur aux collecteurs sont des tubes de soupape à manchon qui sont ouverts par les deux vannes à manchon séparées. Placez le tube dans les vannes à manchon.
- Connectez la sortie du débitmètre 2 L/min à l’entrée de l’entrée latérale du collecteur inférieur.
- Connectez la sortie du collecteur inférieur à l’entrée de la vanne finale (de dérivation) (Figure 4F).
- Connectez la sortie par défaut de la vanne finale au tube de distribution d’odeurs dans la chambre go/no-go. Connectez la sortie d’arrêt par défaut de la dernière vanne à un tube d’échappement (Figure 4G). Il en résulte un débit d’air continu non odorisé de 2 L/min lorsque la dernière vanne est fermée.
- Pour chaque essai, assurez-vous que la dernière soupape s’allume lorsque l’animal lèche, amenant l’air vers l’échappement, et que la soupape d’odeur s’allume simultanément. Cela se traduit par l’équilibre des odeurs dans le flux d’air de fond.
- Après 1 à 1,5 s, assurez-vous que la dernière vanne s’arrête, déviant l’air dans la chambre. Il en résulte une forte augmentation de la concentration d’odorisant. Après 2,5 s, la soupape d’odeur s’éteint et la concentration d’odeur revient à 0.
- Connectez une aiguille de 18 g à l’extrémité de la seringue de 5 ml qui sera utilisée pour administrer la récompense en eau (figure 4H).
- Connectez un tube (2 mm de diamètre) à la pointe de l’aiguille (Figure 4H).
- Connectez l’autre extrémité du tube à l’entrée de la vanne d’eau. Il peut être nécessaire de découper un tube d’un diamètre différent pour s’adapter à l’entrée de la vanne d’eau (Figure 4I).
- Connectez le tube de la sortie de la vanne d’eau au bec à lécher (Figure 5A).
5. Connexion de l’olfactomètre à l’ordinateur et installation du logiciel
- Connectez le SSR48-RACK au DIO96H/50 à l’aide d’un connecteur femelle à femelle à 100 broches. Connectez le câble USB de l’imprimante DIO96/H50 à l’ordinateur (Figure 5B).
- Téléchargez la dernière version du logiciel et des pilotes mccdaq et InstaCal.
REMARQUE : InstaCal est le programme qui teste la communication entre l’ordinateur et DIO96/H50. Téléchargez les derniers logiciels et pilotes ici : https://www.mccdaq.com/software-downloads.aspx. - Exécutez InstaCal. Assurez-vous que le « Universal Serial Bus » répertorie la carte # comme le bon numéro, généralement #1 = Carte #1 USB-DIO96H/50.
- Téléchargez MATLAB.
- Téléchargez les programmes MATLAB pour exécuter l’olfactomètre à partir de https://github.com/restrepd/dropc.
- Ouvrez MATLAB en tant qu’administrateur et définissez le chemin d’accès pour que MATLAB reconnaisse les programmes. Dans l’onglet Accueil de l’environnement MATLAB, cliquez sur Set Path dans la section Environnement. Cela ouvre une boîte de dialogue dans laquelle vous pouvez ajouter des dossiers dans le chemin de recherche.
- Exécutez daqregister('mcc'). Changez le numéro de la carte dans dropcInitializePortsNow.m.
REMARQUE : handles.dio = digitalio('mcc',1) ; %(1 ou 0 selon l’ordinateur). - Testez dropcspm.m en effectuant un essai où l’utilisateur « répond » à chaque essai en connectant la boucle électrique entre le bec à lécher et le sol métallique de la chambre qui est mis à la terre.
REMARQUE : L’olfactomètre est maintenant prêt à l’emploi. Des informations sur la façon d’entraîner la souris se trouvent dans Nicole Arevalo et al.20.
6. Expériences sur les animaux
- Préparez soigneusement les sujets animaux pour commencer le processus expérimental. Pesez chaque souris individuellement à l’aide d’une balance calibrée et notez le poids dans un journal de laboratoire. Surveillez ces données cruciales tout au long de l’étude pour suivre la santé des animaux et réagir rapidement à tout changement de poids.
- Placez doucement les souris dans la chambre de souris spécialement conçue après la pesée. Activer les capteurs et les systèmes de diffusion de stimuli pour la tâche de discrimination olfactive. S’assurer que la chambre minimise le stress sur les animaux tout en maintenant un contrôle précis des conditions expérimentales.
- Assurez-vous que l’animal est à l’aise dans la chambre. Lancez le programme MATLAB pour contrôler des paramètres expérimentaux tels que l’émission de stimuli olfactifs (2,5 s), la distribution d’eau et l’enregistrement des réponses. Analysez les données en temps réel pour obtenir un retour immédiat sur les performances de l’animal.
- Surveillez et analysez en permanence les performances de l’animal. Examinez le score de compétence calculé en fonction du pourcentage de réponses correctes. Visez à ce que chaque animal atteigne un score de performance de 80 ou plus, ce qui marque le seuil de compétence de la tâche.
- Commencez la nouvelle phase de l’expérience une fois que l’animal atteint régulièrement un score de compétence de 80 ou plus, indiquant la maîtrise de la discrimination initiale de la paire d’odeurs. Inversez la paire d’odeurs, en laissant l’odeur précédemment récompensée non récompensée et vice versa.
- Testez la flexibilité cognitive de l’animal et sa capacité à désapprendre et à réapprendre les associations, obtenant ainsi des informations précieuses sur la plasticité de l’apprentissage olfactif chez la souris.
Résultats
En suivant le protocole décrit ici, un olfactomètre peut être mis en place pour tester le comportement go/no-go des souris en différenciant les odeurs. La figure 6A montre le comportement d’une souris au cours du premier jour d’entraînement dans la tâche go/no-go, en utilisant de l’acétate d’éthyle comme odorisant S+ et une combinaison d’acétate d’éthyle et d’acétate de propyle comme S-. Le pourcentage de réussite est calculé comme le pourcentage d’essais au cours desquels la souris obtient un résultat positif ou un rejet correct. Initialement, la souris a commencé à 50 % correcte parce qu’elle léchait en réponse aux deux odorants. Cependant, après plusieurs essais, il a appris à lécher uniquement pour le S+ et a arrêté de lécher pour le S-. La figure 6B montre le pourcentage de correction pour le dernier jour de la tâche go/no-go dans le sens avant, où l’animal a atteint une compétence avec une performance de 80 % ou plus. À ce stade, les odorisants ont été inversés (REV), avec de l’acétate d’éthyle comme odorant S- et la combinaison d’acétate d’éthyle et d’acétate de propyle comme S+. La figure 6C montre le pourcentage de correction le premier jour de la tâche go/no-go dans le sens inverse, où les performances de la souris sont tombées à 10 %. F montre les performances de la souris le dernier jour de l’inversion, où elle a de nouveau atteint la compétence.

Figure 1 : Face avant du tableau blanc de l’olfactomètre et câblage. (A) Les dimensions de l’olfactomètre sont de 22 po L x 16 po H x 8,5 po P, illustrées sans câblage ni cartes d’interface/léchage, telles que livrées par l’atelier de machinerie. Les trous sont pré-percés pour les vannes d’odeur, les thermomètres, les vannes d’eau et finales, la seringue d’eau, le support de bouteille d’odeur, le support de vanne d’odeur et la chambre de la souris. (B) L’olfactomètre préparé avec les 8 boulons nécessaires au montage du SSR48-RACK sur le côté arrière gauche. (C) Olfactomètre avec SSR48-RACK monté, y compris les relais attachés. (D) Blocs de borniers à vis ajoutés à l’olfactomètre, avec des sections désignées pour 12 V, 5 V et la terre. (E) Boîte noire de contrôle avec trous percés pour les interrupteurs à bouton-poussoir momentanés SPST, avec du ruban adhésif étiquetant chaque bouton par commande de vanne. (F) Interrupteur à bouton-poussoir momentané SPST avec deux fils à tube rétractable à code couleur soudés pour protéger les zones exposées. (G) Interrupteur à bouton-poussoir momentané SPST monté sur la boîte noire de commande et fixé avec l’écrou hexagonal inclus. Veuillez cliquer ici pour voir une version agrandie de cette figure.
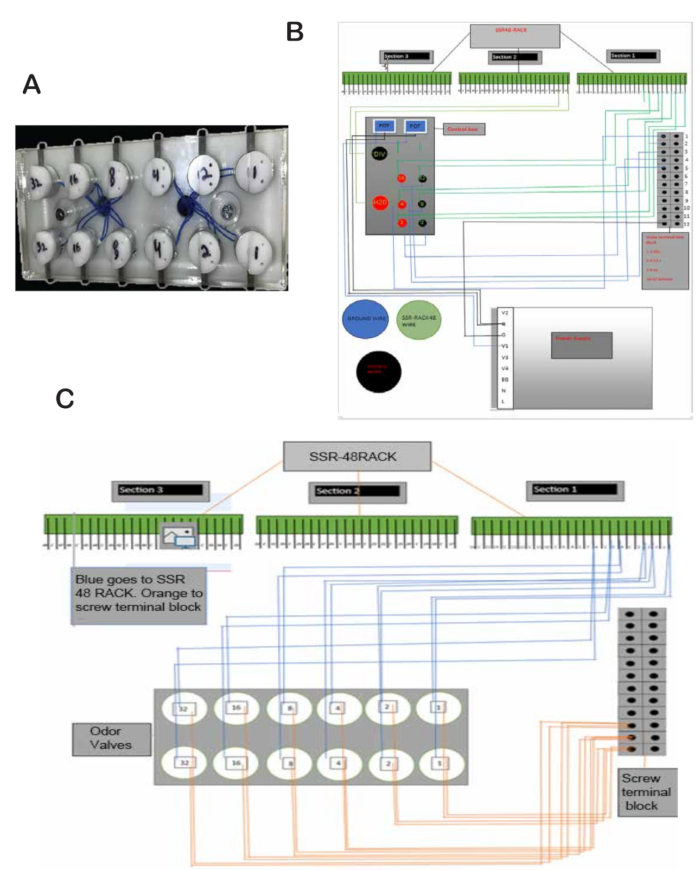
Figure 2 : Vannes anti-odeurs et schémas. (A) Vannes anti-odeurs solidement fixées dans les fentes et fixées à l’aide de vis. (B) Schéma du câblage de la vanne d’odorat sur le SSR48-RACK et les borniers à vis. (C) Schéma de câblage de la boîte noire de commande, de l’alimentation, du SSR48-RACK et des borniers à vis. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Configuration de l’eau et de la vanne finale avec alimentation électrique. (A) Les vannes d’eau et finales ajoutées aux fentes désignées dans l’olfactomètre et fixées par des vis. (B) Câblage d’alimentation connecté pour alimenter l’olfactomètre. (C) Câblage d’alimentation pour le SSR48-RACK. (D) Capteur à lécher avec composants connectés, y compris les résistances, les fils, la LED et l’amplificateur opérationnel. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 4 : Système d’alimentation en air avec débitmètres et tuyaux. (A) Débitmètres fixés au rack à l’aide de vis. (B) Pompe d’aquarium reliée à un tube, assemblé par un joint en T. (C) Un filtre à charbon avec un tube fixé à la sortie, avec des connexions à des régulateurs individuels. (D) Tubes des régulateurs connectés aux entrées du débitmètre. (E) Tube fixé aux sorties du débitmètre. (F) Tube du collecteur à l’entrée finale de la vanne. (G) Vanne finale avec tube connecté à l’orifice d’odeur de l’olfactomètre. (H) Seringue de 5 mL remplie d’eau, le tube étant attaché à une aiguille de 18 g. (I) Tube connecté à l’entrée de la vanne d’eau. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Raccords finaux des vannes d’eau et aperçu du système. (A) Tube de sortie de la vanne d’eau au lixit dans l’olfactomètre. (B) Connexion de l’olfactomètre au DIO96H/50 à l’aide d’un câble femelle à femelle. Veuillez cliquer ici pour voir une version agrandie de cette figure.
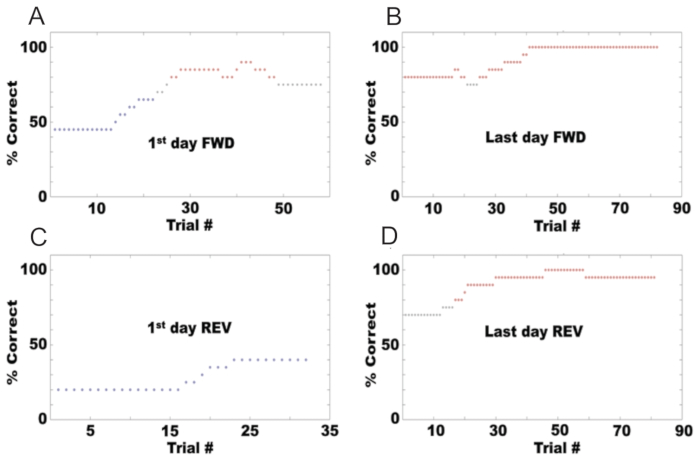
Figure 6 : Exemple de performance comportementale dans une tâche go/no go pour une souris. Le pourcentage de réponses correctes dans chaque séance est affiché pour : (A) Le premier jour de conditionnement avancé (S+ : acétate d’isoamyle à 1 %, S- : huile minérale). (B) Le dernier jour du conditionnement avancé. (C) Le premier jour après l’inversion (S+ : huile minérale, S- : acétate d’isoamyle à 1 %). (D) Le dernier jour du conditionnement inversé. Veuillez cliquer ici pour voir une version agrandie de cette figure.
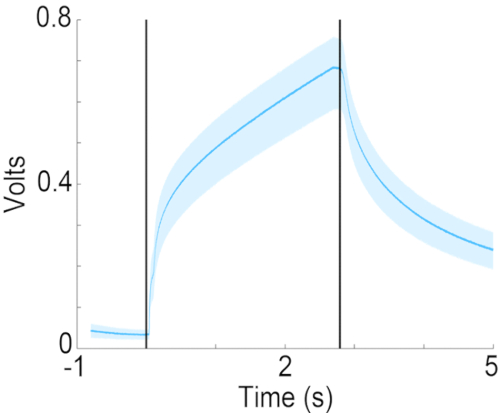
Figure 7 : Évolution de la concentration de l’acétate d’isoamyle dans l’orifice odorant. Concentration mesurée de 10 % d’acétate d’isoamyle (dilué dans de l’huile minérale) dans l’orifice d’odeur, à l’aide d’un dispositif de photoionisation (PID). Les lignes verticales indiquent le début et la fin de la diffusion des odeurs. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Un guide complet étape par étape pour la construction d’un olfactomètre conçu pour les tâches d’association d’odeurs peut être trouvé dans la littérature. Les chercheurs peuvent rencontrer divers défis lors de l’assemblage et du fonctionnement de l’appareil, mais heureusement, il existe des méthodes de dépannage établies pour résoudre ces problèmes. Une fois correctement construit et calibré, l’olfactomètre constitue un outil inestimable pour les scientifiques qui mènent des expériences liées à l’olfaction, permettant un contrôle précis et la délivrance de stimuli olfactifs.
Étapes critiques
La version de MATLAB téléchargée devrait être 2015, car le code écrit est compatible avec cette version, et l’utilisation de toute autre version peut entraîner des problèmes. Il est important de vérifier que la bonne carte est sélectionnée dans instacall. L’installation de mcc.dill peut être effectuée en exécutant daqregister('mcc') tout en étant connecté en tant qu’administrateur MATLAB.
Dépannage
Au début de chaque semaine de formation, exécutez le logiciel d’étalonnage (InstaCal) pour vous assurer que le PC et l’olfactomètre s’interfacent correctement. Ouvrez ce programme, cliquez sur le tableau, puis cliquez sur Étalonnage numérique. Le débit d’air doit être vérifié. Le débit d’air de fond doit être de 2 L/min et le débit vers les flacons d’équilibrage des odeurs doit être de 50 mL/min. Il est extrêmement important de vérifier régulièrement le débit d’air à la sortie de l’olfactomètre.
Avant de placer une souris, il est important de s’assurer que les paramètres suivants sont testés : (1) Vannes d’odeur : Les vannes d’odeur doivent être cliquées lorsque vous appuyez sur le bouton de la boîte noire. Le tube d’air doit bouillonner dans l’huile minérale, sans qu’aucune huile minérale ne soit emprisonnée dans le tube. (2) Tube odorant : Si les odeurs ne produisent pas de bulles, le tube peut être bloqué là où il pince généralement près de la vanne. Le remplacement de la tubulure peut être nécessaire. (3) Vanne finale et vanne d’eau : La vanne finale doit s’ouvrir correctement, avec le bon fonctionnement du tube vérifié. Pour la vanne d’eau, tout air bloquant le débit d’eau doit être dégagé, permettant à l’eau de s’écouler dans le lixit. (4) Débit d’air : Les débitmètres doivent apparaître calibrés et positionnés de manière appropriée. (5) Lumières de relais : Assurez-vous que les « lumières » des relais s’allument correctement pendant l’expérience. (6) Relais de récompense d’eau : Lorsqu’une récompense d’eau est distribuée, le relais au-dessus de l’eau doit clignoter pendant qu’il distribue la récompense. (7) Relais de récompense d’odeur et d’eau : Lorsqu’une odeur est associée à une récompense d’eau, le relais rouge au-dessus du numéro de vanne correspondant doit clignoter en rouge pendant la récompense.
Limitations
La tâche go/no-go teste la capacité de la souris à tester 2 odeurs. Afin d’exécuter la tâche, l’animal doit être soumis à plusieurs séances. Il ne s’agit pas d’une technique à haut débit pour tester la discrimination des odeurs. L’olfactomètre est conçu pour tester les stimuli olfactifs. Il ne s’agit pas d’un appareil de test multisensoriel. Cependant, des modifications peuvent être apportées pour tester d’autres entrées sensorielles.
Cet article décrit un olfactomètre à dilution liquide où l’air bouillonnant à travers l’odorisant dilué dans l’huile minérale à un débit de 50 mL/min est pré-équilibré avec le débit d’air de fond à 2 L/min. Pour cette conception de distribution d’odorisant, la cinétique de dilution de l’odeur dans le flux d’air porteur détermine la vitesse de l’augmentation de la concentration de l’odeur dans le flux d’air de fond. Comme le montre la figure 7, alors que la concentration augmente en 200 ms pour atteindre la moitié de la concentration finale, le taux de changement de concentration ralentit au-delà d’une demi-seconde. Bien que cette configuration ne produise pas de changement carré de la concentration des odeurs, elle a été utilisée avec succès pour étudier la discrimination et la détection des odeurs21. Si le protocole expérimental exige un changement progressif de la concentration de l’odeur, la conception de l’administration de l’odorisant doit être modifiée en trois canaux d’écoulement d’air d’arrière-plan continus de 2 L/min où les agents odorisants sont continuellement délivrés dans l’écoulement d’air d’arrière-plan de deux des canaux d’écoulement d’air d’arrière-plan. Le troisième canal de livraison fournirait de l’air équilibré avec de l’huile minérale. Dans ce cas, des vannes de dérivation seraient utilisées pour détourner l’un des deux odorisants ou de l’air inodore vers l’orifice d’odeur. Cela entraînerait une augmentation progressive de la concentration d’odorant au niveau de l’orifice d’odeur (également rapports précédents19,22). Quoi qu’il en soit, il est essentiel de documenter l’évolution temporelle du changement de concentration des odeurs à l’aide d’un détecteur à photoionisation.
L’olfactomètre décrit ici est conçu pour les expériences comportementales sur les souris, mais cette conception a été utilisée dans le passé pour les rats. La principale différence est qu’il est nécessaire d’augmenter la taille de la chambre pour les études sur des rats23. Enfin, cet olfactomètre évalue le comportement olfactif d’une seule souris. Un olfactomètre automatisé à haut débit a été décrit pour tester plusieurs souris24.
Importance
Ce protocole décrit un olfactomètre sur mesure, qui permet de réduire les coûts par rapport aux autres méthodes disponibles.
Applications futures
L’olfactomètre est conçu spécifiquement pour être utilisé avec des souris et doit être modifié pour être utilisé avec d’autres animaux, tels que les rats. Des fonctionnalités supplémentaires, telles qu’un système d’enregistrement à plusieurs électrodes (par exemple, une carte d’enregistrement à plusieurs électrodes), une carte Arduino Uno ou une caméra, peuvent également être intégrées.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer, et il n’y a pas d’intérêts financiers concurrents.
Remerciements
Cette recherche a été financée par des subventions des NIH K01 NS127850-01, R25 NS080685, R01 NS081248 et DC000566. Nous tenons à remercier tous les membres du laboratoire du Restrepo et de Ramirez-Gordillo pour leur soutien.
matériels
| Name | Company | Catalog Number | Comments |
| 2 1/8’’ modular ic breadboard socket | found on: amazon.com | ASIN : B004MCSOQY | Powers the lights and lick censor |
| 500 piece assorted carbon film resistors 1/4 watt | Found on amazon.com Brand:bojack | Resisters will go on the BreadBoard socket | |
| 50k-ohm linear taper potentiometer | Brand:TWTADE Found on: Amazon.com | Allows to the components of the olfactometer Power supply: Ac 220v-6A Shift diameter: 6mm/0.2” Shaft length: 15mm/0.59” mounting thread. Knob size 15/17mm/0.6 x 0.67”(d*H) the adjustment of power | |
| 5mm red LED | Found on: Amazon.com Brand:EDGELEC | Pre-wired with built in Resistor; 5mm round top bulb and wired LED's-Easy Connection with 3-6V DC Drive it, 7.9 inch long wires. Wattage: 1 Watts | |
| 6 position dual row brrier strip | Found on: Digikey.com | Base Product Number 1546306 | Used for power and ground depending on how it is connected Voltage rating:300v Current rating (amps):20A Wire gauge:12-22 AWG |
| 96 high current 50 pin connector female to female | Found on: Amazon.com Brand: IIVVERR | Part Number:f5c953ee65a980d | Weight: 109G Pitch:2.54mm Total size: 50x6.4cm/2x2.5 inch |
| Aquarium pump -AAPA7.8L 125 GPH, 2 OUTLETS 3W | Found on:Amazon.com Brand: Hydrofarm store | This will connect to the double open end cold water housing and will be used to power the air on the machine | |
| Barbed Tee connector polyethylene 1/4” | Found on: Uplastic.com | Item number:62200 | Connects different air hoses to each other |
| Barbed Tee connector polyethylene 3/16” | Found on: Uplastic.com | Item number:62063 | Connects different air hoses to each other |
| BD general use precision glide hypodermic needle 18 G ½ | Found on: Medneedles.com | Item number: BD 305195 | Used for the water system |
| Black box/manual control box | Brand:Otdorpatio Found on: Amazon | n/a | Used as the control box Dimensions: 3.94x2.68x1.97 |
| Cable, pc power supply internal connections 10ft | Found on: Amazon.com | Connects to the power supply 40 watts | |
| Cflex tubing, white ¼” id x 3/8” OD | Found on:uplastic.com | Item number:54033 | Tubing used in the air system |
| custom-made white base board with holes to fasten the racks for odor valves, flow meters, SSR48 board | The Machine Shop of the Neurotechnology Center in the CU Anschutz Medical Campus | ||
| Diverter valve—miniature inert liquid valve, 3 way | Found on:Radwell.com | Part number:003-0258-900 | 1/8th BARB 24VDC UP TO 1500 SCCM 4.2W |
| Double open end cold water housing with blue sump | Found on:GRAINGER.COM BrandPENTAIR/PENTEK | Compatible Mfr. Model Number150295; 150578; 151117; 151118; 151120; 155003; 244043; 244686; 244687 | |
| Fisherbrand glass EPA vials | Found on: fishersci.com | Catalog no. 02-912-379 | Used for odors |
| Fitting reducer 1/4” x 1/8” | Found on: uplastic.com | Item number: 64370 | Adapter used in the air system hoses. |
| Hard Tubing, intramedic polyethylene, 0.045 (ID) 1 x 100 | |||
| High infrared LED | Found on amazon.com Brand: gikfun | Memory clock speed 1mhz | |
| Ic opamp gp 4 circuit 14dip | Found on: Amazon.com Brand:BOJACK | Operating Voltage 50 Volts Maximum Voltage 50 Volts | |
| Jumper wire kit | Found on: Amazon.com Brand:Elegoo | Item Dimensions LxWxH: 0.04 x 8.27 x 0.04 inches | |
| Mini spst momentary switch | Brand:Radioshack Found on: Amazon.com | B000TLWZM6 | Used for the odor valves Operating volage: 250V Current rating:1 Amps |
| Multimeter | Found on Amazon.com Brand:AstroAl | Accurately measures AC/DC Current, AC/DC Voltage, Capacitance, Frequency, Duty Cycle, Resistance, Diode, Continuity and Temperature | |
| Needle nose | Found on:amazon.com Brand:WorkPro | Will be used to bend wires | |
| Odor valves | Found on:Radwell.com | SKU: 192833415 Part number:225T031 | Pumps odors from odor vials. 30 PSIG 12 VDC |
| Phototransistor | Found on: Amazon.com Brand:HILETGO | Voltage: 1.3-1.5V Receive Range: (NM) 400-1000 Head Size: 5mm x 5mm / 0.2" x 0.2"(D*L) | |
| Phototransistor and LED as pair | |||
| Pipe adapter 3/4” x 1/4” | Found on: uplastic.com | Item number: 64807 | Adapter used in the air system hoses. |
| Pipe adapter for water housing pump- m ¾ x1/4” | Usplastic.com | Item number: 64807 | Temperature range -50f to 275F Maximum pressure: 150psi Weoght 0.0015 lbs |
| Power supply 12v 30A 360W | Found on: Amazon.com Brand:ALITOVE | the main power source of the machine. Input Voltage: 220 Volts Output: DC 12V 30A max. | |
| PTFE Tubing | Found on Amazon.com | ||
| RITEFLOW FLOWMETERS WITH PLAIN ENDS (UNMOUNTED) | Found on:Globalindustrial.com Model number:t9FB3075514 | Item number: H40407-0075 | Monitors air flow in the olfactometer 150mm Scale, Size 2 Manufacturers Part Number:H40407-0075 |
| Screw driver | Found on: Amazon.com Brand:Sharden | Used for screws on olfactometer | |
| Shrimk wrap/tubing(various sizes to fir 18-22 gauge wire | Found on: Amazon.com Brand:eventronic | Material:Made of Polyolefin, Shrinkage Ratio:2:1 (will shrink to 1/2 its supplied diameter) | |
| Silicone Tubing 0.030 x 0.065 | Found on:Amazon.com Brand:Scientific commodities | Tubing for the odor vials | |
| Solder- with lead | Found on:Uline.com | S-25294 | Will be used with the soldering iron |
| Soldering iron | Found on:Uline.com | Model NO. H-10799 | Will be used to solder the Bottons on the control box and other connections |
| Solid State Relay Module Quad Output – Red | Found on: https://www.sealevel.com/ | Part: OB5Q Model: DC Output QSSR Module | Capacitance: 8 pF Dimensions: 2.4" (L) x 1.1" (W) x 3.1" (H) # of I/O : 4 Outputs Max Line Voltage: 60 VDC Max On-State Current: 3A Minimum Line Voltage: 3 VDC Operating Temperature :-30°C to 80°C (-22°F to 176°F) Output Isolation: 4000 Vrms Storage Temperature: -40°C to 100°C (-40°F to 212°F) |
| SPST pushbutton switch | Brand:Apiele Found on: Amazon.com | n/a | Used inside of the control box control water valve and final valve. Operating voltage 250v Current rating: 1 Amps, 3 Amps |
| Ssr-rack 48 | Found on:Radwell.com | SKU: 83105002 | Processes all the connections of the olfactometer and works with quad-type sooid state relays. |
| Stainless steel feeding tubes | |||
| Tip tinner and cleaner | Found on: Amazon.com Brand:Thermaltronics | Model number: FBA-TMT-TC-2 | |
| Valve Ball PVC 1/4” barb buna | Found on: uplastic.com | Item number:62281 | |
| water valve | Found on: Ph.parker.com | Part #: 003-0257-900 | Pumps water into the chamber Maximum Flow Rate: 1500 sccm Voltage (VDC): 24 Maximum Operating Pressure:50 psi, 3.44 bar |
| Wire 22awg | Brand:tuofeng Found on: Amazon.com | N/a | Used to wire different components of the olfactometer Material:copper Gauge 30.0 |
| Wire snips | Found on:Amazon.com Brand:Billbotk | Will be used to snip wires | |
| As Brand: PTFE | Part #036663601452 | Use for delivering odorants. | |
| https://medschool.cuanschutz.edu/neurotechnologycenter/Cores/machine-shop |
Références
- Yeshurun, Y., Sobel, N. An odor is not worth a thousand words: from multidimensional odors to unidimensional odor objects. Annu Rev Psychol. 61, 219-241 (2010).
- Buck, L. B. Unraveling the sense of smell (Nobel lecture). Angew Chem Int Ed Engl. 44, 6128-6140 (2005).
- Spors, H., Wachowiak, M., Cohen, L. B., Friedrich, R. W. Temporal dynamics and latency patterns of receptor neuron input to the olfactory bulb. J Neurosci. 26 (4), 1247-1259 (2006).
- Feinstein, P., Bozza, T., Rodriguez, I., Vassalli, A., Mombaerts, P. Axon guidance of mouse olfactory sensory neurons by odorant receptors and the beta2 adrenergic receptor. Cell. 117 (6), 833-846 (2004).
- Soucy, E. R., Albeanu, D. F., Fantana, A. L., Murthy, V. N., Meister, M. Precision and diversity in an odor map on the olfactory bulb. Nat Neurosci. 12, 210-220 (2009).
- Spors, H., et al. Illuminating vertebrate olfactory processing. J Neurosci. 32, 14102-14108 (2012).
- Kwak, J., Willse, A., Preti, G., Yamazaki, K., Beauchamp, G. K. In search of the chemical basis for MHC odourtypes. Proc Biol Sci. 277 (1693), 2417-2425 (2010).
- Schaefer, M. L., Yamazaki, K., Osada, K., Restrepo, D., Beauchamp, G. K. Olfactory fingerprints for major histocompatibility complex-determined body odors II: relationship among odor maps, genetics, odor composition, and behavior. J Neurosci. 22 (21), 9513-9521 (2002).
- Li, Y., et al. A distinct entorhinal cortex to hippocampal CA1 direct circuit for olfactory associative learning. Nat Neurosci. 20 (4), 559-570 (2017).
- Gadziola, M. A., et al. A neural system that represents the association of odors with rewarded outcomes and promotes behavioral engagement. Cell Rep. 32 (3), 107919 (2020).
- Carlson, K. S., Gadziola, M. A., Dauster, E. S., Wesson, D. W. Selective attention controls olfactory decisions and the neural encoding of odors. Curr Biol. 28 (14), 2195-2205.e4 (2018).
- Moberly, A. H., et al. Olfactory inputs modulate respiration-related rhythmic activity in the prefrontal cortex and freezing behavior. Nat Commun. 9, 1528 (2018).
- Gire, D. H., et al. Information for decision-making and stimulus identification is multiplexed in sensory cortex. Nat Neurosci. 16 (8), 991-993 (2013).
- Ma, M., et al. Molecular layer interneurons in the cerebellum encode for valence in associative learning. Nat Commun. 11 (1), 4217 (2020).
- Bolding, K. A., et al. Robust odor coding across states in piriform cortex requires recurrent circuitry: evidence for pattern completion in an associative network. bioRxiv. , 694331 (2019).
- Bolding, K. A., Franks, K. M. Recurrent cortical circuits implement concentration-invariant odor coding. Science. 361 (6407), eaat6904 (2018).
- Bolding, K. A., Franks, K. M. Complementary codes for odor identity and intensity in olfactory cortex. Elife. 6, e22630 (2017).
- Slotnick, B., Restrepo, D. Olfactometry with mice. Curr Protoc Neurosci. Chapter 8 (Unit 8.20), (2005).
- Williams, E., Dewan, A. Olfactory detection thresholds for primary aliphatic alcohols in mice. Chem Senses. 45 (7), 513-521 (2020).
- Arevalo, N., et al. Open-source JL olfactometer for awake behaving recording of brain activity for mice engaged in olfactory tasks. Animal Models of Reproductive Behavior. Neuromethods. 200, (2023).
- Slotnick, B., Bodyak, N. Odor discrimination and odor quality perception in rats with disruption of connections between the olfactory epithelium and olfactory bulbs. J Neurosci. 22 (10), 4205-4216 (2002).
- Burton, S. D., et al. A novel olfactometer for efficient and flexible odorant delivery. Chem Senses. 44 (3), 173-188 (2019).
- Slotnick, B., Cockerham, R., Pickett, E. Olfaction in olfactory bulbectomized rats. J Neurosci. 24 (41), 9195-9200 (2004).
- Reinert, J. K., Schaefer, A. T., Kuner, T. High-throughput automated olfactory phenotyping of group-housed mice. Front Behav Neurosci. 13, 267 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon