Method Article
Construindo um olfatômetro para estudos de comportamento olfativo de roedores
Neste Artigo
Resumo
Este protocolo descreve a construção de um olfatômetro para experimentos de comportamento olfativo go/no-go. Instruções passo a passo, juntamente com imagens, são fornecidas para garantir a construção bem-sucedida do olfatômetro. Informações para solucionar problemas encontrados durante o processo também estão incluídas.
Resumo
O uso de olfatômetros para estudar o comportamento de roedores e a atividade cerebral durante tarefas olfativas é crucial para a compreensão dos circuitos cerebrais. Esses dispositivos sofisticados permitem que os pesquisadores controlem e forneçam estímulos de odor com precisão, permitindo a investigação de processos olfativos complexos em roedores. Embora os olfatômetros disponíveis comercialmente sejam convenientes, eles apresentam desafios quando surgem problemas técnicos, muitas vezes exigindo assistência cara e potencialmente interrompendo os cronogramas de pesquisa. Este artigo detalha a construção de um olfatômetro personalizado projetado especificamente para experimentos de comportamento olfativo de camundongos, fornecendo uma lista abrangente de peças e instruções passo a passo. O olfatômetro é controlado através do MATLAB, oferecendo uma interface amigável para os pesquisadores. É importante ressaltar que o código-fonte aberto permite que os usuários modifiquem e adaptem o sistema, adaptando tarefas comportamentais para atender a necessidades experimentais específicas. A construção de um olfatômetro personalizado capacita os usuários com o conhecimento e a capacidade de realizar projetos experimentais personalizados e solucionar problemas de forma independente, economizando tempo e recursos. Essa abordagem não apenas aumenta a flexibilidade da pesquisa, mas também promove uma compreensão mais profunda da funcionalidade do equipamento, levando a estudos olfativos mais robustos e confiáveis em roedores.
Introdução
Os intrincados mecanismos subjacentes à tomada de decisão olfativa oferecem insights fascinantes sobre a notável complexidade do sistema de processamento sensorial do cérebro 1,2,3. Dentro do bulbo olfatório de camundongos, uma vasta gama de neurônios sensoriais olfativos converge para aproximadamente 2.200 glomérulos, cada um inervado por neurônios que expressam o mesmo receptor olfativo4. Notavelmente, mesmo odores sintéticos únicos podem estimular uma porção substancial dos cerca de 1.100 receptores olfativos em camundongos 5,6. No entanto, o desafio vai além da detecção inicial de odorantes. A dinâmica temporal da chegada do odor, influenciada pelo ato rítmico de cheirar, enriquece ainda mais a paisagem sensorial, adicionando camadas de informação para o cérebro decifrar. Agravado pela complexidade de estímulos naturais, como a urina coespecífica, que contém centenas de odores, o sistema olfativo enfrenta a formidável tarefa de desembaraçar padrões intrincados de ativação glomerular para diferenciar entre vários cheiros 7,8.
Para enfrentar esse desafio, o cérebro orquestra a atividade neural em várias regiões, incluindo o córtex piriforme, o córtex entorrinal lateral, o hipocampo, o tubérculo olfatório, o córtex pré-frontal e até mesmo o cerebelo 9,10,11,12,13,14. Dentro desses circuitos, as células piramidais no córtex piriforme integram e modulam as informações transmitidas pelas células mitrais, enquanto outras áreas do cérebro contribuem com papéis únicos na formação da percepção olfativa15 , 16 , 17 . Além disso, o processamento de estímulos olfativos pelo cérebro é dinamicamente influenciado por fatores contextuais, ressaltando a adaptabilidade e sofisticação do processo de tomada de decisão olfativa.
Este artigo descreve a construção de um olfatômetro personalizado que permite a avaliação controlada por computador do desempenho comportamental de camundongos que se movem livremente envolvidos em uma tarefa de ir / não ir. Nesta tarefa de aprendizagem associativa, o camundongo privado de água inicia um teste lambendo um bico de entrega de água localizado dentro de um cone de nariz de entrega de odor. Um dos dois odores é administrado 1-1,5 s após o animal iniciar o teste. Se o odorante for o odorante recompensado (S +), o mouse receberá uma recompensa de água se lamber pelo menos uma vez em cada uma das quatro janelas de tempo de 0,5 s (um Hit). Caso contrário, o mouse não recebe nenhuma recompensa (Miss). Se o animal receber o odor não recompensado (S-), nenhuma recompensa é entregue, e se o rato lamber em cada uma das quatro janelas de tempo (Alarme Falso, FA), um atraso de tempo é imposto antes do início do próximo teste. Se o animal não lamber em uma das janelas de tempo, o teste é contado como uma rejeição correta (CR) e nenhum atraso de tempo é aplicado. A porcentagem de desempenho correto é calculada como a porcentagem de tentativas em que o mouse pontua um Hit ou CR em uma janela de vinte tentativas:
Porcentagem correta = 100 ((Acerto + CR) / 20)
Existem duas questões-chave para garantir o funcionamento adequado dos olfatômetros projetados para avaliar o comportamento olfativo go/no-go. Primeiro, o olfatômetro deve monitorar as respostas do mouse em tempo real para fornecer recompensas de odor e água de acordo. Este olfatômetro é obtido monitorando lambedores, seja medindo a resistência entre a tromba d'água e o fundo da câmara ou detectando a capacitância18. Um programa MATLAB usa essas informações para tomar decisões sobre a entrega de odor e a recompensa da água. A segunda questão é a necessidade de entrega confiável e reprodutível de odor. Este olfatômetro é obtido acionando válvulas que equilibram o ar saturado de odor com o ar transportador, que é então entregue a um cone nasal. O ar é equilibrado com o odorante borbulhando-o através de uma solução odorante diluída em óleo mineral. A concentração do odorante é medida com um detector de fotoionização e pode ser calculada com base na pressão de vapor e no coeficiente de atividade, seguindo os procedimentos descritos por Williams e Dewan18,19.
Protocolo
Todos os experimentos foram conduzidos de acordo com protocolos aprovados pelo Comitê Institucional de Cuidados e Uso de Animais do Campus Médico Anschutz da Universidade do Colorado. Os animais utilizados neste estudo foram camundongos CaMKIIα WT machos, com dois meses de idade no momento do implante do tetrodo. Detalhes dos reagentes e equipamentos usados neste estudo são fornecidos na Tabela de Materiais.
1. Placa e solda de botões momentâneos monopolares e de lançamento único (SPST)
- Obtenha o rodapé branco feito sob medida com furos para prender os racks para válvulas de odor, medidores de vazão, placa SSR48 e outros componentes mostrados na Figura 1A.
NOTA: O rodapé branco utilizado neste estudo foi produzido pela Oficina Mecânica do Centro de Neurotecnologia do Campus Médico Anschutz (Figura 1A). Os arquivos de design estão disponíveis em - Adicione parafusos de 1 polegada e espaçadores de 3/4 de polegada para a colocação do SSR48-RACK. Os parafusos estão localizados na parte superior direita da parte traseira do quadro branco (Figura 1A).
- Monte o SSR48-RACK. O SSR48-RACK estará localizado no lado superior esquerdo da parte traseira do quadro branco (Figura 1C).
- Faça furos (0.4 cm) para colocar os blocos de réguas de terminais de parafuso na parte de trás do quadro branco. Os blocos de réguas de terminais de parafuso estarão localizados no meio direito da parte traseira do quadro branco (Figura 1D).
- De cima para baixo: O primeiro bloco de régua de terminais de 4 parafusos será usado para conectar fios de 24 V. O próximo bloco de régua de terminais de parafuso será usado para fios de 5 V. Deixe um bloco de régua de terminais de parafuso vazio e os últimos 4 blocos de réguas de terminais de parafuso serão usados para conectar os fios terra.
- Faça furos (0.8 cm) na caixa de controle para colocação dos interruptores de botão momentâneos SPST. A caixa de controle estará localizada na parte inferior frontal do quadro branco (Figura 1E).
- Configure os interruptores de botão momentâneos SPST. Solde dois fios ao botão momentâneo SPST. É preferível usar duas cores diferentes, como vermelho e preto ou verde (Figura 1F).
- Conecte o botão momentâneo SPST à caixa de controle. Os botões de pressão vêm com uma porca que é usada para prender à caixa preta do controle (Figura 1G).
- Prenda os fios torcendo-os ou prendendo-os com fita adesiva para mantê-los juntos e organizados.
NOTA: A alimentação de 24 V é usada para alimentar as válvulas de aperto e válvulas de odor, e a alimentação de 5 V é usada para o circuito de lambida. - Coloque as válvulas de odor nas ranhuras do rack da válvula de odor localizadas no centro do quadro branco (Figura 2A).
- Descasque os fios que saem das válvulas e solde um fio de cada válvula em um fio mais grosso. Coloque um fio no aterramento nos blocos de régua de terminais de parafuso na parte traseira do quadro branco e um segundo fio no pino correspondente no SSR48-RACK. Por exemplo, a válvula de odor 1 vai para o pino 1, a válvula de odor 2 vai para o pino 2, etc. (Figura 2B).
- Conecte os pinos 1 a 8 no SSR48-RACK a duas válvulas de aperto cada (válvulas de entrada e saída para os frascos de equilíbrio de óleo mineral). Para cada válvula, conecte um fio de um botão à alimentação de 24 V e o outro fio ao pino do SSR48-RACK que está conectado à válvula. O outro fio vai da válvula para o terra. Consulte a Figura 2B,C para colocar os fios em seu lugar.
- Coloque a válvula de água e a válvula final nas ranhuras correspondentes na placa da válvula. O slot está localizado no meio do quadro branco. Veja a placa da válvula na Figura 1 e a colocação das válvulas na Figura 3A.
- Conecte a válvula de água e a válvula final ao terra e aos pinos 17 e 18, respectivamente, no SSR48-RACK. Conecte os botões a 24 V e aos pinos 17 e 18 (Figura 2B).
2. Fonte de alimentação
- Compre uma fonte de alimentação e um cabo de extensão. Informações sobre o tipo específico de fonte de alimentação podem ser encontradas na Tabela de Materiais. A fonte de alimentação fornecerá saídas de 24 V (V3) e 5 V (V1) e aterramento para o olfatômetro.
- Corte o plugue do cabo de alimentação da fonte de alimentação. Especificamente, a parte feminina do cabo de extensão. Uma vez cortado, três fios podem ser vistos. O fio verde é conectado a G (terra) na fonte de alimentação, e os outros dois fios (branco e preto) são conectados a L e N, respectivamente, da entrada de 120 V CA para a fonte de alimentação (Figura 3B).
CUIDADO: Os fios de alimentação de 120 V estão expostos e existe o risco de ferimentos por choque elétrico. É melhor cobri-lo com um isolante. - Corte uma extremidade do fio que alimenta o SSR48-RACK. Conecte um dos fios ao parafuso G na fonte de alimentação e o segundo ao V1 da fonte de alimentação (Figura 3C).
- Na fonte de alimentação, conecte um fio de G2 ao terra nos blocos de régua de terminais de parafuso (Figura 2C).
- Na fonte de alimentação, conecte um fio de V1 aos blocos de régua de terminais de parafuso de 5 V (Figura 2C).
- Na fonte de alimentação, conecte um fio de V3 aos blocos de régua de terminais de parafuso de 24 V (Figura 2C).
3. Placa do sensor de lamber
- Obtenha uma placa de ensaio de 400 pontos de amarração e passe um fio que se conecte dos pontos de amarração B7 a B15 (Figura 3D).
- Conecte uma extremidade de um fio ao ponto de amarração 6+ e a outra extremidade ao ponto de amarração C22 da placa de ensaio (Figura 3D).
- Conecte uma extremidade em D16 e a segunda extremidade a G22 da placa de ensaio (Figura 3D).
- Conecte uma extremidade de um fio ao slot I22 e a segunda extremidade a 29- da placa de ensaio (Figura 3D).
- Conecte uma extremidade de um fio ao slot 20A e a segunda extremidade a 29A da placa de ensaio (Figura 3D).
- Conecte uma extremidade de um fio a 21B e a segunda extremidade a 28B da placa de ensaio (Figura 3D).
- Conecte uma extremidade de um fio ao slot 1+ da placa de ensaio e a segunda extremidade aos 5 V dos blocos de régua de terminais de parafuso (Figura 3D).
- Conecte uma extremidade de um fio ao slot 1- da placa de ensaio e a segunda extremidade ao aterramento dos blocos de régua de terminais de parafuso (Figura 3D).
- Conecte uma extremidade de um fio ao slot C7 da placa de ensaio e a segunda extremidade ao pino 27 no SSR-48RACK (Figura 3D).
- Conecte uma extremidade de um fio ao slot 28C da placa de ensaio e a segunda extremidade terá um clipe jacaré conectado que se conectará à parte metálica da tromba d'água (Figura 3D).
- Conecte uma extremidade de um fio ao slot 20B da placa de ensaio e a outra extremidade ao terminal do meio do potenciômetro (Figura 3D). Os dois terminais conectados aos elementos de resistência do potenciômetro são conectados ao terra e 5 V. O terminal do meio é conectado à placa de ensaio.
- Obtenha resistores de 21 mΩ. Para o primeiro, conecte uma extremidade a 19A e a segunda extremidade a 20D. Para o segundo, conecte uma extremidade a 22C e a outra extremidade a 21D. Conecte ao potenciômetro (Figura 3D).
- Obtenha um resistor de kΩ. Conecte uma extremidade a 14C e a segunda extremidade a 19C. Conecte ao potenciômetro (Figura 3D).
- Obtenha um resistor de 120 Ω. Conecte uma extremidade a 7D e a segunda extremidade a 7H (Figura 3D).
- Obtenha uma luz LED. A cor não importa. Conecte um fio de LED a 7J e o segundo fio a 6- (Figura 3D).
- Obtenha dois amplificadores operacionais (amplificadores operacionais). As conexões para o primeiro são E10 a E16, F10-F16 (Figura 3D).
4. Abastecimento de ar e água
- Coloque dois medidores de vazão (um de 2 L/min e um de 50 cc/min) nos suportes dos medidores de vazão. A Figura 4A mostra o sistema geral de fluxo de ar e a Figura 4B mostra a visão ampliada dos medidores de vazão.
- Obtenha uma bomba de aquário para fornecer um fluxo de ar de 2 L/min. O modelo de bomba de aquário usado aqui tem duas saídas (consulte a Tabela de Materiais). Conecte um pequeno pedaço de tubo de cada uma das duas saídas da bomba do aquário às duas entradas de um conector T (Figura 4B).
- Conecte um pedaço de tubo da saída do conector T à entrada de um filtro de carvão ativado (Figura 4B).
- Conecte a tubulação da saída do filtro de carbono a um conector T e conecte as duas saídas do conector a uma válvula de esfera para ajustar a taxa de fluxo de ar (Figura 4C).
- Conecte a saída de cada válvula de esfera à entrada dos medidores de vazão (Figura 4D).
- Conecte a saída do medidor de vazão de 50 cm/min ao coletor superior, fornecendo ar aos frascos de equilíbrio de odores de 40 mL com odorantes diluídos em óleo mineral (Figura 4E).
- Conecte a saída de cada frasco de odor à entrada correspondente no coletor inferior.
- Os tubos que conectam os frascos de odor aos coletores são tubos de válvula de aperto que são abertos pelas duas válvulas de aperto separadas. Coloque a tubulação nas válvulas de aperto.
- Conecte a saída do medidor de vazão de 2 L/min à entrada da entrada lateral do coletor inferior.
- Conecte a saída do coletor inferior à entrada da válvula final (desviante) (Figura 4F).
- Conecte a saída padrão da válvula final ao tubo de entrega de odor na câmara go/no-go. Conecte a saída padrão da válvula final a um tubo de escape (Figura 4G). Isso resulta em um fluxo de ar contínuo não odorizado de 2 L/min quando a válvula final está desligada.
- Para cada tentativa, certifique-se de que a válvula final ligue quando o animal lamber, levando o ar para o escapamento e, simultaneamente, a válvula de odor seja ligada. Isso resulta no equilíbrio do odor no fluxo de ar de fundo.
- Após 1-1.5 s, certifique-se de que a válvula final se desligue, desviando o ar de volta para a câmara. Isso resulta em um aumento acentuado na concentração de odorantes. Após 2,5 s, a válvula de odor desliga e a concentração de odor retorna a 0.
- Conecte uma agulha de 18 G à ponta da seringa de 5 mL que será usada para fornecer a recompensa da água (Figura 4H).
- Conecte um tubo (2 mm de diâmetro) à ponta da agulha (Figura 4H).
- Conecte a outra extremidade do tubo à entrada da válvula de água. Pode ser necessário cortar um tubo de diâmetro diferente para encaixar na entrada da válvula de água (Figura 4I).
- Conecte o tubo da saída da válvula de água ao bico de lambe-lamber (Figura 5A).
5. Conectando o olfatômetro ao computador e instalando o software
- Conecte o SSR48-RACK ao DIO96H/50 com um conector fêmea para fêmea de 100 pinos. Conecte o cabo USB do DIO96/H50 ao computador (Figura 5B).
- Baixe a versão mais recente do software e drivers mccdaq e InstaCal.
NOTA: InstaCal é o programa que testa a comunicação entre o computador e o DIO96/H50. Baixe o software e os drivers mais recentes aqui: https://www.mccdaq.com/software-downloads.aspx. - Execute o InstaCal. Certifique-se de que o "Universal Serial Bus" liste a placa # como o número correto, geralmente #1 = Placa #1 USB-DIO96H/50.
- Baixe o MATLAB.
- Baixe os programas MATLAB para executar o olfatômetro do https://github.com/restrepd/dropc.
- Abra o MATLAB como administrador e defina o caminho para que o MATLAB reconheça os programas. Na guia Início do ambiente MATLAB, clique em Definir caminho na seção Ambiente. Isso abre uma caixa de diálogo onde você pode adicionar pastas no caminho de pesquisa.
- Execute daqregister('mcc'). Altere o número da placa em dropcInitializePortsNow.m.
NOTA: handles.dio = digitalio('mcc',1); %(1 ou 0 dependendo do computador). - Teste o dropcspm.m realizando uma simulação em que o usuário "responde" a cada tentativa conectando o circuito elétrico entre o bico de lambida e o piso de metal da câmara que está aterrada.
NOTA: O olfatômetro está pronto para uso. Informações sobre como treinar o camundongo são encontradas em Nicole Arevalo et al.20.
6. Experimentos com animais
- Prepare os animais com cuidado para iniciar o processo experimental. Pese cada camundongo individualmente usando uma balança calibrada e registre o peso em um registro de laboratório. Monitore esses dados cruciais ao longo do estudo para acompanhar a saúde dos animais e abordar quaisquer alterações de peso imediatamente.
- Coloque os ratos suavemente na câmara do rato especialmente projetada após a pesagem. Ative os sensores e sistemas de entrega de estímulos para a tarefa de discriminação olfativa. Certifique-se de que a câmara minimize o estresse sobre os animais, mantendo o controle preciso das condições experimentais.
- Certifique-se de que o animal esteja confortável na câmara. Inicie o programa MATLAB para controlar parâmetros experimentais, como fornecer estímulos de odor (2,5 s), dispensar água e registrar respostas. Analise os dados em tempo real para obter feedback imediato sobre o desempenho do animal.
- Monitore e analise o desempenho do animal continuamente. Observe a pontuação de proficiência calculada com base na porcentagem de respostas corretas. Procure que cada animal atinja uma pontuação de desempenho de 80 ou mais, o que marca o limite para a proficiência na tarefa.
- Comece a nova fase do experimento assim que o animal atingir consistentemente uma pontuação de proficiência de 80 ou superior, indicando domínio da discriminação inicial do par de odores. Inverta o par de odores, deixando o cheiro anteriormente recompensado sem recompensa e vice-versa.
- Teste a flexibilidade cognitiva do animal e a capacidade de desaprender e reaprender associações, obtendo assim informações valiosas sobre a plasticidade do aprendizado olfativo em camundongos.
Resultados
Seguindo o protocolo descrito aqui, um olfatômetro pode ser configurado para testar o comportamento go/no-go de camundongos diferenciando entre odores. A Figura 6A mostra o comportamento de um camundongo durante o primeiro dia de treinamento na tarefa go/no-go, usando acetato de etila como odorante S+ e uma combinação de acetato de etila e acetato de propila como S-. A porcentagem correta é calculada como a porcentagem de tentativas em que o mouse obtém um acerto ou rejeição correta. Inicialmente, o mouse começou com 50% correto porque lambeu em resposta a ambos os odores. No entanto, após várias tentativas, aprendeu a lamber apenas para o S+ e parou de lamber para o S-. A Figura 6B mostra a porcentagem correta para o último dia da tarefa go/no-go na direção para frente, onde o animal alcançou proficiência com desempenho de 80% ou mais. Nesse ponto, os odores foram invertidos (REV), com acetato de etila como odorante S- e a combinação de acetato de etila e acetato de propila como S+. A Figura 6C mostra a porcentagem correta no primeiro dia da tarefa go/no-go na direção inversa, onde o desempenho do mouse caiu para 10%. F mostra o desempenho do mouse no último dia de reversão, onde ele novamente alcançou proficiência.

Figura 1: Parte frontal do quadro branco do olfatômetro e fiação. (A) As dimensões do olfatômetro são 22" L x 16" A x 8.5" P, mostradas sem fiação ou interface/placas de lamber, conforme fornecido pela oficina da máquina. Os furos são pré-perfurados para válvulas de odor, termômetros, válvulas de água e finais, seringa de água, rack de garrafa de odor, rack de válvula de odor e câmara do mouse. (B) O olfatômetro preparado com os 8 parafusos necessários para montar o SSR48-RACK no lado esquerdo traseiro. (C) Olfatômetro com SSR48-RACK montado, incluindo relés conectados. (D) Blocos de réguas de terminais de parafuso adicionados ao olfatômetro, com seções designadas para 12 V, 5 V e terra. (E) Caixa preta de controle com furos perfurados para interruptores de botão momentâneos SPST, com fita adesiva rotulando cada botão pelo controle da válvula. (F) Interruptor de botão momentâneo SPST com dois fios retráteis codificados por cores soldados para proteger as áreas expostas. (G) Interruptor de botão momentâneo SPST montado na caixa preta de controle e preso com a porca sextavada incluída. Clique aqui para ver uma versão maior desta figura.
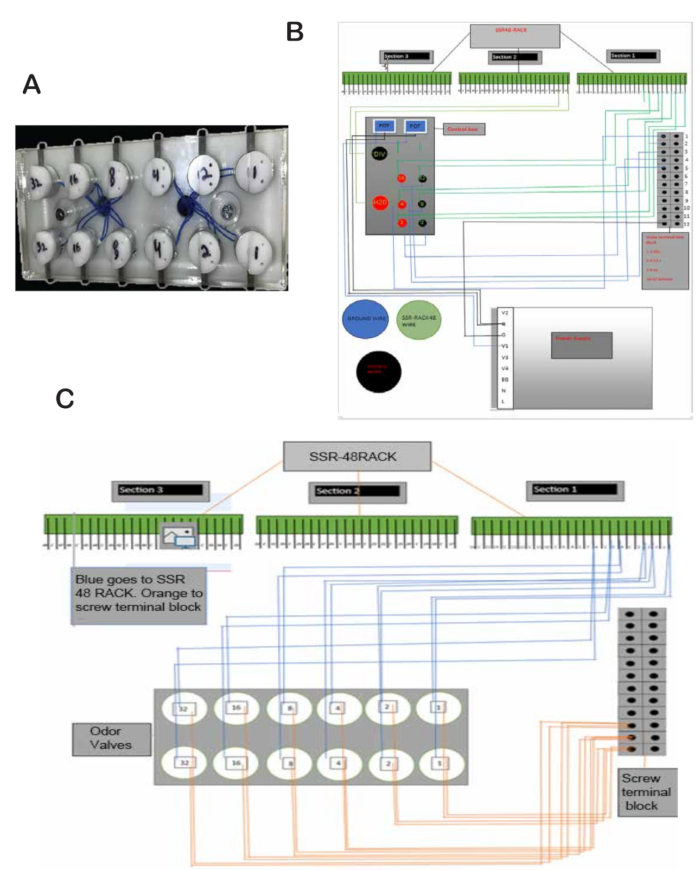
Figura 2: Válvulas de odor e esquemas. (A) Válvulas de odor encaixadas com segurança em ranhuras e fixadas com parafusos. (B) Esquema da fiação da válvula de odor para o SSR48-RACK e blocos de régua de terminais de parafuso. (C) Esquema de fiação da caixa preta de controle, fonte de alimentação, SSR48-RACK e blocos de régua de terminais de parafuso. Clique aqui para ver uma versão maior desta figura.

Figura 3: Configuração final da válvula de água e com fonte de alimentação. (A) Água e válvulas finais adicionadas às ranhuras designadas no olfatômetro e presas com parafusos. (B) Fiação da fonte de alimentação conectada para alimentar o olfatômetro. (C) Fiação de alimentação para o SSR48-RACK. (D) Sensor de lamber com componentes conectados, incluindo resistores, fios, LED e amplificador operacional. Clique aqui para ver uma versão maior desta figura.

Figura 4: Sistema de suprimento de ar com medidores de vazão e tubulação. (A) Medidores de vazão fixados ao rack com parafusos. (B) Bomba de aquário conectada à tubulação, unida a uma junta em T. (C) Um filtro de carbono com tubulação conectada na saída, com conexões a reguladores individuais. (D) Tubulação de reguladores conectados às entradas do medidor de vazão. (E) Tubulação conectada às saídas do medidor de vazão. (F) Tubulação do coletor até a entrada final da válvula. (G) Válvula final com tubulação conectada à porta de odor do olfatômetro. (H) Seringa de 5 mL cheia de água, tubo conectado a uma agulha de 18 G. (I) Tubulação conectada à entrada da válvula de água. Clique aqui para ver uma versão maior desta figura.

Figura 5: Conexões finais da válvula de água e visão geral do sistema. (A) Tubulação da saída da válvula de água para o lixit no olfatômetro. (B) Conexão do olfatômetro ao DIO96H/50 usando um cabo fêmea-fêmea. Clique aqui para ver uma versão maior desta figura.
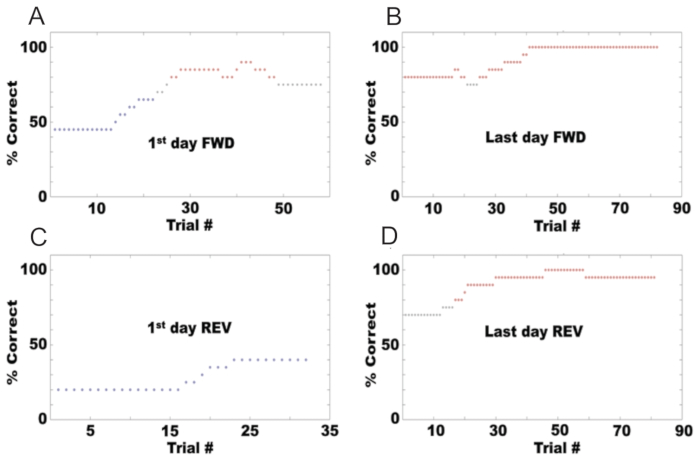
Figura 6: Exemplo de desempenho comportamental em uma tarefa go/no go para um mouse. A porcentagem de respostas corretas em cada sessão é exibida para: (A) O primeiro dia de condicionamento avançado (S+: acetato de isoamila a 1%, S-: óleo mineral). (B) O último dia de condicionamento avançado. (C) O primeiro dia após a reversão (S+: óleo mineral, S-: acetato de isoamila a 1%). (D) O último dia de condicionamento reverso. Clique aqui para ver uma versão maior desta figura.
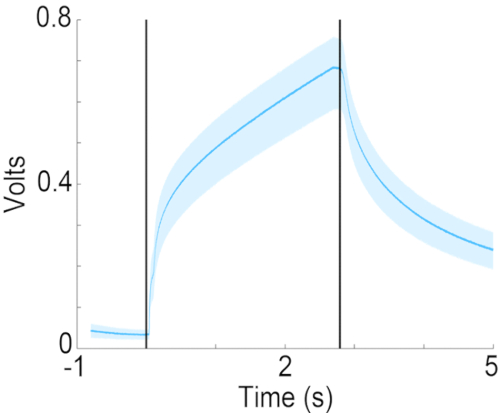
Figura 7: Curso de tempo de concentração de acetato de isoamila na porta de odor. Concentração medida de acetato de isoamila a 10% (diluído em óleo mineral) na porta de odor, usando um dispositivo de fotoionização (PID). As linhas verticais indicam o início e o fim da entrega do odor. Clique aqui para ver uma versão maior desta figura.
Discussão
Um guia passo a passo abrangente para a construção de um olfatômetro projetado para tarefas de associação de odores pode ser encontrado na literatura. Os pesquisadores podem encontrar vários desafios durante a montagem e operação do dispositivo, mas, felizmente, existem métodos de solução de problemas estabelecidos para resolver esses problemas. Uma vez construído e calibrado adequadamente, o olfatômetro serve como uma ferramenta inestimável para cientistas que conduzem experimentos relacionados ao olfato, permitindo o controle preciso e a entrega de estímulos de odor.
Etapas críticas
A versão do MATLAB baixada deve ser 2015, pois o código escrito é compatível com esta versão, e o uso de qualquer outra versão pode causar problemas. É importante verificar se a placa correta está selecionada no instacall. A instalação do mcc.dill pode ser realizada executando daqregister('mcc') enquanto estiver conectado como administrador do MATLAB.
Solucionando problemas
No início de cada semana de treinamento, execute o software de calibração (InstaCal) para certificar-se de que o PC e o olfatômetro estejam interagindo corretamente. Abra este programa, clique na placa e clique em Calibração Digital. A taxa de fluxo de ar precisa ser verificada. O fluxo de ar de fundo deve ser de 2 L/min e o fluxo para os frascos de equilíbrio de odores deve ser de 50 mL/min. É extremamente importante verificar rotineiramente a taxa de fluxo de ar na saída do olfatômetro.
Antes de colocar um mouse, é importante garantir que os seguintes parâmetros sejam testados: (1) Válvulas de odor: As válvulas de odor devem ser clicadas ao pressionar o botão na caixa preta. A tubulação de ar deve borbulhar no óleo mineral, sem óleo mineral preso na tubulação. (2) Tubulação de odor: Se os odores não produzirem bolhas, a tubulação pode ser bloqueada onde normalmente aperta perto da válvula. A substituição da tubulação pode ser necessária. (3) Válvula final e válvula de água: A válvula final deve abrir corretamente, com a tubulação verificada quanto ao funcionamento adequado. Para a válvula de água, qualquer ar que bloqueie o fluxo de água deve ser limpo, permitindo que a água flua para o lixit. (4) Fluxo de ar: Os medidores de vazão precisam parecer calibrados e posicionados adequadamente. (5) Luzes do relé: Certifique-se de que as "luzes" nos relés sejam ativadas corretamente durante o experimento. (6) Relé de recompensa de água: Quando uma recompensa de água é dispensada, o relé acima da água deve piscar enquanto distribui a recompensa. (7) Relé de recompensa de odor e água: Quando um odor é emparelhado com uma recompensa de água, o relé vermelho acima do número da válvula correspondente deve piscar em vermelho durante a recompensa.
Limitações
A tarefa go/no-go testa a capacidade do mouse de testar 2 odores. Para executar a tarefa, o animal deve passar por várias sessões. Esta não é uma técnica de alto rendimento para testar a discriminação de odores. O olfatômetro é projetado para testar estímulos olfativos. Não é um aparelho de teste multissensorial. No entanto, modificações podem ser feitas para testar outras entradas sensoriais.
Este artigo descreve um olfatômetro de diluição líquida onde o ar borbulhando através do odorante diluído em óleo mineral a uma taxa de 50 mL/min é pré-equilibrado com o fluxo de ar de fundo a 2 L/min. Para este projeto de entrega de odor, a cinética de diluição do odor no fluxo de ar transportador determina a velocidade do aumento na concentração do odor no fluxo de ar de fundo. Como mostrado na Figura 7, enquanto a concentração aumenta dentro de 200 ms para metade da concentração final, a taxa de mudança de concentração diminui além de meio segundo. Embora essa configuração não produza uma mudança quadrada na concentração de odores, ela tem sido usada com sucesso para estudar a discriminação e detecção de odores21. Se o protocolo experimental exigir uma mudança radical na concentração de odor, o projeto para a entrega de odor deve ser modificado para três canais contínuos de fluxo de ar de fundo de 2 L/min, onde os odores são continuamente fornecidos ao fluxo de ar de fundo de dois dos canais de fluxo de ar de fundo. O terceiro canal de entrega forneceria ar equilibrado com óleo mineral. Nesse caso, válvulas de desvio seriam usadas para desviar um dos dois odores ou ar livre de odores para a porta de odor. Isso resultaria em aumentos graduais na concentração de odor na porta de odor (também relatórios anteriores 19,22). Independentemente disso, é fundamental documentar o curso do tempo para a mudança na concentração de odor usando um detector de fotoionização.
O olfatômetro descrito aqui é projetado para experimentos comportamentais de camundongos, no entanto, esse design foi usado no passado para ratos. A principal diferença é que é necessário aumentar o tamanho da câmara para estudos com ratos23. Finalmente, este olfatômetro avalia o comportamento olfativo de um único camundongo. Um olfatômetro automatizado de alto rendimento foi descrito para testar vários camundongos24.
Significado
Este protocolo descreve um olfatômetro feito sob medida, que reduz custos em comparação com outros métodos disponíveis.
Aplicações futuras
O olfatômetro é projetado especificamente para uso com camundongos e requer modificações para uso com outros animais, como ratos. Recursos adicionais, como um sistema de gravação com vários eletrodos (por exemplo, uma placa de gravação com vários eletrodos), uma placa Arduino Uno ou uma câmera, também podem ser incorporados.
Divulgações
Os autores não têm nada a divulgar e não há interesses financeiros concorrentes.
Agradecimentos
Esta pesquisa foi apoiada por doações do NIH K01 NS127850-01, R25 NS080685, R01 NS081248 e DC000566. Gostaríamos de agradecer a todos os membros do laboratório de Restrepo e Ramirez-Gordillo por seu apoio.
Materiais
| Name | Company | Catalog Number | Comments |
| 2 1/8’’ modular ic breadboard socket | found on: amazon.com | ASIN : B004MCSOQY | Powers the lights and lick censor |
| 500 piece assorted carbon film resistors 1/4 watt | Found on amazon.com Brand:bojack | Resisters will go on the BreadBoard socket | |
| 50k-ohm linear taper potentiometer | Brand:TWTADE Found on: Amazon.com | Allows to the components of the olfactometer Power supply: Ac 220v-6A Shift diameter: 6mm/0.2” Shaft length: 15mm/0.59” mounting thread. Knob size 15/17mm/0.6 x 0.67”(d*H) the adjustment of power | |
| 5mm red LED | Found on: Amazon.com Brand:EDGELEC | Pre-wired with built in Resistor; 5mm round top bulb and wired LED's-Easy Connection with 3-6V DC Drive it, 7.9 inch long wires. Wattage: 1 Watts | |
| 6 position dual row brrier strip | Found on: Digikey.com | Base Product Number 1546306 | Used for power and ground depending on how it is connected Voltage rating:300v Current rating (amps):20A Wire gauge:12-22 AWG |
| 96 high current 50 pin connector female to female | Found on: Amazon.com Brand: IIVVERR | Part Number:f5c953ee65a980d | Weight: 109G Pitch:2.54mm Total size: 50x6.4cm/2x2.5 inch |
| Aquarium pump -AAPA7.8L 125 GPH, 2 OUTLETS 3W | Found on:Amazon.com Brand: Hydrofarm store | This will connect to the double open end cold water housing and will be used to power the air on the machine | |
| Barbed Tee connector polyethylene 1/4” | Found on: Uplastic.com | Item number:62200 | Connects different air hoses to each other |
| Barbed Tee connector polyethylene 3/16” | Found on: Uplastic.com | Item number:62063 | Connects different air hoses to each other |
| BD general use precision glide hypodermic needle 18 G ½ | Found on: Medneedles.com | Item number: BD 305195 | Used for the water system |
| Black box/manual control box | Brand:Otdorpatio Found on: Amazon | n/a | Used as the control box Dimensions: 3.94x2.68x1.97 |
| Cable, pc power supply internal connections 10ft | Found on: Amazon.com | Connects to the power supply 40 watts | |
| Cflex tubing, white ¼” id x 3/8” OD | Found on:uplastic.com | Item number:54033 | Tubing used in the air system |
| custom-made white base board with holes to fasten the racks for odor valves, flow meters, SSR48 board | The Machine Shop of the Neurotechnology Center in the CU Anschutz Medical Campus | ||
| Diverter valve—miniature inert liquid valve, 3 way | Found on:Radwell.com | Part number:003-0258-900 | 1/8th BARB 24VDC UP TO 1500 SCCM 4.2W |
| Double open end cold water housing with blue sump | Found on:GRAINGER.COM BrandPENTAIR/PENTEK | Compatible Mfr. Model Number150295; 150578; 151117; 151118; 151120; 155003; 244043; 244686; 244687 | |
| Fisherbrand glass EPA vials | Found on: fishersci.com | Catalog no. 02-912-379 | Used for odors |
| Fitting reducer 1/4” x 1/8” | Found on: uplastic.com | Item number: 64370 | Adapter used in the air system hoses. |
| Hard Tubing, intramedic polyethylene, 0.045 (ID) 1 x 100 | |||
| High infrared LED | Found on amazon.com Brand: gikfun | Memory clock speed 1mhz | |
| Ic opamp gp 4 circuit 14dip | Found on: Amazon.com Brand:BOJACK | Operating Voltage 50 Volts Maximum Voltage 50 Volts | |
| Jumper wire kit | Found on: Amazon.com Brand:Elegoo | Item Dimensions LxWxH: 0.04 x 8.27 x 0.04 inches | |
| Mini spst momentary switch | Brand:Radioshack Found on: Amazon.com | B000TLWZM6 | Used for the odor valves Operating volage: 250V Current rating:1 Amps |
| Multimeter | Found on Amazon.com Brand:AstroAl | Accurately measures AC/DC Current, AC/DC Voltage, Capacitance, Frequency, Duty Cycle, Resistance, Diode, Continuity and Temperature | |
| Needle nose | Found on:amazon.com Brand:WorkPro | Will be used to bend wires | |
| Odor valves | Found on:Radwell.com | SKU: 192833415 Part number:225T031 | Pumps odors from odor vials. 30 PSIG 12 VDC |
| Phototransistor | Found on: Amazon.com Brand:HILETGO | Voltage: 1.3-1.5V Receive Range: (NM) 400-1000 Head Size: 5mm x 5mm / 0.2" x 0.2"(D*L) | |
| Phototransistor and LED as pair | |||
| Pipe adapter 3/4” x 1/4” | Found on: uplastic.com | Item number: 64807 | Adapter used in the air system hoses. |
| Pipe adapter for water housing pump- m ¾ x1/4” | Usplastic.com | Item number: 64807 | Temperature range -50f to 275F Maximum pressure: 150psi Weoght 0.0015 lbs |
| Power supply 12v 30A 360W | Found on: Amazon.com Brand:ALITOVE | the main power source of the machine. Input Voltage: 220 Volts Output: DC 12V 30A max. | |
| PTFE Tubing | Found on Amazon.com | ||
| RITEFLOW FLOWMETERS WITH PLAIN ENDS (UNMOUNTED) | Found on:Globalindustrial.com Model number:t9FB3075514 | Item number: H40407-0075 | Monitors air flow in the olfactometer 150mm Scale, Size 2 Manufacturers Part Number:H40407-0075 |
| Screw driver | Found on: Amazon.com Brand:Sharden | Used for screws on olfactometer | |
| Shrimk wrap/tubing(various sizes to fir 18-22 gauge wire | Found on: Amazon.com Brand:eventronic | Material:Made of Polyolefin, Shrinkage Ratio:2:1 (will shrink to 1/2 its supplied diameter) | |
| Silicone Tubing 0.030 x 0.065 | Found on:Amazon.com Brand:Scientific commodities | Tubing for the odor vials | |
| Solder- with lead | Found on:Uline.com | S-25294 | Will be used with the soldering iron |
| Soldering iron | Found on:Uline.com | Model NO. H-10799 | Will be used to solder the Bottons on the control box and other connections |
| Solid State Relay Module Quad Output – Red | Found on: https://www.sealevel.com/ | Part: OB5Q Model: DC Output QSSR Module | Capacitance: 8 pF Dimensions: 2.4" (L) x 1.1" (W) x 3.1" (H) # of I/O : 4 Outputs Max Line Voltage: 60 VDC Max On-State Current: 3A Minimum Line Voltage: 3 VDC Operating Temperature :-30°C to 80°C (-22°F to 176°F) Output Isolation: 4000 Vrms Storage Temperature: -40°C to 100°C (-40°F to 212°F) |
| SPST pushbutton switch | Brand:Apiele Found on: Amazon.com | n/a | Used inside of the control box control water valve and final valve. Operating voltage 250v Current rating: 1 Amps, 3 Amps |
| Ssr-rack 48 | Found on:Radwell.com | SKU: 83105002 | Processes all the connections of the olfactometer and works with quad-type sooid state relays. |
| Stainless steel feeding tubes | |||
| Tip tinner and cleaner | Found on: Amazon.com Brand:Thermaltronics | Model number: FBA-TMT-TC-2 | |
| Valve Ball PVC 1/4” barb buna | Found on: uplastic.com | Item number:62281 | |
| water valve | Found on: Ph.parker.com | Part #: 003-0257-900 | Pumps water into the chamber Maximum Flow Rate: 1500 sccm Voltage (VDC): 24 Maximum Operating Pressure:50 psi, 3.44 bar |
| Wire 22awg | Brand:tuofeng Found on: Amazon.com | N/a | Used to wire different components of the olfactometer Material:copper Gauge 30.0 |
| Wire snips | Found on:Amazon.com Brand:Billbotk | Will be used to snip wires | |
| As Brand: PTFE | Part #036663601452 | Use for delivering odorants. | |
| https://medschool.cuanschutz.edu/neurotechnologycenter/Cores/machine-shop |
Referências
- Yeshurun, Y., Sobel, N. An odor is not worth a thousand words: from multidimensional odors to unidimensional odor objects. Annu Rev Psychol. 61, 219-241 (2010).
- Buck, L. B. Unraveling the sense of smell (Nobel lecture). Angew Chem Int Ed Engl. 44, 6128-6140 (2005).
- Spors, H., Wachowiak, M., Cohen, L. B., Friedrich, R. W. Temporal dynamics and latency patterns of receptor neuron input to the olfactory bulb. J Neurosci. 26 (4), 1247-1259 (2006).
- Feinstein, P., Bozza, T., Rodriguez, I., Vassalli, A., Mombaerts, P. Axon guidance of mouse olfactory sensory neurons by odorant receptors and the beta2 adrenergic receptor. Cell. 117 (6), 833-846 (2004).
- Soucy, E. R., Albeanu, D. F., Fantana, A. L., Murthy, V. N., Meister, M. Precision and diversity in an odor map on the olfactory bulb. Nat Neurosci. 12, 210-220 (2009).
- Spors, H., et al. Illuminating vertebrate olfactory processing. J Neurosci. 32, 14102-14108 (2012).
- Kwak, J., Willse, A., Preti, G., Yamazaki, K., Beauchamp, G. K. In search of the chemical basis for MHC odourtypes. Proc Biol Sci. 277 (1693), 2417-2425 (2010).
- Schaefer, M. L., Yamazaki, K., Osada, K., Restrepo, D., Beauchamp, G. K. Olfactory fingerprints for major histocompatibility complex-determined body odors II: relationship among odor maps, genetics, odor composition, and behavior. J Neurosci. 22 (21), 9513-9521 (2002).
- Li, Y., et al. A distinct entorhinal cortex to hippocampal CA1 direct circuit for olfactory associative learning. Nat Neurosci. 20 (4), 559-570 (2017).
- Gadziola, M. A., et al. A neural system that represents the association of odors with rewarded outcomes and promotes behavioral engagement. Cell Rep. 32 (3), 107919 (2020).
- Carlson, K. S., Gadziola, M. A., Dauster, E. S., Wesson, D. W. Selective attention controls olfactory decisions and the neural encoding of odors. Curr Biol. 28 (14), 2195-2205.e4 (2018).
- Moberly, A. H., et al. Olfactory inputs modulate respiration-related rhythmic activity in the prefrontal cortex and freezing behavior. Nat Commun. 9, 1528 (2018).
- Gire, D. H., et al. Information for decision-making and stimulus identification is multiplexed in sensory cortex. Nat Neurosci. 16 (8), 991-993 (2013).
- Ma, M., et al. Molecular layer interneurons in the cerebellum encode for valence in associative learning. Nat Commun. 11 (1), 4217 (2020).
- Bolding, K. A., et al. Robust odor coding across states in piriform cortex requires recurrent circuitry: evidence for pattern completion in an associative network. bioRxiv. , 694331 (2019).
- Bolding, K. A., Franks, K. M. Recurrent cortical circuits implement concentration-invariant odor coding. Science. 361 (6407), eaat6904 (2018).
- Bolding, K. A., Franks, K. M. Complementary codes for odor identity and intensity in olfactory cortex. Elife. 6, e22630 (2017).
- Slotnick, B., Restrepo, D. Olfactometry with mice. Curr Protoc Neurosci. Chapter 8 (Unit 8.20), (2005).
- Williams, E., Dewan, A. Olfactory detection thresholds for primary aliphatic alcohols in mice. Chem Senses. 45 (7), 513-521 (2020).
- Arevalo, N., et al. Open-source JL olfactometer for awake behaving recording of brain activity for mice engaged in olfactory tasks. Animal Models of Reproductive Behavior. Neuromethods. 200, (2023).
- Slotnick, B., Bodyak, N. Odor discrimination and odor quality perception in rats with disruption of connections between the olfactory epithelium and olfactory bulbs. J Neurosci. 22 (10), 4205-4216 (2002).
- Burton, S. D., et al. A novel olfactometer for efficient and flexible odorant delivery. Chem Senses. 44 (3), 173-188 (2019).
- Slotnick, B., Cockerham, R., Pickett, E. Olfaction in olfactory bulbectomized rats. J Neurosci. 24 (41), 9195-9200 (2004).
- Reinert, J. K., Schaefer, A. T., Kuner, T. High-throughput automated olfactory phenotyping of group-housed mice. Front Behav Neurosci. 13, 267 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados