Method Article
Un nuevo flujo de trabajo para el muestreo y la digitalización de núcleos de incremento
En este artículo
Resumen
Presentamos un protocolo para utilizar monturas impresas en 3D para fijar núcleos de incremento en el campo sin necesidad de desempaquetarlos y pegarlos en monturas de madera. El nuevo soporte GSC permite colocar los núcleos en un micrótomo central para cortar su superficie y transferirlos directamente a la captura de imagen digital.
Resumen
Aquí presentamos un nuevo flujo de trabajo que va desde la toma de núcleos de incremento en el campo, almacenándolos y transportándolos al laboratorio, hasta la digitalización de sus anillos de árboles para análisis posteriores para análisis dendroecológicos posteriores. El procedimiento implica el uso de nuevos portadores de muestras para núcleos de incremento. Estos nuevos soportes Gärtner Schneider Core (GSC) se diseñan utilizando software de modelado tridimensional (3D) y finalmente se imprimen con una impresora 3D. Utilizando estos soportes desde el principio en el campo, los núcleos se pueden cortar directamente con un micrótomo central, y su superficie se puede digitalizar sin más reorganización utilizando un nuevo sistema de captura de imágenes de alta resolución. Por lo tanto, están disponibles para el análisis directo. Este sistema permite digitalizar anillos de árboles a partir de núcleos y discos, y también tomar imágenes de micro secciones largas (hasta 40 cm) utilizando luz transmitida. Esta característica es de especial interés para aplicaciones dendroecológicas y geomórficas para identificar el inicio de cualquier perturbación en microsecciones cortadas con un micrótomo central.
Introducción
El principio de la datación de los anillos de los árboles mediante la aplicación de la técnica de datación cruzada fue introducido por primera vez por el científico forestal austriaco Arthur Freiherr von Seckendorff-Gudent en 18811. En la primera mitaddel siglo XX , esta técnica fue reinventada por el "Padre de la Dendrocronología" Andrew Ellicott Douglass, quien la aplicó intensivamente en la datación de sitios arqueológicos y árboles vivos2.
Hoy en día, la dendroecología, el tema de investigación que actúa como una especie de marco ambiental de la dendrocronología, se define como el estudio de los anillos de los árboles y sus variaciones de crecimiento inherentes causadas por cambios ecológicos y ambientales en el tiempo3. En la investigación dendroecológica, se utilizan muchas otras características además de las variaciones del ancho del anillo, como los isótopos estables, la densidad tardía de la madera o las características de las células dentro de anillos individuales, para correlacionar estos datos con los parámetros ambientales y comprender mejor el impacto de las condiciones ambientales en el crecimiento de los árboles a lo largo del tiempo4. A través de la integración continua de los estudios anatómicos de la madera a la investigación dendroecológica, la investigación en dendroecología evolucionó en la última década y es más que nunca una columna vertebral en la reconstrucción de las condiciones climáticas pasadas 5,6,7,8.
A pesar de que el desarrollo técnico en cuanto a la preparación y análisis de muestras, especialmente en anatomía de la madera, fue fuerte en la última década 9,10,11,12,13,14, casi no hubo avances reales en cuanto a la simplificación de las técnicas de muestreo 15. A pesar de, por ejemplo, la tecnología de ondas acústicas16, hasta el día de hoy no existe un método "no destructivo" fiable para extraer las características de los anillos de los árboles.
En consecuencia, todos los estudios relacionados con los anillos de los árboles siguen basándose en muestras de madera tomadas de árboles o arbustos tomados en los sitios de interés. Cuando se enfoca en los árboles, el procedimiento estándar es tomar núcleos de incremento de los tallos15.
La toma de núcleos mediante el uso de núcleos incrementales se expresa con frecuencia como una técnica "no destructiva"17. En comparación con tomar discos de los tallos, esto es correcto; Sin embargo, esta técnica de muestreo provoca un agujero en el tallo de aproximadamente 1 cm de diámetro, que en su mayoría llega más allá de la médula del tallo3. El árbol es capaz de cerrar esta herida por sí solo, pero este proceso provoca reacciones de crecimiento, alterando la estructura común en las proximidades de la herida, así como una decoloración más o menos intensa de la madera existente alrededor del agujero debido a enfermedades fúngicas 18,19. Por lo tanto, debería llamarse mejor "mínimamente invasivo" en lugar de "no destructivo".
La técnica de tomar núcleos de incremento evolucionó recientemente a través de la capacidad de utilizar taladros mecánicos, lo que resultó en muestras de mayor calidad, especialmente para análisis anatómicos de madera15. Este procedimiento también ahorra mucho tiempo en el campo en comparación con la extracción manual de núcleos. Lo que no cambió fue el procedimiento de manipulación de los núcleos, desde la extracción del árbol hasta el etiquetado, el almacenamiento para el transporte y la preparación en el laboratorio para diversas técnicas de análisis posibles.
Los núcleos aún deben empacarse en contenedores estables, como pajitas hechas de plástico o papel, para evitar que se rompan durante el transporte. El etiquetado de los corazones se realiza directamente en el núcleo con lápices suaves o (más frecuentemente) en el exterior de cada pajita. Cuando se utilizan recipientes de plástico, los corazones deben sacarse después de un corto tiempo para evitar la propagación de hongos. Por lo tanto, los núcleos deben volver a sacarse de los contenedores. Para estabilizar los núcleos y evitar que se doblen cuando comiencen a secarse, los núcleos deben fijarse en un soporte. Esto también ayuda con la posterior preparación de la superficie para análisis posteriores. Al hacerlo, las etiquetas también deben transferirse a los soportes respectivos. Un procedimiento estándar es pegar los núcleos en soportes de madera o fijarlos con cinta adhesiva en los surcos de los tableros corrugados. Pegarlos en soportes de madera es la técnica más utilizada. Aunque este procedimiento es perfecto para estabilizar y lijar o cortar los núcleos, tiene varias desventajas con respecto a los posibles análisis químicos, isotópicos e incluso anatómicos de la madera. Otra desventaja, a pesar del tiempo requerido, es la transferencia propensa a errores de las etiquetas de cada núcleo a los nuevos soportes.
En dendrocronología, las mediciones del ancho de los anillos como base para una datación precisa son la columna vertebral de todos los estudios dendroecológicos20. Aunque muchos laboratorios todavía confían en las mediciones manuales utilizando tablas de medición, por ejemplo, Lintab21 con binoculares adjuntos, existe una tendencia a usar escáneres planos para digitalizar las superficies del núcleo y medir el ancho del anillo utilizando software como CooRecorder22 o WinDENDRO23. Desafortunadamente, estos escáneres, por ejemplo, el ampliamente utilizado Epson Expression 10000XL, no tienen suficiente resolución para representar claramente las estructuras como traqueidas de madera temprana o tardía (Figura 1). Por esta razón, las imágenes resultantes no son adecuadas para reconocer estructuras difíciles como anillos muy estrechos o fluctuaciones de densidad, que son críticas para un procedimiento de datación cruzada preciso sin volver a los núcleos originales con binoculares24,25.
Dado que la alta resolución de la imagen es un requisito previo indispensable para un análisis adecuado de las imágenes en la ciencia de los anillos de los árboles10, se desarrolló un nuevo sistema de captura de imágenes en WSL (Skippy; https://www.wsl.ch/en/services-produkte/skippy/) para digitalizar los anillos de los árboles en las superficies del núcleo utilizando una cámara digital, lo que da como resultado imágenes que presentan una resolución más alta que todos los escáneres planos existentes. Este sistema se basó en la idea del sistema ATRICS26, desarrollado en 2007. Más recientemente, se presentó un sistema de captura de imágenes simple pero eficiente comparable al Skippy como un kit de autoensamblaje27.
La digitalización de los anillos de los árboles, es decir, la captura de imágenes con luz reflejada, es un paso importante en la creación de imágenes de alta resolución de núcleos o discos de incremento para respaldar una medición de ancho de anillo digital y eficiente en el tiempo. El sistema desarrollado en WSL también permite tomar imágenes de micro secciones largas (hasta 40 cm) utilizando luz transmitida. Esta característica adicional es, por ejemplo, de interés para las aplicaciones dendrogeomórficas para identificar el inicio de la madera de reacción en micro secciones.
En el estudio, presentamos un protocolo para facilitar el proceso de manejo de núcleos en el campo y en el laboratorio. La base de la nueva técnica presentada es una montura reutilizable; el nuevo soporte GSC GärtnerSchneiderCore (GSC) diseñado con software de modelado 3D e impreso con una impresora 3D. El soporte GSC permite un manejo sencillo de los núcleos tomados en el campo sin tener que volver a empaquetarlos o etiquetarlos. También presentamos un nuevo y eficiente sistema para digitalizar las superficies preparadas de los núcleos. Este protocolo abarca todo el procedimiento, desde la toma de núcleos en el campo hasta la preparación de la muestra, la digitalización de las superficies de los núcleos para los análisis posteriores y, finalmente, su almacenamiento en un archivo.
Protocolo
1. Creación del titular del GSC
- Abra el modelo 3D del soporte en un programa de corte que sea compatible con una impresora 3D. Cree un archivo de impresión que pueda ser leído por la impresora 3D (en este caso, un archivo "*.gcode").
NOTA: El modelo 3D se puede diseñar utilizando cualquier software de modelado 3D. - Transfiera el archivo de impresión a la impresora 3D mediante una tarjeta de memoria o una memoria USB y active el archivo de impresión en la impresora 3D.
- Tan pronto como se imprima el soporte, espere hasta que el soporte se enfríe a temperatura ambiente (RT). A continuación, retira la placa a la que se adhiere el soporte de la impresora y dobla un poco la placa hasta que la forma se separe de la superficie.
- Retire todo el exceso de roscas o accesorios del soporte.
NOTA: El número de soportes que se imprimirán a la vez depende del tamaño de la impresora. En una impresora 3D con una dimensión de placa de 36 cm x 36 cm, se pueden imprimir alrededor de 30 soportes con una longitud de 35 cm en una sola tirada. El tiempo necesario para imprimir 30 soportes depende del dispositivo. En promedio, esto debe hacerse en aproximadamente 8 horas (impresión nocturna).
2. Extracción, estabilización y transporte de núcleos de incremento en el campo
- Tome un taladro inalámbrico equipado con un refuerzo de par y un desentrañador de incremento, seleccione la posición de extracción de muestras y coloque el descorazonador perpendicular al eje de crecimiento del tallo.
NOTA: Lo mismo se puede hacer manualmente usando el descorazonador de incrementos sin un taladro inalámbrico. - Comience a descorazonar hasta que el descorazonador alcance al menos la mitad del diámetro del tallo. Verifique la profundidad como se explicó anteriormente sosteniendo el extractor (que tiene la misma longitud que el descorazonador) al lado del descorazonador.
- En el caso de utilizar un taladro inalámbrico, retire el taladro, coloque el mango en el descorazonador (que ya es el caso cuando se utiliza el descorazonador de incremento manualmente), tome el extractor con el lado abierto hacia arriba e insértelo completamente en el descorazonador.
- Gire el descoronador de incrementos hacia atrás (una vuelta completa) para separar el núcleo del tallo. Saque el extractor, incluido el núcleo.
- Retire el núcleo del extractor. Verifique la dirección de la fibra del núcleo para garantizar una orientación vertical de las fibras al colocar el núcleo en el soporte.
NOTA: La dirección de la fibra se puede verificar en ambos extremos del núcleo, así como en el costado del núcleo. Para esto, sostenga el núcleo contra la luz y gírelo hasta que se vea un lado brillante. Esto sucede porque, en este lado, las paredes radiales de las células están cortadas longitudinalmente y reflejan la luz de manera diferente al resto del núcleo. - Coloque el núcleo en la parte superior del soporte con la dirección de la fibra en posición vertical. Presione la parte superior del núcleo con todos los dedos hasta que el núcleo se deslice en el soporte.
- Etiquete el núcleo en el costado del soporte con un lápiz suave, lo que permite escribir incluso en vidrio.
NOTA: La escritura se puede quitar posteriormente con una goma común. - Coloque el soporte con el núcleo en la caja de transporte y cierre la tapa.
3. Preparación de los núcleos montados en el laboratorio
- OPCIONAL: Incrustación de los núcleos montados en parafina para un posible micro seccionamiento.
- Coloque una caja de acero con una tapa provista de una válvula para la conexión de una bomba de vacío en una placa calefactora, llénela hasta aproximadamente 2 cm con parafina y espere hasta que se haya derretido por completo.
- Saque los núcleos montados de la caja de transporte. Coloque los soportes con los núcleos tal como están en la parafina líquida y cierre la tapa.
- Ponga en marcha la bomba de vacío, aplique un vacío constante y ligero al recipiente y espere unas 2 h. Debido a la estructura abierta del soporte, la parafina puede penetrar en los núcleos sin barreras adicionales.
- Detenga la bomba de vacío y abra la tapa. Saque los soportes con los núcleos, colóquelos en una rejilla y deje que se enfríen.
- Si es necesario, retire el exceso de parafina de los lados del soporte.
- Preparación de las superficies principales
- Saque los núcleos montados de la caja de transporte o del baño de parafina. Coloque el soporte con el núcleo tal como está en el portamuestras de un micrótomo de núcleo. Asegúrese de orientar el núcleo de manera que la madera tardía de los anillos mire hacia la hoja.
- Apriete los tornillos del portamuestras hasta que el soporte del núcleo esté completamente seguro.
- Levante el portamuestras hasta que el núcleo toque ligeramente la hoja. Tira de la cuchilla sobre toda la extensión del núcleo para cortar la primera parte de la parte superior.
- Empuje la cuchilla hacia atrás detrás del núcleo, levante el portamuestras unas micras y repita el procedimiento hasta obtener una superficie plana de al menos 2-3 mm de ancho.
- Tan pronto como la superficie se corte según lo previsto, retire el soporte del núcleo del soporte de muestras del micrótomo.
NOTA: Se recomienda cortar los núcleos con un micrótomo y no lijarlos porque la superficie es más limpia y recta, y las celdas no están llenas de polvo.
4. Digitalización de las superficies del núcleo
- Coloque el soporte de núcleo con la superficie de núcleo plana sobre la mesa de un sistema de captura de imágenes, como se presenta aquí el sistema WSL-Skippy.
- Asegúrese de alinear el soporte del núcleo con la dirección de movimiento de la mesa o la cámara.
- Coloque la mesa con el soporte central debajo de la cámara para que el anillo más externo esté en el centro de visión debajo del objetivo de la cámara.
- Coloque una escala junto al inicio del núcleo y tome una imagen con fines de calibración.
NOTA: Esto solo debe hacerse una vez cuando se hacen imágenes de muchos núcleos en sucesión. - Defina la longitud del núcleo en el software e inicie el proceso de captura de imágenes. Cuando se toma la última imagen, la mesa vuelve a la posición inicial.
- Retire la muestra de la mesa, coloque el siguiente soporte debajo de la cámara y repita el procedimiento descrito anteriormente definiendo la longitud del núcleo hasta que se fotografíen todos los núcleos.
- Utilice un software de costura (sin distorsiones), por ejemplo, PTGui, para combinar las imágenes individuales en una imagen final de la superficie del núcleo.
5. Almacenamiento de los núcleos
- Tome los núcleos analizados en el soporte y colóquelos en el estante de almacenamiento portátil impreso con una impresora 3D.
- Etiquete el bastidor para identificar los núcleos desde el exterior.
- Guarde el estante en un estante o en cualquier otro archivo disponible.
Resultados
Titular de GSC
Los soportes de los núcleos se imprimen (por defecto) con una longitud de 35 cm, que corresponde casi al tamaño máximo de impresión de la impresora 3D utilizada (Original Prusa XL, volumen de construcción de 36 cm × 36 cm × 36 cm). En caso de que se tomen núcleos más largos, el soporte se puede extender con soportes adicionales conectándolos con pequeñas piezas de conexión a través de las hendiduras que están presentes en ambos extremos de todos los soportes (Figura 2A).
Al realizar trabajo de campo, el tiempo necesario para almacenar los núcleos directamente en el soporte es comparable a simplemente ponerlos en una pajita u otro material de envoltura. Aunque es necesario respetar la dirección de la fibra de cada núcleo antes de presionar el núcleo en el soporte (Figura 2), este tiempo adicional es de solo unos segundos y se puede respaldar mediante el uso de una lente. En nuestra experiencia, el tiempo adicional necesario (si lo hay) suma aproximadamente 1 minuto para 10 núcleos. Este tiempo extra mínimo también se refiere a los núcleos rotos. En lugar de colocar los núcleos rotos pieza por pieza en una pajita, estas piezas simplemente se colocan en el soporte una tras otra y se presionan.
Para garantizar el transporte seguro de los núcleos en el campo y al laboratorio, diseñamos e imprimimos una caja de transporte especial para los soportes, incluidos los núcleos (Figura 3). Los soportes se pueden colocar simplemente en la caja, donde se estabilizan mediante pequeñas protuberancias que encajan exactamente en las hendiduras de ambos extremos de los soportes. A continuación, la caja se puede cerrar mediante una tapa que se introduce en las ranuras laterales de la caja.
La ventaja real del nuevo soporte se hace evidente en el laboratorio. En lugar de sacar los núcleos de la paja (u otros recipientes), preparar soportes de madera con pista, fijar los núcleos en el soporte, transferir la etiqueta al nuevo soporte y esperar al menos unas horas hasta que el pegamento esté seco y estable para su posterior procesamiento, los núcleos en el soporte pueden (i) fijarse directamente en un micrótomo de núcleo para cortar una superficie plana o (ii) se pueden lijar directamente con un lijado máquina sin necesidad de ningún otro proceso de preparación. La eliminación de la necesidad de transferir las etiquetas a cualquier nuevo soporte evita especialmente posibles errores de transmisión.
Dado que los soportes pueden diseñarse para cualquier diámetro de núcleo, no importa si se necesitan para núcleos "estándar" de 5 mm o núcleos de 10 mm o 12 mm, ya que se toman para, por ejemplo, análisis de isótopos u otros análisis químicos.
En relación con los análisis de isótopos o químicos, la ventaja del soporte es que los núcleos se fijan sin necesidad de pegamento o medio de fijación. Por lo tanto, los núcleos no están contaminados y se pueden quitar fácilmente del soporte para análisis más específicos. Además, en lo que respecta a los análisis anatómicos de la madera, la capacidad de extraer fácilmente los núcleos del soporte permite un manejo sencillo de los núcleos para la preparación de microsecciones.
La posibilidad opcional de incrustar núcleos fijados en el soporte permite estabilizar estructuras sensibles, ya que las células con paredes celulares delgadas tienden a romperse durante el corte. Estabilizar el núcleo incrustándolo en parafina es, en muchos casos, más eficiente que simplemente agregar una solución de almidón de maíz.
Otra ventaja también aparece cuando los núcleos deben almacenarse para inspecciones posteriores o reanálisis. Los soportes pueden colocarse en estanterías especialmente diseñadas (Figura 4) y también imprimirse con una impresora 3D comparable al almacenamiento en la caja de transporte. Los soportes GSC con los núcleos se colocan en el estante tal cual y luego se pueden almacenar en cualquier lugar. La anchura de las estanterías, es decir, el número de núcleos que se pueden fijar en una sola estantería, depende del espacio disponible en una estantería o sala de almacenamiento. Los modelos de bastidor se pueden adaptar a cualquier necesidad específica e imprimir en consecuencia.
Digitalización de superficies de núcleo o disco
El sistema de captura de imágenes, desarrollado en WSL (Figura 5), permite digitalizar anillos de árboles (captura de imágenes automatizada) para crear imágenes de alta resolución de núcleos o discos de incremento para respaldar una medición de ancho de anillo digital y eficiente en el tiempo. El sistema consiste en una placa fijada en una varilla roscada que mueve la muestra por debajo del objetivo (Sony FE 90 mm f/2.8 Macro) de una cámara de 61 MP (Sony Alpha 7R IV) en pasos predefinidos entre 0,1 a 1 cm. Las imágenes se toman utilizando el sistema de enfoque automático de la cámara para garantizar imágenes individuales enfocadas. La resolución de la cámara permite una resolución real de cada imagen de 6500 ppp probada con un objetivo de resolución SilverFast (USAF 1951). Esto puede sonar un poco bajo en comparación con la resolución oficial de un escáner plano con una resolución especificada de 4800 ppp. Sin embargo, al analizar imágenes del mismo objetivo tomadas con un escáner Epson XL con una resolución de 4800 ppp, las imágenes resultantes mostraron una resolución real de solo 1825 ppp (Figura 6). La alta resolución de las imágenes permite una visión clara de las células individuales y, para ello, una definición clara de los límites de los anillos capturados en las imágenes (Figura 7). Si la superficie de los núcleos o de los discos utilizados está bien preparada, no es necesario volver a la muestra original para comprobar de nuevo la estructura. Después de unir las imágenes individuales, las imágenes principales resultantes se pueden analizar utilizando el software de análisis preferido.
El sistema de captura de imágenes también permite tomar imágenes de micro secciones de hasta una longitud de 40 cm utilizando luz transmitida. Esta característica es de interés para, por ejemplo, aplicaciones dendrogeomórficas para identificar el inicio de la madera de reacción u otras características específicas en microsecciones de núcleos de árboles enteros (Figura 8).

Figura 1: Imágenes de escaneo de Larix decidua Mill. Anillos de árboles escaneados a diferentes resoluciones utilizando un escáner plano. Haga clic aquí para ver una versión más grande de esta figura.
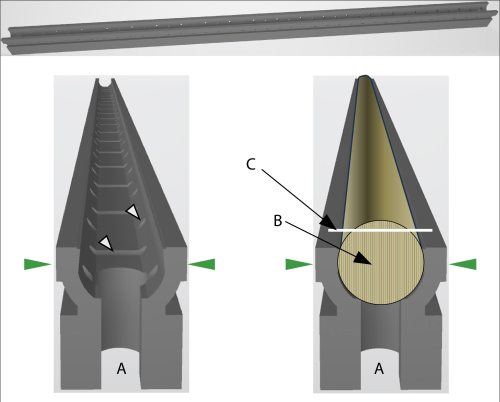
Figura 2: Vista esquemática del soporte GSC. (A) La abertura en ambos extremos del soporte permite conectar dos soportes con un pequeño poste para fijar núcleos más largos. Las flechas verdes indican la dirección de la presión cuando el soporte está fijado en el micrótomo central. Izquierda: Las flechas blancas indican las aberturas que permiten la circulación de aire o líquido (para incrustar). Derecha: El soporte GSC con un núcleo presionado. (B) La dirección de la fibra del núcleo debe estar en posición vertical. (C) La línea blanca indica la superficie de corte del núcleo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Caja de transporte para almacenar y transportar el soporte GSC con los núcleos en el campo. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Marcos de almacenamiento para colocar los soportes GSC para el almacenamiento final en un archivo. Los marcos se pueden apilar para ahorrar espacio. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: El sistema de captura de imágenes desarrollado en WSL. Haga clic aquí para ver una versión más grande de esta figura.
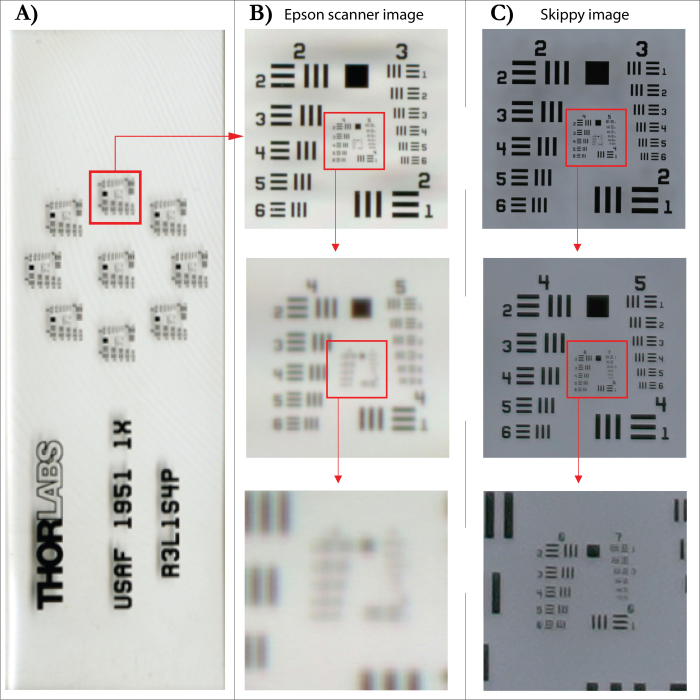
Figura 6: Comparación de la resolución de imagen entre un escáner plano y el sistema de captura de imágenes. (A) Objetivo de resolución SilverFast (USAF 1951). (B) Imagen escaneada con un escáner plano con una resolución especificada de 4800 ppp (interpolada) y las respectivas ampliaciones de sección a continuación. (C) Imagen tomada con el sistema de captura de imágenes y las respectivas ampliaciones de sección a continuación. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7: Imagen compuesta de un molino Larix decidua . núcleo de incremento (imagen superior) y las respectivas ampliaciones de sección a continuación. Se tomaron imágenes individuales de la composición con el sistema de captura de imágenes. Haga clic aquí para ver una versión más grande de esta figura.
Figura 8: Imagen compuesta de una micro sección de un núcleo de incremento completo (Larix decidua Mill.) y la respectiva ampliación de la sección. Las imágenes individuales del compuesto fueron tomadas por el sistema de captura de imágenes (luz transmitida). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
La inclusión de la anatomía de la madera en los estudios dendroecológicos abrió ampliamente estos estudios para nuevos y profundos análisis de las condiciones ambientales pasadas 28,29,30. Estas nuevas técnicas también intensificaron los esfuerzos analíticos, es decir, el tiempo de laboratorio necesario para generar los datos de interés. Han sido numerosos los intentos de optimizar el trabajo de laboratorio y de reducir el tiempo necesario en el laboratorio con respecto a las técnicas anatómicas de la madera 9,12,13,15,30. Pero casi no se han hecho esfuerzos para facilitar el procedimiento común de manipulación, preparación y almacenamiento de núcleos para estos estudios.
La impresión 3D ofrece nuevas posibilidades en este sentido9. El nuevo soporte de núcleo impreso en 3D es el primer intento de simplificar todo este procedimiento, haciéndolo menos lento y, por lo tanto, más eficiente.
Mientras que los núcleos almacenados en pajitas de plástico31,32 o contenedores comparables deben extraerse para evitar que se desarrollen hongos en el exterior (y pronto también en el interior) del núcleo, los núcleos fijados en los soportes GSC pueden permanecer como están. Hasta este punto, es comparable a almacenarlos en pajitas de papel33.
La ventaja se hace evidente tan pronto como todo el procedimiento de (i) retirar los núcleos de la paja (u otro contenedor), (ii) pegarlos en soportes de madera o fijarlos en otros objetos como soportes de cable, y (iii) el proceso posiblemente propenso a errores de transferir el código respectivo utilizado para cada núcleo, ya que fue casi un estándar durante décadas34, se vuelve innecesario.
La estructura abierta del soporte GSC permite almacenar los núcleos sin riesgo de infestación de hongos, como sería el caso cuando se almacena en un contenedor de plástico. Como se ha descrito anteriormente, el soporte también permite una incrustación en parafina para estabilizar la estructura. Sin embargo, esta "simple" incrustación no puede compararse con los procedimientos comunes de incrustación que utilizan casetes para incrustar la muestra en un bloque de parafina, como se hace para los micronúcleos35. La técnica simple es bastante comparable a la aplicación de almidón de maíz al cortar micro secciones36. Estabilizará mejor las células y evitará que se rompan durante el procedimiento de corte, pero requiere más tiempo que simplemente agregar almidón de maíz. Esta forma de incrustación no estabilizará todo el núcleo como si estuviera incrustado en un bloque. Si el núcleo se rompe, las secciones también se romperán. Dado que el soporte GSC encaja en el micrótomocentral 37, la preparación de la superficie para el posterior proceso de digitalización solo lleva unos minutos.
Para el proceso de digitalización de los anillos de los árboles, la aplicación de escáneres planos, frecuentemente utilizados para las mediciones de la intensidad del azul38,39, no fue satisfactoria en cuanto a vistas más detalladas de la estructura del anillo debido a la baja calidad de las imágenes resultantes. Aunque los límites de los anillos comunes (anchos) de las coníferas eran visibles en estas imágenes, los anillos estrechos, o incluso las fluctuaciones de densidad, eran casi imposibles de identificar.
Aunque existen nuevos y fascinantes intentos de digitalizar los anillos de los árboles en alta resolución, como la tomografía computarizada de rayosX 40, el uso de cámaras digitales de alta resolución sigue siendo la forma más eficiente y rentable de producir imágenes de alta calidad para mediciones posteriores.
Divulgaciones
Los autores declaran que no tienen intereses financieros contrapuestos.
Agradecimientos
Los autores desean agradecer al Prof. Jussi Grießinger por apoyar la idea de crear el nuevo soporte.
Materiales
| Name | Company | Catalog Number | Comments |
| Core-microtome | WSL | https://www.wsl.ch/en/services-produkte/microtomes/ | Microtome to cut micro sections from increment cores |
| Epson Expression 10000XL | EPSON | https://epson.com/Support/Scanners/Expression-Series/Epson-Expression-10000XL---Graphic-Arts/s/SPT_E10000XL-GA | flatbed scanner |
| GSC holder | WSL | in-house | 3D printed mount to fix cores for transport, preparation, analyses, and storage |
| Skippy image capturing system | WSL | https://www.wsl.ch/en/services-produkte/skippy/) | Image capturing system developed at WSL equiped with a 61 MP camera (Sony Alpha 7R IV and Sony FE 90mm f/2.8 Macro lens) |
Referencias
- Wimmer, R. Arthur Freiherr von Seckendorff-Gudent and the early history of tree-ring crossdating. Dendrochronologia. 19 (1), 153-158 (2001).
- McGraw, D. J. Andrew Ellicott Douglass and the giant sequoias in the founding of dendrochronology. Tree-Ring Res. 59 (1), 21-27 (2003).
- Schweingruber, F. H. . Tree Rings and Environment: Dendroecology. , (1996).
- Amoroso, M. M., Daniels, L. D., Baker, P. J., Camarero, J. J. . Dendroecology: Tree-Ring Analyses Applied to Ecological Studies (Vol.231). 231, (2017).
- Lopez-Saez, J., Corona, C., Von Arx, G., Fonti, P., Slamova, L., Stoffel, M. Tree-ring anatomy of Pinus cembra trees opens new avenues for climate reconstructions in the European Alps. Sci Total Environ. 855, 158605 (2023).
- Björklund, J., et al. Fennoscandian tree-ring anatomy shows a warmer modern than medieval climate. Nature. 620 (7972), 97-103 (2023).
- Camarero, J. J., Colangelo, M., Rodriguez-Gonzalez, P. M. Tree growth, wood anatomy and carbon and oxygen isotopes responses to drought in Mediterranean riparian forests. Forest Ecol Manag. 529, 120710 (2023).
- Huang, R., Xu, C., Grießinger, J., Feng, X., Zhu, H., Bräuning, A. Rising utilization of stable isotopes in tree rings for climate change and forest ecology. JForestry Res. 35, 13 (2024).
- Schneider, L., Gärtner, H. Additive manufacturing for lab applications in environmental sciences: pushing the boundaries of rapid prototyping. Dendrochronologia. 76, 126015 (2022).
- Björklund, J., et al. Scientific merits and analytical challenges of tree-ring densitometry. Rev Geophys. 57, 1224-1264 (2019).
- Katzenmaier, M., Garnot, V. S. F., Björklund, J., Schneider, L., Wegner, J. D., von Arx, G. Towards ROXAS AI: Deep learning for faster and more accurate conifer cell analysis. Dendrochronologia. 81, 126126 (2023).
- Gärtner, H., Lucchinetti, S., Schweingruber, F. H. A new sledge microtome to combine wood anatomy and tree-ring ecology. IAWA J. 36 (4), 452-459 (2015).
- Gärtner, H., et al. A technical perspective in modern tree-ring research - how to overcome dendroecological and wood anatomical challenges. J Vis Exp. 97 (e52337), (2015).
- Gärtner, H., Banzer, L., Schneider, L., Schweingruber, F. H., Bast, A. Preparing micro sections of entire (dry) conifer increment cores for wood anatomical time-series analyses. Dendrochronologia. 34, 19-23 (2015).
- Gärtner, H., Schneider, L., Lucchinetti, S., Cherubini, P. Advanced workflow for taking high-quality increment cores - new techniques and devices. J Vis Exp. (193), e64747 (2023).
- Wang, X. Acoustic measurements on trees and logs: a review and analysis. Wood Sci Technol. 47, 965-975 (2013).
- Steenkamp, C. J., Van Rooyen, M. W., Van Rooyen, N. A non-destructive sampling method for dendrochronology in hardwood species. South Afr For J. 186, 5-7 (1999).
- Toole, E. R., Gammage, J. L. Damage from increment borings in bottomland hardwoods. J For. 57, 909-911 (1959).
- Grissino-Mayer, H. D. A manual and tutorial for the proper use of an increment borer. Tree-Ring Res. 59 (2), 63-79 (2003).
- Griffin, D., et al. Gigapixel macro photography of tree rings. Tree-Ring Res. 77, 86-94 (2021).
- . LINTAB-Precision ring by ring Available from: https://rinntech.info/products/lintab/ (2003)
- . Regent Instruments Available from: https://regentinstruments.com (2024)
- De Micco, V., et al. Intra-annual density fluctuations in tree rings: How, when, where, and why. IAWA J. 37, 232-259 (2016).
- Edwards, J., et al. Intra-annual climate anomalies in northwestern North America following the 1783-1784 CE Laki eruption. J Geophys Res Atmos. 126, e2020JD033544 (2020).
- Levanič, T. ATRICS-A new system for image acquisition in dendrochronology. Tree-Ring Res. 63 (2), 117-122 (2007).
- García-Hidalgo, M., et al. CaptuRING: A do-it-yourself tool for wood sample digitization. Methods Ecol Evol. 13 (6), 1185-1191 (2022).
- Rodriguez, D. R. O., et al. Exploring wood anatomy, density and chemistry profiles to understand the tree-ring formation in Amazonian tree species. Dendrochronologia. 71, 125915 (2022).
- Gärtner, H., Farahat, E. Cambial activity of Moringa peregrina (Forssk.) Fiori in arid environments. Front Plant Sci. 12, 760002 (2021).
- Gärtner, H., Lucchinetti, S., Schweingruber, F. H. New perspectives for wood anatomical analysis in dendrosciences: the GSL1-microtome. Dendrochronologia. 32, 47-51 (2014).
- Maeglin, R. R. . Increment Cores: How to Collect, Handle, and Use Them (Vol. 25). , (1979).
- Agee, J. K., Huff, M. H. . The Care and Feeding of Increment Borers. , (1986).
- Phipps, R. L., , . . Collecting, Preparing, Crossdating, and Measuring Tree Increment Cores (No. 85-4148). , (1985).
- Cole, D. M. . Protection and Storing Increment Cores in Plastic Straws. 216, (1977).
- Rossi, S., Anfodillo, T., Menardi, R. Trephor: a new tool for sampling microcores from tree stems. IAWA J. 27 (1), 89-97 (2006).
- Schneider, L., Gärtner, H. The advantage of using a starch based non-Newtonian fluid to prepare micro sections. Dendrochronologia. 31, 175-178 (2013).
- Gärtner, H., Nievergelt, D. The core-microtome: A new tool for surface preparation on corse and time series analysis of varying cell parameters. Dendrochronologia. 28 (2), 85-92 (2010).
- McCarroll, D., Pettigrew, E., Luckman, A., Guibal, F., Edouard, J. L. Blue reflectance provides a surrogate for latewood density of high-latitude pine tree rings. Arct Antarct Alp Res. 34 (4), 450-453 (2002).
- Björklund, J., Seftigen, K., Kaczka, R. J., Rydval, M., Wilson, R. A standard definition and terminology for Blue Intensity from conifers. Dendrochronologia. 85, 126200 (2024).
- Van den Bulcke, J., et al. Advanced X-ray CT scanning can boost tree ring research for earth system sciences. Ann Bot. 124 (5), 837-847 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados