Method Article
Increment Cores의 샘플링 및 디지털화를 위한 새로운 워크플로우
요약
우리는 3D 프린팅 마운트를 사용하여 목재 마운트에 포장을 풀고 붙일 필요 없이 현장에서 증분 코어를 고정하는 프로토콜을 제시합니다. 새로운 GSC 홀더를 사용하면 코어 마이크로톰에 코어를 배치하여 표면을 절단하고 디지털 이미지 캡처로 직접 전송할 수 있습니다.
초록
여기에서는 현장에서 증분 코어를 가져와 보관하고 실험실로 운반하는 것부터 후속 dendroecological 분석을 위한 추가 분석을 위해 나이테를 디지털화하는 것까지 새로운 워크플로우를 제시합니다. 이 절차에는 증분 코어를 위한 새로운 샘플 캐리어의 사용이 포함됩니다. 이 새로운 Gärtner Schneider Core(GSC) 홀더는 3차원(3D) 모델링 소프트웨어를 사용하여 설계되고 최종적으로 3D 프린터로 인쇄됩니다. 현장에서 처음부터 이러한 마운트를 사용하여 코어 마이크로톰으로 코어를 직접 절단할 수 있으며, 그런 다음 새로운 고해상도 이미지 캡처 시스템을 사용하여 추가 재배열 없이 코어의 표면을 디지털화할 수 있습니다. 따라서 직접 분석에 사용할 수 있습니다. 이 시스템을 사용하면 코어와 디스크에서 나이테를 디지털화할 수 있으며 투과광을 사용하여 긴 마이크로 섹션(최대 40cm)에서 이미지를 촬영할 수도 있습니다. 이 기능은 core-microtome으로 절단된 미세 절편에서 교란의 시작을 식별하기 위한 dendroecological 및 geomorphic 응용 분야에서 특히 중요합니다.
서문
교차 연대 측정 기법을 적용하여 나이테 연대 측정의 원리는 1881년 오스트리아의 산림 과학자 Arthur Freiherr von Seckendorff-Gudent에 의해 처음으로 소개되었습니다1. 20세기 전반기에 이 기법은 "연대학학의 아버지"인 앤드류 엘리콧 더글라스(Andrew Ellicott Douglass)에 의해 재발명되었으며, 그는 고고학 유적지와 살아있는 나무의 연대 측정에 집중적으로 적용했다2.
오늘날 덴드로연대학의 일종의 환경적 틀 역할을 하는 연구주제인 덴드로생태학은 나이테와 시간의 흐름에 따른 생태적, 환경적 변화에 의한 나이테 및 그 고유의 성장 변동에 대한 연구로 정의된다3. 수생태학 연구에서는 안정 동위원소, 늦은 목재 밀도 또는 단일 고리 내의 세포 특성과 같은 고리 너비 변화 이외의 많은 다른 특성을 사용하여 이러한 데이터를 환경 매개변수와 상호 연관시켜 시간이 지남에 따라 환경 조건이 나무 성장에 미치는 영향을 더 잘 이해합니다4. 목재 해부학 연구가 dendroecological 연구에 지속적으로 통합됨에 따라 dendroecology 연구는 지난 10 년 동안 발전했으며 과거의 기후 조건을 재구성하는 데 그 어느 때보 다 중추가되고 있습니다 5,6,7,8.
특히 목재 해부학에서 시료 전처리 및 분석에 관한 기술적 발전이 지난 10년 동안 활발했지만(9,10,11,12,13,14) 샘플링 기법의 단순화에 대한 실질적인 진전은 거의 없었다15. 예를 들어, 음파 기술(acousticwave technology)16에도 불구하고, 오늘날까지 나무에서 나이테의 특성을 추출할 수 있는 신뢰할 수 있는 "비파괴적" 방법은 없다.
결과적으로, 나이테와 관련된 모든 연구는 여전히 관심 지역에서 채취한 나무나 관목에서 채취한 나무 샘플에 의존하고 있습니다. 나무에 초점을 맞출 때 표준 절차는 줄기15에서 증분 코어를 취하는 것입니다.
증분 코어를 사용하여 코어를 취하는 것은 종종 "비파괴적" 기술로 표현됩니다17. 줄기에서 디스크를 채취하는 것과 비교하면 이것은 맞습니다. 그럼에도 불구하고, 이 샘플링 기법은 지름이 약 1cm인 줄기에 구멍을 뚫게 하며, 대부분줄기 3의 속을 넘어서 도달한다. 나무는 스스로 이 상처를 봉합할 수 있지만, 이 과정은 성장 반응을 일으켜 상처 근처의 일반적인 구조를 변화시킬 뿐만 아니라 곰팡이 질병으로 인해 구멍 주변의 기존 나무가 다소 강하게 변색됩니다18,19. 따라서 "비파괴적"이라기보다는 "최소 침습적"이라고 부르는 것이 좋습니다.
증분 코어를 취하는 기술은 최근 기계식 드릴을 사용할 수 있는 기능을 통해 발전하여 특히 목재 해부학적 분석을 위한 고품질 샘플을 생성했습니다15. 이 절차는 또한 수동 응어리를 빼는 것과 비교된 분야에 있는 많은 시간을 절약합니다. 변하지 않은 것은 나무에서 추출하는 것부터 시작하여 라벨링, 운송을 위해 보관하고 다양한 가능한 분석 기술을 위해 실험실에서 준비하는 것에 이르기까지 코어를 처리하는 절차였습니다.
코어는 운송 중 파손을 방지하기 위해 플라스틱이나 종이로 만든 빨대와 같은 안정적인 용기에 여전히 포장해야 합니다. 코어에 라벨을 붙이는 것은 부드러운 연필을 사용하여 코어에 직접 또는 (더 자주) 각 빨대의 외부에서 수행됩니다. 플라스틱 용기를 사용할 때는 곰팡이의 확산을 방지하기 위해 짧은 시간 후에 코어를 제거해야 합니다. 따라서 컨테이너에서 코어를 다시 꺼내야 합니다. 코어를 안정화하고 건조를 시작할 때 구부러지는 것을 방지하려면 코어를 마운트에 고정해야 합니다. 이는 추가 분석을 위한 후속 표면 준비에도 도움이 됩니다. 그렇게 할 때 라벨도 해당 마운트로 옮겨야 합니다. 표준 절차는 코어를 나무 마운트에 붙이거나 골판지의 릴에 테이프로 고정하는 것입니다. 나무 산에 붙이는 것이 가장 자주 사용되는 기술입니다. 이 절차는 코어를 안정화하고 샌딩 또는 절단하는 데 적합하지만 잠재적인 화학적, 동위원소 및 목재 해부학적 분석과 관련하여 몇 가지 단점이 있습니다. 또 다른 단점은 시간이 필요함에도 불구하고 각 코어의 레이블을 새 마운트로 전송하는 오류가 발생하기 쉽다는 것입니다.
dendrochronology에서, 정확한 연대측정의 기초로서 고리 너비 측정은 모든 dendroecological 연구의 근간이다20. 많은 실험실에서 여전히 쌍안경이 부착된 Lintab21과 같은 측정 테이블을 사용한 수동 측정에 의존하고 있지만, CooRecorder22 또는 WinDENDRO23과 같은 소프트웨어를 사용하여 코어 표면을 디지털화하고 링 너비를 측정하기 위해 평판 스캐너를 사용하는 추세입니다. 안타깝게도 널리 사용되는 Epson Expression 10000XL과 같은 스캐너는 구조물을 얼리우드 또는 레이트우드 기관으로 명확하게 묘사할 수 있는 충분한 해상도를 가지고 있지 않습니다(그림 1). 이러한 이유로, 생성된 이미지는 매우 좁은 고리 또는 밀도 변동과 같은 어려운 구조를 인식하는 데 적합하지 않으며, 이는 쌍안경(24, 25)을 사용하여 원래의 코어로 돌아가지 않고 정확한 교차 연대 측정 절차에 중요하다.
나이테 과학10에서 적절한 이미지 분석을 위해서는 높은 이미지 해상도가 필수 불가결한 전제 조건이기 때문에, WSL(Skippy; https://www.wsl.ch/en/services-produkte/skippy/)에서는 디지털 카메라를 사용하여 코어 표면의 나이테를 디지털화하기 위한 새로운 이미지 캡처 시스템을 개발하여 기존의 모든 평판 스캐너보다 더 높은 해상도의 이미지를 제공했습니다. 이 시스템은 2007년에 개발된 ATRICS 시스템26의 아이디어를 기반으로 합니다. 가장 최근에는 Skippy에 필적하는 간단하지만 효율적인 이미지 캡처 시스템이 자체 조립 키트(27)로 제시되었습니다.
나이테를 디지털화하는 것, 즉 반사광 이미지 캡처는 시간 효율적인 디지털 기반 나이테 너비 측정을 지원하기 위해 증분 코어 또는 디스크의 고해상도 이미지를 생성하는 데 중요한 단계입니다. WSL에서 개발한 시스템은 투과광을 사용하여 긴 마이크로 섹션(최대 40cm)에서 이미지를 촬영할 수도 있습니다. 이 추가 기능은 예를 들어, 마이크로 섹션에서 반응 목재의 시작을 식별하기 위한 dendrogeomorphic 응용 분야에 관심이 있습니다.
이 연구에서는 현장과 실험실에서 코어를 처리하는 과정을 용이하게 하는 프로토콜을 제시합니다. 제시된 새로운 기술의 기반은 재사용 가능한 마운트입니다. 3D 모델링 소프트웨어를 사용하여 설계하고 3D 프린터로 프린팅한 새로운 GSC 홀더 GärtnerSchneiderC광석(GSC) 홀더. GSC 홀더를 사용하면 현장에서 가져온 코어를 다시 포장하거나 라벨을 다시 부착하지 않고도 간단하게 처리할 수 있습니다. 또한 코어의 준비된 표면을 디지털화하기 위한 효율적인 새 시스템을 제시합니다. 이 프로토콜은 현장에서 코어를 채취하는 것부터 시료 준비, 후속 분석을 위해 코어 표면을 디지털화하고 최종적으로 아카이브에 저장하는 것까지 전체 절차에 걸쳐 있습니다.
프로토콜
1. GSC 홀더 생성
- 3D 프린터와 호환되는 슬라이서 프로그램에서 홀더의 3D 모델을 엽니다. 3D 프린터에서 읽을 수 있는 인쇄 파일(이 경우 "*.gcode" 파일)을 만듭니다.
참고: 3D 모델은 모든 3D 모델링 소프트웨어를 사용하여 설계할 수 있습니다. - 메모리 카드 또는 USB 스틱을 사용하여 인쇄 파일을 3D 프린터로 전송하고 3D 프린터에서 인쇄 파일을 활성화합니다.
- 홀더가 인쇄되자마자 홀더가 실온(RT)으로 냉각될 때까지 기다리십시오. 그런 다음 프린터에서 홀더가 붙어있는 플레이트를 제거하고 형태가 표면에서 분리될 때까지 플레이트를 약간 구부립니다.
- 홀더에서 과도한 나사산이나 부착물을 모두 제거합니다.
참고: 한 번에 인쇄할 홀더의 수는 프린터의 크기에 따라 다릅니다. 플레이트 치수가 36cm x 36cm인 3D 프린터에서는 한 번에 길이가 35cm인 홀더 약 30개를 인쇄할 수 있습니다. 30개의 홀더를 인쇄하는 데 필요한 시간은 장치에 따라 다릅니다. 평균적으로 이 작업은 약 8시간(야간 인쇄)에 완료되어야 합니다.
2. 현장에서 증분 코어를 추출, 안정화 및 운반합니다.
- 토크 부스터와 증분 코어가 장착된 무선 드릴을 사용하여 코어링 위치를 선택하고 코어를 스템의 성장 축에 수직으로 배치합니다.
알림: 무선 드릴 없이 증분 코어를 사용하여 수동으로 동일한 작업을 수행할 수 있습니다. - 코어가 스템 직경의 절반 이상에 도달할 때까지 코어를 빼기 시작합니다. 코어와 같은 길이의 추출기(코어와 길이가 같음)를 코어와 함께 잡고 위에서 설명한 대로 깊이를 확인하십시오.
- 무선 드릴을 사용하는 경우 드릴을 제거하고 핸들을 코어에 놓고(증분 코어를 수동으로 사용하는 경우 이미 해당됨) 열린 면이 위를 향하도록 추출기를 잡고 코어에 완전히 삽입합니다.
- 증분 코어를 뒤로 돌려(한 바퀴 완전히 회전) 스템에서 코어를 부러뜨립니다. 코어를 포함하여 추출기를 꺼냅니다.
- 추출기에서 코어를 제거합니다. 코어를 홀더에 배치할 때 섬유의 수직 방향을 확인하기 위해 코어의 섬유 방향을 확인하십시오.
알림: 파이버 방향은 코어의 양쪽 끝과 코어 측면에서 확인할 수 있습니다. 이를 위해 코어를 빛에 대고 빛나는 면이 보일 때까지 돌립니다. 이것은 이 쪽에서 방사형 세포벽이 세로로 절단되고 코어의 나머지 부분과 다르게 빛을 반사하기 때문에 발생합니다. - 섬유 방향을 수직으로 하여 홀더 위에 코어를 놓습니다. 코어가 홀더 안으로 미끄러질 때까지 모든 손가락으로 코어 상단을 누릅니다.
- 부드러운 연필을 사용하여 홀더 측면의 코어에 라벨을 붙이면 유리에도 쓸 수 있습니다.
알림: 글씨는 나중에 일반 고무로 제거할 수 있습니다. - 코어가 있는 홀더를 운송 상자에 넣고 덮개를 닫습니다.
3. 실험실에서 마운트된 코어 준비
- 선택 사항: 잠재적인 미세 절편을 위해 장착된 코어를 파라핀에 내장합니다.
- 진공 펌프 연결용 밸브가 장착된 뚜껑이 있는 강철 상자를 핫플레이트에 놓고 파라핀을 약 2cm까지 채우고 완전히 녹을 때까지 기다립니다.
- 운송 상자에서 장착된 코어를 꺼냅니다. 코어가 있는 홀더를 액체 파라핀에 있는 그대로 놓고 뚜껑을 닫습니다.
- 진공 펌프를 시작하고 용기에 일정하고 가벼운 진공을 가한 다음 약 2시간 동안 기다립니다. 홀더의 개방형 구조로 인해 파라핀은 추가 장벽 없이 코어를 관통할 수 있습니다.
- 진공 펌프를 멈추고 뚜껑을 엽니다. 코어가 있는 홀더를 꺼내 그리드에 놓고 식힙니다.
- 필요한 경우 홀더 측면에서 여분의 파라핀을 제거합니다.
- 코어 곡면 준비
- 장착된 코어를 운송 상자 또는 파라핀 수조에서 꺼냅니다. 코어가 있는 홀더를 core-microtome의 샘플 홀더에 있는 그대로 놓습니다. 링의 레이트우드가 칼날을 향하도록 코어의 방향을 지정해야 합니다.
- 샘플 홀더의 나사를 조입니다.amp코어 홀더가 완전히 고정될 때까지 홀더.
- 샘플을 들어 올립니다.amp코어가 블레이드에 약간 닿을 때까지 홀더. 코어의 전체 범위에 걸쳐 칼날을 당겨 상단의 첫 번째 부분을 자릅니다.
- 코어 뒤에 있는 칼을 뒤로 밀고 샘플 홀더를 몇 미크론 들어 올린 다음 너비가 최소 2-3mm인 평면 표면이 얻어질 때까지 절차를 반복합니다.
- 표면이 의도한 대로 절단되자마자 마이크로톰의 샘플 홀더에서 코어 홀더를 제거합니다.
알림: 코어 마이크로톰으로 코어를 절단하고 샌딩하지 않는 것은 표면이 더 깨끗하고 직선이며 셀이 먼지로 채워지지 않기 때문에 권장됩니다.
4. 코어 표면의 디지털화
- WSL-Skippy 시스템이 여기에 나와 있는 것처럼 이미지 캡처 시스템의 테이블에 일반 코어 표면이 있는 코어 홀더를 놓습니다.
- 코어 홀더를 테이블이나 카메라의 이동 방향에 맞춰야 합니다.
- 코어 홀더가 카메라 아래에 있는 테이블을 배치하여 가장 바깥쪽 링이 카메라 대물렌즈 아래의 중앙에 오도록 합니다.
- 코어의 시작 부분 옆에 저울을 놓고 보정을 위해 이미지를 촬영합니다.
참고: 이 작업은 많은 코어의 이미지를 연속적으로 수행할 때 한 번만 수행하면 됩니다. - 소프트웨어에서 코어의 길이를 정의하고 이미지 캡처 프로세스를 시작합니다. 마지막 이미지를 촬영하면 테이블이 시작 위치로 다시 이동합니다.
- 테이블에서 샘플을 제거하고 다음 홀더를 카메라 아래에 놓고 모든 코어가 촬영될 때까지 코어의 길이를 정의하여 앞에서 설명한 절차를 반복합니다.
- PTGui와 같은 (왜곡 없는) 스티칭 소프트웨어를 사용하여 단일 이미지를 코어 표면의 최종 이미지 하나로 결합합니다.
5. 코어 보관
- 홀더에서 분석된 코어를 3D 프린터로 인쇄한 휴대용 보관 랙에 넣습니다.
- 랙에 레이블을 지정하여 외부에서 코어를 식별합니다.
- 랙을 선반 또는 사용 가능한 다른 아카이브에 보관하십시오.
결과
GSC 홀더
코어 홀더는 (기본적으로) 35cm 길이로 인쇄되며, 이는 사용 된 3D 프린터의 최대 인쇄 크기 (Original Prusa XL, 빌드 볼륨 36cm × 36cm × 36cm)에 거의 해당합니다. 더 긴 코어를 사용하는 경우 모든 홀더의 양쪽 끝에 있는 홈을 통해 작은 연결 조각으로 연결하여 홀더를 추가 홀더로 확장할 수 있습니다(그림 2A).
현장 조사를 할 때 코어를 홀더에 직접 보관하는 데 필요한 시간은 단순히 빨대나 기타 포장재에 넣는 것과 비슷합니다. 코어를 홀더에 밀어 넣기 전에 각 코어의 섬유 방향을 존중해야 하지만(그림 2) 이 추가 시간은 몇 초에 불과하며 렌즈를 사용하여 지원할 수 있습니다. 경험에 따르면 필요한 추가 시간(있는 경우)은 10개의 코어에 대해 약 1분까지 합산됩니다. 이 최소한의 추가 시간은 또한 깨진 코어를 나타냅니다. 부러진 코어를 한 조각씩 빨대에 넣는 대신, 이 조각들을 홀더에 차례로 넣고 압착하기만 하면 됩니다.
현장과 실험실로의 코어의 안전한 운송을 보장하기 위해 코어를 포함한 홀더를 위한 특수 운송 상자를 설계하고 인쇄했습니다(그림 3). 홀더는 홀더의 양쪽 끝에 있는 움푹 들어간 곳에 정확히 맞는 작은 돌출부로 안정화되는 상자에 간단히 넣을 수 있습니다. 그런 다음 상자의 측면 홈에서 밀어 넣는 덮개로 상자를 닫을 수 있습니다.
새로운 홀더의 진정한 장점은 실험실에서 명백해집니다. 밀짚(또는 다른 용기)에서 코어를 꺼내고, 단서가 있는 나무 마운트를 준비하고, 마운트에 코어를 고정하고, 라벨을 새 마운트로 옮기고, 접착제가 건조하고 안정되어 추가 처리를 위해 안정될 때까지 최소 몇 시간을 기다리는 대신, 홀더의 코어는 직접 (i) 코어 마이크로톰에 고정하여 평평한 표면을 절단하거나 (ii) 샌딩으로 직접 샌딩할 수 있습니다 추가 준비 과정이 필요 없는 기계. 라벨을 새 마운트로 전송할 필요가 없기 때문에 특히 가능한 전송 오류를 방지할 수 있습니다.
홀더는 모든 코어 직경에 맞게 설계할 수 있으므로 동위원소 또는 기타 화학 분석과 같은 "표준" 5mm 코어, 10mm 또는 12mm 코어에 필요한지 여부는 중요하지 않습니다.
동위원소 또는 화학 분석과 관련하여 홀더의 장점은 접착제나 고정 매체 없이 코어가 고정된다는 것입니다. 따라서 코어가 오염되지 않으며 보다 구체적인 분석을 위해 홀더에서 쉽게 제거할 수 있습니다. 또한 목재 해부학적 분석과 관련하여 홀더에서 코어를 쉽게 제거할 수 있는 기능을 통해 마이크로 섹션을 준비하기 위해 코어를 간단하게 처리할 수 있습니다.
홀더에 고정된 코어를 내장할 수 있는 선택적 가능성은 얇은 세포벽을 가진 셀이 절단하는 동안 파손되는 경향이 있기 때문에 민감한 구조를 안정화할 수 있습니다. 코어를 파라핀에 내장하여 안정화하는 것은 대부분의 경우 단순히 옥수수 전분 용액을 추가하는 것보다 더 효율적입니다.
또 다른 이점은 나중에 검사하거나 재해석하기 위해 코어를 보관해야 할 때도 나타납니다. 홀더는 특별히 설계된 랙에 넣을 수 있으며(그림 4) 운반 상자의 보관함에 필적하는 3D 프린터를 사용하여 인쇄할 수도 있습니다. 코어가 있는 GSC 홀더는 그대로 랙에 배치되어 어느 위치에나 보관할 수 있습니다. 랙의 너비, 즉 단일 랙에 고정할 수 있는 코어 수는 선반이나 보관실에서 사용할 수 있는 공간에 따라 다릅니다. 랙 모델은 특정 요구 사항에 맞게 조정하고 그에 따라 인쇄할 수 있습니다.
코어 또는 디스크 표면 디지털화
WSL에서 개발된 이미지 캡처 시스템(그림 5)을 사용하면 나이테를 디지털화(자동 이미지 캡처)하여 증분 코어 또는 디스크의 고해상도 이미지를 생성하여 시간 효율적인 디지털 기반 링 너비 측정을 지원할 수 있습니다. 이 시스템은 나사산 막대에 고정된 플레이트로 구성되어 61MP 카메라(Sony Alpha 90R IV)의 대물렌즈(Sony FE 90mm f/2.8 Macro) 아래로 샘플을 0.1cm에서 1cm 사이의 사전 정의된 단계로 이동합니다. 초점이 맞춰진 단일 이미지를 보장하기 위해 카메라의 자동 초점 시스템을 사용하여 이미지를 촬영합니다. 카메라의 해상도는 SilverFast 해상도 대상(USAF 1951)을 사용하여 테스트한 각 이미지의 실제 해상도인 6500dpi를 허용합니다. 이것은 지정된 해상도가 4800dpi인 평판 스캐너의 공식 해상도에 비해 약간 낮게 들릴 수 있습니다. 그러나 4800dpi 해상도를 사용하여 Epson XL 스캐너로 촬영한 동일한 대상의 이미지를 테스트할 때 결과 이미지의 실제 해상도는 1825dpi에 불과했습니다(그림 6). 이미지의 고해상도는 단일 세포를 명확하게 볼 수 있게 해주며, 이를 위해 이미지에서 캡처된 고리 경계를 명확하게 정의할 수 있습니다(그림 7). 사용된 코어나 디스크의 표면이 잘 준비되어 있으면 구조를 다시 확인하기 위해 원래 샘플로 돌아갈 필요가 없습니다. 단일 이미지를 스티칭한 후 선호하는 분석 소프트웨어를 사용하여 결과 코어 이미지를 분석할 수 있습니다.
또한 이미지 캡처 시스템을 사용하면 투과광을 사용하여 최대 40cm 길이의 마이크로 섹션에서 이미지를 촬영할 수 있습니다. 이 특징은 예를 들어, 전체 나무 코어의 미세 단면에서 반응 목재 또는 기타 특정 특징의 시작을 식별하기 위한 dendrogeomorphic 응용 분야에 관심이 있습니다(그림 8).

그림 1: Larix decidua Mill의 스캔 이미지. 평판 스캐너를 사용하여 다양한 해상도로 스캔한 나이테. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
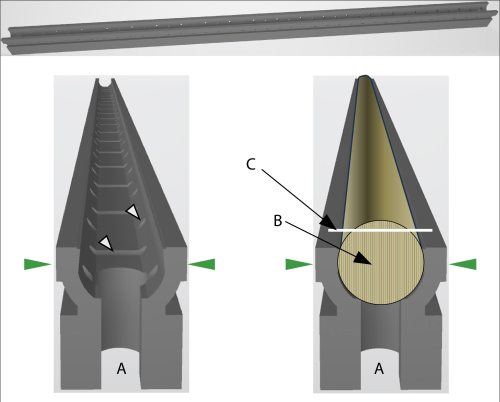
그림 2: GSC 홀더의 개략도. (A) 홀더의 양쪽 끝에 있는 개구부는 두 개의 홀더를 작은 기둥으로 연결하여 더 긴 코어를 고정할 수 있습니다. 녹색 화살표는 홀더가 코어 마이크로톰에 고정될 때의 압력 방향을 나타냅니다. 왼쪽: 흰색 화살표는 공기 또는 액체(임베딩용) 순환을 허용하는 개구부를 나타냅니다. 오른쪽: 코어가 눌려 있는 GSC 홀더. (B) 코어의 섬유 방향은 수직이어야 합니다. (C) 흰색 선은 코어의 절단면을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 현장에서 코어가 있는 GSC 홀더를 보관하고 운반하기 위한 운반 상자. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: 아카이브의 최종 저장을 위해 GSC 홀더를 배치하기 위한 저장 프레임. 공간을 절약하기 위해 프레임을 쌓을 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5: WSL에서 개발한 이미지 캡처 시스템. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
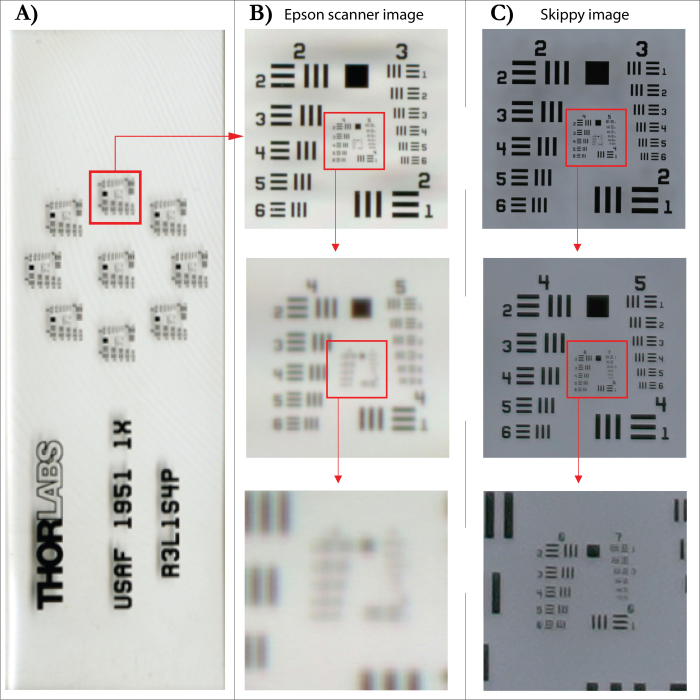
그림 6: 플랫베드 스캐너와 이미지 캡처 시스템 간의 이미지 해상도 비교. (A) SilverFast 해상도 목표(USAF 1951). (B) 4800dpi(보간)의 지정된 해상도와 아래의 각 섹션 확대를 가진 평판 스캐너로 스캔한 이미지. (C) 이미지 캡처 시스템으로 촬영한 이미지 및 아래의 해당 섹션 확대. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 7 : Larix decidua Mill의 합성 이미지. 증분 코어 (상단 이미지) 및 아래의 각 섹션 확대. 합성물의 단일 이미지는 이미지 캡처 시스템으로 촬영했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
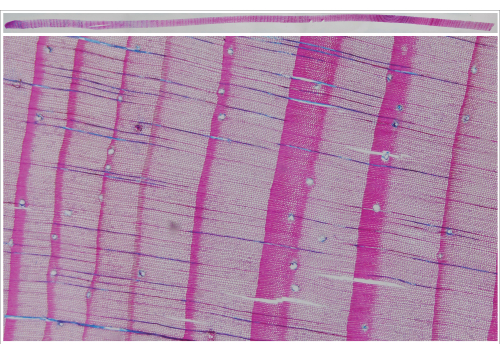
그림 8: 전체 증분 코어(Larix decidua Mill.) 및 각 섹션 확대의 마이크로 섹션의 합성 이미지. 합성물의 단 하나 심상은 이미지 붙잡음 체계 (투과된 빛)를 가지고 갔다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
dendroecological 연구에 목재 해부학이 포함됨에 따라 이러한 연구는 과거 환경 조건에 대한 새롭고 심층적 인 분석을 위해 널리 열렸습니다 28,29,30. 이러한 새로운 기술은 또한 분석 작업, 즉 관심 있는 데이터를 생성하는 데 필요한 실험실 시간을 강화했습니다. 목재 해부학 기술과 관련하여 실험실 작업을 최적화하고 실험실에서 필요한 시간을 줄이기위한 수많은 시도가있었습니다 9,12,13,15,30. 그러나 이러한 연구를 위해 취해진 코어를 취급, 준비 및 보관하는 일반적인 절차를 완화하기 위한 노력은 거의 이루어지지 않았습니다.
3D 프린팅은 이와 관련하여 새로운 가능성을 제공합니다9. 새로운 3D 프린팅 코어 홀더는 이 전체 절차를 단순화하기 위한 첫 번째 시도로, 시간이 덜 걸리고 더 효율적입니다.
플라스틱 빨대31,32 또는 이와 유사한 용기에 저장된 코어는 곰팡이가 코어의 외부(그리고 곧 내부)에서 발생하는 것을 방지하기 위해 제거해야 하지만 GSC 홀더에 고정된 코어는 그대로 유지될 수 있습니다. 여기까지는 종이 빨대(33)에 보관하는 것과 비슷하다.
(i) 짚(또는 다른 용기)에서 코어를 제거하고, (ii) 나무 마운트에 붙이거나 케이블 지지대로 다른 물체에 고정하는 전체 절차, (iii) 수십 년 동안 거의 표준이었던 각 코어에 사용되는 각 코드를 전송하는 오류가 발생하기 쉬운 프로세스인 전체 절차가 즉시 명확해집니다34, 불필요하게 됩니다.
GSC 홀더의 개방형 구조로 인해 플라스틱 용기에 보관할 때와 같이 곰팡이 침입의 위험 없이 코어를 보관할 수 있습니다. 상술한 바와 같이, 홀더는 또한 파라핀에 매립을 허용하여 구조를 안정화시킨다. 그럼에도 불구하고, 이러한 "간단한" 임베딩은 마이크로 코어(35)에 대해 수행되는 것처럼, 샘플을 파라핀 블록에 매장하기 위해 카세트를 사용하는 일반적인 임베딩 절차와 비교할 수 없다. 간단한 기술은 마이크로 섹션36을 절단할 때 옥수수 전분을 적용하는 것과 다소 비슷합니다. 절단 과정에서 세포를 더 잘 안정화하고 파손을 방지하지만 단순히 옥수수 전분을 추가하는 것보다 시간이 더 많이 걸립니다. 이러한 형태의 임베딩은 마치 블록에 임베디드된 것처럼 전체 코어를 안정화하지 않습니다. 코어가 파손되면 섹션도 파손됩니다. GSC-홀더가 코어-마이크로톰(37)에 맞기 때문에 후속 디지털화 프로세스를 위해 표면을 준비하는 데 몇 분밖에 걸리지 않습니다.
나이테를 디지털화하는 과정에서, 청색 강도측정(38,39)에 자주 사용되는 평판 스캐너의 적용은 결과 이미지의 품질이 다소 낮기 때문에 나이테 구조에 대한 보다 상세한 보기와 관련하여 만족스럽지 않았습니다. 침엽수의 일반적인(넓은) 고리의 경계가 이 이미지에서 보였지만, 좁은 고리 또는 밀도 변동을 식별하는 것은 거의 불가능했습니다.
X-ray CT40과 같이 나이테를 고해상도로 디지털화하려는 새로운 시도가 있지만, 여전히 고해상도 디지털 카메라를 사용하는 것이 추가 측정을 위한 고품질 이미지를 생성하는 가장 효율적이고 비용 효율적인 방법입니다.
공개
저자는 경쟁하는 재정적 이익이 없다고 선언합니다.
감사의 말
저자는 새로운 홀더를 만드는 아이디어를 지원해 준 Jussi Grießinger 교수에게 감사를 표하고 싶습니다.
자료
| Name | Company | Catalog Number | Comments |
| Core-microtome | WSL | https://www.wsl.ch/en/services-produkte/microtomes/ | Microtome to cut micro sections from increment cores |
| Epson Expression 10000XL | EPSON | https://epson.com/Support/Scanners/Expression-Series/Epson-Expression-10000XL---Graphic-Arts/s/SPT_E10000XL-GA | flatbed scanner |
| GSC holder | WSL | in-house | 3D printed mount to fix cores for transport, preparation, analyses, and storage |
| Skippy image capturing system | WSL | https://www.wsl.ch/en/services-produkte/skippy/) | Image capturing system developed at WSL equiped with a 61 MP camera (Sony Alpha 7R IV and Sony FE 90mm f/2.8 Macro lens) |
참고문헌
- Wimmer, R. Arthur Freiherr von Seckendorff-Gudent and the early history of tree-ring crossdating. Dendrochronologia. 19 (1), 153-158 (2001).
- McGraw, D. J. Andrew Ellicott Douglass and the giant sequoias in the founding of dendrochronology. Tree-Ring Res. 59 (1), 21-27 (2003).
- Schweingruber, F. H. . Tree Rings and Environment: Dendroecology. , (1996).
- Amoroso, M. M., Daniels, L. D., Baker, P. J., Camarero, J. J. . Dendroecology: Tree-Ring Analyses Applied to Ecological Studies (Vol.231). 231, (2017).
- Lopez-Saez, J., Corona, C., Von Arx, G., Fonti, P., Slamova, L., Stoffel, M. Tree-ring anatomy of Pinus cembra trees opens new avenues for climate reconstructions in the European Alps. Sci Total Environ. 855, 158605 (2023).
- Björklund, J., et al. Fennoscandian tree-ring anatomy shows a warmer modern than medieval climate. Nature. 620 (7972), 97-103 (2023).
- Camarero, J. J., Colangelo, M., Rodriguez-Gonzalez, P. M. Tree growth, wood anatomy and carbon and oxygen isotopes responses to drought in Mediterranean riparian forests. Forest Ecol Manag. 529, 120710 (2023).
- Huang, R., Xu, C., Grießinger, J., Feng, X., Zhu, H., Bräuning, A. Rising utilization of stable isotopes in tree rings for climate change and forest ecology. JForestry Res. 35, 13 (2024).
- Schneider, L., Gärtner, H. Additive manufacturing for lab applications in environmental sciences: pushing the boundaries of rapid prototyping. Dendrochronologia. 76, 126015 (2022).
- Björklund, J., et al. Scientific merits and analytical challenges of tree-ring densitometry. Rev Geophys. 57, 1224-1264 (2019).
- Katzenmaier, M., Garnot, V. S. F., Björklund, J., Schneider, L., Wegner, J. D., von Arx, G. Towards ROXAS AI: Deep learning for faster and more accurate conifer cell analysis. Dendrochronologia. 81, 126126 (2023).
- Gärtner, H., Lucchinetti, S., Schweingruber, F. H. A new sledge microtome to combine wood anatomy and tree-ring ecology. IAWA J. 36 (4), 452-459 (2015).
- Gärtner, H., et al. A technical perspective in modern tree-ring research - how to overcome dendroecological and wood anatomical challenges. J Vis Exp. 97 (e52337), (2015).
- Gärtner, H., Banzer, L., Schneider, L., Schweingruber, F. H., Bast, A. Preparing micro sections of entire (dry) conifer increment cores for wood anatomical time-series analyses. Dendrochronologia. 34, 19-23 (2015).
- Gärtner, H., Schneider, L., Lucchinetti, S., Cherubini, P. Advanced workflow for taking high-quality increment cores - new techniques and devices. J Vis Exp. (193), e64747 (2023).
- Wang, X. Acoustic measurements on trees and logs: a review and analysis. Wood Sci Technol. 47, 965-975 (2013).
- Steenkamp, C. J., Van Rooyen, M. W., Van Rooyen, N. A non-destructive sampling method for dendrochronology in hardwood species. South Afr For J. 186, 5-7 (1999).
- Toole, E. R., Gammage, J. L. Damage from increment borings in bottomland hardwoods. J For. 57, 909-911 (1959).
- Grissino-Mayer, H. D. A manual and tutorial for the proper use of an increment borer. Tree-Ring Res. 59 (2), 63-79 (2003).
- Griffin, D., et al. Gigapixel macro photography of tree rings. Tree-Ring Res. 77, 86-94 (2021).
- . LINTAB-Precision ring by ring Available from: https://rinntech.info/products/lintab/ (2003)
- . Regent Instruments Available from: https://regentinstruments.com (2024)
- De Micco, V., et al. Intra-annual density fluctuations in tree rings: How, when, where, and why. IAWA J. 37, 232-259 (2016).
- Edwards, J., et al. Intra-annual climate anomalies in northwestern North America following the 1783-1784 CE Laki eruption. J Geophys Res Atmos. 126, e2020JD033544 (2020).
- Levanič, T. ATRICS-A new system for image acquisition in dendrochronology. Tree-Ring Res. 63 (2), 117-122 (2007).
- García-Hidalgo, M., et al. CaptuRING: A do-it-yourself tool for wood sample digitization. Methods Ecol Evol. 13 (6), 1185-1191 (2022).
- Rodriguez, D. R. O., et al. Exploring wood anatomy, density and chemistry profiles to understand the tree-ring formation in Amazonian tree species. Dendrochronologia. 71, 125915 (2022).
- Gärtner, H., Farahat, E. Cambial activity of Moringa peregrina (Forssk.) Fiori in arid environments. Front Plant Sci. 12, 760002 (2021).
- Gärtner, H., Lucchinetti, S., Schweingruber, F. H. New perspectives for wood anatomical analysis in dendrosciences: the GSL1-microtome. Dendrochronologia. 32, 47-51 (2014).
- Maeglin, R. R. . Increment Cores: How to Collect, Handle, and Use Them (Vol. 25). , (1979).
- Agee, J. K., Huff, M. H. . The Care and Feeding of Increment Borers. , (1986).
- Phipps, R. L., , . . Collecting, Preparing, Crossdating, and Measuring Tree Increment Cores (No. 85-4148). , (1985).
- Cole, D. M. . Protection and Storing Increment Cores in Plastic Straws. 216, (1977).
- Rossi, S., Anfodillo, T., Menardi, R. Trephor: a new tool for sampling microcores from tree stems. IAWA J. 27 (1), 89-97 (2006).
- Schneider, L., Gärtner, H. The advantage of using a starch based non-Newtonian fluid to prepare micro sections. Dendrochronologia. 31, 175-178 (2013).
- Gärtner, H., Nievergelt, D. The core-microtome: A new tool for surface preparation on corse and time series analysis of varying cell parameters. Dendrochronologia. 28 (2), 85-92 (2010).
- McCarroll, D., Pettigrew, E., Luckman, A., Guibal, F., Edouard, J. L. Blue reflectance provides a surrogate for latewood density of high-latitude pine tree rings. Arct Antarct Alp Res. 34 (4), 450-453 (2002).
- Björklund, J., Seftigen, K., Kaczka, R. J., Rydval, M., Wilson, R. A standard definition and terminology for Blue Intensity from conifers. Dendrochronologia. 85, 126200 (2024).
- Van den Bulcke, J., et al. Advanced X-ray CT scanning can boost tree ring research for earth system sciences. Ann Bot. 124 (5), 837-847 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유