Method Article
Ein neuer Workflow für die Probenahme und Digitalisierung von inkrementellen Kernen
In diesem Artikel
Zusammenfassung
Wir stellen ein Protokoll vor, um 3D-gedruckte Halterungen zu verwenden, um inkrementelle Kerne im Feld zu fixieren, ohne dass sie ausgepackt und auf Holzhalterungen geklebt werden müssen. Der neue GSC-Halter ermöglicht es, die Kerne in ein Kernmikrotom zu legen, um ihre Oberfläche zu schneiden und sie direkt in die digitale Bildaufnahme zu übertragen.
Zusammenfassung
Hier stellen wir einen neuen Arbeitsablauf vor, der von der Entnahme von inkrementellen Kernen im Feld über die Lagerung und den Transport ins Labor bis hin zur Digitalisierung ihrer Baumringe für weitere Analysen für nachfolgende dendroökologische Analysen reicht. Das Verfahren beinhaltet die Verwendung neuer Probenträger für Inkrementkerne. Diese neuen Gärtner Schneider Core (GSC) Halter werden mit Hilfe einer dreidimensionalen (3D) Modellierungssoftware entworfen und schließlich mit einem 3D-Drucker gedruckt. Mit diesen Halterungen von Anfang an im Feld können die Kerne direkt mit einem Kernmikrotom geschnitten und ihre Oberfläche dann ohne weitere Neuanordnung mit einem neuen hochauflösenden Bilderfassungssystem digitalisiert werden. Sie stehen somit für die direkte Analyse zur Verfügung. Dieses System ermöglicht die Digitalisierung von Baumringen aus Bohrkernen und Scheiben sowie die Aufnahme von Bildern von langen Mikroschnitten (bis zu 40 cm) mit Durchlicht. Diese Eigenschaft ist von besonderem Interesse für dendroökologische und geomorphologische Anwendungen, um das Auftreten von Störungen in Schliffen zu identifizieren, die mit einem Kernmikrotom geschnitten wurden.
Einleitung
Das Prinzip der Datierung von Baumringen unter Anwendung der Kreuzdatierungstechnik wurde erstmals 1881 von dem österreichischen Forstwissenschaftler Arthur Freiherr von Seckendorff-Gudent eingeführt1. In der ersten Hälfte des 20. Jahrhunderts wurde diese Technik vom "Vater der Dendrochronologie" Andrew Ellicott Douglass neu erfunden und intensiv bei der Datierung archäologischer Stätten und lebender Bäume angewandt2.
Heutzutage wird die Dendroökologie, das Forschungsthema, das als eine Art Umweltrahmen der Dendrochronologie fungiert, definiert als die Untersuchung von Baumringen und ihren inhärenten Wachstumsvariationen, die durch ökologische und umweltbedingte Veränderungen in der Zeit verursachtwerden 3. In der dendroökologischen Forschung werden viele andere Merkmale als Ringbreitenvariationen, wie stabile Isotope, späte Holzdichte oder Zelleigenschaften innerhalb einzelner Ringe, verwendet, um diese Daten mit Umweltparametern zu korrelieren und den Einfluss der Umweltbedingungen auf das Baumwachstum im Laufe der Zeit besser zu verstehen4. Durch die fortlaufende Integration von holzanatomischen Studien in die dendroökologische Forschung hat sich die dendroökologische Forschung im letzten Jahrzehnt weiterentwickelt und ist mehr denn je ein Rückgrat bei der Rekonstruktion vergangener Klimabedingungen 5,6,7,8.
Obwohl die technische Entwicklung in Bezug auf die Probenvorbereitung und -analyse, insbesondere in der Holzanatomie, in den letzten zehn Jahren stark war 9,10,11,12,13,14, gab es fast keine wirklichen Fortschritte in Bezug auf die Vereinfachung der Probenahmetechniken15. Entgegen z.B. der akustischen Wellentechnologie16 gibt es bis heute keine verlässliche "zerstörungsfreie" Methode, um die Eigenschaften von Ringen von Bäumen zu extrahieren.
Folglich stützen sich alle jahrringbezogenen Studien nach wie vor auf Holzproben, die von Bäumen oder Sträuchern entnommen wurden, die an den interessierenden Standorten entnommen wurden. Bei der Fokussierung auf Bäume besteht das Standardverfahren darin, inkrementelle Kerne aus den Stämmen15 zu entnehmen.
Die Entnahme von Kernen mit Hilfe von Inkrementkernen wird häufig als "zerstörungsfreie" Technik ausgedrückt17. Verglichen mit der Entnahme von Scheiben aus Stängeln ist dies korrekt; Nichtsdestotrotz verursacht diese Probenahmetechnik ein Loch im Stiel von etwa 1 cm Durchmesser, das meist über das Mark des Stielshinausreicht 3. Der Baum ist in der Lage, diese Wunde von selbst zu schließen, aber dieser Prozess verursacht Wachstumsreaktionen, die die gemeinsame Struktur in der Nähe der Wunde verändern sowie eine mehr oder weniger starke Verfärbung des vorhandenen Holzes um das Loch herum aufgrund von Pilzkrankheiten18,19. Man sollte es also eher als "minimalinvasiv" denn als "zerstörungsfrei" bezeichnen.
Die Technik der Entnahme von inkrementellen Kernen hat sich in jüngster Zeit durch die Möglichkeit entwickelt, mechanische Bohrer zu verwenden, was zu qualitativ hochwertigeren Proben führt, insbesondere für holzanatomische Analysen15. Dieses Verfahren spart auch viel Zeit im Feld im Vergleich zum manuellen Kernbohren. Unverändert blieb das Verfahren des Umgangs mit den Bohrkernen, angefangen bei der Extraktion aus dem Baum über die Beschriftung, Lagerung für den Transport bis hin zur Vorbereitung im Labor für verschiedene mögliche Analysetechniken.
Die Hülsen müssen nach wie vor in stabilen Behältern, wie z. B. Strohhalmen aus Kunststoff oder Papier, verpackt werden, damit sie während des Transports nicht brechen. Die Beschriftung der Kerne erfolgt direkt auf dem Kern mit weichen Bleistiften oder (häufiger) auf der Außenseite jedes Strohhalms. Bei der Verwendung von Kunststoffbehältern müssen die Kerne nach kurzer Zeit herausgenommen werden, um die Ausbreitung von Pilzen zu vermeiden. Die Kerne müssen also wieder aus den Behältern entnommen werden. Um die Kerne zu stabilisieren und zu verhindern, dass sie sich beim Trocknen verbiegen, müssen die Kerne auf einer Halterung fixiert werden. Dies hilft auch bei der anschließenden Oberflächenvorbereitung für weitere Analysen. Dabei müssen auch die Etiketten auf die jeweiligen Passepartouts übertragen werden. Ein Standardverfahren ist das Aufkleben der Kerne auf Holzhalterungen oder das Fixieren mit Klebeband in den Rillen von Wellpappen. Das Aufkleben auf Holzhalterungen ist die am häufigsten verwendete Technik. Obwohl dieses Verfahren perfekt zum Stabilisieren und Schleifen oder Schneiden der Kerne geeignet ist, hat es mehrere Nachteile in Bezug auf mögliche chemische, isotopische und sogar holzanatomische Analysen. Ein weiterer Nachteil, trotz des Zeitaufwands, ist die fehleranfällige Übertragung der Labels für jeden Kern auf die neuen Mounts.
In der Dendrochronologie sind Ringbreitenmessungen als Grundlage für eine genaue Datierung das Rückgrat aller dendroökologischen Studien20. Obwohl viele Labore immer noch auf manuelle Messungen mit Messtabellen setzen, z. B. Lintab21 mit angeschlossenem Fernglas, gibt es einen Trend zum Einsatz von Flachbettscannern zur Digitalisierung von Kernoberflächen und zur Messung der Ringbreite mit Software wie CooRecorder22 oder WinDENDRO23. Leider haben diese Scanner, wie z.B. der weit verbreitete Epson Expression 10000XL, keine ausreichende Auflösung, um Strukturen als Früh- oder Spätholztracheiden eindeutig darzustellen (Abbildung 1). Aus diesem Grund sind die resultierenden Bilder nicht geeignet, um schwierige Strukturen wie sehr schmale Ringe oder Dichtefluktuationen zu erkennen, die für ein genaues Cross-Datierverfahren ohne Rückgriff auf die ursprünglichen Kerne mit einem Fernglas entscheidend sind24,25.
Da eine hohe Bildauflösung eine unabdingbare Voraussetzung für adäquate Bildanalysen in der Jahrringforschung10 ist, wurde an der WSL ein neues Bilderfassungssystem (Skippy; https://www.wsl.ch/en/services-produkte/skippy/) entwickelt, um Baumringe auf Bohrkernoberflächen mit einer Digitalkamera zu digitalisieren, was zu Bildern führt, die eine höhere Auflösung aufweisen als alle bestehenden Flachbettscanner. Dieses System basiert auf der Idee des ATRICS-Systems26, das 2007 entwickelt wurde. Zuletzt wurde ein einfaches, aber effizientes Bilderfassungssystem, vergleichbar mit dem Kippy, als Selbstbausatz27 vorgestellt.
Die Digitalisierung von Baumringen, d.h. die Erfassung von Auflichtbildern, ist ein wichtiger Schritt bei der Erstellung hochauflösender Bilder von Inkrementkernen oder Scheiben, um eine zeiteffiziente, digital basierte Ringbreitenmessung zu unterstützen. Das an der WSL entwickelte System ermöglicht auch die Aufnahme von Bildern aus langen Mikroschnitten (bis zu 40 cm) mittels Durchlicht. Dieses zusätzliche Merkmal ist z.B. für dendrogeomorphe Anwendungen interessant, um das Auftreten von Reaktionsholz in Mikroschnitten zu identifizieren.
In der Studie stellen wir ein Protokoll vor, das den Umgang mit Bohrkernen im Feld und im Labor erleichtern soll. Die Basis der vorgestellten neuen Technik ist eine wiederverwendbare Halterung; der neue GSC-Halter GärtnerSchneiderErz(GSC) Halter, der mit Hilfe einer 3D-Modellierungssoftware entworfen und mit einem 3D-Drucker gedruckt wurde. Der GSC-Halter ermöglicht eine einfache Handhabung der im Feld entnommenen Bohrkerne, ohne dass diese neu verpackt oder etikettiert werden müssen. Außerdem stellen wir ein effizientes neues System zur Digitalisierung der vorbereiteten Oberflächen der Kerne vor. Dieses Protokoll umfasst das gesamte Verfahren von der Entnahme von Bohrkernen vor Ort über die Probenvorbereitung bis hin zur Digitalisierung der Kernoberflächen für nachfolgende Analysen und schließlich deren Speicherung in einem Archiv.
Protokoll
1. Anlegen des GSC-Inhabers
- Öffnen Sie das 3D-Modell des Halters in einem Slicer-Programm, das mit einem 3D-Drucker kompatibel ist. Erstellen Sie eine Druckdatei, die vom 3D-Drucker gelesen werden kann (in diesem Fall eine "*.gcode"-Datei).
HINWEIS: Das 3D-Modell kann mit jeder 3D-Modellierungssoftware entworfen werden. - Übertragen Sie die Druckdatei mit einer Speicherkarte oder einem USB-Stick auf den 3D-Drucker und aktivieren Sie die Druckdatei auf dem 3D-Drucker.
- Sobald der Halter gedruckt ist, warten Sie, bis der Halter auf Raumtemperatur (RT) abgekühlt ist. Entfernen Sie dann die Platte, an der der Halter haftet, vom Drucker und biegen Sie die Platte ein wenig, bis sich die Form von der Oberfläche löst.
- Entfernen Sie alle überschüssigen Gewinde oder Aufsätze aus der Halterung.
HINWEIS: Die Anzahl der Halter, die gleichzeitig gedruckt werden sollen, hängt von der Größe des Druckers ab. Auf einem 3D-Drucker mit einem Plattenmaß von 36 cm x 36 cm kann man rund 30 Halter mit einer Länge von 35 cm in einem Durchgang drucken. Die Zeit, die benötigt wird, um 30 Halter zu drucken, hängt vom Gerät ab. Im Durchschnitt sollte dies in ca. 8 h (Drucken über Nacht) erledigt sein.
2. Extrahieren, Stabilisieren und Transportieren von Inkrementkernen im Feld
- Nehmen Sie einen Akku-Bohrschrauber, der mit einem Drehmomentverstärker und einem Inkrementalbohrer ausgestattet ist, wählen Sie die Position des Kernbohrers und platzieren Sie den Bohrer senkrecht zur Wachstumsachse des Stiels.
HINWEIS: Das Gleiche kann manuell mit dem Inkrementalgreifer ohne Akkubohrer durchgeführt werden. - Beginnen Sie mit dem Entkernen, bis der Entkerner mindestens die Hälfte des Stieldurchmessers erreicht hat. Überprüfen Sie die Tiefe wie oben beschrieben, indem Sie den Extraktor (der die gleiche Länge wie der Entkerner hat) neben den Entkerner halten.
- Wenn Sie einen Akku-Bohrschrauber verwenden, nehmen Sie den Bohrer ab, setzen Sie den Griff auf den Ausbohrer (was bereits bei der manuellen Verwendung des Inkrementalbohrers der Fall ist), nehmen Sie den Auszieher mit der offenen Seite nach oben und setzen Sie ihn vollständig in den Ausbohrer ein.
- Drehen Sie den Inkrementierkern nach hinten (eine volle Umdrehung), um den Kern vom Stiel abzubrechen. Nehmen Sie den Extraktor einschließlich des Kerns heraus.
- Entfernen Sie den Kern aus dem Extraktor. Überprüfen Sie die Faserrichtung des Kerns, um eine aufrechte Ausrichtung der Fasern zu gewährleisten, wenn Sie den Kern in den Halter legen.
HINWEIS: Die Faserrichtung kann sowohl an beiden Enden des Kerns als auch an der Seite des Kerns überprüft werden. Halten Sie dazu den Kern gegen das Licht und drehen Sie ihn, bis ein seitliches Leuchten zu sehen ist. Dies geschieht, weil auf dieser Seite die radialen Zellwände in Längsrichtung geschnitten sind und das Licht anders reflektieren als der Rest des Kerns. - Legen Sie den Kern mit der Faserrichtung aufrecht auf den Halter. Mit allen Fingern auf den Kern drücken, bis der Kern in die Halterung gleitet.
- Beschriften Sie den Kern an der Seite des Halters mit einem weichen Bleistift, so dass auch auf Glas geschrieben werden kann.
HINWEIS: Die Schrift kann später mit einem handelsüblichen Gummi entfernt werden. - Setzen Sie die Halterung mit dem Kern in die Transportbox ein und schließen Sie die Abdeckung.
3. Vorbereitung der montierten Kerne im Labor
- OPTIONAL: Einbetten der montierten Kerne in Paraffin für mögliche Mikroschnitte.
- Stellen Sie einen Stahlkasten mit einem Deckel und einem Ventil für den Anschluss einer Vakuumpumpe auf eine Kochplatte, füllen Sie ihn bis zu ca. 2 cm mit Paraffin und warten Sie, bis er vollständig geschmolzen ist.
- Nehmen Sie die montierten Kerne aus der Transportbox. Setzen Sie die Halter mit den Kernen, so wie sie sind, in das flüssige Paraffin ein und schließen Sie den Deckel.
- Starten Sie die Vakuumpumpe, legen Sie ein konstantes, leichtes Vakuum auf den Behälter an und warten Sie ca. 2 h. Durch die offene Struktur des Halters kann das Paraffin ohne zusätzliche Barrieren in die Kerne eindringen.
- Stoppen Sie die Vakuumpumpe und öffnen Sie den Deckel. Die Halterungen mit den Kernen herausnehmen, auf ein Gitter legen und abkühlen lassen.
- Entfernen Sie bei Bedarf überschüssiges Paraffin von den Seiten des Halters.
- Vorbereiten der Kernoberflächen
- Nehmen Sie die montierten Kerne aus der Transportbox oder dem Paraffinbad. Platzieren Sie den Halter mit dem Kern so wie er sich in dem Probenhalter eines Kernmikrotoms befindet. Achte darauf, den Kern so auszurichten, dass das Spätholz der Ringe zur Klinge zeigt.
- Ziehen Sie die Schrauben des Probenhalters fest, bis der Kernhalter vollständig sitzt.
- Heben Sie den Probenhalter an, bis der Kern die Klinge leicht berührt. Ziehe die Klinge über die gesamte Ausdehnung des Kerns, um den ersten Teil der Oberseite abzuschneiden.
- Schieben Sie das Messer hinter den Kern zurück, heben Sie den Probenhalter einige Mikrometer an und wiederholen Sie den Vorgang, bis eine ebene Fläche von mindestens 2-3 mm Breite erreicht ist.
- Sobald die Oberfläche wie vorgesehen geschnitten ist, entfernen Sie den Kernhalter vom Probenhalter des Mikrotoms.
HINWEIS: Es wird empfohlen, die Kerne mit einem Kernmikrotom zu schneiden und nicht zu schleifen, da die Oberfläche sauberer und gerade ist und die Zellen nicht mit Staub gefüllt sind.
4. Digitalisieren der Kernflächen
- Platzieren Sie den Kernhalter mit der glatten Kernfläche auf dem Tisch eines Bilderfassungssystems, wie hier das WSL-Skippy-System vorgestellt wird.
- Achten Sie darauf, dass der Kernhalter mit der Bewegungsrichtung des Tisches oder der Kamera ausgerichtet ist.
- Positionieren Sie den Tisch mit dem Kernhalter unter der Kamera, sodass sich der äußerste Ring in der Bildmitte unter dem Kameraobjektiv befindet.
- Platzieren Sie eine Skala neben dem Beginn des Kerns und nehmen Sie ein Bild zur Kalibrierung auf.
HINWEIS: Dies muss nur einmal gemacht werden, wenn Bilder von vielen Kernen hintereinander erstellt werden. - Definieren Sie die Länge des Kerns in der Software und starten Sie den Bildaufnahmeprozess. Wenn das letzte Bild aufgenommen wurde, bewegt sich der Tisch wieder in die Ausgangsposition.
- Nehmen Sie die Probe vom Tisch, platzieren Sie den nächsten Halter unter der Kamera und wiederholen Sie das zuvor beschriebene Verfahren, indem Sie die Länge des Kerns festlegen, bis alle Kerne fotografiert sind.
- Verwenden Sie eine (verzerrungsfreie) Stitching-Software, z.B. PTGui, um die Einzelbilder zu einem endgültigen Bild der Kernoberfläche zusammenzusetzen.
5. Lagerung der Kerne
- Nehmen Sie die analysierten Kerne in die Halterung und legen Sie sie in das tragbare Lagerregal, das mit einem 3D-Drucker gedruckt wurde.
- Beschriften Sie das Rack, um die Kerne von außen zu identifizieren.
- Bewahren Sie das Regal in einem Regal oder einem anderen verfügbaren Archiv auf.
Ergebnisse
GSC-Inhaber
Die Kernhalter sind (standardmäßig) auf eine Länge von 35 cm gedruckt, was fast der maximalen Druckgröße des verwendeten 3D-Druckers entspricht (Original Prusa XL, Bauvolumen 36 cm × 36 cm × 36 cm). Falls längere Kerne verwendet werden, kann der Halter mit zusätzlichen Haltern erweitert werden, indem diese mit kleinen Verbindungsstücken durch die Vertiefungen verbunden werden, die an beiden Enden aller Halter vorhanden sind (Abbildung 2A).
Bei der Feldarbeit ist die Zeit, die benötigt wird, um die Kerne direkt in der Halterung zu lagern, vergleichbar mit dem einfachen Einstecken in einen Strohhalm oder ein anderes Verpackungsmaterial. Obwohl es notwendig ist, die Faserrichtung jedes Kerns zu respektieren, bevor der Kern in den Halter gedrückt wird (Abbildung 2), beträgt diese zusätzliche Zeit nur wenige Sekunden und kann mit einer Linse unterstützt werden. Unserer Erfahrung nach beläuft sich der zusätzliche Zeitaufwand (wenn überhaupt) auf etwa 1 Minute für 10 Kerne. Diese minimale zusätzliche Zeit bezieht sich auch auf gebrochene Kerne. Statt zerbrochene Kerne Stück für Stück in einen Strohhalm zu nehmen, werden diese Stücke einfach nacheinander in den Halter gelegt und eingedrückt.
Um den sicheren Transport der Bohrkerne im Feld und ins Labor zu gewährleisten, haben wir eine spezielle Transportbox für die Halterungen inklusive der Bohrkerne entworfen und gedruckt (Abbildung 3). Die Halter können einfach in die Box gelegt werden, wo sie durch kleine Ausbuchtungen stabilisiert werden, die genau in die Vertiefungen an beiden Enden der Halter passen. Verschlossen werden kann die Box dann durch einen Deckel, der an den seitlichen Rillen der Box eingeschoben wird.
Der eigentliche Vorteil der neuen Halterung zeigt sich im Labor. Anstatt die Kerne aus dem Strohhalm (oder anderen Behältern) zu nehmen, Holzhalterungen mit Hinweis vorzubereiten, die Kerne auf der Halterung zu fixieren, das Etikett auf die neue Halterung zu übertragen und mindestens ein paar Stunden zu warten, bis der Kleber trocken und stabil für die weitere Verarbeitung ist, können die Kerne im Halter direkt (i) in einem Kernmikrotom fixiert werden, um eine ebene Oberfläche zu schneiden oder (ii) direkt mit einem Schleifen geschliffen werden Maschine, ohne dass ein weiterer Vorbereitungsprozess erforderlich ist. Durch den Wegfall des Transfers der Etiketten auf neue Passepartouts werden insbesondere mögliche Übertragungsfehler vermieden.
Da die Halter für jeden Kerndurchmesser ausgelegt werden können, spielt es keine Rolle, ob sie für "normale" 5 mm Kerne oder 10 mm oder 12 mm Kerne benötigt werden, da sie z.B. für Isotopen- oder andere chemische Analysen verwendet werden.
Bezogen auf Isotopen- oder chemische Analysen besteht der Vorteil des Halters darin, dass die Kerne fixiert werden, ohne dass Klebstoff oder Fixiermedium erforderlich sind. So werden die Kerne nicht verunreinigt und können für spezifischere Analysen leicht aus dem Halter entfernt werden. Auch bei holzanatomischen Analysen ermöglicht die Möglichkeit, die Kerne leicht aus dem Halter zu entfernen, eine einfache Handhabung der Kerne für die Vorbereitung von Schliffen.
Die optionale Möglichkeit, im Halter fixierte Kerne einzubetten, ermöglicht die Stabilisierung empfindlicher Strukturen, da Zellen mit dünnen Zellwänden dazu neigen, beim Schneiden zu brechen. Die Stabilisierung des Kerns durch Einbetten in Paraffin ist in vielen Fällen effizienter als die einfache Zugabe einer Maisstärkelösung.
Ein weiterer Vorteil ergibt sich auch, wenn die Kerne für spätere Inspektionen oder erneute Analysen gelagert werden müssen. Die Halterungen können in speziell dafür vorgesehenen Racks platziert werden (Abbildung 4) und auch mit einem 3D-Drucker gedruckt werden, vergleichbar mit der Aufbewahrung in der Transportbox. Die GSC-Halter mit den Kernen werden so in das Rack gelegt, wie sie sind und können dann an jedem beliebigen Ort gelagert werden. Die Breite der Regale, also wie viele Kerne in einem Regal fixiert werden können, hängt vom zur Verfügung stehenden Platz in einem Regal oder Lagerraum ab. Die Rack-Modelle können an jeden spezifischen Bedarf angepasst und entsprechend bedruckt werden.
Digitalisieren von Kern- oder Scheibenoberflächen
Das an der WSL entwickelte Bilderfassungssystem (Abbildung 5) ermöglicht die Digitalisierung von Baumringen (automatisiertes Image Capturing), um hochauflösende Bilder von inkrementellen Kernen oder Scheiben zu erstellen, um eine zeiteffiziente, digital basierte Ringbreitenmessung zu unterstützen. Das System besteht aus einer Platte, die an einer Gewindestange befestigt ist und die Probe unter das Objektiv (Sony FE 90 mm f/2.8 Macro) einer 61-MP-Kamera (Sony Alpha 7R IV) in vordefinierten Schritten zwischen 0,1 und 1 cm bewegt. Die Bilder werden mit dem Autofokus-System der Kamera aufgenommen, um scharfe Einzelbilder zu gewährleisten. Die Auflösung der Kamera erlaubt eine reale Auflösung jedes Bildes von 6500 dpi, getestet mit einem SilverFast-Auflösungstarget (USAF 1951). Das mag im Vergleich zur offiziellen Auflösung eines Flachbettscanners mit einer angegebenen Auflösung von 4800 dpi etwas niedrig klingen. Beim Testen von Bildern desselben Ziels, die mit einem Epson XL-Scanner mit einer Auflösung von 4800 dpi aufgenommen wurden, zeigten die resultierenden Bilder jedoch nur eine reale Auflösung von 1825 dpi (Abbildung 6). Die hohe Auflösung der Bilder ermöglicht eine klare Sicht auf die einzelnen Zellen und damit eine klare Definition der in den Bildern erfassten Ringgrenzen (Abbildung 7). Wenn die Oberfläche der verwendeten Kerne oder Scheiben gut vorbereitet ist, muss nicht auf das Originalmuster zurückgegriffen werden, um die Struktur erneut zu überprüfen. Nach dem Zusammenfügen der Einzelbilder können die resultierenden Kernbilder mit der bevorzugten Analysesoftware analysiert werden.
Das Bilderfassungssystem ermöglicht auch die Aufnahme von Bildern aus Mikroschnitten bis zu einer Länge von 40 cm mittels Durchlicht. Dieses Merkmal ist z.B. für dendrogeomorphe Anwendungen interessant, um das Auftreten von Reaktionsholz oder andere spezifische Merkmale in Mikroschnitten ganzer Baumkerne zu identifizieren (Abbildung 8).

Abbildung 1: Scanbilder der Larix decidua Mill. Baumringe, die mit einem Flachbettscanner in unterschiedlichen Auflösungen gescannt wurden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
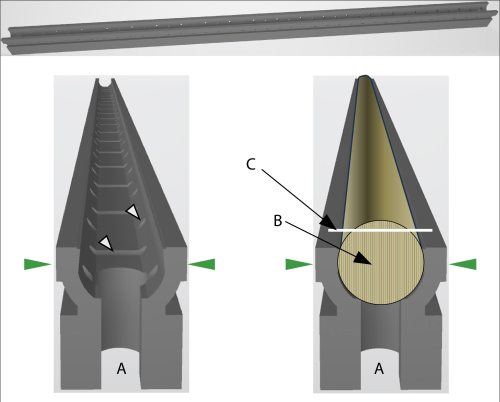
Abbildung 2: Schematische Darstellung des GSC-Halters. (A) Die Öffnung an beiden Enden des Halters ermöglicht es, zwei Halter mit einem kleinen Pol zu verbinden, um längere Kerne zu befestigen. Die grünen Pfeile zeigen die Druckrichtung an, wenn der Halter im Kernmikrotom fixiert ist. Links: Weiße Pfeile zeigen Öffnungen an, die die Zirkulation von Luft oder Flüssigkeit (zum Einbetten) ermöglichen. Rechts: Der GSC-Halter mit eingepresstem Kern. (B) Die Faserrichtung des Kerns muss aufrecht sein. (C) Die weiße Linie zeigt die Schnittfläche des Kerns an. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Transportbox zur Lagerung und zum Transport des GSC-Halters mit den Bohrkernen im Feld. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 4: Lagerrahmen zum Ablegen der GSC-Halter für die Endlagerung in einem Archiv. Die Rahmen können platzsparend gestapelt werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Das an der WSL entwickelte Bilderfassungssystem. Bitte klicken Sie hier, um eine grössere Version dieser Abbildung anzuzeigen.
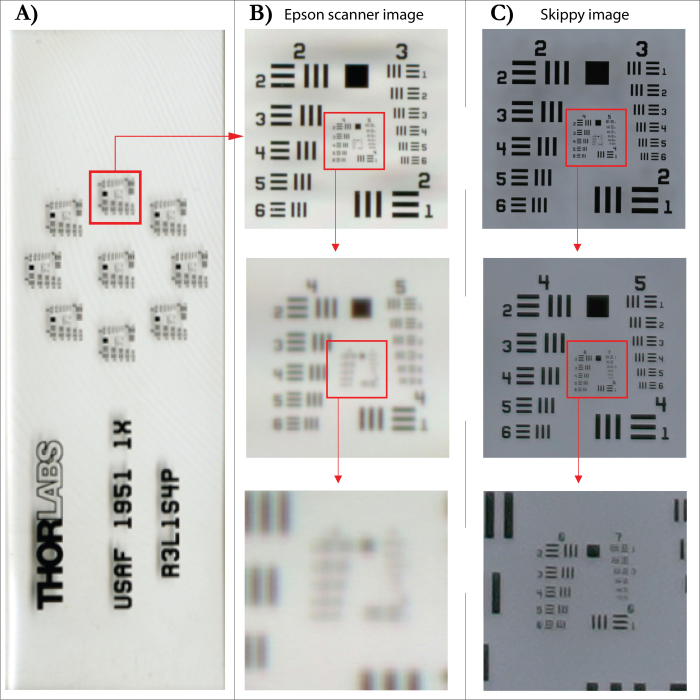
Abbildung 6: Vergleich der Bildauflösung zwischen einem Flachbettscanner und dem Bilderfassungssystem. (A) SilverFast-Auflösungsziel (USAF 1951). (B) Bild, das mit einem Flachbettscanner mit einer angegebenen Auflösung von 4800 dpi (interpoliert) und den entsprechenden Abschnittsvergrößerungen unten gescannt wurde. (C) Bild, das mit dem Bilderfassungssystem aufgenommen wurde, und die entsprechenden Abschnittsvergrößerungen unten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: Zusammengesetztes Bild eines Larix decidua Mill.-Inkrementkerns (oberes Bild) und entsprechende Schnittvergrößerungen unten. Einzelbilder des Komposits wurden mit dem Bilderfassungssystem aufgenommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
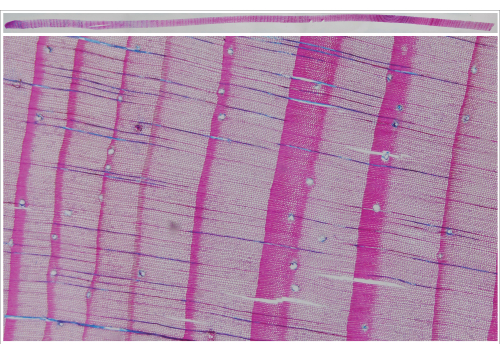
Abbildung 8: Kompositbild eines Mikroschnitts eines gesamten Inkrementkerns (Larix decidua Mill.) und entsprechende Schnittvergrößerung. Einzelbilder des Komposits wurden mit dem Bilderfassungssystem (Durchlicht) aufgenommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die Einbeziehung der Holzanatomie in dendroökologische Studien öffnete diese Studien weitgehend für neue und tiefergehende Analysen vergangener Umweltbedingungen 28,29,30. Diese neuen Techniken intensivierten auch den analytischen Aufwand, d. h. die Laborzeit, die benötigt wurde, um die interessierenden Daten zu generieren. Es gab zahlreiche Versuche, die Laborarbeit zu optimieren und den Zeitaufwand im Labor für holzanatomische Techniken zu reduzieren 9,12,13,15,30. Es wurden jedoch fast keine Anstrengungen unternommen, um das übliche Verfahren der Handhabung, Aufbereitung und Lagerung von Bohrkernen, die für diese Studien entnommen wurden, zu vereinfachen.
Der 3D-Druck bietet in dieser Hinsicht neue Möglichkeiten9. Der neue, 3D-gedruckte Kernhalter ist der erste Versuch, das gesamte Verfahren zu vereinfachen und damit zeitsparender und damit effizienter zu machen.
Während Kerne, die in Kunststoffstrohhalmen31,32 oder vergleichbaren Behältern gelagert werden, herausgenommen werden müssen, um die Entwicklung von Pilzen an der Außenseite (und bald auch an der Innenseite) des Kerns zu verhindern, können Kerne, die in den GSC-Haltern befestigt sind, so bleiben, wie sie sind. Bis zu diesem Punkt ist es vergleichbar mit der Aufbewahrung in Papierstrohhalmen33.
Der Vorteil wird deutlich, sobald die ganze Prozedur des (i) Entfernens der Kerne aus dem Strohhalm (oder einem anderen Behälter), (ii) des Aufklebens auf Holzhalterungen oder des Befestigens an anderen Gegenständen als Kabelhalterungen und (iii) der möglicherweise fehleranfällige Prozess der Übertragung des jeweiligen Codes für jeden Kern verwendet wird, wie er nun schon jahrzehntelang fast ein Standard war34, unnötig wird.
Die offene Struktur des GSC-Halters ermöglicht die Lagerung der Bohrkerne ohne das Risiko eines Pilzbefalls, wie es bei der Lagerung in einem Kunststoffbehälter der Fall wäre. Wie oben beschrieben, ermöglicht der Halter auch eine Einbettung in Paraffin, um die Struktur zu stabilisieren. Dennoch ist diese "einfache" Einbettung nicht vergleichbar mit herkömmlichen Einbettungsverfahren, bei denen Kassetten zur Einbettung der Probe in einen Paraffinblock verwendet werden, wie sie bei Mikrokernen35 durchgeführt wird. Die einfache Technik ist eher vergleichbar mit dem Auftragen von Maisstärke beim Schneiden von Mikroschnitten36. Es stabilisiert die Zellen besser und verhindert, dass sie während des Schneidvorgangs brechen, ist aber zeitaufwändiger als die einfache Zugabe von Maisstärke. Diese Form der Einbettung stabilisiert nicht den gesamten Kern, als wäre er in einen Block eingebettet. Wenn der Kern gebrochen ist, brechen auch die Abschnitte. Da der GSC-Halter in das Kernmikrotom37 passt, dauert die Vorbereitung der Oberfläche für den anschließenden Digitalisierungsprozess nur wenige Minuten.
Für den Prozess der Digitalisierung von Baumringen war der Einsatz von Flachbettscannern, die häufig für Messungen der Blauintensität38,39 verwendet werden, hinsichtlich der detaillierteren Ansichten der Ringstruktur aufgrund der eher geringen Qualität der resultierenden Bilder nicht zufriedenstellend. Obwohl die Grenzen der üblichen (breiten) Ringe von Nadelbäumen auf diesen Bildern sichtbar waren, waren schmale Ringe oder sogar Dichteschwankungen fast unmöglich zu identifizieren.
Obwohl es faszinierende neue Versuche gibt, Baumringe in hoher Auflösung zu digitalisieren, wie z.B. Röntgen CT40, ist der Einsatz von Digitalkameras mit hoher Auflösung immer noch die effizienteste und kostengünstigste Möglichkeit, qualitativ hochwertige Bilder für weitere Messungen zu erzeugen.
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden finanziellen Interessen haben.
Danksagungen
Die Autoren danken Prof. Jussi Grießinger für die Unterstützung der Idee zur Schaffung des neuen Halters.
Materialien
| Name | Company | Catalog Number | Comments |
| Core-microtome | WSL | https://www.wsl.ch/en/services-produkte/microtomes/ | Microtome to cut micro sections from increment cores |
| Epson Expression 10000XL | EPSON | https://epson.com/Support/Scanners/Expression-Series/Epson-Expression-10000XL---Graphic-Arts/s/SPT_E10000XL-GA | flatbed scanner |
| GSC holder | WSL | in-house | 3D printed mount to fix cores for transport, preparation, analyses, and storage |
| Skippy image capturing system | WSL | https://www.wsl.ch/en/services-produkte/skippy/) | Image capturing system developed at WSL equiped with a 61 MP camera (Sony Alpha 7R IV and Sony FE 90mm f/2.8 Macro lens) |
Referenzen
- Wimmer, R. Arthur Freiherr von Seckendorff-Gudent and the early history of tree-ring crossdating. Dendrochronologia. 19 (1), 153-158 (2001).
- McGraw, D. J. Andrew Ellicott Douglass and the giant sequoias in the founding of dendrochronology. Tree-Ring Res. 59 (1), 21-27 (2003).
- Schweingruber, F. H. . Tree Rings and Environment: Dendroecology. , (1996).
- Amoroso, M. M., Daniels, L. D., Baker, P. J., Camarero, J. J. . Dendroecology: Tree-Ring Analyses Applied to Ecological Studies (Vol.231). 231, (2017).
- Lopez-Saez, J., Corona, C., Von Arx, G., Fonti, P., Slamova, L., Stoffel, M. Tree-ring anatomy of Pinus cembra trees opens new avenues for climate reconstructions in the European Alps. Sci Total Environ. 855, 158605 (2023).
- Björklund, J., et al. Fennoscandian tree-ring anatomy shows a warmer modern than medieval climate. Nature. 620 (7972), 97-103 (2023).
- Camarero, J. J., Colangelo, M., Rodriguez-Gonzalez, P. M. Tree growth, wood anatomy and carbon and oxygen isotopes responses to drought in Mediterranean riparian forests. Forest Ecol Manag. 529, 120710 (2023).
- Huang, R., Xu, C., Grießinger, J., Feng, X., Zhu, H., Bräuning, A. Rising utilization of stable isotopes in tree rings for climate change and forest ecology. JForestry Res. 35, 13 (2024).
- Schneider, L., Gärtner, H. Additive manufacturing for lab applications in environmental sciences: pushing the boundaries of rapid prototyping. Dendrochronologia. 76, 126015 (2022).
- Björklund, J., et al. Scientific merits and analytical challenges of tree-ring densitometry. Rev Geophys. 57, 1224-1264 (2019).
- Katzenmaier, M., Garnot, V. S. F., Björklund, J., Schneider, L., Wegner, J. D., von Arx, G. Towards ROXAS AI: Deep learning for faster and more accurate conifer cell analysis. Dendrochronologia. 81, 126126 (2023).
- Gärtner, H., Lucchinetti, S., Schweingruber, F. H. A new sledge microtome to combine wood anatomy and tree-ring ecology. IAWA J. 36 (4), 452-459 (2015).
- Gärtner, H., et al. A technical perspective in modern tree-ring research - how to overcome dendroecological and wood anatomical challenges. J Vis Exp. 97 (e52337), (2015).
- Gärtner, H., Banzer, L., Schneider, L., Schweingruber, F. H., Bast, A. Preparing micro sections of entire (dry) conifer increment cores for wood anatomical time-series analyses. Dendrochronologia. 34, 19-23 (2015).
- Gärtner, H., Schneider, L., Lucchinetti, S., Cherubini, P. Advanced workflow for taking high-quality increment cores - new techniques and devices. J Vis Exp. (193), e64747 (2023).
- Wang, X. Acoustic measurements on trees and logs: a review and analysis. Wood Sci Technol. 47, 965-975 (2013).
- Steenkamp, C. J., Van Rooyen, M. W., Van Rooyen, N. A non-destructive sampling method for dendrochronology in hardwood species. South Afr For J. 186, 5-7 (1999).
- Toole, E. R., Gammage, J. L. Damage from increment borings in bottomland hardwoods. J For. 57, 909-911 (1959).
- Grissino-Mayer, H. D. A manual and tutorial for the proper use of an increment borer. Tree-Ring Res. 59 (2), 63-79 (2003).
- Griffin, D., et al. Gigapixel macro photography of tree rings. Tree-Ring Res. 77, 86-94 (2021).
- . LINTAB-Precision ring by ring Available from: https://rinntech.info/products/lintab/ (2003)
- . Regent Instruments Available from: https://regentinstruments.com (2024)
- De Micco, V., et al. Intra-annual density fluctuations in tree rings: How, when, where, and why. IAWA J. 37, 232-259 (2016).
- Edwards, J., et al. Intra-annual climate anomalies in northwestern North America following the 1783-1784 CE Laki eruption. J Geophys Res Atmos. 126, e2020JD033544 (2020).
- Levanič, T. ATRICS-A new system for image acquisition in dendrochronology. Tree-Ring Res. 63 (2), 117-122 (2007).
- García-Hidalgo, M., et al. CaptuRING: A do-it-yourself tool for wood sample digitization. Methods Ecol Evol. 13 (6), 1185-1191 (2022).
- Rodriguez, D. R. O., et al. Exploring wood anatomy, density and chemistry profiles to understand the tree-ring formation in Amazonian tree species. Dendrochronologia. 71, 125915 (2022).
- Gärtner, H., Farahat, E. Cambial activity of Moringa peregrina (Forssk.) Fiori in arid environments. Front Plant Sci. 12, 760002 (2021).
- Gärtner, H., Lucchinetti, S., Schweingruber, F. H. New perspectives for wood anatomical analysis in dendrosciences: the GSL1-microtome. Dendrochronologia. 32, 47-51 (2014).
- Maeglin, R. R. . Increment Cores: How to Collect, Handle, and Use Them (Vol. 25). , (1979).
- Agee, J. K., Huff, M. H. . The Care and Feeding of Increment Borers. , (1986).
- Phipps, R. L., , . . Collecting, Preparing, Crossdating, and Measuring Tree Increment Cores (No. 85-4148). , (1985).
- Cole, D. M. . Protection and Storing Increment Cores in Plastic Straws. 216, (1977).
- Rossi, S., Anfodillo, T., Menardi, R. Trephor: a new tool for sampling microcores from tree stems. IAWA J. 27 (1), 89-97 (2006).
- Schneider, L., Gärtner, H. The advantage of using a starch based non-Newtonian fluid to prepare micro sections. Dendrochronologia. 31, 175-178 (2013).
- Gärtner, H., Nievergelt, D. The core-microtome: A new tool for surface preparation on corse and time series analysis of varying cell parameters. Dendrochronologia. 28 (2), 85-92 (2010).
- McCarroll, D., Pettigrew, E., Luckman, A., Guibal, F., Edouard, J. L. Blue reflectance provides a surrogate for latewood density of high-latitude pine tree rings. Arct Antarct Alp Res. 34 (4), 450-453 (2002).
- Björklund, J., Seftigen, K., Kaczka, R. J., Rydval, M., Wilson, R. A standard definition and terminology for Blue Intensity from conifers. Dendrochronologia. 85, 126200 (2024).
- Van den Bulcke, J., et al. Advanced X-ray CT scanning can boost tree ring research for earth system sciences. Ann Bot. 124 (5), 837-847 (2019).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten