Method Article
Ecosistema modelo basado en agarosa para el cultivo de metanótrofos en un contragradiente de metano-oxígeno
En este artículo
Resumen
Se describe un protocolo para la preparación de un ecosistema modelo simple que recrea el contragradiente metano-oxígeno encontrado en el hábitat natural de las bacterias aerobias oxidantes de metano, permitiendo el estudio de su fisiología en un contexto espacialmente resuelto. También se describen las modificaciones de los ensayos bioquímicos comunes para su uso con el ecosistema modelo basado en agarosa.
Resumen
Las bacterias aeróbicas oxidantes de metano, conocidas como metanótrofos, desempeñan funciones importantes en el ciclo biogeoquímico. Los metanótrofos ocupan un nicho ambiental específico dentro de los contragradientes de metano-oxígeno que se encuentran en suelos y sedimentos, lo que influye en su comportamiento a nivel individual y comunitario. Sin embargo, los métodos convencionales para estudiar la fisiología de estos microorganismos que mitigan los gases de efecto invernadero a menudo utilizan cultivos planctónicos homogéneos, que no representan con precisión los gradientes espaciales y químicos que se encuentran en el medio ambiente. Esto dificulta la comprensión de los científicos de cómo se comportan estas bacterias in situ. Aquí, se describe un ecosistema modelo simple y económico llamado jeringa de gradiente, que utiliza agarosa semisólida para recrear los empinados contragradientes de metano-oxígeno característicos de los hábitats naturales de los metanótrofos. La jeringa de gradiente permite el cultivo de cepas metanotróficas y el enriquecimiento de consorcios mixtos de oxidación de metano a partir de muestras ambientales, revelando fenotipos solo visibles en este contexto espacialmente resuelto. Este protocolo también informa de varios ensayos bioquímicos que han sido modificados para ser compatibles con la matriz semisólida de agarosa, lo que puede ser valioso para los investigadores que cultivan microorganismos dentro de otros sistemas basados en agarosa.
Introducción
Los microorganismos que viven en una interfaz anóxico-óxica a menudo cumplen importantes funciones ecológicas1. Un ejemplo son las bacterias aeróbicas oxidantes de metano (metanótrofos), que existen en contragradientes de metano y oxígeno en suelos y sedimentos2. Estos microorganismos poseen características metabólicas y fisiológicas únicas que les permiten explotar los gradientes gaseosos presentes en sus ambientes y han sido objeto de investigación en curso durante décadas 3,4,5. En la actualidad, la mayoría de las investigaciones publicadas sobre los metanótrofos y las comunidades oxidantes de metano se basan en el trabajo con cultivos planctónicos homogéneos que a menudo no logran capturar los gradientes espaciales y químicos que son inherentes a sus hábitats microbianos naturales. Esta limitación dificulta nuestra comprensión de la fisiología microbiana y nuestra capacidad para vincular la información genómica con los rasgos fenotípicos.
Este protocolo informa de un ecosistema modelo simple basado en laboratorio que crea condiciones reproducibles para estudiar tanto metanótrofos específicos, como la cepa LW13 de Methylomonas sp., como comunidades oxidantes de metano directamente a partir de muestras de suelo ambientales. Es importante destacar que el cultivo en la jeringa de gradiente da como resultado fenotipos específicos de contragradiente que no están presentes en cultivos planctónicos homogéneos6, lo que pone de manifiesto la capacidad del sistema para desvelar nuevos aspectos de la fisiología del metanótrofo. Inspirada en los ecosistemas modelo 7,8,9 publicados anteriormente, la jeringa de gradiente es un método simplificado que se puede utilizar para recopilar información química y molecular de microorganismos cultivados con este enfoque.
Los procedimientos informados para los análisis genéticos, químicos y moleculares se han modificado para trabajar de manera confiable en cultivos microbianos cultivados dentro de una matriz de agarosa semisólida. Estos procedimientos también pueden ser útiles para analizar bacterias cultivadas en otros sistemas semisólidos basados en agarosa, como los utilizados para los ensayos de natación con agar blando bacteriano. La adaptación de estos análisis a contextos espacialmente resueltos puede abrir nuevas vías para el estudio de la vida microbiana en entornos más relevantes desde el punto de vista ecológico.
Protocolo
Los detalles de los reactivos y el equipo utilizado en el estudio se enumeran en la Tabla de Materiales.
1. Preparación y extrusión de jeringas de gradiente
NOTA: La preparación de la jeringa de gradiente debe realizarse utilizando una técnica estéril.
- Utilice varias colonias de Methylomonas sp. LW13 recién cultivadas en una placa para inocular 6 mL de medio de sales minerales de nitrato (NMS) en un tubo de vidrio de 18 mm x 150 mm. Selle el tubo con un tapón de suero y un sello de engarce de aluminio, y agregue metano con una jeringa a una atmósfera final de 50% (v/v) de metano en el aire. Agite este cultivo líquido planctónico a 200 rpm a temperatura ambiente hasta que esté turbio (aproximadamente un día).
- Paso de cultivos líquidos 1:10 a medios frescos. Continúe cultivando cultivos líquidos de metanótrofos hasta el crecimiento de la fase logarítmica (OD600 de ~0,5) y ajuste a un OD600 = 1,0.
- Prepare las jeringas retirando el émbolo adjunto y guardándolas en un recipiente estéril. Coloque una punta de filtro de PTFE estéril en la jeringa y colóquela en una gradilla estándar para tubos de ensayo con la punta hacia abajo.
- Por cada jeringa de 10 mL, mezcle bien 1 mL de células del paso 1.2 con 5 mL de NMS y 4 mL de agarosa fundida (0,5% m/v, enfriada a 55 °C) en un tubo cónico estéril. Estos volúmenes se pueden ampliar para llenar varias jeringas en paralelo.
- Vierta lentamente o use una pipeta serológica para agregar la mezcla a cada jeringa, hasta la marca de 8 mL. Deje que la agarosa dentro de las jeringas se solidifique (~ 15 min), luego cubra con un tapón de butilo de goma estéril de 20 mm. Asegure el tapón a la jeringa con cinta de laboratorio y etiquételo con el contenido de la jeringa.
- Para añadir metano al espacio de cabeza de la jeringa, llene una jeringa grande (60 ml) con CH4 al 100 % y coloque una punta de filtro de PTFE (0,2 μm, 25 mm) conectada a una aguja estéril (23 g). Perfore el tapón de goma con la jeringa grande y perfore una segunda aguja estéril a través del tapón para crear una salida de gas.
- Pise el émbolo de la jeringa grande para permitir que 20 mL de CH4 al 100% atravesen el espacio de cabeza, teniendo cuidado de quitar la aguja de salida cuando queden 1-2 mL de CH4 en la jeringa grande para evitar el reflujo de oxígeno a través de la aguja de salida.
- Incubar las jeringas a 18 °C, repitiendo diariamente los pasos 1,6 y 1,7 para reponer el metano.
- Para extruir la agarosa, sustituya la punta del filtro de PTFE por una aguja estéril de 23 G y sustituya el tapón de goma por el émbolo de la jeringa suministrado. Presione lentamente el émbolo para dispensar incrementos de 1 mL en tubos de microcentrífuga estériles de 1,5 mL separados.
2. Determinación de las concentraciones de gas en contragradiente
- Medición del gradiente de oxígeno disuelto
- Use una hoja de afeitar para cortar el ancho de una jeringa llena de agarosa (preparada siguiendo los pasos 1.1-1.8) cerca del filtro de PTFE. Sujete la jeringa abierta a una bomba de jeringa orientada hacia un microelectrodo tipo Clark, con el extremo abierto hacia la punta del electrodo.
- Ajuste la configuración de la bomba de jeringa para mover la jeringa hacia el microelectrodo a una velocidad de 1 mL/min (0,6 cm/min); comience a registrar las mediciones de oxígeno disuelto en el software Unisense Logger tan pronto como la bomba de jeringa comience a moverse.
- Medición del gradiente de metano
- Inmediatamente antes de la extrusión, reemplace la punta del filtro de la jeringa por una llave de paso unidireccional conectada a una aguja de 23 G y cambie rápidamente el tapón de goma por un émbolo de jeringa. Añada ocho alícuotas de agarosa de 1 mL a viales herméticos al gas de 12 mL evacuados y deje que las muestras se equilibren a temperatura ambiente durante 1 h.
- Equilibre los viales de muestra a la presión atmosférica abriendo y volviendo a sellar inmediatamente los viales o perforando y retirando rápidamente una aguja. Inyecte 500 μL de espacio de cabeza del vial en un cromatógrafo de gases con detección de ionización de llama (GC-FID) utilizando una jeringa hermética al gas. Cree una curva de calibración derivada de los estándares CH4 para convertir el área de pico (pA*min) a μmol/L.
3. Recuento de células en la jeringa de gradiente
- Citometría de flujo
- Extruya 1 mL de segmentos de agarosa de jeringas de gradiente inoculadas con LW13 de tipo salvaje o mutante, como se describe en el paso 1.9. Además, prepare y extruya la agarosa de una jeringa estéril sin células como control negativo.
- Añadir 0,75 mL de NaCl al 0,85% (m/v) en agua a todas las muestras de agarosa extruida y homogeneizar por vórtice. Además, diluya las muestras 1:10 transfiriendo 100 μL a un nuevo tubo de microcentrífuga y añadiendo 900 μL de la solución salina.
- Agregue 3 μL de una mezcla 1:1 de manchas de SYTO9 y yoduro de propidio, luego incube en la oscuridad a temperatura ambiente durante 15 minutos. Para determinar las células por ml de agarosa, sonicar la suspensión de perlas de recuento de microesferas en un baño de agua durante 5 min. A continuación, añada 10 μL de la suspensión a cada muestra antes del análisis por citometría de flujo.
- Analice muestras con un citómetro de flujo 10,11 con los siguientes parámetros: activación en fluorescencia verde, caudal de 10 μL/s y tasa de análisis de partículas inferior a 1.000 partículas/s.
- Compare SSC vs. Diagramas de puntos FITC entre muestras de control libres de células y muestras de agarosa inoculadas para dibujar puertas de voltaje de "eventos bacterianos" que excluyen las partículas de agarosa de fondo. Además, extraiga las puertas de voltaje para las cuentas de conteo de microesferas, que deben ser consistentes entre las muestras.
- Para determinar la concentración de células en cada segmento de agarosa dentro de la jeringa de gradiente, use la siguiente ecuación, teniendo en cuenta que el factor de dilución para el protocolo anterior es 17.7275 y que 10-6 mL es el volumen de una perla de microesfera.
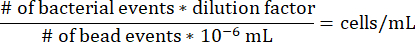
- Recuento de unidades formadoras de colonias dentro de la jeringa de gradiente
- Extruya 1 mL de segmentos de agarosa en tubos de microcentrífuga separados y estériles de 2 mL, agregue 800 μL de NMS y vórtice durante 10 s para ayudar en el pipeteo.
- Prepare una placa estéril de 96 pocillos añadiendo 180 μL de NMS a cada pocillo. Añadir 20 μL de muestras de agarosa diluida a cada pocillo de la primera columna y pipetear para mezclar.
- Con una pipeta multicanal, diluya las muestras en serie diez veces transfiriendo 20 μL de la primera fila de pocillos a la segunda fila de pocillos y pipeteando 10 veces para mezclar. Continúe este proceso hasta la última fila del plato.
- Etiquete las placas de rejilla cuadrada que contengan agar NMS o el medio de su elección. Con una pipeta multicanal, detecte 5 μL de una columna de la placa de 96 pocillos en la placa de agar. Dependiendo del tamaño de la placa de agar, se pueden ver varias columnas en la misma placa.
- Incubar placas con menos de un 40% de metano en el aire y crecer a 18 °C. Cuente las colonias bacterianas después de 2-3 días y determine las unidades formadoras de colonias por mililitro (UFC/mL).
4. Ensayos de detección de biomoléculas
- Ensayo de polisacáridos
- Extruya 1 mL de gajos de agarosa en tubos de microcentrífuga separados de 2 mL y mezcle con 1 mL de una solución de Na2CO3 al 1% (m/v) en agua. Calentar las muestras a 80 °C durante 30 min con vórtice cada 5-10 min, seguido de centrifugación a 4.000 x g a 4 °C durante 20 min.
- Recoja el sobrenadante combinado con tres volúmenes de etanol al 100% e incube a 20 °C durante al menos 2 h (o toda la noche).
- Recoja los polisacáridos precipitados con etanol por centrifugación a 16.100 x g a 4 °C durante 30 min. Retire el sobrenadante y seque al aire el pellet. Vuelva a suspender el pellet en 100 μL de agua desionizada.
- Mida el contenido relativo de polisacáridos de cada segmento de agarosa utilizando un ensayo colorimétrico de ácido fenol-sulfúrico12,13. Combine 50 μL del extracto resuspendido con 150 μL de ácido sulfúrico concentrado y 30 μL de fenol al 5% (v/v) en agua en una placa transparente de 96 pocillos.
- Mida la absorbancia a 490 nm utilizando un lector de microplacas y calcule el contenido relativo de polisacáridos de cada segmento de agarosa como porcentaje de la absorbancia del segmento de agarosa más cercano al filtro de PTFE.
- Ensayo de proteínas
- Extruya la agarosa en tubos de microcentrífuga separados de 1,5 mL y transfiera 100 μL de cada alícuota a tubos de ensayo de vidrio.
- Determine la concentración total de proteínas utilizando el protocolo de probeta de un kit de ensayo de proteínas BCA. Prepare los patrones BSA de albúmina con agarosa extruida de una jeringa estéril como diluyente.
- Ensayo de ADN extracelular
- Extruya la agarosa en tubos de microcentrífuga separados de 1,5 mL y transfiera 20 μL de cada uno a tubos de microcentrífuga de 0,2 mL.
- Mida las concentraciones de ADN utilizando el kit de ensayo de alta sensibilidad 1x dsDNA disponible en el mercado siguiendo el protocolo del fabricante.
5. Extracción de ARN
- Prepare el tampón de extracción combinando lo siguiente en 800 mL de agua libre de RNasa: 2,0 g de CTAB, 2,0 g de polivinilpirrolidona (PVP 40), 81,8 g de NaCl, 100 mM de Tris-HCl (pH 8,0) y 20 mM de EDTA. Sube el volumen a 1 L y autoclave; almacenar a 4 °C.
- Alicuente el tampón de extracción preparado y agregue una concentración final del 1% (v/v) de beta-mercaptoetanol justo antes de usar. Calentar el tampón a 65 °C con un baño de agua o un bloque de calor.
- Divida cada jeringa de gradiente en secciones de 1 mL extruyendo la agarosa en tubos de microcentrífuga de 2 mL separados y libres de RNasa siguiendo el procedimiento del paso 1.9.
- Centrifugar las muestras a 21.000 x g, 4 °C, durante 15 min y desechar el sobrenadante, manteniendo las muestras en hielo.
- Añadir 600 μL de tampón de extracción precalentado a cada 1 mL granulado de agarosa extruida. Añadir aproximadamente 200 μL de perlas de circonio/sílice y homogeneizar las muestras durante 3 min a 30 Hz/s utilizando un batidor de perlas, deteniéndose a mitad de camino para colocar las muestras en hielo durante 2 min.
- Centrifugar las muestras a 15.000 x g, 4 °C, durante 2 min para reducir la formación de espuma. Extraiga las muestras añadiendo 600 μL de cloroformo: alcohol isoamílico (24:1) a los tubos y vórtice durante 10 s.
- Centrifugar las muestras a 15.000 x g, 4 °C, durante 8 min. Transfiera con cuidado la fase acuosa superior a un nuevo tubo de microcentrífuga libre de RNasa y agregue 600 μL de cloroformo: alcohol isoamílico (24:1) a la fase superior transferida y al vórtice durante 10 s.
- Centrifugar las muestras a 15.000 x g, 4 °C, durante 8 min y transferir la nueva fase acuosa superior a un nuevo tubo de microcentrífuga libre de RNasa. Añadir un volumen igual de isopropanol a la fase superior transferida e incubar las muestras durante varias horas a -20 °C. Opcional: las muestras se pueden dejar a -20 °C durante la noche.
- Recoja los precipitados que contienen ARN centrifugando muestras a 16.100 x g, 4 °C durante 30 min.
- Deseche el sobrenadante y lave el pellet con 300 μL de etanol frío al 75% (v/v) hecho con agua libre de RNasa y centrifugar a 16.100 x g, 4 °C, durante 5 min.
- Vuelva a lavar los pellets siguiendo el paso 5.10.
- Después de eliminar el sobrenadante de etanol, deje que los gránulos se sequen al aire durante 15 minutos. Disuelva los gránulos en 100 μL de agua libre de RNasa.
- Tratar las muestras con DNasa I a 37 °C durante 30 min siguiendo el protocolo del fabricante.
- Inactiva la DNasa I añadiendo 300 μL de fenol ácido: cloroformo: IAA (125:24:1, pH 4,5). Vórtice durante 10 s e incube a temperatura ambiente durante 5 min.
- Centrifugar a 16.100 x g, 4 °C, durante 5 min y mantener la fase acuosa superior transfiriéndola a un nuevo tubo de microcentrífuga libre de RNasa.
- Opcional: Agrupar el ARN del mismo segmento en todas las jeringas replicadas combinando las fases superiores en un tubo cónico.
- Añadir 1 volumen de isopropanol igual al volumen de la fase superior que contiene ARN y añadir 7,5 M de LiCl hasta una concentración final de 0,8 M, invirtiendo varias veces para mezclar.
- Incubar las muestras durante varias horas a -20 °C. Opcional: las muestras se pueden dejar a -20 °C durante la noche.
- Centrifugar las muestras a 16.100 x g, 4 °C, durante 15 min y desechar cuidadosamente el sobrenadante. Lave el pellet que contiene ARN dos veces añadiendo etanol frío al 70% (v/v) en agua sin RNasa, centrifugando a 16.100 x g, 4 °C, durante 5 min, y eliminando el sobrenadante.
- Deje que los gránulos se sequen al aire a temperatura ambiente durante 10 minutos y vuelva a suspender en 50 μL de agua sin RNasa. Almacene las muestras de ARN a -80 °C.
- Opcional, dependiendo de la calidad del ARN: Las muestras se pueden volver a purificar utilizando un kit de purificación de ARN para eliminar ARN pequeños (<200 nt).
- Para confirmar que las muestras de ARN no contienen ADN residual, utilice 1 μL de ARN purificado como molde para la amplificación por PCR utilizando cebadores universales de genes de ARNr bacteriano 16S 27F/1492R. Incluya dos reacciones de PCR adicionales que contengan 1 μL de ADN genómico (diluido 1:100) o agua libre de nucleasas para que sirvan como controles positivos y negativos, respectivamente.
- Administre los productos con un gel TBE de agarosa al 1% utilizando electroforesis en gel14.
NOTA: Las muestras de ARN sin contaminación de ADN deben dar lugar a la ausencia de una banda en el carril de muestra. Si las muestras de ARN muestran contaminación de ADN, vuelva a procesar las muestras a partir del paso 5.13. El ARN está listo para el análisis posterior y, opcionalmente, se puede analizar para cuantificar su integridad midiendo el número de integridad del ARN (RIN).
Resultados
Aquí, el ecosistema modelo de jeringa de gradiente se utilizó para cultivar una sola cepa (el metanótrofo Methylomonas sp. cepa LW13) (Figura 1A)6, pero también se puede utilizar para enriquecer para una comunidad microbiana oxidante de metano mediante la inoculación directa del suelo (Figura 1B). La presencia de un contragradiente de metano-oxígeno se validó midiendo la concentración de metano y oxígeno en jeringas libres de células e inoculadas (Figura 1C). En el caso de las jeringas de gradiente inoculadas con LW13, se formó un contragradiente en el plazo de un día después de enjuagar la jeringa, que se intensificaba a lo largo de tres días de incubación. Durante el mismo período de tiempo, se formó una banda horizontal a la misma profundidad a la que ambos sustratos de gas alcanzaron sus concentraciones más bajas (Figura 1A). El pronunciado gradiente de gas y el agotamiento de metano y oxígeno más allá de la profundidad de la banda horizontal mostraron que LW13 metabolizaba aeróbicamente el metano y producía un fenotipo no observado en el cultivo planctónico homogéneo. Este fenotipo también es producido por otras bacterias metanotróficas aisladas de la misma muestra ambiental que LW136. La variación dependiente de la cepa en el momento y la profundidad del desarrollo de la banda horizontal entre diferentes cepas metanotróficas sugirió que la banda horizontal se vio afectada por el comportamiento específico de cada microbio cuando se cultivó en un contexto espacialmente resuelto6.
El número de células en todo el tapón de agarosa se midió mediante citometría de flujo y recuentos de colonias (UFC/mL) (Figura 2A). Este método se utilizó para comparar la distribución celular y la supervivencia de LW13 de tipo salvaje con una cepa mutante de LW13 que contenía una deleción en el gen de la fucosa 4-O-acetiltransferasa (OAT), que previamente se demostró que influía en el desarrollo de bandas horizontales6. El mutante ΔOAT de LW13 tuvo un menor crecimiento general en la jeringa de gradiente durante 6 días en comparación con el tipo salvaje, un efecto que no se observó en cultivos planctónicos homogéneos de las mismas cepas6. La cepa mutante no formó la misma banda horizontal distintiva que el tipo salvaje LW13 cuando se cultivó en la jeringa de gradiente (Figura 2B). El número de células y la apariencia de la banda horizontal se restauraron a niveles similares al tipo salvaje tras la complementación génica en la cepa mutante. Estos resultados demuestran que la jeringa de gradiente se puede utilizar para vincular genes a fenotipos específicos que solo están presentes en el contragradiente de metano-oxígeno.
Se adaptaron una variedad de técnicas genéticas, químicas y moleculares para su uso con bacterias cultivadas dentro de una matriz de agarosa semisólida. El ecosistema del modelo de jeringa de gradiente se puede utilizar fácilmente para ensayos de cuantificación biomolecular estándar con la inclusión de agarosa no inoculada como control negativo. Se midió la concentración de tres biomoléculas diferentes que se encuentran comúnmente en sustancias poliméricas extracelulares y biopelículas: polisacáridos, proteínas y ADN extracelular15 (Figura 3). En los segmentos de jeringa inoculados con LW13, la banda horizontal tenía significativamente más polisacáridos que otros segmentos, sin un aumento significativo de proteínas o ADN extracelular.
Se utilizó RNA-seq para medir las diferencias transcripcionales en el crecimiento de LW13 a diferentes profundidades de la jeringa. Se logró una extracción robusta de ARN utilizando un tampón de extracción basado en CTAB seguido de etapas convencionales de extracción y precipitación de fenol: cloroformo. Los resultados del análisis de RNA-seq se utilizaron posteriormente para identificar los genes implicados en la producción de la banda horizontal de polisacáridos. Estos resultados indican que la agarosa semisólida, esencial para la creación de un ecosistema modelo resuelto espacialmente, no impide realizar más análisis bioquímicos que generalmente se reservan para cultivos planctónicos y en placas.
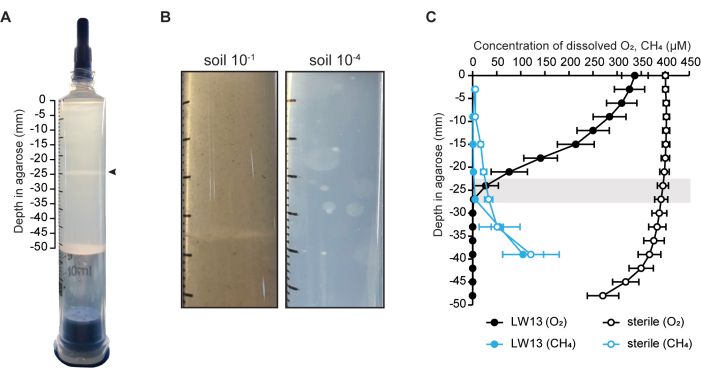
Figura 1: El ecosistema del modelo de jeringa de gradiente. (A) La jeringa de gradiente inoculada con el metanótrofo Methylomonas sp. LW13. Una banda horizontal distintiva (punta de flecha) se desarrolla dentro de los dos días posteriores al lavado de la jeringa con 100% de metano. (B) Fotos en primer plano de jeringas de gradiente inoculadas con tierra diluida 10-1 y 10-4 e incubadas durante dos semanas. Las jeringas de gradiente que contenían suelo más diluido dieron lugar a colonias esféricas en toda la agarosa, mientras que los inóculos de suelo más concentrados dieron lugar a una banda distinta. (C) Caracterización del contragradiente metano-oxígeno en jeringas de gradiente estéril e inoculadas con LW13 después de tres días de incubación. La barra gris indica el rango de profundidades a las que se ubicó la banda de polisacáridos; Los datos muestran la media ± DE de tres experimentos independientes con tres réplicas técnicas cada uno. Los paneles (A) y (C) fueron modificados a partir de Beals et al.6. Haga clic aquí para ver una versión más grande de esta figura.
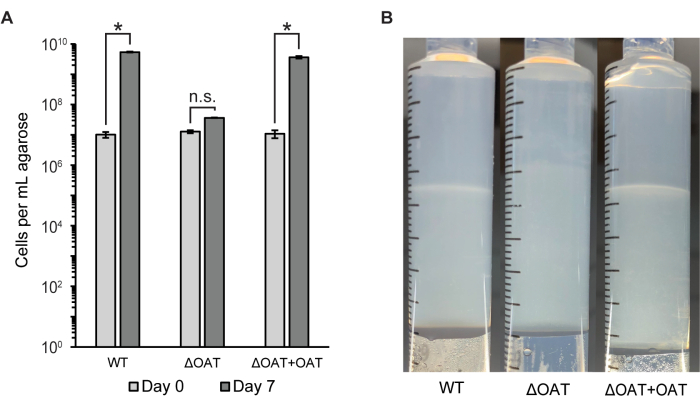
Figura 2: Cuantificación del tipo salvaje y mutante de LW13 después de la incubación en la jeringa de gradiente. (A) El número total de células LW13 por ml de agarosa extruida recuperada de jeringas de gradiente en el día 0 y el día 7 medido por citometría de flujo. ΔOAT contiene una deleción del gen de la fucosa 4-O-acetiltransferasa, que se encontró altamente expresada en células ubicadas en la profundidad de la banda de polisacáridos. ΔOAT+OAT contiene el gen OAT insertado en una ubicación distal del genoma de ΔOAT. *, significativamente diferente ( prueba t heterocedástica de dos colas, α = 0,05); n.s., no significativamente diferente. Los datos muestran la media ± desviación estándar de tres experimentos independientes con dos réplicas técnicas cada uno. (B) Desarrollo de banda horizontal en jeringas de gradiente inoculadas con LW13 tipo salvaje, ΔOAT o ΔOAT+OAT después de siete días de incubación. Esta figura fue modificada a partir de Beals et al.6. Haga clic aquí para ver una versión más grande de esta figura.
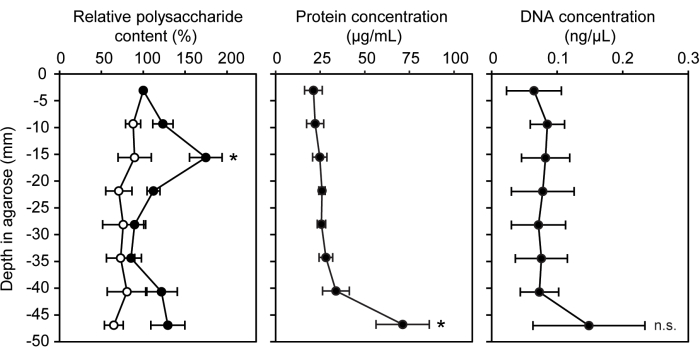
Figura 3: Cuantificación de biomoléculas a profundidades crecientes de la jeringa de gradiente. Contenido relativo de polisacáridos (%), concentración de proteínas (μg/mL) y concentración de ADN (ng/μL) en ocho secciones de jeringas de gradiente inoculadas con LW13 incubadas durante siete días (círculos llenos; los círculos abiertos muestran los valores de las jeringas de gradiente estériles). Los datos muestran la media ± desviación estándar de tres experimentos independientes con tres réplicas técnicas cada uno. Para el contenido relativo de polisacáridos, * indica una diferencia significativa con respecto al control estéril a una profundidad equivalente ( prueba t heterocedástica de dos colas, α = 0,05). Para las concentraciones de proteínas y ADN, * indica una diferencia significativa con respecto a la sección que contiene la banda horizontal (ANOVA de un factor con análisis post hoc de Tukey-Kramer); N.D., no significativo. La figura fue modificada a partir de Beals et al.6. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Métodos para el cultivo de metanótrofo
Los metanótrofos se han estudiado durante décadas para comprender su fisiología, su comportamiento individual y comunitario en el entorno natural y su potencial para la mitigación del metano en aplicaciones industriales. A lo largo de estos estudios, gran parte de la investigación realizada se ha realizado utilizando cultivos planctónicos homogéneos donde se pierde el contexto espacial. El ecosistema del modelo de jeringa de gradiente se desarrolló para replicar el contragradiente de metano-oxígeno característico de los hábitats naturales de metanótrofos en el laboratorio, lo que permitió a los investigadores estudiar los metanótrofos que crecen en un entorno que se asemeja más al lugar donde evolucionaron estos organismos.
Durante los últimos 30 años, los investigadores han recreado el contragradiente de metano-oxígeno en el laboratorio utilizando una variedad de métodos, a menudo con el objetivo principal de aislar y clasificar metanótrofos de consorcios mixtos de oxidación de metano. Estos métodos se pueden dividir en dos enfoques, ambos implicando el uso de cámaras opuestas de metano y oxígeno: suspendiendo el suelo relativamente inalterado en una membrana16,17,18, o inoculando pequeñas cantidades de suelo o cultivo bacteriano puro en un medio mínimo en agarosa 7,8,19. El método de jeringa de gradiente descrito aquí combina el enfoque basado en jeringas de Dedysh y colaboradores9 con el cultivo de metanótrofos de trabajos previos de Amaral y Knowles8, y Schink y colaboradores7. El último de estos métodos sentó las bases para el cultivo de metanótrofos en un contragradiente de metano-oxígeno y utilizó un flujo continuo de metano y oxígeno a ambos lados del tapón de agarosa. Si bien esto proporciona un entorno más constante, este enfoque agrega complejidad a la configuración experimental y requiere fuentes de gas dedicadas.
Por el contrario, la jeringa de gradiente descrita aquí se basa en el lavado diario de la jeringa para proporcionar metano fresco, un proceso que tarda menos de un minuto por jeringa, al tiempo que proporciona un acceso continuo al oxígeno atmosférico a través de una punta de filtro de PTFE estéril. Este método más simple puede permitir una adopción más amplia de este ecosistema modelo para estudiar metanótrofos en un contexto espacialmente resuelto. El protocolo descrito también detalla los análisis a nivel químico y molecular que se pueden realizar directamente sobre las bacterias incubadas en la agarosa semisólida. Como resultado, las bacterias no necesitan ser extirpadas y cultivadas fuera de la matriz de agarosa antes del análisis, preservando las condiciones de gradiente gaseoso en el momento del muestreo.
Observaciones sobre el protocolo
Debido a que las bacterias se cultivan dentro de una jeringa volumétrica de polipropileno, los investigadores pueden usar el émbolo de la jeringa adjunto para segmentar de manera precisa y reproducible el tapón de agarosa mientras se mantiene la integridad espacial de la matriz de agarosa que aún permanece en el cilindro de la jeringa. Sin el diseño hermético inherente a la jeringa, los tapones de agarosa tendrían que retirarse del cilindro de la jeringa y cortarse, lo que introduciría incertidumbre en el volumen de los segmentos de agarosa y liberaría cantidades incuantificables de metano y oxígeno disuelto a la atmósfera. La extrusión de agarosa a través de una aguja estéril simplifica la preparación de la muestra y ayuda a homogeneizar los segmentos extruidos sin cizallar las células bacterianas. Este método permite a los investigadores dividir cada jeringa de gradiente inoculada en al menos ocho segmentos de agarosa y realizar experimentos paralelos en metanótrofos que crecen en un rango de concentraciones de oxígeno y metano.
Al optimizar la extracción de ARN de agarosa con alto contenido de polisacáridos, se descubrió que los reactivos comunes como el tiocianato de guanidio y TRIzol conducían a la gelificación de la agarosa, que obstruía las columnas de purificación y resistía la granulación por centrifugación. Los bajos rendimientos y la calidad del ARN también fueron motivo de preocupación, ya que las moléculas grandes de polisacáridos pueden atrapar ácidos nucleicos, mientras que los polisacáridos pequeños pueden coprecipitar con el ARN20. En su lugar, se utilizó un tampón de extracción que contenía el tensioactivo catiónico CTAB, que solubiliza las membranas lipídicas20; y NaCl, que impide que se formen complejos CTAB-ácidos nucleicos y permite que los ácidos nucleicos precipiten, pero mantiene los polisacáridos en la solución21. Las RNasas se desnaturalizaron mediante la inclusión de β-mercaptoetanol en el tampón CTAB. Para el experimento de secuenciación de ARN, se incluyó un paso opcional de purificación basado en columna para excluir los ARN pequeños (<200 nucleótidos) antes de la preparación de la biblioteca.
Limitaciones y consideraciones
Mientras que el NMS y la agarosa proporcionan una matriz media mínima para el cultivo de bacterias metanotróficas, la jeringa de gradiente descrita aquí sólo recrea los gradientes de gases de los hábitats metanotróficos, pero no otros gradientes presentes en esos entornos, como los metales traza22, la salinidad23 u otros nutrientes24. Es posible que estos gradientes se puedan agregar a un sistema similar en el futuro. Además, el volumen de la jeringa (8 mL de agarosa) limita la biomasa total por jeringa, lo que requiere la agrupación de varias jeringas para algunos análisis (como se describe en el paso 5.16). Aunque la jeringa portátil segmenta convenientemente la agarosa en alícuotas de 1 mL, su tamaño también limita el espacio de cabeza a aproximadamente 4 mL, lo que limita la cantidad de metano a granel que se puede almacenar para los microbios cultivados. Dado que las tasas de oxidación del metano son proporcionales a la tasa de crecimiento de los metanótrofosaeróbicos 25, se recomienda la reposición diaria del metano del espacio de cabeza. Si bien esto aún puede resultar en períodos de limitación de metano, estos períodos son reproducibles en el laboratorio y probablemente imitan situaciones que se encuentran en entornos naturales.
Al utilizar la jeringa de gradiente, la presencia de los polisacáridos de agarosa requiere algunos ajustes en los ensayos utilizados para analizar los metanótrofos cultivados en este sistema. Por ejemplo, los protocolos que requieren la transferencia de pequeños volúmenes de agarosa extruida necesitan múltiples pasos de dilución con una homogeneización completa entre cada dilución para un pipeteo preciso. Además, en casos como el ensayo de polisacáridos, donde los polisacáridos inherentes a la matriz de agarosa reaccionarán con el reactivo de ácido sulfúrico-fenol, es esencial la inclusión de un control de agarosa negativo estéril y libre de células. Los primeros intentos de mitigar estos problemas mediante la inclusión de la enzima hidrolizadora de agarosa β-agarasa fueron infructuosos e introdujeron una variable desconocida en los experimentos biológicos. El uso de múltiples réplicas técnicas, la dilución completa, la homogeneización y la inclusión de controles se pueden utilizar para mitigar la mayoría de los desafíos inherentes a la matriz de agarosa.
Aplicaciones
Además de los estudios de una sola cepa, la jeringa de gradiente puede soportar el cocultivo de múltiples cepas, y el suelo se puede utilizar como inóculo en lugar del cultivo bacteriano puro. El diseño simple del ecosistema del modelo de jeringa de gradiente es susceptible al cultivo de otros tipos de microorganismos que existen en la interfaz entre ambientes anóxicos y óxicos mediante el uso de un sustrato de gas diferente, como H2 o CO, en lugar de metano. En resumen, el uso de un ecosistema modelo simple y espacialmente resuelto permite a los investigadores estudiar la fisiología única y las adaptaciones metabólicas de los microorganismos anóxico-óxicos y se puede utilizar para vincular genes con fenotipos de organismos.
Divulgaciones
Los autores declaran no tener conflictos de intereses.
Agradecimientos
Este trabajo fue apoyado por la financiación inicial del Departamento de Química de la Universidad de Utah y el Premio NSF CAREER # 2339190. Agradecemos a los miembros del Puri Lab por sus útiles discusiones. Agradecemos a Rachel Hurrell (Universidad de Utah) por la orientación inicial con el experimento de citometría de flujo.
Materiales
| Name | Company | Catalog Number | Comments |
| 1% Gas mix analytical standard | Supelco | 22561 | 1% each component in nitrogen: carbon monoxide, carbon dioxide, hydrogen, methane and oxygen |
| 100% Methane | Airgas | ME CP300 | chemically pure grade |
| 15 ppm Gas mix analytical standard | Supelco | 23470-U | 15 ppm each component in nitrogen: methane, ethane, ethylene, acetylene, propane, propylene, propyne, and n-butane |
| 1x Nitrate mineral salts | see CAS numbers below | Dissolve the following in Mili-Q water and autoclave: 0.2 g/L MgSO4·7H2O, 0.2 g/L CaCl2·6H2O, 1 g/L KNO3, and 30 μM LaCl3. Before use, add trace elements to a 1X final concentration and phosphate buffer (pH 6.8) to a final concentration of 5.8 mM. | |
| 23 G needle | BD Biosciences | 305194 | sterile, Luer-Lok |
| 500x Trace elements | see CAS numbers below | Dissolve the following in Milli-Q water: 1.0 g/L Na2-EDTA, 2.0 g/L FeSO4·7H2O, 0.8 g/L ZnSO4·7H2O, 0.03 g/L MnCl2·4H2O, 0.03 g/L H3BO3, 0.2 g/L CoCl2·6H2O, 0.6 g/L CuCl2·2H2O, 0.02 g/L NiCl2·6H2O, and 0.05 g/L Na2MoO·2H2O. | |
| 96 Well plate | CELLTREAT | 229596 | sterile |
| Acid phenol:chloroform:IAA (125:24:1) | Invitrogen | AM9720 | pH 4.5 |
| Agarose | Fisher Scientific | BP160 | molecular biology grade, CAS 9012-36-6 |
| Aluminum crimp seals | VWR | 30618-460 | 20 mm |
| Bead beater | Qiagen | 9003240 | TissueLyser III |
| Butyl rubber stopper | Chemglass Life Science | 50-143-854 | 20 mm, blue |
| Chloroform:isoamyl alcohol (24:1) | Millipore Sigma | 25666 | BioUltra, for molecular biology |
| Clark-type O2 microelectrode | Unisense | OX-500 | |
| DEPC-treated water | Thermo Scientific | R0601 | |
| DNase I (Ambion) | Invitrogen | AM2222 | |
| Flow cytometer | Beckman Coulter | CytoFLEX | |
| Gas chromatograph (flame ionization detection) | Agilent | 6890N | |
| Gastight analytical syringe | Hamilton | 81220 | 1750 TLL |
| Gastight analytical syringe needle | Hamilton | 7729-07 | 22 G, metal hub needle, 2 in, point style 5 |
| Gas-tight vials | Labco | 938W | Exetainer vial: 12 mL, round bottom |
| Glass culture tubes | Bellco Glass | 2048-00150 | 18 x 150 mm |
| LiCl precipitation solution (7.5 M) | Invitrogen | AM9480 | |
| One-way stopcock | VWR | MFLX30600-00 | inlet port: female luer, outlet port: male luer lock |
| Petri dish, square | Fisher Scientific | FB0875711A | 100 x 100 mm |
| Phosphate buffer, 0.2 M (pH 6.8) | see CAS numbers below | Dissolve the following in Milli-Q water and autoclave: 12.24 g/L KH2PO4, 26.29 g/L Na2HPO4 · 7H2O | |
| Pierce BCA Protein Assay Kit | Thermo Scientific | 23225 | |
| PTFE syringe filter tip | Thermo Scientific | 03-050-469 | hydrophobic, pore size: 0.2 µm, diameter: 4 mm |
| Qubit 1x dsDNA High Sensitivity Assay Kit | Invitrogen | Q33230 | |
| Qubit 4 Fluorometer | Invitrogen | Q33238 | |
| RNA Clean & Concentrator-5 | Zymo Research | R1013 | |
| Serum stopper | Fisher Scientific | 03-340-302 | 20 mm |
| Syringe | BD Biosciences | 302995 | Luer-Lock, 10 mL, single use, sterile |
| Syringe pump | New Era Pump Systems Inc. | 1000-US | NE-1000 one channel programmable |
| SYTO9, propidium iodide, microspheres | Invitrogen | L34856 | LIVE/DEAD BacLight Bacterial Viability Kit |
| Zirconia/silica beads | BioSpec Products | 11079101z | 0.1 mm diameter |
| Chemical reagents | CAS number | ||
| CaCl2·6H2O | 7774-34-7 | ||
| CoCl2·6H2O | 7791-13-1 | ||
| Concentrated sulfuric acid | 7664-93-9 | ||
| CTAB, cetrimonium bromide | 57-09-0 | ||
| CuCl2·2H2O | 10125-13-0 | ||
| Ethanol | 64-17-5 | ||
| FeSO4·7H2O | 7782-63-0 | ||
| H3BO3 | 10043-35-3 | ||
| Isopropanol | 69-63-0 | ||
| KH2PO4 | 7778-77-0 | ||
| KNO3 | 7757-79-1 | ||
| LaCl3 | 10099-58-8 | ||
| MgSO4·7H2O | 10034-99-8 | ||
| MnCl2·4H2O | 13446-34-9 | ||
| Na2CO3, sodium carbonate | 497-19-8 | ||
| Na2-EDTA | 139-33-3 | ||
| Na2HPO4 · 7H2O | 7782-85-6 | ||
| Na2MoO·2H2O | 10102-40-6 | ||
| NaCl, sodium chloride | 7647-14-5 | ||
| NiCl2·6H2O | 7791-20-0 | ||
| Phenol (90% solution in water) | 108-95-2 | ||
| PVP40, polyvinylpyrrolidone | 9003-39-8 | ||
| Tris-HCl | 1185-53-1 | ||
| ZnSO4·7H2O | 7446-20-0 | ||
| β-Mercaptoethanol | 60-24-2 |
Referencias
- Brune, A., Frenzel, P., Cypionka, H. Life at the oxic-anoxic interface: microbial activities and adaptations. FEMS Microbiol Rev. 24 (5), 691-710 (2000).
- Auman, A. J., Stolyar, S., Costello, A. M., Lidstrom, M. E. Molecular characterization of methanotrophic isolates from freshwater lake sediment. Appl Environ Microbiol. 66 (12), 5259-5266 (2000).
- Whittenbury, R., Phillips, K. C., Wilkinson, J. F. Enrichment, isolation and some properties of methane-utilizing bacteria. J Gen Microbiol. 61 (2), 205-218 (1970).
- Koo, C., Rosenzweig, A. Biochemistry of aerobic biological methane oxidation. Chem Soc Rev. 50 (5), 3424-3436 (2021).
- Strong, P. J., Xie, S., Clarke, W. P. Methane as a resource: Can the methanotrophs add value. Environ Sci Technol. 49 (7), 4001-4018 (2015).
- Beals, D. G., Puri, A. W. Linking methanotroph phenotypes to genotypes using a simple spatially resolved model ecosystem. ISME J. 18 (1), wrae060(2024).
- Bussmann, I., Rahalkar, M., Schink, B. Cultivation of methanotrophic bacteria in opposing gradients of methane and oxygen. FEMS Microbiol. Ecol. 56 (3), 331-344 (2006).
- Amaral, J. A., Knowles, R. Growth of methanotrophs in methane and oxygen counter gradients. FEMS Microbiol Lett. 126 (3), 215-220 (1995).
- Danilova, O. V., et al. A new cell morphotype among methane oxidizers: a spiral-shaped obligately microaerophilic methanotroph from northern low-oxygen environments. ISME J. 10 (11), 2734-2743 (2016).
- Ou, F., McGoverin, C., Swift, S., Vanholsbeeck, F. Absolute bacterial cell enumeration using flow cytometry. J Appl Microbiol. 123 (2), 464-477 (2017).
- Krause, S. M. B., et al. Lanthanide-dependent cross-feeding of methane-derived carbon is linked by microbial community interactions. Proc Natl Acad Sci USA. 114 (2), 358-363 (2017).
- Masuko, T., et al. Carbohydrate analysis by a phenol-sulfuric acid method in microplate format. Anal Biochem. 339 (1), 69-72 (2005).
- Felz, S., Al-Zuhairy, S., Aarstad, O. A., van Loosdrecht, M. C. M., Lin, Y. M. Extraction of structural extracellular polymeric substances from aerobic granular sludge. J Vis Exp. (115), e54534(2016).
- Lee, P. Y., Costumbrado, J., Hsu, C. Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. J Vis Exp. (62), e3923(2012).
- Costa, O. Y. A., Raaijmakers, J. M., Kuramae, E. E. Microbial extracellular polymeric substances: Ecological function and impact on soil aggregation. Front Microbiol. 9, 1636(2018).
- Sinke, A. J. C., Cottaar, F. H. M., Buis, K., Keizer, P. Methane oxidation by methanotrophs and its effects on the phosphate flux over the sediment-water interface in a eutrophic lake. Microb Ecol. 24 (3), 259-269 (1992).
- Murase, J., Frenzel, P. A methane-driven microbial food web in a wetland rice soil. Environ Microbiol. 9 (12), 3025-3034 (2007).
- Reim, A., Lüke, C., Krause, S., Pratscher, J., Frenzel, P. One millimetre makes the difference: High-resolution analysis of methane-oxidizing bacteria and their specific activity at the oxic-anoxic interface in a flooded paddy soil. ISME J. 6 (11), 2128-2139 (2012).
- Rahalkar, M., Bussmann, I., Schink, B. Methylosoma difficile gen. nov., sp. nov., a novel methanotroph enriched by gradient cultivation from littoral sediment of Lake Constance. Int J Syst Evol Microbiol. 57 (5), 1073-1080 (2007).
- Wang, L., Stegemann, J. P. Extraction of high-quality RNA from polysaccharide matrices using cetlytrimethylammonium bromide. Biomaterials. 31 (7), 1612(2010).
- Liyanage, N. M. N., Chandrasekara, B. C. H. W. M., Bandaranayake, P. C. G. A CTAB protocol for obtaining high-quality total RNA from cinnamon (Cinnamomum zeylanicum Blume). 3 Biotech. 11 (4), 201(2021).
- Semrau, J. D., DiSpirito, A. A., Gu, W., Yoon, S. Metals and methanotrophy. Appl Environ Microbiol. 84 (6), e02289-e02317 (2018).
- Zhang, S., et al. Salinity significantly affects methane oxidation and methanotrophic community in Inner Mongolia lake sediments. Front Microbiol. 13, 1067017(2023).
- Fox, A. L., Trefry, J. H. Nutrient fluxes from recent deposits of fine-grained, organic-rich sediments in a Florida estuary. Front Mar Sci. , (2023).
- He, L., et al. A methanotrophic bacterium to enable methane removal for climate mitigation. Proc Natl Acad Sci. 120 (35), e2310046120(2023).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados