Method Article
Metan-oksijen karşı gradyanında metanotrof yetiştirmek için agaroz tabanlı model ekosistem
Bu Makalede
Özet
Aerobik metan oksitleyici bakterilerin doğal ortamlarında bulunan metan-oksijen karşı gradyanını yeniden oluşturan ve fizyolojilerinin mekansal olarak çözülmüş bir bağlamda incelenmesini sağlayan basit bir model ekosistem hazırlamak için bir protokol açıklanmaktadır. Agaroz bazlı model ekosistemi ile kullanım için yaygın biyokimyasal tahlillerde yapılan değişiklikler de açıklanmaktadır.
Özet
Metanotrof olarak bilinen aerobik metan oksitleyici bakteriler, biyojeokimyasal döngüde önemli roller oynar. Metanotroflar, topraklarda ve çökeltilerde bulunan metan-oksijen karşı gradyanları içinde belirli bir çevresel niş işgal eder ve bu da davranışlarını bireysel ve topluluk düzeyinde etkiler. Bununla birlikte, bu sera gazı azaltıcı mikroorganizmaların fizyolojisini incelemek için geleneksel yöntemler genellikle çevrede bulunan mekansal ve kimyasal gradyanları doğru bir şekilde temsil etmeyen homojen planktonik kültürler kullanır. Bu, bilim adamlarının bu bakterilerin yerinde nasıl davrandığını anlamalarını engeller. Burada, metanotrofların doğal yaşam alanlarının karakteristik özelliği olan dik metan-oksijen karşı gradyanlarını yeniden oluşturmak için yarı katı agaroz kullanan, gradyan şırınga adı verilen basit, ucuz bir model ekosistem açıklanmaktadır. Degrade şırınga, metanotrofik suşların yetiştirilmesine ve çevresel örneklerden karışık metan oksitleyici konsorsiyumların zenginleştirilmesine izin vererek, yalnızca bu mekansal olarak çözülmüş bağlamda görülebilen fenotipleri ortaya çıkarır. Bu protokol ayrıca, diğer agaroz bazlı sistemler içinde mikroorganizmaları kültürleyen araştırmacılar için değerli olabilecek yarı katı agaroz matrisi ile uyumlu olacak şekilde modifiye edilmiş çeşitli biyokimyasal tahlilleri de rapor eder.
Giriş
Anoksik-oksik bir arayüzde yaşayan mikroorganizmalar genellikle önemli ekolojik rollere hizmet eder1. Bir örnek, topraklarda ve çökeltilerdemetan ve oksijenin karşı gradyanlarında bulunan aerobik metan oksitleyici bakterilerdir (metanotroflar) 2. Bu mikroorganizmalar, çevrelerinde bulunan gaz gradyanlarından yararlanmalarını sağlayan benzersiz metabolik ve fizyolojik özelliklere sahiptir ve onlarca yıldır devam eden araştırmalara konu olmuştur 3,4,5. Şu anda, metanotroflar ve metan oksitleyici topluluklar hakkında yayınlanan araştırmaların çoğu, doğal mikrobiyal habitatlarına özgü mekansal ve kimyasal gradyanları yakalayamayan homojen planktonik kültürlerle yapılan çalışmalara dayanmaktadır. Bu sınırlama, mikrobiyal fizyolojiyi anlamamızı ve genomik bilgiyi fenotipik özelliklerle ilişkilendirme yeteneğimizi engellemektedir.
Bu protokol, hem Methylomonas sp. suşu LW13 gibi spesifik metanotrofları hem de doğrudan çevresel toprak örneklerinden metan oksitleyici toplulukları incelemek için tekrarlanabilir koşullar yaratan basit, laboratuvar tabanlı bir model ekosistemi rapor eder. Daha da önemlisi, gradyan şırıngada yetiştirme, homojen planktonik kültürlerde6 bulunmayan karşı gradyana özgü fenotiplerle sonuçlanır ve sistemin metanotrof fizyolojisinin yeni yönlerini ortaya çıkarma yeteneğini vurgular. Daha önce yayınlanmış model ekosistemlerden 7,8,9 ilham alan gradyan şırınga, bu yaklaşım kullanılarak kültürlenen mikroorganizmalardan kimyasal ve moleküler bilgi toplamak için kullanılabilecek basitleştirilmiş bir yöntemdir.
Genetik, kimyasal ve moleküler analizler için rapor edilen prosedürler, yarı katı bir agaroz matrisi içinde yetiştirilen mikrobiyal kültürler üzerinde güvenilir bir şekilde çalışacak şekilde değiştirilmiştir. Bu prosedürler, bakteriyel yumuşak agar yüzme deneyleri için kullanılanlar gibi diğer yarı katı agaroz bazlı sistemlerde yetiştirilen bakterileri analiz etmek için de yararlı olabilir. Bu analizleri mekansal olarak çözülmüş bağlamlara uyarlamak, ekolojik olarak daha ilgili ortamlarda mikrobiyal yaşamı incelemek için yeni yollar açabilir.
Protokol
Çalışmada kullanılan reaktiflerin ve ekipmanların detayları Malzeme Tablosunda listelenmiştir.
1. Degrade şırıngaların hazırlanması ve ekstrüzyonu
NOT: Gradyan şırınga hazırlığı steril teknik kullanılarak yapılmalıdır.
- 18 mm x 150 mm'lik bir cam tüpte 6 mL nitrat mineral tuzları (NMS) ortamını aşılamak için bir plaka üzerinde taze yetiştirilmiş birkaç Methylomonas sp. LW13 kolonisi kullanın. Tüpü bir serum tıpa ve alüminyum kıvrımlı conta ile kapatın ve havadaki %50 (h/h) metanın nihai atmosferine bir şırınga kullanarak metan ekleyin. Bu planktonik sıvı kültürü oda sıcaklığında 200 rpm'de bulanıklaşana kadar (yaklaşık bir gün) çalkalayın.
- Sıvı kültürleri 1:10 oranında taze ortama geçirin. Metanotrofların sıvı kültürlerini log faz büyümesine (OD600 / ~ 0.5) büyütmeye devam edin ve bir OD600 = 1.0'a ayarlayın.
- Beraberindeki pistonu çıkararak ve steril bir kapta tutarak şırıngaları hazırlayın. Şırıngaya steril bir PTFE filtre ucu takın ve ucu aşağı bakacak şekilde standart bir test tüpü rafına yerleştirin.
- Her 10 mL şırınga için, steril bir konik tüpte 5 mL NMS ve 4 mL erimiş agaroz (% 0.5 m / v, 55 ° C'ye soğutulmuş) ile adım 1.2'den 1 mL hücreleri iyice karıştırın. Bu hacimler, birden fazla şırıngayı paralel olarak doldurmak için ölçeklendirilebilir.
- Karışımı her bir şırıngaya 8 mL işaretine kadar eklemek için yavaşça dökün veya serolojik bir pipet kullanın. Şırıngaların içindeki agarozun katılaşmasına izin verin (~ 15 dakika), ardından steril 20 mm kauçuk bütil tıpa ile kapatın. Laboratuvar bandı kullanarak tıpayı şırıngaya sabitleyin ve şırınga içeriği ile etiketleyin.
- Şırınga kafa boşluğuna metan eklemek için, büyük (60 mL) bir şırıngayı %100CH4 ile doldurun ve steril bir iğneye (0.2 G) bağlı bir PTFE filtre ucu (25 μm, 23 mm) takın. Lastik tıpayı büyük şırınga ile delin ve bir gaz çıkışı oluşturmak için durdurucudan ikinci bir steril iğneyi delin.
- 20 mL %100 CH4'ün baş boşluğundan akmasına izin vermek için büyük şırınga üzerindeki pistona bastırın, büyük şırıngada 1-2 mL CH4 kaldığında çıkış iğnesini çıkarmaya dikkat edin çıkış iğnesinden oksijen geri akışını önlemek için.
- Şırıngaları 18 °C'de inkübe edin, metanı yenilemek için her gün 1.6 ve 1.7 adımlarını tekrarlayın.
- Agarozu çıkarmak için, PTFE filtre ucunu steril bir 23 G iğne ile değiştirin ve lastik tıpayı verilen şırınga pistonu ile değiştirin. 1 mL'lik artışları ayrı steril 1.5 mL mikrosantrifüj tüplerine dağıtmak için pistonu yavaşça bastırın.
2. Karşı gradyan gaz konsantrasyonlarının belirlenmesi
- Çözünmüş oksijen gradyanının ölçülmesi
- PTFE filtresine yakın agaroz dolgulu bir şırınganın (1.1-1.8 adımları izlenerek hazırlanmıştır) genişliğini kesmek için bir tıraş bıçağı kullanın. Açılan şırıngayı, açık ucu elektrotun ucuna bakacak şekilde Clark tipi bir mikroelektroda yönlendirilmiş bir şırınga pompasına sabitleyin.
- Şırıngayı mikroelektroda doğru 1 mL/dk (0,6 cm/dk) hızında hareket ettirmek için şırınga pompasının ayarlarını yapın; şırınga pompası hareket etmeye başlar başlamaz çözünmüş oksijen ölçümlerini Unisense Logger yazılımına kaydetmeye başlayın.
- Metan gradyanının ölçülmesi
- Ekstrüzyondan hemen önce, şırınga filtre ucunu 23 G'lik bir iğneye bağlı tek yönlü bir muslukla değiştirin ve lastik tıpayı bir şırınga pistonu ile hızlı bir şekilde değiştirin. Boşaltılmış 12 mL gaz geçirmez şişeleri ayırmak için sekiz adet 1 mL agaroz alikotu ekleyin ve numunelerin oda sıcaklığında 1 saat dengelenmesine izin verin.
- Numune şişelerini kırarak ve hemen yeniden kapatarak veya bir iğneyi delerek ve hızlı bir şekilde çıkararak numune şişelerini atmosferik basınca dengeleyin. Gaz geçirmez bir şırınga kullanarak alev iyonizasyon algılamalı (GC-FID) bir gaz kromatografına 500 μL flakon üst boşluğu enjekte edin. Tepe alanını (pA*dk) μmol/L'ye dönüştürmek için CH4 standartlarından türetilen bir kalibrasyon eğrisi oluşturun.
3. Degrade şırıngadaki hücreleri sayma
- Akış sitometrisi
- Adım 1.9'da belirtildiği gibi vahşi tip veya mutant LW13 ile aşılanmış gradyan şırıngalardan 1 mL agaroz segmentini ekstrüde edin. Ayrıca, negatif kontrol olarak hücre içermeyen, steril bir şırıngadan agaroz hazırlayın ve ekstrüde edin.
- Tüm ekstrüde agaroz örneklerine suya 0.75 mL %0.85 (m/h) NaCl ekleyin ve girdaplama ile homojenize edin. Ayrıca, 100 μL'yi yeni bir mikrosantrifüj tüpüne aktararak ve 900 μL tuz çözeltisi ekleyerek numuneleri 1:10 oranında seyreltin.
- 3 μL 1: 1 SYTO9 ve propidyum iyodür boyaları karışımı ekleyin, ardından karanlıkta oda sıcaklığında 15 dakika inkübe edin. Agarozun mL başına hücrelerini belirlemek için, mikroküre sayma boncuğu süspansiyonunu bir su banyosunda 5 dakika boyunca sonikleştirin. Ardından, akış sitometrisi analizinden önce her numuneye 10 μL süspansiyon ekleyin.
- Numuneleri bir akış sitometresi10,11 ile aşağıdaki parametrelerle analiz edin: yeşil floresan üzerinde tetikleme, 10 μL/s akış hızı ve 1.000 partikül/s'nin altında partikül analiz hızı.
- SSC ile karşılaştırın. FITC nokta çizimleri, arka plan agaroz parçacıklarını dışlayan "bakteriyel olay" voltaj kapıları çizmek için hücresiz kontrol numuneleri ile aşılanmış agaroz numuneleri arasındadır. Ek olarak, mikroküre sayma boncukları için numuneler arasında tutarlı olması gereken voltaj kapıları çizin.
- Degrade şırınga içindeki her bir agaroz segmentindeki hücrelerin konsantrasyonunu belirlemek için, yukarıdaki protokol için seyreltme faktörünün 17.7275 olduğunu ve 10-6 mL'nin bir mikroküre boncuğunun hacmi olduğunu belirterek aşağıdaki denklemi kullanın.
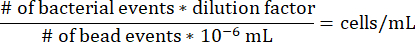
- Gradyan şırınga içinde koloni oluşturan birimlerin sayımı
- 1 mL agaroz segmentini ayrı, steril 2 mL mikrosantrifüj tüplerine ekstrüde edin, 800 μL NMS ekleyin ve pipetlemeye yardımcı olmak için 10 saniye boyunca vorteksleyin.
- Her oyuğa 180 μL NMS ekleyerek steril bir 96 oyuklu plaka hazırlayın. İlk kolondaki her bir oyuğa 20 μL seyreltilmiş agaroz numunesi ekleyin ve karıştırmak için pipetleyin.
- Çok kanallı bir pipet kullanarak, ilk kuyucuk sırasından 20 μL'yi ikinci kuyucuk sırasına aktararak ve karıştırmak için 10 kez pipetleyerek numuneleri on kat seri olarak seyreltin. Plakanın son sırasına kadar bu işleme devam edin.
- NMS agar veya tercih edilen ortamı içeren kare ızgara plakalarını etiketleyin. Çok kanallı bir pipet kullanarak, 96 oyuklu plakanın bir kolonundan agar plakasına 5 μL'yi noktalayın. Agar plakasının boyutuna bağlı olarak, aynı plaka üzerinde birden fazla sütun tespit edilebilir.
- Plakaları havada% 40 metanın altında inkübe edin ve 18 ° C'de büyütün. 2-3 gün sonra bakteri kolonilerini sayın ve mililitre başına koloni oluşturan birimleri (CFU/mL) belirleyin.
4. Biyomolekül tespit testleri
- Polisakkarit testi
- 1 mL agaroz segmentini ayrı 2 mL mikrosantrifüj tüplerine ekstrüde edin ve su içinde 1 mL %1 (m/h)Na2CO3çözeltisi ile karıştırın. Numuneleri her 5-10 dakikada bir girdaplama ile 30 dakika boyunca 80 ° C'ye ısıtın, ardından 20 dakika boyunca 4 ° C'de 4.000 x g'da santrifüjleyin.
- Üç hacim% 100 etanol ile birleştirilmiş süpernatanı toplayın ve en az 2 saat (veya gece boyunca) 20 ° C'de inkübe edin.
- Etanol ile çökeltilmiş polisakkaritleri, 30 dakika boyunca 4 ° C'de 16.100 x g'da santrifüjleme yoluyla toplayın. Süpernatanı çıkarın ve peleti havayla kurutun. Peleti 100 μL deiyonize suda tekrar süspanse edin.
- Bir fenol-sülfürik asit kolorimetrik test12,13 kullanarak her bir agaroz segmentinin nispi polisakkarit içeriğini ölçün. 50 μL yeniden süspanse edilmiş ekstraktı 150 μL konsantre sülfürik asit ve 30 μL %5 (h/h) fenol ile 96 oyuklu berrak bir plakada suda birleştirin.
- Bir mikroplaka okuyucu kullanarak 490 nm'de absorbansı ölçün ve her bir agaroz segmentinin nispi polisakkarit içeriğini, PTFE filtresine en yakın agaroz segmentinin absorbansının yüzdesi olarak hesaplayın.
- Protein tahlili
- Agarozu ayrı 1.5 mL mikrosantrifüj tüplerine ekstrüde edin ve her bir alikotun 100 μL'sini cam test tüplerine aktarın.
- Bir BCA protein tahlil kitinin test tüpü protokolünü kullanarak toplam protein konsantrasyonunu belirleyin. Seyreltici olarak steril bir şırıngadan ekstrüde edilmiş agaroz ile albümin BSA standartlarını hazırlayın.
- Hücre dışı DNA tahlili
- Agarozu ayrı 1.5 mL mikrosantrifüj tüplerine ekstrüde edin ve her birinin 20 μL'sini 0.2 mL mikrosantrifüj tüplerine aktarın.
- Üreticinin protokolünü takip ederek ticari olarak temin edilebilen 1x dsDNA yüksek hassasiyetli tahlil kitini kullanarak DNA konsantrasyonlarını ölçün.
5. RNA ekstraksiyonu
- Aşağıdakileri 800 mL RNaz içermeyen suda birleştirerek ekstraksiyon tamponunu hazırlayın: 2.0 g CTAB, 2.0 g polivinilpirolidon (PVP 40), 81.8 g NaCl, 100 mM Tris-HCl (pH 8.0) ve 20 mM EDTA. Hacmi 1 L'ye getirin ve otoklavlayın; 4 °C'de saklayın.
- Hazırlanan ekstraksiyon tamponunu ayırın ve kullanımdan hemen önce %1 (h/h) nihai beta-merkaptoetanol konsantrasyonu ekleyin. Bir su banyosu veya ısı bloğu kullanarak tamponu 65 °C'ye ısıtın.
- Adım 1.9'daki prosedürü izleyerek agarozu ayrı RNaz içermeyen 2 mL mikrosantrifüj tüplerine ekstrüde ederek her gradyan şırıngayı 1 mL'lik bölümlere bölün.
- Numuneleri 21.000 x g, 4 °C'de 15 dakika santrifüjleyin ve numuneleri buz üzerinde tutarak süpernatanı atın.
- Her peletlenmiş 1 mL ekstrüde agaroza 600 μL önceden ısıtılmış ekstraksiyon tamponu ekleyin. Yaklaşık 200 μL zirkonya/silika boncuk ekleyin ve bir boncuk çırpıcı kullanarak numuneleri 30 Hz/s'de 3 dakika boyunca homojenize edin, numuneleri 2 dakika boyunca buz üzerine yerleştirmek için yarıya kadar duraklatın.
- Köpürmeyi azaltmak için numuneleri 15.000 x g, 4 °C'de 2 dakika santrifüjleyin. Tüplere 600 μL kloroform: izoamil alkol (24:1) ekleyerek ve 10 saniye boyunca girdaplayarak numuneleri çıkarın.
- Numuneleri 15.000 x g, 4 °C'de 8 dakika santrifüjleyin. Üst sulu fazı dikkatlice yeni bir RNaz içermeyen mikrosantrifüj tüpüne aktarın ve aktarılan üst faza 600 μL kloroform: izoamil alkol (24: 1) ekleyin ve 10 saniye boyunca girdap yapın.
- Numuneleri 15.000 x g, 4 ° C'de 8 dakika santrifüjleyin ve yeni üst sulu fazı yeni bir RNaz içermeyen mikrosantrifüj tüpüne aktarın. Aktarılan üst faza eşit hacimde izopropanol ekleyin ve numuneleri -20 °C'de birkaç saat inkübe edin. İsteğe bağlı: numuneler gece boyunca -20 °C'de bırakılabilir.
- Numuneleri 16.100 x g, 4 °C'de 30 dakika santrifüjleyerek RNA içeren çökeltileri toplayın.
- Süpernatanı atın ve peleti RNaz içermeyen su ile yapılan 300 μL soğuk %75 (h/h) etanol ile yıkayın ve 16.100 x g, 4 °C'de 5 dakika santrifüjleyin.
- Adım 5.10'u izleyerek peletleri tekrar yıkayın.
- Etanol süpernatantını çıkardıktan sonra, peletlerin 15 dakika kurumasını bekleyin. Peletleri 100 μL RNaz içermeyen suda çözün.
- Numuneleri, üreticinin protokolünü izleyerek 30 dakika boyunca 37 ° C'de DNaz I ile muamele edin.
- 300 μL asit fenol ekleyerek DNaz I'i inaktive edin: kloroform: IAA (125: 24: 1, pH 4.5). 10 saniye vorteksleyin ve oda sıcaklığında 5 dakika inkübe edin.
- 16.100 x g, 4 ° C'de 5 dakika santrifüjleyin ve üst sulu fazı yeni bir RNaz içermeyen mikrosantrifüj tüpüne aktararak tutun.
- İsteğe bağlı: Üst fazları konik bir tüpte birleştirerek tüm replike şırıngalarda aynı segmentten RNA'yı havuzlayın.
- RNA içeren üst fazın hacmine eşit 1 hacim izopropanol ekleyin ve karıştırmak için birkaç kez ters çevirerek 0,8 M'lik bir nihai konsantrasyona 7,5 M LiCl ekleyin.
- Numuneleri -20 °C'de birkaç saat inkübe edin. İsteğe bağlı: numuneler gece boyunca -20 °C'de bırakılabilir.
- Numuneleri 16.100 x g, 4 °C'de 15 dakika santrifüjleyin ve süpernatanı dikkatlice atın. RNA içeren peleti, RNaz içermeyen suya soğuk %70 (h/h) etanol ekleyerek, 16.100 x g, 4 °C'de 5 dakika santrifüjleyerek ve süpernatanı çıkararak iki kez yıkayın.
- Peletlerin oda sıcaklığında 10 dakika kurumasına izin verin ve 50 μL RNaz içermeyen suda tekrar süspanse edin. RNA örneklerini -80 °C'de saklayın.
- RNA kalitesine bağlı olarak isteğe bağlı: Numuneler, küçük (<200 nt) RNA'ları çıkarmak için bir RNA saflaştırma kiti kullanılarak yeniden saflaştırılabilir.
- RNA örneklerinin artık DNA içermediğini doğrulamak için, evrensel bakteriyel 16S rRNA gen primerleri 27F/1492R kullanılarak PCR amplifikasyonu için şablon olarak 1 μL saflaştırılmış RNA kullanın. Sırasıyla pozitif ve negatif kontroller olarak hizmet etmek için 1 μL genomik DNA (1:100 seyreltilmiş) veya nükleaz içermeyen su içeren iki ek PCR reaksiyonu ekleyin.
- Ürünleri, jel elektroforezi14 kullanarak% 1 agaroz TBE jeli üzerinde çalıştırın.
NOT: DNA kontaminasyonu olmayan RNA örnekleri, numune şeridinde bir bant olmamasına neden olmalıdır. RNA örnekleri DNA kontaminasyonu gösteriyorsa, adım 5.13'ten başlayarak örnekleri yeniden işleyin. RNA, aşağı akış analizi için hazırdır ve isteğe bağlı olarak, RNA Bütünlük Numarasını (RIN) ölçerek bütünlüğünü ölçmek için analiz edilebilir.
Sonuçlar
Burada, gradyan şırınga modeli ekosistemi, tek bir suşun (metanotrof Methylomonas sp. suşu LW13) yetiştirmek için kullanıldı (Şekil 1A)6, ancak doğrudan toprak aşılaması yoluyla metan oksitleyici bir mikrobiyal topluluğu zenginleştirmek için de kullanılabilir (Şekil 1B). Bir metan-oksijen karşı gradyanının varlığı, hücresiz ve aşılanmış şırıngalar boyunca metan ve oksijen konsantrasyonunun ölçülmesiyle doğrulandı (Şekil 1C). LW13 ile aşılanmış gradyan şırıngalar için, şırınganın yıkanmasından sonraki bir gün içinde bir karşı gradyan oluştu ve bu da üç günlük inkübasyon boyunca demlendi. Aynı zaman periyodunda, her iki gaz substratının da en düşük konsantrasyonlarına ulaştığı aynı derinlikte yatay bir bant oluştu (Şekil 1A). Dik gaz gradyanı ve yatay bandın derinliğini geçen metan ve oksijenin tükenmesi, LW13'ün metanı aerobik olarak metabolize ettiğini ve homojen planktonik kültürde gözlenmeyen bir fenotip ürettiğini gösterdi. Bu fenotip aynı zamanda LW136 ile aynı çevresel numuneden izole edilen diğer metanotrofik bakteriler tarafından da üretilir. Farklı metanotrotrofik suşlar arasındaki yatay bant gelişiminin zamanlaması ve derinliğindeki gerinim bağımlı varyasyon, yatay bandın, mekansal olarak çözülmüş bir bağlamda yetiştirildiğinde her bir mikrobun spesifik davranışından etkilendiğini düşündürdü6.
Tüm agaroz tıkacındaki hücre sayısı, akış sitometrisi ve koloni sayıları (CFU/mL) kullanılarak ölçüldü (Şekil 2A). Bu yöntem, vahşi tip LW13'ün hücre dağılımını ve sağkalımını, daha önce yatay bant gelişimini etkilediği gösterilen fukoz 4-O-asetiltransferaz (OAT) geninde bir delesyon içeren mutant bir LW13 suşu ile karşılaştırmak için kullanıldı6. LW13'ün ΔOAT mutantı, aynı suşların homojen planktonik kültürlerinde gözlenmeyen bir etkiolan vahşi tipe kıyasla 6 gün boyunca gradyan şırıngasında daha düşük toplam büyümeye sahipti. Mutant suş, gradyan şırıngada kültürlendiğinde LW13 vahşi tipi ile aynı belirgin yatay bandı oluşturmadı (Şekil 2B). Hücre sayıları ve yatay bant görünümü, mutant suşta gen tamamlaması üzerine vahşi tipe benzer seviyelere geri getirildi. Bu sonuçlar, gradyan şırıngasının, genleri yalnızca metan-oksijen karşı gradyanında bulunan spesifik fenotiplere bağlamak için kullanılabileceğini göstermektedir.
Yarı katı bir agaroz matrisi içinde yetiştirilen bakterilerle kullanım için çeşitli genetik, kimyasal ve moleküler teknikler uyarlanmıştır. Gradyan şırınga modeli ekosistemi, negatif kontrol olarak aşılanmamış agarozun dahil edilmesiyle standart biyomoleküler miktar tayin testleri için kolayca kullanılabilir. Hücre dışı polimerik maddelerde ve biyofilmlerde yaygın olarak bulunan üç farklı biyomolekülün konsantrasyonu ölçüldü: polisakkaritler, protein ve hücre dışı DNA15 (Şekil 3). LW13 ile aşılanmış şırınga segmentlerinde, yatay bant, protein veya hücre dışı DNA'da önemli bir artış olmaksızın diğer segmentlerden önemli ölçüde daha fazla polisakkarite sahipti.
RNA-seq, şırınganın farklı derinliklerinde büyüyen LW13'teki transkripsiyonel farklılıkları ölçmek için kullanıldı. Sağlam RNA ekstraksiyonu, CTAB bazlı bir ekstraksiyon tamponu ve ardından geleneksel fenol: kloroform ekstraksiyonu ve çökeltme adımları kullanılarak elde edildi. RNA-seq analizinden elde edilen sonuçlar daha sonra yatay polisakkarit bandının üretiminde rol oynayan genleri tanımlamak için kullanıldı. Bu sonuçlar, mekansal olarak çözülmüş bir model ekosistemin oluşturulması için gerekli olan yarı katı agarozun, genellikle planktonik ve plaka bazlı kültürler için ayrılan daha fazla biyokimyasal analizi engellemediğini göstermektedir.
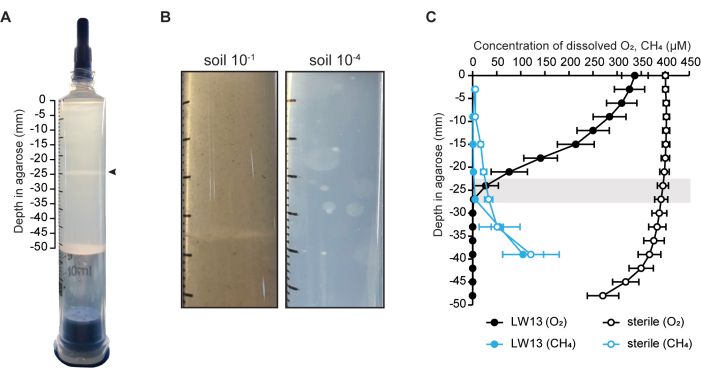
Şekil 1: Gradyan şırınga modeli ekosistemi. (A) Metanotrof Methylomonas sp. LW13 ile aşılanmış gradyan şırınga. Şırıngayı %100 metan ile yıkamaktan sonraki iki gün içinde belirgin bir yatay bant (ok ucu) gelişir. (B) 10-1 ve 10-4 oranında seyreltilmiş toprakla aşılanmış ve iki hafta boyunca inkübe edilmiş gradyan şırıngaların yakın çekim fotoğrafları. Daha seyreltik toprak içeren gradyan şırıngalar, agaroz boyunca küresel kolonilerle sonuçlanırken, daha konsantre toprak inokülü belirgin bir bantla sonuçlandı. (C) Üç günlük inkübasyondan sonra LW13 ile aşılanmış ve steril gradyan şırıngalarda metan-oksijen karşı gradyanının karakterizasyonu. Gri çubuk, polisakkarit bandının bulunduğu derinlik aralığını gösterir; veriler, her biri üç teknik kopyaya sahip üç bağımsız deneyin ortalama ± SD'sini göstermektedir. Paneller (A) ve (C), Beals ve ark.6'dan modifiye edilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
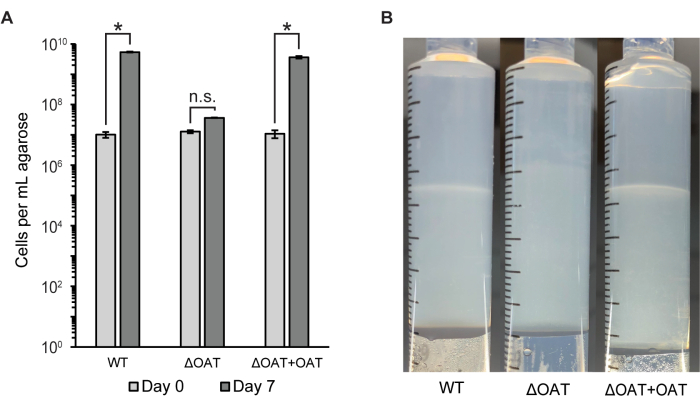
Şekil 2: Degrade şırıngada inkübasyondan sonra LW13 vahşi tip ve mutantın miktar tayini. (A) Akış sitometrisi ile ölçülen 0. ve 7. günlerde gradyan şırıngalardan geri kazanılan mL ekstrüde agaroz başına toplam LW13 hücresi sayısı. ΔOAT, polisakkarit bandının derinliğinde bulunan hücrelerde yüksek oranda eksprese edildiği bulunan fukoz 4-O-asetiltransferaz geninin bir delesyonunu içerir. ΔOAT + OAT, ΔOAT genomunun distal bir yerine yerleştirilen OAT genini içerir. *, anlamlı derecede farklı (iki kuyruklu heteroskedastik t-testi, α = 0.05); N.S., önemli ölçüde farklı değil. Veriler, her biri iki teknik kopya içeren üç bağımsız deneyin ortalama ± SD'sini göstermektedir. (B) Yedi günlük inkübasyondan sonra LW13 yabani tip, ΔOAT veya ΔOAT + OAT ile aşılanmış gradyan şırıngalarda yatay bant gelişimi. Bu rakam Beals ve ark.6'dan değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
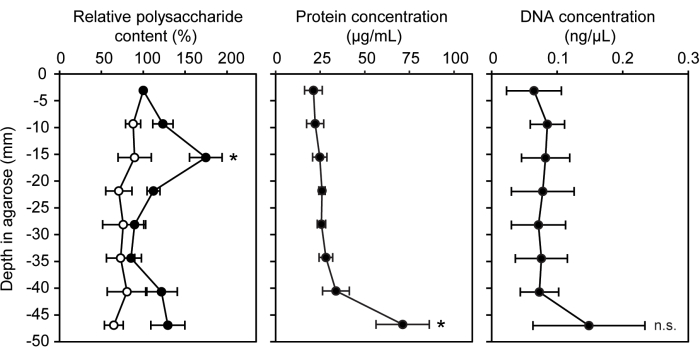
Şekil 3: Gradyan şırınganın artan derinliklerinde biyomoleküllerin miktarının belirlenmesi. Yedi gün boyunca inkübe edilen LW13 ile aşılanmış gradyan şırıngaların sekiz bölümündeki nispi polisakkarit içeriği (%), protein konsantrasyonu (μg/mL) ve DNA konsantrasyonu (ng/μL) (dolu daireler; açık daireler steril gradyan şırıngalardan gelen değerleri gösterir). Veriler, her biri üç teknik kopya içeren üç bağımsız deneyin ortalama ± SD'sini göstermektedir. Bağıl polisakkarit içeriği için, * eşdeğer derinlikte steril kontrolden önemli bir farkı gösterir (iki kuyruklu heteroscedastic t-testi, α = 0.05). Protein ve DNA konsantrasyonları için, * yatay bandı içeren bölümden önemli bir farkı gösterir (Tukey-Kramer post hoc analizi ile tek yönlü ANOVA); N.S., önemli değil. Şekil, Beals ve ark.6'dan değiştirilmiştir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Metanotrof yetiştiriciliği için yöntemler
Metanotroflar, fizyolojilerini, doğal ortamdaki bireysel ve topluluk davranışlarını ve endüstriyel uygulamalarda metan azaltma potansiyellerini anlamak için onlarca yıldır incelenmiştir. Bu çalışmalar boyunca, yapılan araştırmaların çoğu, mekansal bağlamın kaybolduğu homojen planktonik kültürler kullanılarak gerçekleştirilmiştir. Gradyan şırınga modeli ekosistemi, laboratuvardaki doğal metanotrof habitatlarının metan-oksijen karşı gradyan özelliğini çoğaltmak için geliştirildi ve araştırmacıların, bu organizmaların evrimleştiği yere daha yakından benzeyen bir ortamda büyüyen metanotronları incelemelerine olanak tanıdı.
Geçtiğimiz 30 yıl boyunca, araştırmacılar laboratuvarda metan-oksijen karşı gradyanını çeşitli yöntemler kullanarak, genellikle karışık metan oksitleyici konsorsiyumlardan metanotrofları izole etmek ve sınıflandırmak amacıyla yeniden yarattılar. Bu yöntemler, her ikisi de karşıt metan ve oksijen odalarının kullanımını içeren iki yaklaşıma ayrılabilir: nispeten bozulmamış toprağı bir zar16,17,18 üzerinde askıya almak veya az miktarda toprak veya saf bakteri kültürünü agaroz 7,8,19'da minimal bir ortama aşılamak. Burada açıklanan gradyan şırınga yöntemi, Dedysh ve iş arkadaşlarının9 şırınga temelli yaklaşımını, Amaral ve Knowles8 ve Schink ve iş arkadaşları7 tarafından önceki çalışmalardan metanotrofların yetiştirilmesiyle birleştirir. Bu yöntemlerin sonuncusu, bir metan-oksijen karşı gradyanında metanotrofların yetiştirilmesi için temeli attı ve agaroz tıkacının her iki tarafında sürekli bir metan ve oksijen akışı kullandı. Bu daha sabit bir ortam sağlarken, bu yaklaşım deney düzeneğine karmaşıklık katar ve özel gaz kaynakları gerektirir.
Buna karşılık, burada açıklanan gradyan şırınga, steril bir PTFE filtre ucu aracılığıyla atmosferik oksijene sürekli erişim sağlarken, şırınga başına bir dakikadan az süren bir işlem olan taze metan sağlamak için şırınganın günlük olarak yıkanmasına dayanır. Bu daha basit yöntem, metanotrofları mekansal olarak çözülmüş bir bağlamda incelemek için bu model ekosistemin daha geniş bir şekilde benimsenmesini sağlayabilir. Tarif edilen protokol ayrıca, yarı katı agarozda inkübe edilen bakteriler üzerinde doğrudan gerçekleştirilebilecek kimyasal ve moleküler düzeydeki analizleri de detaylandırır. Sonuç olarak, numune alma sırasındaki gaz gradyanı koşullarını koruyarak, analizden önce bakterilerin agaroz matrisi dışında eksize edilmesine ve kültürlenmesine gerek yoktur.
Protokol ile ilgili açıklamalar
Bakteriler polipropilen hacimsel bir şırınga içinde kültürlendiğinden, araştırmacılar, şırınga namlusunda hala kalan agaroz matrisinin uzamsal bütünlüğünü korurken, agaroz tıkacını doğru ve tekrarlanabilir bir şekilde segmentlere ayırmak için beraberindeki şırınga pistonunu kullanabilirler. Şırınganın doğasında bulunan hava geçirmez tasarım olmasaydı, agaroz tapalarının şırınga namlusundan çıkarılması ve dilimlenmesi gerekirdi, bu da agaroz segmentlerinin hacminde belirsizlik yaratır ve atmosfere ölçülemeyen miktarlarda metan ve çözünmüş oksijen salınırdı. Steril bir iğne ile agaroz ekstrüzyonu, numune hazırlamayı basitleştirir ve bakteri hücrelerini kesmeden ekstrüde segmentleri homojenize etmeye yardımcı olur. Bu yöntem, araştırmacıların her bir aşılanmış gradyan şırıngasını en az sekiz agaroz segmentine bölmelerine ve bir dizi oksijen ve metan konsantrasyonlarında büyüyen metanotroflar üzerinde paralel deneyler yapmalarına olanak tanır.
Yüksek polisakkarit içerikli agarozdan RNA ekstraksiyonunu optimize ederken, guanidyum tiyosiyanat ve TRIzol gibi yaygın reaktiflerin, saflaştırma kolonlarını tıkayan ve santrifüjleme ile peletlemeye direnen agaroz jelleşmesine yol açtığı bulundu. Büyük polisakkarit molekülleri nükleik asitleri yakalayabildiğinden, küçük polisakkaritler RNA20 ile birlikte çökelebildiğinden, düşük RNA verimi ve kalitesi de bir endişe kaynağıydı. Bunun yerine, lipid zarlarını20 çözündüren katyonik yüzey aktif madde CTAB içeren bir ekstraksiyon tamponu kullanıldı; ve CTAB-nükleik asit komplekslerinin oluşmasını önleyen ve nükleik asitlerin çökelmesine izin veren ancak polisakkaritleriçözelti 21'de tutan NaCl. RNazlar, CTAB tamponuna β-merkaptoetanolün dahil edilmesiyle denatüre edildi. RNA-seq deneyi için, kütüphane hazırlığından önce küçük (<200 nükleotid) RNA'ları dışlamak için isteğe bağlı bir sütun tabanlı saflaştırma adımı dahil edildi.
Sınırlamalar ve dikkat edilmesi gerekenler
NMS ve agaroz, metanotrofik bakterilerin yetiştirilmesi için minimal bir orta matris sağlarken, burada tarif edildiği gibi gradyan şırınga, yalnızca metanotrofik habitatların gaz gradyanlarını yeniden oluşturur, ancak eser metaller22, tuzluluk23 veya diğer besinler24 gibi bu ortamlarda bulunan diğer gradyanları yeniden oluşturmaz. Bu gradyanların gelecekte benzer bir sisteme eklenmesi mümkündür. Ek olarak, şırınganın hacmi (8 mL agaroz), şırınga başına toplam biyokütleyi sınırlar ve bazı analizler için birden fazla şırınganın havuzlanmasını gerektirir (adım 5.16'da açıklandığı gibi). Elde taşınan şırınga, agarozu uygun bir şekilde 1 mL'lik alikotlara ayırsa da, boyutu aynı zamanda üst boşluğu yaklaşık 4 mL ile sınırlar ve ekili mikroplar için depolanabilecek toplu metan miktarını sınırlar. Metan oksidasyon oranları, aerobik metanotrofların25 büyüme hızı ile orantılı olduğundan, günlük üst boşluk metanı yenilenmesi önerilir. Bu hala metan sınırlaması dönemlerine neden olabilirken, bu dönemler laboratuvarda tekrarlanabilir ve muhtemelen doğal ortamlarda bulunan durumları taklit eder.
Gradyan şırıngayı kullanırken, agaroz polisakkaritlerin varlığı, bu sistemde yetiştirilen metanotrofları analiz etmek için kullanılan tahlillerde bazı ayarlamalar yapılmasını gerektirir. Örneğin, küçük hacimlerde ekstrüde agarozun transferini gerektiren protokoller, doğru pipetleme için her seyreltme arasında kapsamlı homojenizasyon ile birden fazla seyreltme adımına ihtiyaç duyar. Ek olarak, agaroz matrisine özgü polisakkaritlerin sülfürik asit-fenol reaktifi ile reaksiyona gireceği polisakkarit testi gibi durumlarda, steril, hücresiz bir agaroz negatif kontrolünün dahil edilmesi esastır. Agaroz-hidrolize edici enzim β-agarazı dahil ederek bu sorunları hafifletmeye yönelik erken girişimler başarısız oldu ve biyolojik deneylere bilinmeyen bir değişken getirdi. Birden fazla teknik kopyanın kullanılması, kapsamlı seyreltme, homojenizasyon ve kontrollerin dahil edilmesi, agaroz matrisinin doğasında bulunan zorlukların çoğunu azaltmak için kullanılabilir.
Uygulama
Tek suşlu çalışmalara ek olarak, gradyan şırınga birden fazla suşun ko-kültürünü destekleyebilir ve toprak, saf bakteri kültürü yerine aşı olarak kullanılabilir. Gradyan şırınga modeli ekosisteminin basit tasarımı, metan yerineH2 veya CO gibi farklı bir gaz substratı kullanılarak anoksik ve oksik ortamlar arasındaki arayüzde bulunan diğer mikroorganizma türlerinin kültürüne uygundur. Özetle, basit, mekansal olarak çözülmüş bir model ekosistemin kullanılması, araştırmacıların anoksik-oksik mikroorganizmaların benzersiz fizyolojisini ve metabolik adaptasyonlarını incelemelerine olanak tanır ve genleri organizma fenotipleriyle ilişkilendirmek için kullanılabilir.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmemektedir.
Teşekkürler
Bu çalışma, Utah Üniversitesi Kimya Bölümü ve NSF KARİYER Ödülü #2339190'den başlangıç finansmanı ile desteklenmiştir. Yararlı tartışmalar için Puri Lab üyelerine teşekkür ederiz. Akış sitometrisi deneyine ilk rehberlik için Rachel Hurrell'e (Utah Üniversitesi) teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1% Gas mix analytical standard | Supelco | 22561 | 1% each component in nitrogen: carbon monoxide, carbon dioxide, hydrogen, methane and oxygen |
| 100% Methane | Airgas | ME CP300 | chemically pure grade |
| 15 ppm Gas mix analytical standard | Supelco | 23470-U | 15 ppm each component in nitrogen: methane, ethane, ethylene, acetylene, propane, propylene, propyne, and n-butane |
| 1x Nitrate mineral salts | see CAS numbers below | Dissolve the following in Mili-Q water and autoclave: 0.2 g/L MgSO4·7H2O, 0.2 g/L CaCl2·6H2O, 1 g/L KNO3, and 30 μM LaCl3. Before use, add trace elements to a 1X final concentration and phosphate buffer (pH 6.8) to a final concentration of 5.8 mM. | |
| 23 G needle | BD Biosciences | 305194 | sterile, Luer-Lok |
| 500x Trace elements | see CAS numbers below | Dissolve the following in Milli-Q water: 1.0 g/L Na2-EDTA, 2.0 g/L FeSO4·7H2O, 0.8 g/L ZnSO4·7H2O, 0.03 g/L MnCl2·4H2O, 0.03 g/L H3BO3, 0.2 g/L CoCl2·6H2O, 0.6 g/L CuCl2·2H2O, 0.02 g/L NiCl2·6H2O, and 0.05 g/L Na2MoO·2H2O. | |
| 96 Well plate | CELLTREAT | 229596 | sterile |
| Acid phenol:chloroform:IAA (125:24:1) | Invitrogen | AM9720 | pH 4.5 |
| Agarose | Fisher Scientific | BP160 | molecular biology grade, CAS 9012-36-6 |
| Aluminum crimp seals | VWR | 30618-460 | 20 mm |
| Bead beater | Qiagen | 9003240 | TissueLyser III |
| Butyl rubber stopper | Chemglass Life Science | 50-143-854 | 20 mm, blue |
| Chloroform:isoamyl alcohol (24:1) | Millipore Sigma | 25666 | BioUltra, for molecular biology |
| Clark-type O2 microelectrode | Unisense | OX-500 | |
| DEPC-treated water | Thermo Scientific | R0601 | |
| DNase I (Ambion) | Invitrogen | AM2222 | |
| Flow cytometer | Beckman Coulter | CytoFLEX | |
| Gas chromatograph (flame ionization detection) | Agilent | 6890N | |
| Gastight analytical syringe | Hamilton | 81220 | 1750 TLL |
| Gastight analytical syringe needle | Hamilton | 7729-07 | 22 G, metal hub needle, 2 in, point style 5 |
| Gas-tight vials | Labco | 938W | Exetainer vial: 12 mL, round bottom |
| Glass culture tubes | Bellco Glass | 2048-00150 | 18 x 150 mm |
| LiCl precipitation solution (7.5 M) | Invitrogen | AM9480 | |
| One-way stopcock | VWR | MFLX30600-00 | inlet port: female luer, outlet port: male luer lock |
| Petri dish, square | Fisher Scientific | FB0875711A | 100 x 100 mm |
| Phosphate buffer, 0.2 M (pH 6.8) | see CAS numbers below | Dissolve the following in Milli-Q water and autoclave: 12.24 g/L KH2PO4, 26.29 g/L Na2HPO4 · 7H2O | |
| Pierce BCA Protein Assay Kit | Thermo Scientific | 23225 | |
| PTFE syringe filter tip | Thermo Scientific | 03-050-469 | hydrophobic, pore size: 0.2 µm, diameter: 4 mm |
| Qubit 1x dsDNA High Sensitivity Assay Kit | Invitrogen | Q33230 | |
| Qubit 4 Fluorometer | Invitrogen | Q33238 | |
| RNA Clean & Concentrator-5 | Zymo Research | R1013 | |
| Serum stopper | Fisher Scientific | 03-340-302 | 20 mm |
| Syringe | BD Biosciences | 302995 | Luer-Lock, 10 mL, single use, sterile |
| Syringe pump | New Era Pump Systems Inc. | 1000-US | NE-1000 one channel programmable |
| SYTO9, propidium iodide, microspheres | Invitrogen | L34856 | LIVE/DEAD BacLight Bacterial Viability Kit |
| Zirconia/silica beads | BioSpec Products | 11079101z | 0.1 mm diameter |
| Chemical reagents | CAS number | ||
| CaCl2·6H2O | 7774-34-7 | ||
| CoCl2·6H2O | 7791-13-1 | ||
| Concentrated sulfuric acid | 7664-93-9 | ||
| CTAB, cetrimonium bromide | 57-09-0 | ||
| CuCl2·2H2O | 10125-13-0 | ||
| Ethanol | 64-17-5 | ||
| FeSO4·7H2O | 7782-63-0 | ||
| H3BO3 | 10043-35-3 | ||
| Isopropanol | 69-63-0 | ||
| KH2PO4 | 7778-77-0 | ||
| KNO3 | 7757-79-1 | ||
| LaCl3 | 10099-58-8 | ||
| MgSO4·7H2O | 10034-99-8 | ||
| MnCl2·4H2O | 13446-34-9 | ||
| Na2CO3, sodium carbonate | 497-19-8 | ||
| Na2-EDTA | 139-33-3 | ||
| Na2HPO4 · 7H2O | 7782-85-6 | ||
| Na2MoO·2H2O | 10102-40-6 | ||
| NaCl, sodium chloride | 7647-14-5 | ||
| NiCl2·6H2O | 7791-20-0 | ||
| Phenol (90% solution in water) | 108-95-2 | ||
| PVP40, polyvinylpyrrolidone | 9003-39-8 | ||
| Tris-HCl | 1185-53-1 | ||
| ZnSO4·7H2O | 7446-20-0 | ||
| β-Mercaptoethanol | 60-24-2 |
Referanslar
- Brune, A., Frenzel, P., Cypionka, H. Life at the oxic-anoxic interface: microbial activities and adaptations. FEMS Microbiol Rev. 24 (5), 691-710 (2000).
- Auman, A. J., Stolyar, S., Costello, A. M., Lidstrom, M. E. Molecular characterization of methanotrophic isolates from freshwater lake sediment. Appl Environ Microbiol. 66 (12), 5259-5266 (2000).
- Whittenbury, R., Phillips, K. C., Wilkinson, J. F. Enrichment, isolation and some properties of methane-utilizing bacteria. J Gen Microbiol. 61 (2), 205-218 (1970).
- Koo, C., Rosenzweig, A. Biochemistry of aerobic biological methane oxidation. Chem Soc Rev. 50 (5), 3424-3436 (2021).
- Strong, P. J., Xie, S., Clarke, W. P. Methane as a resource: Can the methanotrophs add value. Environ Sci Technol. 49 (7), 4001-4018 (2015).
- Beals, D. G., Puri, A. W. Linking methanotroph phenotypes to genotypes using a simple spatially resolved model ecosystem. ISME J. 18 (1), wrae060 (2024).
- Bussmann, I., Rahalkar, M., Schink, B. Cultivation of methanotrophic bacteria in opposing gradients of methane and oxygen. FEMS Microbiol. Ecol. 56 (3), 331-344 (2006).
- Amaral, J. A., Knowles, R. Growth of methanotrophs in methane and oxygen counter gradients. FEMS Microbiol Lett. 126 (3), 215-220 (1995).
- Danilova, O. V., et al. A new cell morphotype among methane oxidizers: a spiral-shaped obligately microaerophilic methanotroph from northern low-oxygen environments. ISME J. 10 (11), 2734-2743 (2016).
- Ou, F., McGoverin, C., Swift, S., Vanholsbeeck, F. Absolute bacterial cell enumeration using flow cytometry. J Appl Microbiol. 123 (2), 464-477 (2017).
- Krause, S. M. B., et al. Lanthanide-dependent cross-feeding of methane-derived carbon is linked by microbial community interactions. Proc Natl Acad Sci USA. 114 (2), 358-363 (2017).
- Masuko, T., et al. Carbohydrate analysis by a phenol-sulfuric acid method in microplate format. Anal Biochem. 339 (1), 69-72 (2005).
- Felz, S., Al-Zuhairy, S., Aarstad, O. A., van Loosdrecht, M. C. M., Lin, Y. M. Extraction of structural extracellular polymeric substances from aerobic granular sludge. J Vis Exp. (115), e54534 (2016).
- Lee, P. Y., Costumbrado, J., Hsu, C. Y., Kim, Y. H. Agarose gel electrophoresis for the separation of DNA fragments. J Vis Exp. (62), e3923 (2012).
- Costa, O. Y. A., Raaijmakers, J. M., Kuramae, E. E. Microbial extracellular polymeric substances: Ecological function and impact on soil aggregation. Front Microbiol. 9, 1636 (2018).
- Sinke, A. J. C., Cottaar, F. H. M., Buis, K., Keizer, P. Methane oxidation by methanotrophs and its effects on the phosphate flux over the sediment-water interface in a eutrophic lake. Microb Ecol. 24 (3), 259-269 (1992).
- Murase, J., Frenzel, P. A methane-driven microbial food web in a wetland rice soil. Environ Microbiol. 9 (12), 3025-3034 (2007).
- Reim, A., Lüke, C., Krause, S., Pratscher, J., Frenzel, P. One millimetre makes the difference: High-resolution analysis of methane-oxidizing bacteria and their specific activity at the oxic-anoxic interface in a flooded paddy soil. ISME J. 6 (11), 2128-2139 (2012).
- Rahalkar, M., Bussmann, I., Schink, B. Methylosoma difficile gen. nov., sp. nov., a novel methanotroph enriched by gradient cultivation from littoral sediment of Lake Constance. Int J Syst Evol Microbiol. 57 (5), 1073-1080 (2007).
- Wang, L., Stegemann, J. P. Extraction of high-quality RNA from polysaccharide matrices using cetlytrimethylammonium bromide. Biomaterials. 31 (7), 1612 (2010).
- Liyanage, N. M. N., Chandrasekara, B. C. H. W. M., Bandaranayake, P. C. G. A CTAB protocol for obtaining high-quality total RNA from cinnamon (Cinnamomum zeylanicum Blume). 3 Biotech. 11 (4), 201 (2021).
- Semrau, J. D., DiSpirito, A. A., Gu, W., Yoon, S. Metals and methanotrophy. Appl Environ Microbiol. 84 (6), e02289-e02317 (2018).
- Zhang, S., et al. Salinity significantly affects methane oxidation and methanotrophic community in Inner Mongolia lake sediments. Front Microbiol. 13, 1067017 (2023).
- Fox, A. L., Trefry, J. H. Nutrient fluxes from recent deposits of fine-grained, organic-rich sediments in a Florida estuary. Front Mar Sci. , (2023).
- He, L., et al. A methanotrophic bacterium to enable methane removal for climate mitigation. Proc Natl Acad Sci. 120 (35), e2310046120 (2023).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır