Case Report
Novedosa e innovadora técnica híbrida para la disección aórtica tipo A
En este artículo
Resumen
El protocolo describe el reemplazo aórtico ascendente combinado con cobertura endovascular de todo el arco aórtico con un injerto de stent fenestrado en un paciente con disección aórtica aguda tipo A en ausencia de desgarro en el arco aórtico.
Resumen
La disección aórtica aguda tipo A (TAAD) de Stanford es una urgencia quirúrgica caracterizada por una alta tasa de mortalidad y numerosas complicaciones. En el tratamiento de la TAAD, el momento de la cirugía y la elección del procedimiento quirúrgico son de suma importancia. La reconstrucción abierta del arco aórtico total sigue siendo el estándar de oro para la cirugía del arco aórtico y es uno de los procedimientos más desafiantes. Sin embargo, este enfoque es invasivo, relativamente prolongado y se asocia con sangrado sustancial, lo que requiere altos niveles de habilidad del operador y conlleva el riesgo de múltiples complicaciones, particularmente neurológicas. Este informe describe un nuevo procedimiento híbrido denominado Reemplazo de Aorta Ascendente Abierta Combinado con Colocación de Arco Aórtico Total Fenestrado. Se seleccionó un caso en el que la lesión no afectaba al arco aórtico, al menos en el lado de mayor curvatura del arco. Se realizó reemplazo aórtico ascendente, seguido de intervención del arco con injertos de stent automodificados para preservar las ramas nativas del arco aórtico. Este enfoque permite una rápida simplificación del procedimiento, evita la hipotermia profunda o el paro circulatorio asociados con la cirugía abierta convencional y mitiga las complicaciones neurológicas.
Introducción
La disección aórtica es una urgencia cardiovascular poco frecuente asociada a una alta tasa de mortalidad; sin embargo, su incidencia ha aumentado en los últimos años mientras que la edad de inicio ha disminuido, particularmente para la disección aórtica tipo A (TAAD) de Stanford1,2. El reemplazo aórtico sigue siendo el procedimiento más común utilizado para el TAAD3. Se presentan numerosas complicaciones postoperatorias y se elevan las tasas de mortalidad debido a traumatismos significativos y paro circulatorio hipotérmico prolongado 4,5.
El desarrollo de la reparación aórtica endovascular torácica (TEVAR) ha llevado a la aparición de la cirugía híbrida 6,7,8, haciendo que el procedimiento sea mínimamente invasivo y menos complejo. Aunque existen indicaciones estrictas, la reducción de la pérdida de sangre, el menor tiempo operatorio y la ausencia de paro hipotérmico profundo mitigan el alto riesgo de complicaciones postoperatorias.
La cirugía híbrida tiene como objetivo acortar el tiempo de recuperación funcional. Se reemplazó la porción ascendente de la aorta, independientemente de si se manejó la raíz. El arco se fenestraba con injertos de stent (SG) y un stent cubría la porción descendente para agrandar la luz verdadera. Esta técnica híbrida da como resultado un tiempo quirúrgico más corto, una disminución de la pérdida de sangre y el riesgo de eventos neurológicos postoperatorios y complicaciones significativas son comparables o menores que los asociados con el reemplazo abierto. Los pasos quirúrgicos se simplifican a través de un manejo reducido de las tres ramas del arco, en comparación con otras cirugías híbridas anteriores9. Estudios anteriores han demostrado que la cirugía híbrida se caracteriza por una reducción del trauma y una recuperación acelerada. Se reconoce que pueden existir numerosas variaciones en casi todas las etapas del procedimiento10,11.
En este estudio se presenta un abordaje de la cirugía híbrida que incorpora TEVAR. La identificación precisa y la alineación cuidadosa, particularmente de las tres ramas del supraarco, son críticas. Este caso involucra a un hombre de 55 años que presentó un fuerte dolor torácico. La angiografía por tomografía computarizada (ATC) sugirió TAAD sin ruptura del arco. La paciente consintió en someterse a cirugía híbrida, seguida de reemplazo aórtico ascendente y arcada total mediante implante de SGs fenestradas automodificadas (Figura 1), y finalmente fue dada de alta hospitalaria.
PRESENTACIÓN DEL CASO:
Paciente masculino de 55 años que acudió a consulta por opresión torácica y dolor iniciado hace 11 horas sin ningún desencadenante aparente. Tenía antecedentes de hipertensión arterial desde hacía 3 años, con una presión arterial máxima de 150/100 mmHg, y no tomaba ningún medicamento para controlar su presión arterial. También tenía 20 años de historia de gota, sin antecedentes de hiperlipidemia, diabetes mellitus, hepatitis B o tuberculosis. Negó cirugías previas, transfusiones de sangre, alergias a medicamentos o alimentos y no informó antecedentes familiares significativos. Al ingreso, el paciente se encontraba alerta y orientado y recibía oxígeno a través de una cánula nasal. La monitorización cardíaca reveló una frecuencia cardíaca de 68 latidos por minuto, saturación de oxígeno del 100%, frecuencia respiratoria de 16 respiraciones por minuto y presión arterial de 126/83 mmHg en la extremidad superior izquierda, 139/79 mmHg en la extremidad superior derecha, 135/80 mmHg en la extremidad inferior izquierda y 150/84 mmHg en la extremidad inferior derecha. La temperatura de la piel de las extremidades superiores era fría, más aún en el lado derecho. Ambas pupilas eran iguales en tamaño, redondas y de aproximadamente 3 mm de diámetro, y eran reactivas a la luz. Los sonidos respiratorios de ambos pulmones fueron claros en la auscultación, sin estertores secos o húmedos. Los ruidos cardíacos fueron normales y no se escucharon soplos patológicos en ninguno de los sitios de auscultación valvular. El abdomen estaba blando, sin sensibilidad ni dolor de rebote. El hígado y el bazo no eran palpables por debajo de la caja torácica. Las extremidades mostraron una fuerza muscular normal y no se observó edema en las extremidades inferiores. Los pulsos del pedal dorsal eran palpables y no se presentaron signos patológicos.
Diagnóstico, evaluación y planificación:
Tras el ingreso del paciente, se realizaron las pruebas e investigaciones adecuadas. La ecocardiografía cardíaca reveló los siguientes diagnósticos: 1. hipertrofia ventricular izquierda, 2. dilatación proximal de la aorta ascendente. Se encontró que la aorta era anormal, y el examen posterior de la ATC confirmó el diagnóstico de disección aórtica (tipo Stanford A) sin ruptura de la aorta ascendente o del arco. La disección involucró la arteria mesentérica superior, las arterias ilíacas comunes bilaterales y la arteria ilíaca externa derecha. La arteria renal derecha fue irrigada por la pseudocavidad, y se observaron derrames pleurales bilaterales y expansión inadecuada de los lóbulos pulmonares inferiores. Se administró tratamiento sintomático, que incluyó control de la presión arterial y la frecuencia cardíaca y analgesia. Se confirmó el diagnóstico del paciente, se realizó un examen de cabeza y abdomen, se excluyeron contraindicaciones para la cirugía y se proporcionó a la familia del paciente información detallada para facilitar la preparación preoperatoria.
Protocolo
Se obtuvo el consentimiento informado por escrito de la paciente para el procedimiento, y se dio su consentimiento para someterse a un reemplazo aórtico ascendente con las SG fenestradas. Este estudio se llevó a cabo de acuerdo con todas las directrices institucionales, nacionales e internacionales de bienestar humano12 y recibió la aprobación del Comité de Ética de la Facultad de Medicina de Tongji, Universidad de Ciencia y Tecnología de Huazhong (documento de la Junta de Revisión Institucional número TJ-IRB20220124). Se obtuvo el consentimiento informado por escrito de los pacientes para la publicación del manuscrito y las imágenes que lo acompañan.
1. Evaluación preoperatoria de la CTA
- La fenestración se diseñó de acuerdo con las características de la lesión, la medición precisa antes de la operación y la configuración de la SG (Figura 2).
- Los diámetros de la aorta y de las tres arterias ramificadas principales se midieron mediante imágenes de TAC, empleando el diámetro circular o el diámetro medio elíptico de las arterias. Las mediciones se realizaron en múltiples puntos de referencia anatómica, con especial atención al arco aórtico y sus ramas, que son cruciales para la planificación de la cirugía híbrida para el TAAD.
- Para obtener mediciones precisas, primero se definió una línea central a lo largo de la aorta y sus ramas. Para cada arteria, el diámetro se midió en el plano de la sección transversal perpendicular que intersectaba la línea central en el sitio de medición elegido para evitar artefactos o irregularidades en la pared del vaso que pudieran influir en la precisión de las mediciones.
- La aorta se midió en puntos clave, incluyendo la aorta ascendente, el arco aórtico (distal al origen de la arteria braquiocefálica) y la aorta torácica descendente. Del mismo modo, se midieron los diámetros de las ramas principales (braquiocefálica, carótida común izquierda y subclavia izquierda) en el origen y en los puntos distales a lo largo del arco, lo que garantizó la consistencia en la técnica de medición. Las mediciones se obtuvieron utilizando una herramienta de software calibrada capaz de generar vistas transversales precisas y permitir una evaluación confiable del diámetro.
- El ángulo del arco aórtico es el ángulo entre la línea entre los extremos proximal y distal del arco aórtico y el plano horizontal. El ángulo del arco se determinó con el paciente en decúbito supino. Este ángulo determina el ángulo de proyección del bulbo cuando se despliega el arco aórtico. Suele ser oblicuo anterior izquierdo de 30°-60°, con una media de 45°.
2. Reemplazo aórtico ascendente
- El injerto vascular artificial (AVG) apropiado se seleccionó en función del diámetro natural del vaso, medido por CTA.
- Se evaluó el estado de la sección del seno aórtico, la íntima de la raíz aórtica, el ostium de la arteria coronaria y las estructuras de las valvas de la válvula aórtica para determinar si se debía tratar el segmento más proximal.
- En este caso, la válvula aórtica estaba comprometida en la lesión, incluyendo la afectación del anillo aórtico y la regurgitación de la válvula. Tras la administración de heparina para lograr una adecuada anticoagulación, se estableció la circulación extracorpórea (CEC) a través de las arterias axilar y femoral y el paciente no sufrió un paro cardíaco hipotérmico profundo. Se asistió a la ECC para realizar la intervención quirúrgica de forma segura.
- A continuación, se extirpó la aorta ascendente y se suturó un injerto artificial a medida (30 mm), seleccionado en función de las mediciones preoperatorias de la ATC, para reemplazar el segmento aórtico enfermo. Al mismo tiempo, la válvula aórtica se reemplazó por una prótesis valvular mecánica para abordar la disfunción valvular y garantizar la estabilidad hemodinámica a largo plazo.
- A lo largo del procedimiento, se preservó la integridad del ostium de la arteria coronaria evitando esta zona para operaciones quirúrgicas y se inspeccionaron cuidadosamente las estructuras de la raíz aórtica para garantizar la alineación adecuada del injerto y la válvula. El procedimiento tuvo como objetivo lograr un éxito inmediato y a largo plazo en la restauración de la integridad y la función aórtica.
3. Fenestración de SGs
- Una vez finalizado el reemplazo aórtico ascendente, el tórax se dejó abierto deliberadamente para facilitar la evaluación posterior de la anastomosis distal. Para asegurar la identificación precisa del sitio anastomótico para su posterior evaluación, se colocaron pinzas Kelly o clips de titanio en el lugar de la anastomosis distal. Estos marcadores sirven como puntos de referencia anatómicos claros para la imagen y las intervenciones quirúrgicas posteriores.
- Tras la colocación de los marcadores, se realizó una angiografía por sustracción digital (DSA)13 para evaluar la integridad y permeabilidad del segmento aórtico recién construido (Figura 3). Se empleó la técnica de imagen DSA para obtener imágenes de alta resolución y en tiempo real de la anastomosis distal, lo que permitió una evaluación precisa de la dinámica del flujo sanguíneo y la ausencia de complicaciones como estenosis, fugas o malposición. El proceso de sustracción digital mejora la visibilidad de las estructuras vasculares al eliminar el tejido de fondo y resaltar la luz llena de contraste.
- La posición y la longitud de las aberturas de la SG se determinaron con base en las imágenes intraoperatorias y los datos de CTA preoperatorios. En este caso, la ubicación del desgarro descendente fue cerca de la arteria subclavia izquierda.
- Para evitar la endofuga y el manejo incompleto de la lesión, se planificó una ventana in situ en la arteria subclavia izquierda para implantar el Viabahn, y una fenestración in vitro en las dos ramas de arco restantes.
- En primer lugar, se cubrió el extremo anterior del stent y superó en 10-15 mm la anastomosis aórtica distal. La longitud de la ventana de las SG se definió por el extremo proximal del ostium del tronco braquiocefálico y el extremo distal del ostium de la arteria carótida común izquierda. La anchura de la ventana estaba determinada principalmente por el diámetro de los vasos del arco y su posición relativa entre sí.
- Para posicionar con precisión las ventanas de los SG con las ramas correspondientes del arco aórtico, se utilizaron suturas fijas de materiales radiopacos como alambre de acero inoxidable o placas metálicas delgadas en ambos extremos de la ventana del SG. Estos materiales se eligen por su radiopacidad, lo que permite una visualización clara bajo guía fluoroscópica durante el procedimiento.
- La sutura se realizó con la colocación cuidadosa de suturas interrumpidas o continuas a través de las SG en los bordes de la ventana. El alambre o lámina metálica se fijó al stent en estos puntos para asegurar un posicionamiento estable y una alineación precisa de la ventana modificada con los vasos del arco, particularmente a nivel del tronco braquiocefálico y la arteria carótida común izquierda, para minimizar el riesgo de complicaciones como reestenosis o desalineación del ostium de la rama.
- Si las ramas estaban más separadas en la proa, se usaban ventanas separadas para cada una de las tres ramas, lo que requería mediciones precisas de una imagen en 3D.
4. Implantación de SGs
- Las SG modificadas se implantaron a través de la arteria femoral (Figura 4).
- Se giró el mango de los SG y se soltó el SG antes de desenfundarlo lentamente y abrir el soporte a la posición inicial de la superposición del soporte. El lado de la SG correspondiente al punto blanco en el mango se identifica como el lado de apertura y se confirmó el marcador del lado de apertura.
- Las posiciones anterior y posterior de la ventana de apertura también pueden marcarse utilizando los segmentos SG correspondientes. La posición del arco aórtico y de la rama dentro del arco se determinó repetidamente marcando el arco aórtico y dos ramas con marcadores de pantalla y los marcadores correspondientes en el hueso.
- Se avanzó una guía a través de la vaina hasta la arteria subclavia izquierda, con fluoroscopia en tiempo real que guió el procedimiento para garantizar la colocación precisa del catéter en el sitio correspondiente a las SG previamente desplegadas, después de lo cual se introdujo un catéter con balón a través de la vaina y se avanzó hasta el ostium de la arteria subclavia.
- La dilatación con balón se realizó cuidadosamente en el sitio de las SG para optimizar la expansión del stent, mejorar la aposición a la pared aórtica y restaurar el flujo en la aorta disecada. El balón se infló gradualmente y la presión se controló cuidadosamente para evitar lesiones en los vasos y garantizar una expansión adecuada del stent. Después de una dilatación exitosa con balón, se colocó un injerto de stent cubierto de Viabahn en todo el sitio para minimizar el riesgo de endofuga y asegurar la posición de los SG.
- Dependiendo de las necesidades del paciente, se implantó un segundo stent en la aorta descendente para eliminar la mayor cantidad posible de la falsa luz.
5. Colocación de la guía
- En el procedimiento TEVAR para TAAD, la implantación de SG requiere un manejo meticuloso de la guía para garantizar un despliegue preciso del stent. Inicialmente, se seleccionó una guía y se le dio una forma cuidadosa para que coincidiera con la anatomía aórtica. Para apoyar adecuadamente la guía y evitar cualquier complicación durante el avance, se utilizó un AVG ramificado o pretratado.
- Una vez que la guía estuvo firmemente en su lugar, la SG avanzó sobre la guía, lo que garantizó un despliegue suave y controlado en el sitio objetivo mediante guía fluoroscópica.
- En este caso de cirugía híbrida para TAAD, el implante del stent (SG) se complicó por un injerto aórtico de reemplazo corto (AVG) y la presencia de una válvula aórtica mecánica, que impedía el paso de la guía a través de la válvula. Para superar este desafío, se utilizó un AVG ramificado o pretratado, que permitió colocar la guía por encima de la válvula aórtica, evitando la interacción directa con los componentes mecánicos de la válvula.
- El AVG se avanzó cuidadosamente para que la guía sobresaliera del injerto, anclada fuera de la luz de la válvula aórtica. Esto proporcionó una vía estable y segura para hacer avanzar la guía a través de la aorta, al tiempo que evitaba cualquier daño potencial a la válvula o la interrupción de su función. La posición de la guía se monitoreó cuidadosamente mediante fluoroscopia para garantizar su ubicación adecuada sobre la válvula.
- Además, dado que el AVG de reemplazo es corto y la válvula aórtica no ha sido reemplazada, la guía se extendió hasta el ventrículo. La punta fue tratada previamente para garantizar que estuviera curvada, lo que redujo el riesgo de daño cardíaco. Sin embargo, cuando la AVG de reemplazo tiene la longitud ideal, la válvula aórtica no afecta a la guía y se colocó directamente en el vaso.
6. DSA postoperatorio
- Después del procedimiento quirúrgico, se realizó DSA para evaluar el resultado de la reparación híbrida en el paciente. La DSA proporcionó imágenes de alta resolución, lo que permitió una visualización detallada de toda la aorta, incluidas las tres ramas principales del arco aórtico (tronco braquiocefálico, arteria carótida común izquierda y arteria subclavia izquierda). Esto fue crucial para asegurar que el arco aórtico estuviera bien permeable, sin evidencia de estenosis ni compromiso alguno en el flujo de sangre a la cabeza, el cuello y las extremidades superiores.
- Además, DSA permite la evaluación de los SG recién desplegados, confirmando que se colocaron correctamente sin torceduras ni desplazamientos. El procedimiento también fue fundamental para detectar cualquier complicación potencial, como fugas internas, migración del stent o endofugas, que podrían comprometer la reparación y requerir una intervención adicional. El flujo sanguíneo suave y sin obstrucciones a través del arco aórtico y hacia las ramas se utilizó como indicador de un resultado exitoso, lo que garantiza que el procedimiento híbrido haya restaurado eficazmente la hemodinámica normal.
- Después de que la DSA confirmara la ausencia de cualquier fuga y la colocación exitosa del injerto de stent, el tórax se cerró en capas. Esto implica el cierre cuidadoso del pericardio, seguido de la reaproximación de los músculos de la pared torácica, la fascia y la piel, asegurando una hemostasia adecuada y minimizando el riesgo de complicaciones postoperatorias como infección o dehiscencia de la herida.
Resultados
Los resultados representativos de este caso demuestran el éxito técnico y la viabilidad del enfoque híbrido del TAAD. La operación se completó en un plazo razonable de 6 h con una pérdida sanguínea controlada de 500 mL, lo que refleja la naturaleza mínimamente invasiva del enfoque híbrido en comparación con la cirugía abierta tradicional. La rápida recuperación del paciente, despertando solo 3 horas después de la operación sin ninguna anomalía sensorial o motora, es un indicador importante de la efectividad del procedimiento para mantener la integridad neural y vascular. La ausencia de complicaciones como déficits neurológicos y el hecho de que el paciente no requirió hipotermia profunda durante el procedimiento pone de manifiesto la disminución del estrés fisiológico impuesto por la técnica híbrida.
Además, la TAC postoperatoria (Figura 5), que no mostró fugas significativas de contraste, ni desprendimiento del stent y un flujo sanguíneo suave en las tres ramas del arco aórtico, respaldan el éxito técnico de la colocación del stent y confirman la permeabilidad y estabilidad de la reparación. Estos resultados de imágenes son fundamentales para demostrar la eficacia del procedimiento híbrido en la reparación del TAAD y el restablecimiento del flujo sanguíneo normal a la cabeza, el cuello y las extremidades superiores. El paciente fue dado de alta el día postoperatorio 11 sin mayores complicaciones, lo que subraya aún más la evolución favorable y la rápida recuperación asociada a este abordaje.
Para analizar el resultado, es importante valorar tanto los resultados postoperatorios inmediatos, como se observa en los datos de imagen y recuperación, como el seguimiento a largo plazo para evaluar la durabilidad del injerto de stent y la posibilidad de complicaciones tardías como endofugas o reestenosis. Además, la comparación de este enfoque híbrido con las técnicas quirúrgicas tradicionales en términos de tiempo operatorio, pérdida de sangre y tasas de complicaciones podría proporcionar información valiosa sobre los beneficios de la cirugía híbrida en el TAAD.
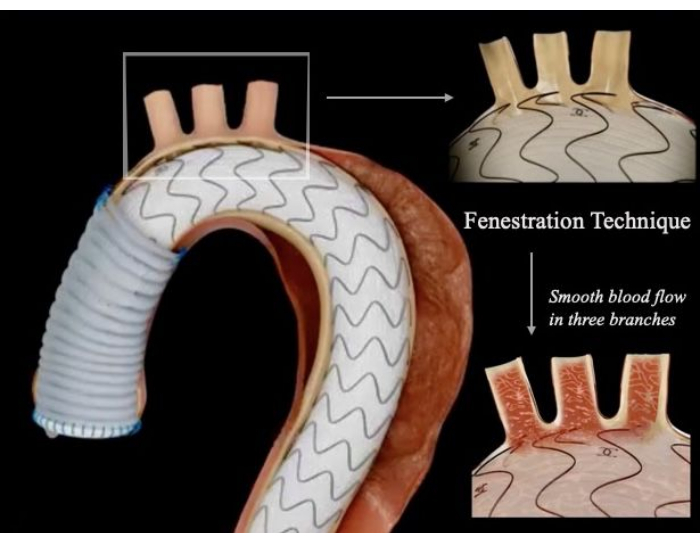
Figura 1: Diagrama esquemático de la técnica híbrida de reemplazo aórtico ascendente combinado con un injerto de stent fenestrado. El sitio fenestrado se alineó con precisión con las ramas del arco, lo que permitió un flujo sanguíneo suave a la cabeza, el cuello y las extremidades superiores y la extirpación completa de la lesión aórtica sin endofugas. Haga clic aquí para ver una versión más grande de esta figura.
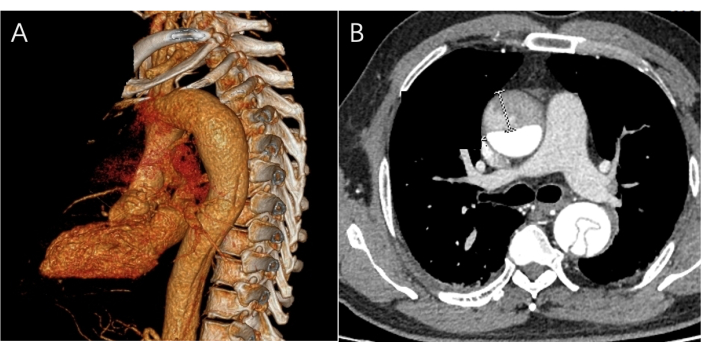
Figura 2: Imágenes de la TAC preoperatoria. (A) Se ve una imagen tridimensional de CTA del sitio de la lesión, pero no hay desgarros en la aorta. (B) La imagen del plano transversal del CTA muestra las partes ascendente y descendente de la aorta presentando una doble luz con un colgajo intimal. Haga clic aquí para ver una versión más grande de esta figura.
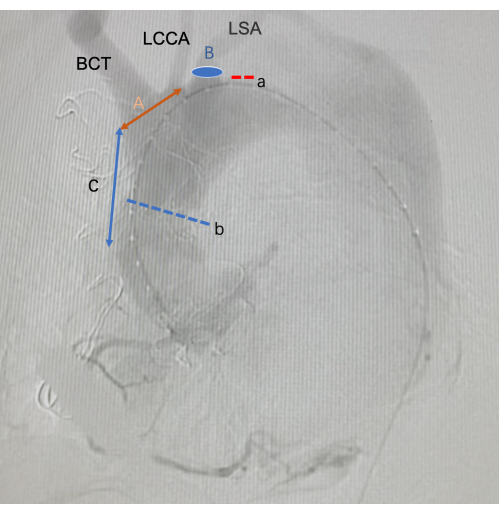
Figura 3: Imágenes de la DSA intraoperatoria. a es el desgarro de la disección aórtica. B es la anastomosis distal de un injerto vascular artificial. A es la longitud de la fenestración in vitro . B es la posición de la fenestración en el traje. C es la longitud de la posición inicial de la fenestración de la SG desde el extremo anterior de la SG. Abreviaturas: BCT = tronco braquiocefálico; LCCA = Arteria carótida común izquierda; LSA = Arteria subclavia izquierda Haga clic aquí para ver una versión más grande de esta figura.
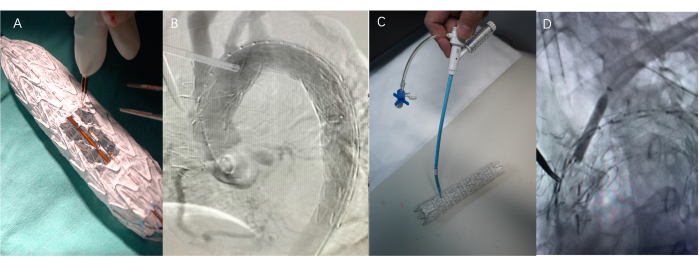
Figura 4: Procedimiento quirúrgico. (A) Automodificación de injertos de stent utilizando una pluma de cauterización o bisturí - Cirugía fenestrada. La longitud de la ventana es la longitud total de las protuberancias de las ramas, y el ancho es el diámetro de las ramas. (B) El proceso de implantar un injerto de stent (SG). (C) Agujas ajustables de flexión y perforación utilizadas en la tecnología de fenestración in situ. Este dispositivo puede ajustar de forma flexible el ángulo y la posición de la parte delantera. (D) Use un globo para dilatar el sitio de punción para facilitar la implantación del Viabahn después de que la aguja haya pasado a través del stent cubierto. Haga clic aquí para ver una versión más grande de esta figura.
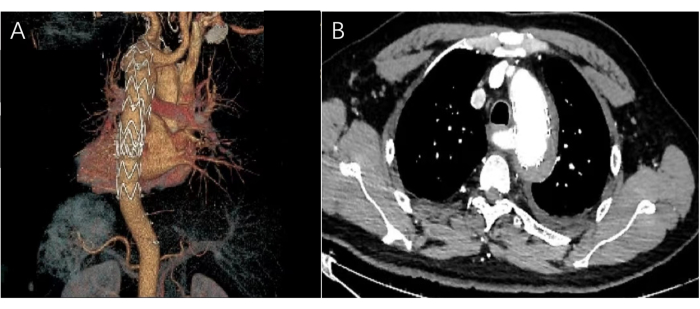
Figura 5: Imágenes de la TAC postoperatoria. (A) La imagen tridimensional postoperatoria de CTA muestra que el stent aórtico está en el arco aórtico y el desgarro de la arteria subclavia izquierda está completamente cerrado. (B) La imagen CTA horizontal muestra la sombra del stent sin hematoma ni fuga de contraste. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este procedimiento está actualmente indicado para pacientes seleccionados con arcos aórticos de calidad, como aquellos con 1) desgarros en la aorta descendente y/o ascendente donde el arco aórtico está lo suficientemente intacto como para permitir el uso de una pinza de bloqueo, sin desgarros en el lado de mayor curvatura y sin atrapamiento de las ramas supraarteriales; 2) incluso si hay desgarros en el arco, se limitan al lado de menor curvatura y el procedimiento TEVAR aislará los desgarros, minimizando el riesgo de fugas internas. Los pasos clave en el procedimiento de fenestración son los siguientes: reemplazo aórtico ascendente, examen de DSA intraoperatorio, fenestración de las SG, implantación de SG modificadas que cubren y extienden la anastomosis en 10-15 mm, localización y acoplamiento a la rama del arco, y uso de una guía súper rígida.
Este procedimiento requiere menos anastomosis, reduce el número de pasos quirúrgicos, es fácil de realizar y evita el paro circulatorio hipotérmico profundo14. En TEVAR, el tórax no se sutura y solo se utiliza una membrana adhesiva, principalmente para evitar la reheparinización y la readministración de protamina, lo que aumenta el riesgo de hemorragia torácica y de no detectar la hemorragia a tiempo. Además, la membrana adhesiva proporciona un punto de apoyo si el stent tiene dificultades para atravesar la anastomosis distal. En caso de malposición, el problema puede abordarse con prontitud, por ejemplo, creando un bypass o realizando una punción con aguja de la membrana. Además de las complicaciones quirúrgicas habituales, las complicaciones neurológicas deben ser vigiladas estrechamente en el postoperatorio15,16. El tratamiento del arco puede afectar el suministro de sangre a la cabeza, el cuello y las extremidades superiores. Debido a este riesgo, se realiza una DSA al menos en el postoperatorio en el quirófano para evaluar el suministro de sangre a las ramas del arco. La función motora y sensorial de la extremidad afectada debe evaluarse lo antes posible cuando el paciente esté despierto. La estabilidad de las SG puede verse comprometida después de la cirugía abierta en el stent suprayacente, y existe el riesgo de migración de la SG. Este procedimiento híbrido requiere un alto nivel de habilidad por parte del cirujano cardíaco, que no solo debe dominar las técnicas quirúrgicas abiertas, sino también tener habilidades endovasculares avanzadas.
Al asegurar que la zona de anclaje sea lo suficientemente larga, el uso de un stent superpuesto puede minimizar el número de pasos del procedimiento17. El diseño del stent superpuesto se puede adaptar a las características de la lesión del paciente18. Por ejemplo, si las tres ramas del arco supraaórtico están muy espaciadas, se pueden seleccionar ventanas dobles o triples para mantener la estabilidad del stent. Cuando las ramas supraaórticas del arco están comprometidas, como en el caso de una arteria infraclavicular recortada, se puede utilizar la fenestración in vitro combinada con la fenestración in situ para implantar un stent de rama en el vaso, reduciendo así el riesgo de endofuga. Este abordaje puede ayudar a garantizar la estabilidad del stent, como se ha demostrado en este caso.
La cirugía híbrida es factible, pero se necesitan estudios prospectivos futuros para validar este enfoque. La técnica descrita, en combinación con mediciones adecuadas de CTA y una localización precisa de la ruptura, puede ofrecer una alternativa valiosa tanto a la cirugía abierta tradicional como a los procedimientos híbridos clásicos. Se necesitan más estudios para comparar los resultados a corto y largo plazo de este procedimiento híbrido con los de la cirugía abierta y la cirugía híbrida clásica.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores no tienen agradecimientos.
Materiales
| Name | Company | Catalog Number | Comments |
| Adjustable bend | Lifetech | 106938370117414.00 | The Lifetech Adjustable Bend is constructed from high-quality, biocompatible materials, ensuring both flexibility and durability. The outer layer is typically composed of a polyurethane or similar material that is resistant to kinking, while the inner components include a nickel-titanium alloy (nitinol), known for its superelastic properties, which allow the catheter to return to its original shape after bending to improve the navigability and adaptability of endovascular procedures in challenging vascular anatomies. |
| Artificial vascular graft | Terumo | 734006 | The artificial vascular graft used in this study is made from expanded polytetrafluoroethylene (ePTFE), a biocompatible synthetic material used in vascular surgeries. |
| Balloon catheter | Boston Scientific | H74939171060410 | The Boston Scientific B-Balloon Catheter is a highly advanced, precision-engineered device designed for use in percutaneous transluminal angioplasty (PTA) procedures, particularly in vascular interventions. Its key feature is the balloon catheter technology, which allows for the effective dilation of stenotic lesions in both peripheral and coronary arteries. |
| Guidewire | Cook Medical | G14544 | The Cook Guidewire is a high-performance medical device used to navigate and guide catheters, balloons, and other devices in interventional procedures. It is made from durable materials such as stainless steel and nickel-titanium alloy and is available in a range of sizes and designs tailored to specific clinical needs. The guidewire features a flexible, torqueable, and pushable structure that allows precise navigation through challenging anatomical pathways. |
| Mechanical valve | Medtronic | A7700 | The mechanical heart valve is a widely used prosthetic device designed for the replacement of damaged or diseased heart valves and is particularly suitable for younger patients who require a long-lasting solution for valve replacement, with a proven clinical track record of over 20 years of durability. |
| Pigtail catheter | Cook Medical | G11916 | The Cook Pigtail Catheter is constructed from radiopaque materials, allowing for clear visualization under fluoroscopy,and a versatile, reliable device that enhances the effectiveness of various diagnostic and therapeutic interventions. Its flexible, radiopaque design and pigtail shape provide stability and ease of navigation, making it a valuable tool for clinicians performing cardiac and vascular procedures. |
| Stent-graft | Lifetech | (01)06938370139126 | The Lifetech Stent-Graft is a highly effective and reliable solution for the endovascular treatment of a variety of vascular conditions, particularly aortic dissection.It has a discontinuous, non-radiopaque metal strip on the back.Its hybrid design, incorporating a self-expanding nitinol stent with a durable, biocompatible graft, provides both structural support and sealing, offering significant advantages over traditional open surgery in terms of patient recovery and procedural risk. |
| Stent-graft | Medtronic | VAMF3232C200TE | The Medtronic Stent-Graft represents a significant advancement in the field of endovascular surgery, offering a safe and effective alternative to open surgical repair for patients with complex vascular pathologies such as aortic dissection. The combination of a self-expanding nitinol stent with a durable, biocompatible graft provides optimal sealing and long-term durability. |
| Viabahn | Gore | VBHR080202W | The Gore Viabahn Stent-Graft is composed of a stainless steel or nitinol stent covered by a ePTFE (expanded polytetrafluoroethylene) graft.The Viabahn combines the mechanical support of a self-expanding stent with the sealing capabilities of a biocompatible graft, providing a durable, minimally invasive solution to treat complex vascular lesions. |
Referencias
- Zhu, Y., et al. Type A aortic dissection-experience over 5 decades: JACC historical breakthroughs in perspective. J Am Coll Cardiol. 76 (14), 1703-1713 (2020).
- Kallenbach, K., et al. Treatment of the aortic root in acute aortic dissection type A: insights from the German registry for acute aortic dissection type A. Eur J Cardiothorac Surg. , ezac261 (2022).
- Hagan, P. G., et al. The international registry of acute aortic dissection (IRAD): new insights into an old disease. JAMA. 283 (7), 897-903 (2000).
- Mousavizadeh, M., et al. Hypothermic circulatory arrest time affects neurological outcomes of frozen elephant trunk for acute type A aortic dissection: A systematic review and meta-analysis. J Card Surg. 36 (9), 3337-3351 (2021).
- Pupovac, S. S., et al. Moderate versus deep hypothermia in type A acute aortic dissection repair: Insights from the international registry of acute aortic dissection. Ann Thorac Surg. 112 (6), 1893-1899 (2021).
- National Society of Vascular Surgery, China. Chinese expert consensus on hybrid technique on treating thoracic aortic pathologies involving the aortic arch. Chinese Circ J. 35 (2), 124-130 (2020).
- National Committee of Experts on Cardiovascular Diseases. The Chinese expert consensus on hybridization techniques for treatment of aortic diseases involving the arch. Chinese J Circ. 35 (2), 124-130 (2020).
- Zhang, L., et al. Hybrid and frozen elephant trunk for total arch replacement in DeBakey type I dissection. J Thorac Cardiovasc Surg. 158 (5), 1285-1292 (2019).
- Liu, X., et al. Hybrid total arch replacement via ministernotomy for Stanford type A aortic dissection. Front Cardiovasc Med. 10, 1231905 (2023).
- Liu, Y., et al. Early outcomes of hybrid type II arch repair versus total arch replacement with frozen elephant trunk in acute DeBakey type I aortic dissection: a propensity score-matched analysis. Interact Cardiovasc Thorac Surg. 31 (4), 565-572 (2020).
- Liu, S., et al. Midterm outcomes of one-stage hybrid aortic arch repair for stanford type A aortic dissection: A single center's experience. Semin Thorac Cardiovasc Surg. 35 (2), 311-321 (2023).
- World Medical Association. World Medical Association Declaration of Helsinki: ethical principles for medical research involving human subjects. JAMA. 310 (20), 2191-2194 (2013).
- Dai, L., et al. Safety and effectiveness of the sutureless integrated stented graft prosthesis in an animal model. Heliyon. 10 (9), e30323 (2024).
- Sirota, D. A., et al. Hybrid technologies for reconstruction of proximal aortic dissection. Sovrem Tekhnologii Med. 15 (3), 42-51 (2023).
- Jensen, C. W., Chen, E. P. Management of brain malperfusion in acute type A aortic dissection. Asian Cardiovasc Thorac Ann. 30 (3), 364-370 (2022).
- Gaul, C., Dietrich, W., Erbguth, F. J. Neurological symptoms in aortic dissection: a challenge for neurologists. Cerebrovasc Dis. 26 (1), 1-8 (2008).
- Kuzniar, M. K., Wanhainen, A., Tegler, G., Mani, K. Endovascular treatment of chronic aortic dissection with fenestrated and branched stent grafts. J Vasc Surg. 73 (5), 1573-1582 (2021).
- Tenorio, E. R., et al. Fenestrated and branched aortic research Consortium investigators. Outcomes of endovascular repair of chronic postdissection compared with degenerative thoracoabdominal aortic aneurysms using fenestrated-branched stent grafts. J Vasc Surg. 72 (3), 822-836.e9 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados