Retirada de Sangue I
Fonte: Kay Stewart, RVT, RLATG, CMAR; Valerie A. Schroeder, RVT, RLATG. Universidade de Notre Dame, IN
A coleta de sangue é um requisito comum para estudos de pesquisa que envolvem ratos e ratos. O método de retirada de sangue em camundongos e ratos depende do volume de sangue necessário, da frequência da amostragem, do estado de saúde do animal a ser sangrado e do nível de habilidade do técnico. 1 Todos os métodos discutidos-retro-orbital sinus sangram, sangramentos iniciais de corte de cauda e sangramentos intracardiac - requerem o uso de uma anestesia geral.
Antes do procedimento de sangramento, o tipo de amostra necessária deve ser determinado. Procedimentos experimentais podem exigir sangue inteiro, plasma ou soro. Para o sangue inteiro, um anticoagulante deve ser adicionado à amostra. O plasma, que contém fibrinogênio e outros fatores de coagulação quando separados dos glóbulos vermelhos, pode ser extraído de uma amostra anticoagulada. O soro é obtido através da coleta de sangue sem um anticoagulante. O soro resultará da centrifugação da amostra uma vez que um coágulo tenha se formado. Como a amostra coagula, o soro não conterá fibrinogênio ou outros fatores de coagulação. Tanto o plasma quanto o soro são obtidos através do uso de uma centrífuga a 2200-2500 RPM por um mínimo de 15 minutos.
Para uma amostra que deve produzir sangue inteiro ou plasma, deve-se usar um anticoagulante apropriado. Anticoagulantes comumente usados para animais de laboratório são heparina, citrato de sódio e ácido tetraáctico de etilenodiamina (EDTA); seleção da qual é baseada em necessidades de pesquisa. Sequester-uma forma líquida de EDTA, heparina e citrato de sódio pode ser carregado diretamente na seringa para revestir as superfícies. Isso permite o contato do anticoagulante diretamente à medida que o sangue é extraído, auxiliando na prevenção da coagulação. Como o sangue de rato coagula mais rápido do que a maioria do sangue mamífero, é essencial que a razão correta de anticoagulante para sangue seja usada para coleta de sangue.
A seleção da agulha é baseada no tamanho do animal e no local da venipunctura. Em geral, quanto maior o furo da agulha, mais rapidamente a amostra pode ser coletada. Menos danos às células sanguíneas é outro benefício para agulhas maiores. No entanto, a principal desvantagem para agulhas de grande porte é o dano potencial ao vaso. Em camundongos e ratos, as opções de tamanho variam de agulhas de calibre 20-29 que têm 0,5-1,5 polegadas de comprimento. Se uma agulha é muito longa, não só é estranho usar, mas ter o espaço extra na agulha pode resultar em coagulação. O tamanho adequado da agulha está listado para cada método na seção de procedimentos.
O tamanho da amostra necessária também deve ser predeterminado. Devido ao pequeno tamanho do rato ou rato, a quantidade máxima de coleta de sangue deve ser calculada para um sangramento de sobrevivência. Um rato médio pesando 25 gramas tem um volume sanguíneo total de 1,8 ml; o rato médio pesando 250 gramas tem um volume sanguíneo total de 16 ml. Para uma única amostra de sangue em um rato ou rato sem substituição de fluido, o volume máximo de sangue que pode ser removido com segurança é de 10% do volume sanguíneo total, ou 7,7-8 μl/g. Assim, para um rato médio, 10% do seu volume sanguíneo é de 193-200 μl. Para um rato médio de 250 gramas, isso equivale a 1,9-2,0 ml. Estudos mostraram que remover mais de 15% do volume sanguíneo pode causar choque hipovolêmico. 1,2 No entanto, com a substituição do fluido, até 15% do volume total do sangue ou 12 μl/g-podem ser removidos. Para um mouse de 25 gramas, isso equivale a 300 μl; para um rato de 250 gramas, é equivalente a 3 ml. Para a substituição do fluido, os fluidos devem ser aquecidos e dados subcutâneamente.
Se for necessário colher várias amostras, o volume sanguíneo extraído é reduzido. O volume máximo de sangue que pode ser extraído por semana não é superior a 7,5% do volume sanguíneo total, ou 6 μl/g. Para um mouse de 25 gramas, isso equivale a 145-150 μl por semana. Para um rato de 250 gramas, isso equivale a 1,45-1,50 ml por semana. Se a amostragem ocorrer a cada 2 semanas, até 10% do volume sanguíneo total (8 μl/g) poderá ser sorteado. Isso equivale a 200 μl a cada 2 semanas para um rato médio, e até 2,00 ml a cada 2 semanas para um rato de 250 gramas. Um estudo, realizado em ratos com o peso médio de 250 gramas, revelou que quando os volumes sanguíneos de 15-20% foram removidos, levou mais de 29 dias para que os níveis sanguíneos se normalizassem. 1,2 Para a coleta de sangue repetida, a substituição do fluido não permite um maior volume sanguíneo ou coleta de sangue mais frequente, pois substitui apenas o volume. O animal precisará de tempo para repor as células sanguíneas.
O uso do plexo retro-orbital tem sido uma prática comum no passado. No entanto, muitas preocupações sobre a humanidade desse procedimento surgiram. Durante o procedimento, o movimento excessivo do tubo hematócrito uma vez colocado no canthus medial do olho pode causar danos aos tecidos circundantes, resultando em inchaço das pálpebras e/ou membranas conjuntivistas. Os tecidos inchados podem fazer com que o globo ocular se projeta o suficiente para que o fechamento da pálpebra seja impedido, resultando potencialmente em secagem e danos na córnea. Dor do inchaço pode desencadear arranhões e automutilação que resulta em enucleação do olho. A colocação inadequada do tubo hematócrito durante uma hemorragia retro-orbital pode cortar o nervo óptico, resultando em cegueira. Se o tubo hematócrito for avançado em um ângulo impróprio, o olho pode ser forçado a sair da órbita, permitindo que as pálpebras caiam atrás do globo ocular. Se isso ocorrer, é muito difícil substituir corretamente o olho na tomada. Outras questões que podem surgir incluem fratura dos frágeis ossos da órbita, penetração do globo ocular que resulta na perda de humor vítreo, ou a formação de um hematoma atrás do olho que pode resultar em dor extrema devido à pressão no olho e estruturas circundantes. Apesar de todas essas preocupações, se um técnico qualificado realiza o procedimento e o animal é totalmente anestesiado com um anestésico geral, como a anestesia ininhante isoflurane, o sangramento retro-orbital tem se mostrado um método eficaz de coleta de sangue em roedores.
A estrutura anatômica da área orbital é diferente entre o rato e o rato. O rato tem o sinuso retro-orbital- uma coleção de vasos que criam um seio na área orbital. Na órbita do olho de rato, há um plexo de vasos que fluem atrás desse olho; no entanto, eles não formam um seio, como no rato. Consequentemente, é mais fácil realizar este procedimento em camundongos. Para a coleta de amostragem repetida através do plexo retro-orbital, é necessário um mínimo de 10 dias entre os sangramentos para permitir que os tecidos da área se curem. Embora a anestesia geral seja recomendada, o procedimento pode ser realizado em camundongos sem anestesia geral se um anestésico oftalmológico tópico, como proparaca ou tetracaína, for aplicado antes do procedimento. Como os ratos não têm o seio retro-orbital, e como suas membranas ao redor da órbita são muito mais fortes, é obrigatório anestesiar-los para este procedimento.
Amostras seriais de um pequeno volume podem ser obtidas usando um método de clipe de cauda. A amputação inicial da cauda deve ser limitada a uma ponta traseira, aproximadamente 0,5-1,0 mm de comprimento em camundongos e 2,0 mm em ratos. 1 O procedimento de corte de cauda para coleta de sangue permite coletas em série interrompendo a cicatriz ou coágulo do corte original na extremidade da cauda. Geralmente, não é necessária amputação adicional da ponta da cauda. Os volumes de sangue coletados variam de 20-100 μL para camundongos e 75-150 μL para ratos. A quantidade coletada é variável entre os animais e pode ser influenciada pela idade, estado de saúde e peso.
A amostra coletada de um corte de cauda pode conter sangue arterial e venoso, juntamente com contaminação do produto tecidual. A qualidade da amostra diminui se a cauda for acariciada ou "ordenhada" para obter mais sangue. Para aumentar o fluxo sanguíneo, a cauda pode ser aquecida com compressas quentes, uma lâmpada de calor ou submersão em água morna. A pressão deve ser aplicada na ponta da cauda para hemostasia, e os animais devem ser verificados a cada 5-10 minutos para garantir que a hemostasia tenha sido alcançada. A hemostasia é frequentemente retardada com amostragem repetida. Um pó esticado pode ser usado para hemostasia. Para a amputação inicial, recomenda-se anestesia (geral ou local). O sangramento subsequente não deve exigir anestesia, especialmente porque os animais se habituam ao procedimento. A anestesia causará uma queda na pressão arterial, dificultando a coleta de sangue com essa técnica.
Uma alternativa para um corte de cauda é o corte do vaso de cauda. Este procedimento é facilmente realizado em camundongos e ratos. No entanto, como com o corte da cauda, as amostras podem estar contaminadas com produtos tecidos, especialmente no camundongo. Para ratos, uma agulha hipodérmica é inserida no vaso, e o sangue é coletado do centro da agulha. Um estudo demonstrou o uso de um torniquete colocado acima do local de punção da agulha para auxiliar na coleta de sangue. 3 Uma seringa não é usada para tirar o sangue do vaso, pois a pressão criada a partir da seringa vai colapsar o vaso. Este método também pode ser usado para amostragem serial, pois um coágulo pode ser removido para fazer com que o local sangre novamente. Assim como nos cortes de cauda, é imprescindível garantir a hemostasia aplicando pressão no local e rechecando o animal a cada 5-10 minutos.
Muitas vezes, os estudos requerem uma amostra de sangue não-sutaracival, grande que é coletada através de exsanguinação através de um sangramento intracardiac ou da veia cava caudal. 4 Aproximadamente metade do volume sanguíneo total pode ser coletado de um rato ou rato por punção cardíaca. Isso equivale a 40 μl/g ou aproximadamente 1 ml para um mouse médio de 25 gramas. Um rato de 250 gramas produziria aproximadamente 10 ml de sangue. O animal deve ser anestesiado para exsanguinação. A anestesia inalante ou narcoseco2 pode ser usada por um técnico proficiente; anestesia injetável também pode ser usada. No entanto, pode haver uma diminuição da pressão arterial e da circulação, o que pode diminuir a quantidade de sangue coletada.
O método caudal vena cava exige que o animal seja profundamente anestesiado para expor cirurgicamente o vaso. A narcose co2 não é suficiente, pois o coração deve estar batendo e o animal respirando durante a retirada de sangue. Durante o procedimento, a retirada muito rápida do sangue pode fazer com que o vaso entre em colapso no chanfrado da seringa, ocluindo a abertura e impedindo a coleta de sangue. Além disso, as paredes do vaso são finas e, portanto, o movimento da mão e da agulha deve ser evitado para evitar ruptura ou vazamento de sangue do local de entrada da agulha. Como a agulha não está passando pela pele, este método resulta na coleta de uma amostra estéril. Métodos aditivos de eutanásia devem ser empregados para garantir que o animal não se recupere da anestesia. Este método é frequentemente seguido por perfusão cardíaca ou aórtica.
O método intracardiac pode ser realizado tanto com o animal contido manualmente uma vez que é anestesiado (método fechado), ou o coração pode ser exposto cirurgicamente de acordo com o protocolo para o método de coleta de sangue vena cava caudal (método aberto). Para o método fechado, os marcos para colocação da agulha são o sulco formado pela caixa torácica no processo xifoide, no lado esquerdo do animal.
1. Sangramento retro-orbital
- Equipamento
- Prepare um frasco de sino, ou câmara de indução anestésico, para administrar um gás anestésico como isoflurano. Ao usar um frasco de sino, é imprescindível que o anestésico líquido não entre em contato com o animal, para evitar a absorção através da pele. Uma plataforma com pequenos buracos pode ser usada.
- São preferidos tubos de microhematocrito que possuem 50-75 microliters. Os tubos embrulhados mylar são menos propensos a quebrar entre os dedos do operador e devem ser considerados como uma medida de segurança.
- Várias espessuras de papel toalha, ou outros materiais isolantes, são colocadas na superfície de trabalho para manter o calor corporal do animal durante o procedimento.
- Preparação e posicionamento do animal
- O animal é anestesiado com um anestésico de inalação, como isoflurano, em um frasco de sino ou câmara de indução de anestesia a gás, para efeito.
- Uma vez que o animal é totalmente anestesiado, ele é removido e colocado em recumedência lateral.
- O olho é salientes colocando um dedo na parte superior da cabeça e ao longo da mandíbula, e puxando a pele para trás e para baixo.
- Evite aplicar pressão na traqueia, pois isso pode entrar em colapso ou ocluir as vias aéreas causando a morte por asfixia.
- Retirada de sangue
- O microhematocrit é colocado no canthus medial do olho e direcionado caudally a um ângulo de 30-45° do plano do nariz.
- Aplique pressão enquanto gira suavemente o tubo hematócrito. Isso cortará as membranas conjuntivistas e romperá o plexo ocular.
- O sangue fluirá para o tubo hematócrito por ação capilar.
- Evite empurrar tão fundo que você atingiu o osso na parte de trás da cavidade ocular.
- Uma vez que o sangue começa a fluir, mantenha a pressão para manter o olho salientes.
- Para coletar vários tubos de sangue, não é necessário colocar o próximo tubo no plexo ocular, pois o sangue continuará a fluir e pode ser coletado como vem do canthus medial.
- Para parar de sangrar, solte a pele e deixe o olho voltar à posição normal. Aplique pressão na órbita para garantir hemostasia.
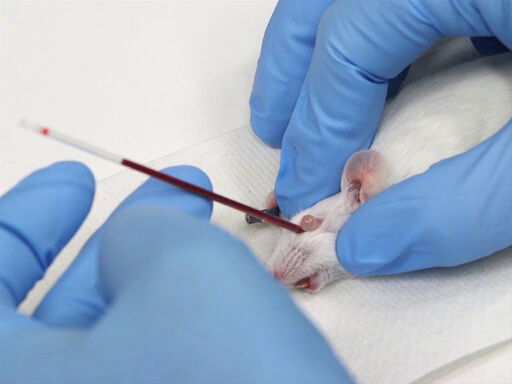
Figura 1. Retirada de sangue orbital retrô em camundongos.
2. Procedimentos de sangramento na cauda: corte de cauda e corte de cauda
- Equipamento
- Uma lâmina de bisturi estéril, de preferência uma lâmina número 11 ou uma lâmina de barbear de um lado único, é usada para fazer a amputação inicial para o método de corte de cauda. A tesoura não deve ser utilizada porque o corte feito por tesoura é esmagamento, promovendo assim a coagulação e a redução do fluxo sanguíneo. Para o procedimento de corte da cauda, uma lâmina de bisturi número 11 ou 15 é usada para fazer o corte.
- Um tubo de contenção que permite o acesso à cauda do mouse é preparado.
- Toalhas de papel absorvente ou gaze são usadas como substrato para a realização do corte de cauda.
- Também são necessários tubos de coleta ou tubos hematócritos.
- O pó esticado deve estar disponível para auxiliar na hemostasia.
- Restrição
- O animal é colocado no tubo de tal forma que a cauda é acessível. Para os contê-inérculos do tipo Broome, o animal é puxado garupa primeiro para dentro do tubo. Para outros tubos, o animal é colocado de cabeça.
- Os animais são fixados no tubo de tal forma que não podem se virar ou retirar a cauda.
- Alguns camundongos permitirão a coleta de cauda e sangue com mínima contenção manual se eles forem autorizados a pegar uma superfície áspera.
- Alguns ratos exigirão anestesia por inalação para este método de coleta de sangue.
- Retirada de sangue
- A cauda é limpa com água morna para remover detritos e causar leve vasodilatação. NÃO use água quente.
- Para o corte da cauda, a cauda é estendida, e a extremidade da cauda (0,5-1 mm para ratos e até 2 mm para ratos) é cortada com a lâmina do bisturi.
- Para o corte da cauda, a cauda é estendida, e um corte é feito com a lâmina do bisturi aproximadamente 2/3 a distância da garupa, diretamente sobre a veia traseira lateral.
- A cauda pode ser acariciada de garupa para ponta para incentivar o fluxo sanguíneo; no entanto, isso diminuirá a qualidade da amostra.
- O sangue é coletado da ponta ou corte usando tubos hematócritos ou permitido pingar em um frasco de coleta.
3. Coleta de sangue cardíaco
- Equipamento
- Para um rato, é preferível uma seringa de 3 cc com uma agulha calibre 22-25 x 1". Seringas menores não têm a mesma pressão nas costas e podem dificultar a retirada de sangue. Agulhas menores que 25 medidores restringem o fluxo de sangue, levando ao aumento da coagulação e danos às células sanguíneas. Agulhas menores que 1" podem não atingir o nível do coração quando se aproximam do diafragma.
- Para um rato, é preferível uma seringa de 10-12 cc com uma agulha de calibre x 1,5". Dependendo do tamanho do rato, uma seringa menor pode não conter todo o volume sanguíneo a ser coletado, e assim a seringa teria que ser alterada durante o procedimento. Agulhas menores que 20 medidores restringem o fluxo do sangue, levando ao aumento da coagulação. Agulhas menores que 1,5" podem não atingir o nível do coração quando se aproximam do diafragma.
- Um tubo de coleta de sangue de tamanho suficiente é usado para manter o sangue coletado.
- Restrição
- A contenção adequada é essencial para o sucesso deste método. O animal é segurado pelo scruff com o corpo pendurado verticalmente. É importante que o corpo seja reto para evitar a deflexão do coração ou uma torção do peito.
- Uma posição alternativa é a recumbência dorsal ao colocar a agulha entre as costelas do lado esquerdo do animal. Isso é especialmente útil para ratos muito grandes ou quando vários animais devem ser sangrados.
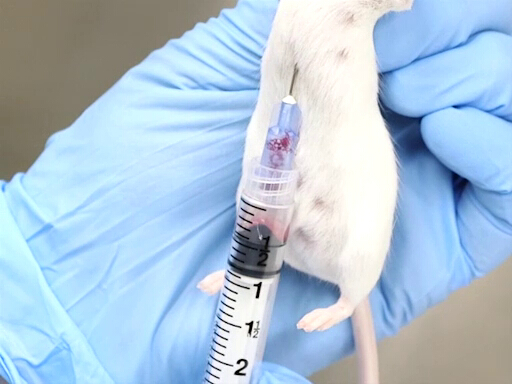
Figura 2. Retirada de sangue cardíaco com rato mantido verticalmente.
- Retirada de sangue
- A abordagem do aspecto posterior, pontuando o diafragma é mais facilmente realizada quando o rato ou rato é mantido verticalmente pelo scruff.
- A agulha é avançada no entalhe apenas à esquerda do xiphoide do animal.
- A agulha deve ser paralela à coluna vertebral e colocada logo abaixo das costelas.
- O coração está localizado aproximadamente ao nível do cotovelo.
- Coloque a agulha, bisbida, no peito, e perfure o coração.
- Aplique uma leve pressão nas costas com a seringa. Se a agulha estiver no coração, o sangue fluirá para dentro da seringa.
- Espere até que o sangue tenha enchido a seringa antes de adicionar pressão adicional nas costas na seringa.
- A abordagem lateral do lado esquerdo do animal requer o posicionamento do animal na recumbência dorsal.
- O ponto de entrada é medido contra o ponto do cotovelo na parede do peito. O coração está localizado aproximadamente ao nível do cotovelo.
- A agulha é inserida perpendicular ao plano da mesa em um ponto no meio da parede do peito como medido dorsoventrally.
- Coloque a agulha, bisbida, no peito, e perfure o coração.
- Aplique uma leve pressão nas costas com a seringa. Se a agulha estiver no coração, o sangue fluirá para dentro da seringa.
- Espere até que o sangue tenha enchido a seringa antes de adicionar pressão adicional na seringa.
- A abordagem do aspecto posterior, pontuando o diafragma é mais facilmente realizada quando o rato ou rato é mantido verticalmente pelo scruff.
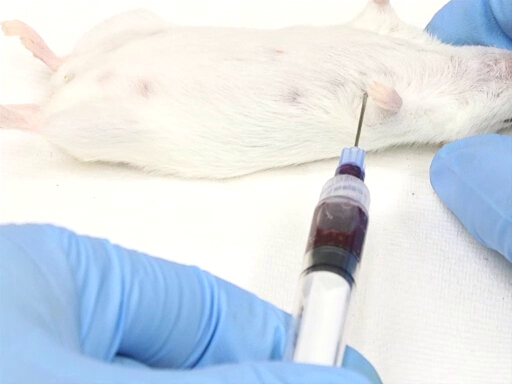
Figura 3. Retirada de sangue cardíaco com rato em posição de recumbência dorsal.
- Dicas técnicas
- O coração normal está situado com o ápice apontando para a esquerda. Em raros casos, o coração pode ser invertido, resultando em dificuldade em perfurar o coração.
- A pressão excessiva nas costas na seringa pode colapsar o coração, ocluindo o bisel da agulha e impedindo o fluxo sanguíneo para dentro da seringa.
- Aplicar pressão traseira e liberá-la repetidamente iniciará a coagulação na seringa.
- Aplicar suavemente pressão no fígado pode forçar o volume sanguíneo adicional para o sistema circulatório, tornando-o disponível para retirada.
4. Retirada posterior de sangue vena cava
- Equipamento
- Uma seringa de tuberculose com uma agulha calibre 25-29 é usada para coleta de sangue no camundongo. Para ratos, é necessária uma seringa de 10-12 cc com uma agulha calibre 22-25 x 1".
- Uma plataforma cirúrgica, bandeja de dissecção ou outra superfície para proteger o animal são necessárias, juntamente com laços, fita ou pinos para afixar os membros em posição.
- A anestesia injetável ou a anestesia da inalação é necessária. Se usar anestesia de inalação, é desejável que o anestésico seja entregue através de um vaporizador de precisão com um cone de nariz. O comprimento do procedimento é tal que o uso de uma câmara de indução sem entrega adicional de gás anestésico não fornecerá tempo suficiente para completar a retirada de sangue antes que o animal reaviva.
- São necessárias tesouras de íris para o rato, ou uma tesoura afiada para o rato, juntamente com pequenas fórceps atraumáticas do polegar e uma esponja de gaze de 2"x 2".
- Restrição
- Quando o animal é totalmente anestesiado, determinado por pinça do dedo do dedo ou beliscão da cauda, o animal é colocado em recumbência dorsal.
- Os membros são fixados na plataforma com fita ou pinos. Os membros devem ser estendidos para longe do corpo.
- Retirada
- A pele é levantada e um pequeno corte transverso é feito através da pele logo acima da pelve em fêmeas, ou logo acima do prepuce em machos.
- O ponto da tesoura é colocado no corte, e uma incisão midline é feita através da pele da pelve/prepuce para o xifoide.
- A pele é refletida lateralmente para cada lado. Dissecção contundente pode ser necessária para soltá-lo do músculo subjacente.
- O músculo é levantado, e um pequeno corte transverso é feito através do músculo logo acima do corte da pele.
- O ponto da tesoura é colocado no abdômen e uma incisão média é feita através do músculo para o xiphoide. Certifique-se de inclinar o ponto da tesoura para cima para evitar o corte de quaisquer órgãos.
- Corte transversalmente ao longo da curva das costelas de cada lado. Tenha cuidado extra para não perfurar o fígado.
- Mova suavemente os intestinos para a esquerda do animal para expor a veia cava posterior.
- Coloque uma almofada de gaze no fígado, e descanse o índice e o dedo médio no fígado.
- Por outro lado, insira a agulha, bivele para cima, na veia cava no meio do caminho entre a junção dos vasos renais e a bifurcação ilícíaca.
- Retire lentamente o sangue enquanto aplica pressão no fígado.
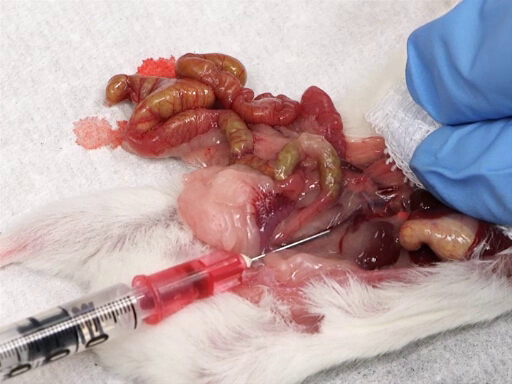
Figura 4. Retirada de sangue da veia cava posterior.
A coleta de sangue para ratos e ratos pode ser realizada com uma variedade de técnicas. Embora muitos fatores, como tamanho amostral, frequência de amostragem e o tamanho e idade do animal influenciem isso, o componente mais essencial é o nível de habilidade do técnico que realiza a coleta amostral. Para os métodos aqui descritos, o uso adequado de anestésicos também é crucial para amostras de qualidade e para o bem-estar dos animais.
- Guidelines for the survival bleeding of mice and rats. 2010.
- Diehl, K.H., Hull, R., Morton, D., Pfister, R., Rabemampianina, Y., Smith, D., Vidal, J.M., and van de Vorstenbosch, C. 2001. A good practical guide to the administration of substances and removal of blood, including routes and volumes. Journal of Applied Toxicology. 21. 15-23.
- Omaye, S.T., Skala, J.H., Gretz, M.D., Schaus, E.E., and Wade, C.E. 1987. Simple method for bleeding the unanaesthetized rat by tail venipuncture. Laboratory Animals. 21. 261-264.
- Adeghe, A.J-H. and Cohen, J. 1986. A better method for terminal bleeding of mice. Laboratory Animals. 20. 70-72.
Pular para...
Vídeos desta coleção:

Now Playing
Retirada de Sangue I
Lab Animal Research
170.7K Visualizações

Técnicas de manuseio e contenção de roedores
Lab Animal Research
173.2K Visualizações

Procedimentos de Cuidados Básicos
Lab Animal Research
27.6K Visualizações

Fundamentos da Reprodução e Desmame
Lab Animal Research
35.5K Visualizações

Identificação de roedores I
Lab Animal Research
54.4K Visualizações

Identificação de Roedores II
Lab Animal Research
25.5K Visualizações

Administração de Composto I
Lab Animal Research
99.9K Visualizações

Administração de Composto II
Lab Animal Research
34.6K Visualizações

Administração de Composto III
Lab Animal Research
31.2K Visualizações

Administração de Composto IV
Lab Animal Research
51.2K Visualizações

Retirada de Sangue II
Lab Animal Research
72.7K Visualizações

Indução e Manutenção da Anestesia
Lab Animal Research
50.0K Visualizações

Considerações para cirurgia de roedores
Lab Animal Research
22.3K Visualizações

Necropsia diagnóstica e coleta de tecidos
Lab Animal Research
57.8K Visualizações

Coleta de Tecido Estéril
Lab Animal Research
34.7K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados