L'équilibre entre un liquide et sa vapeur dépend de la température du système ; une augmentation de la température provoque une augmentation correspondante de la pression de vapeur de son liquide. L'équation de Clausius-Clapeyron donne la relation quantitative entre la pression de vapeur (P) d'une substance et sa température (T) ; elle prédit la vitesse à laquelle la pression de vapeur augmente par unité d'augmentation de la température.
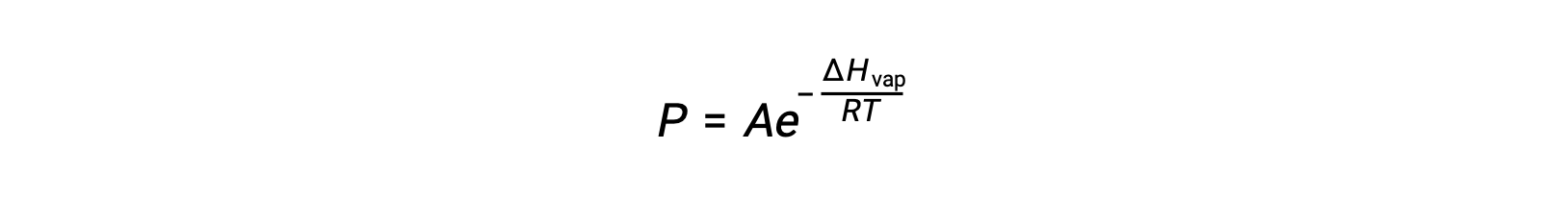
Où ΔHvap est l'enthalpie de vaporisation du liquide, R est la constante des gaz et A est une constante dont la valeur dépend de l'identité chimique de la substance. La température (T) doit être en Kelvin dans cette équation. Cependant, comme la relation entre la pression de vapeur et la température n'est pas linéaire, l'équation est souvent réorganisée sous forme logarithmique pour produire l'équation linéaire :
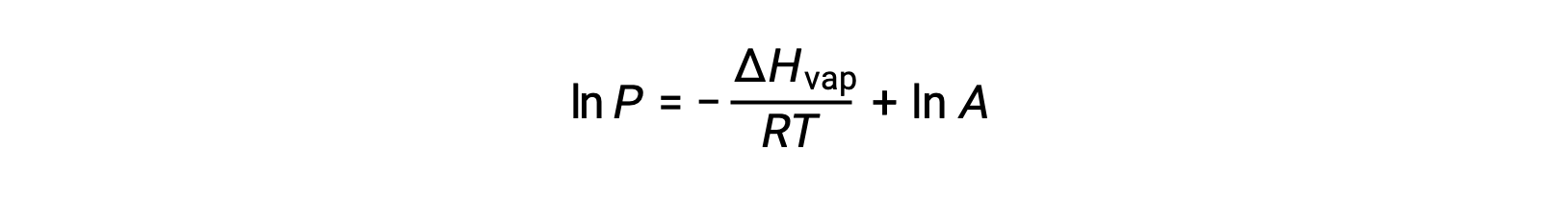
Pour tout liquide, si l’enthalpie de vaporisation et la pression de vapeur à une température particulière est connue, l’équation de Clausius-Clapeyron permet de déterminer la pression de vapeur du liquide à une température différente. Pour ce faire, l'équation linéaire peut être exprimée dans un format à deux points. Si à la température T1, la pression de vapeur est P1 et si à la température T2, la pression de vapeur est P2, les équations linéaires correspondantes sont :
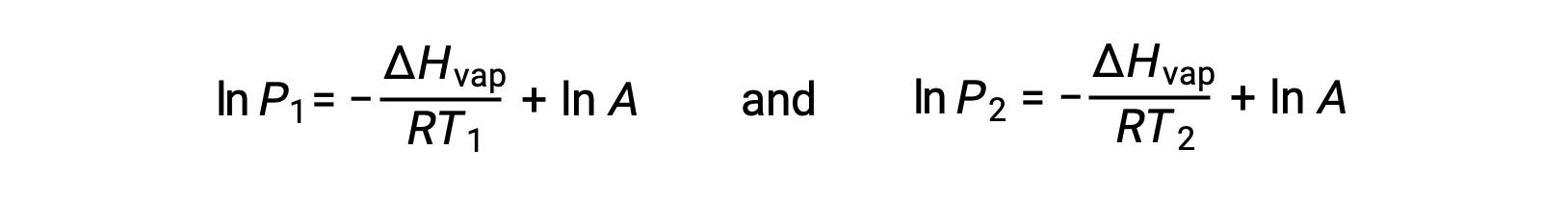
Puisque la constante, A, est la même, ces deux équations peuvent être réorganisées pour isoler ln A et les définir comme étant égales l'une à l'autre :
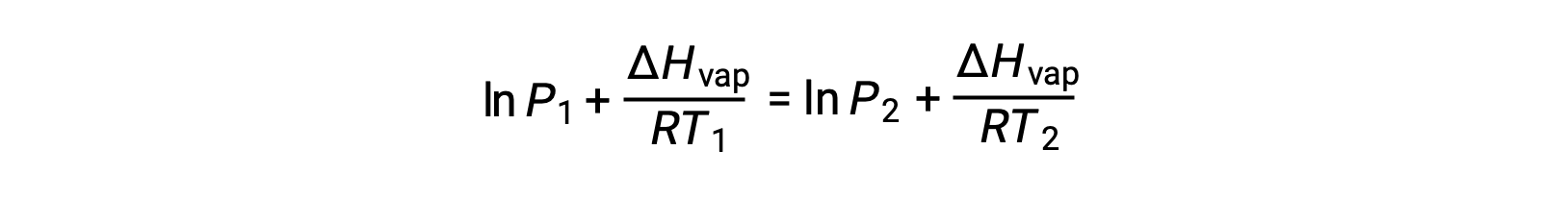
qui peuvent être combinées en :
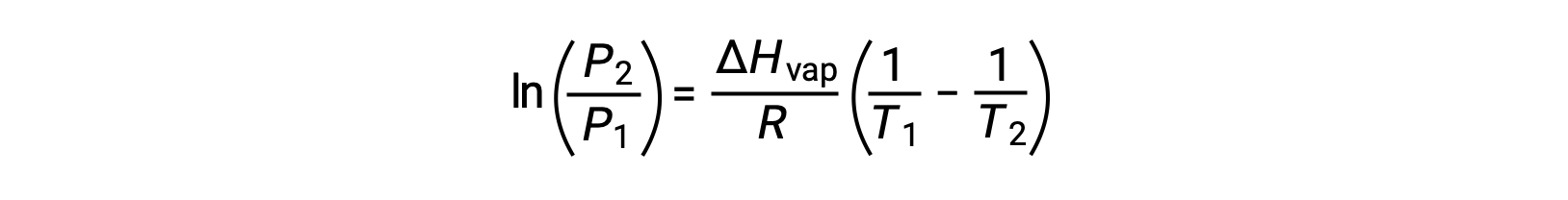
Ce texte est adapté de Openstax, Chimie 2e, Section 10.3 : Transitions de phases.
Du chapitre 11:

Now Playing
11.9 : Équation de Clausius-Clapeyron
Liquides, solides et forces intermoléculaires
54.4K Vues

11.1 : Comparaison moléculaire des gaz, liquides et solides
Liquides, solides et forces intermoléculaires
39.5K Vues

11.2 : Forces intermoléculaires vs intramoléculaires
Liquides, solides et forces intermoléculaires
83.3K Vues

11.3 : Forces intermoléculaires
Liquides, solides et forces intermoléculaires
54.6K Vues

11.4 : Comparaison des forces intermoléculaires : point de fusion, point d'ébullition et miscibilité
Liquides, solides et forces intermoléculaires
43.2K Vues

11.5 : Tension superficielle, capillarité et viscosité
Liquides, solides et forces intermoléculaires
27.0K Vues

11.6 : Changement d'état
Liquides, solides et forces intermoléculaires
18.3K Vues

11.7 : Changement d'état : vaporisation et condensation
Liquides, solides et forces intermoléculaires
16.7K Vues

11.8 : Pression de vapeur saturante
Liquides, solides et forces intermoléculaires
33.6K Vues

11.10 : Changement d'état : fusion et congélation
Liquides, solides et forces intermoléculaires
12.0K Vues

11.11 : Changement d'état : sublimation et condensation solide
Liquides, solides et forces intermoléculaires
16.4K Vues

11.12 : Courbes de température de changement d'état
Liquides, solides et forces intermoléculaires
21.7K Vues

11.13 : Diagrammes de phases
Liquides, solides et forces intermoléculaires
37.9K Vues

11.14 : Structures des solides
Liquides, solides et forces intermoléculaires
13.3K Vues

11.15 : Solides moléculaires et ioniques
Liquides, solides et forces intermoléculaires
16.2K Vues
See More