Par rapport à l'eau pure, la solubilité d'un composé ionique est moindre dans les solutions aqueuses contenant un ion commun (un autre ion produit également par dissolution du composé ionique). C'est un exemple d'un phénomène connu sous le nom d'effet d'ion commun, qui est une conséquence de la loi d'action de masse pouvant être expliquée en utilisant le principe de Le Châtelier. Considérons la dissolution de l'iodure d'argent :
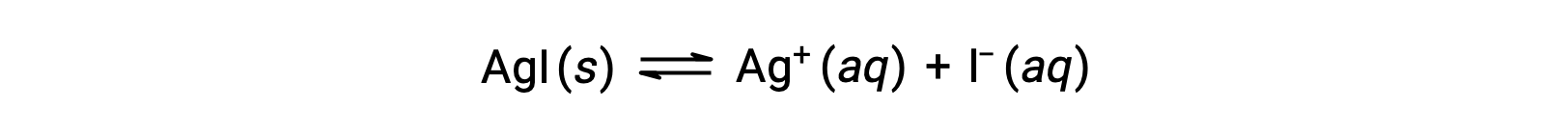
Cet équilibre de solubilité peut être déplacé par l'addition d'ions argent(I) ou iodure, ce qui entraîne la précipitation d'AgI et une diminution des concentrations d'Ag+ et d'I– dissous. Dans les solutions qui contiennent déjà l'un ou l'autre de ces ions, moins d'AgI peut être dissout que dans les solutions sans ces ions.
Cet effet peut également être expliqué en termes d'action des masses, tel que représenté dans l'expression du produit de solubilité :
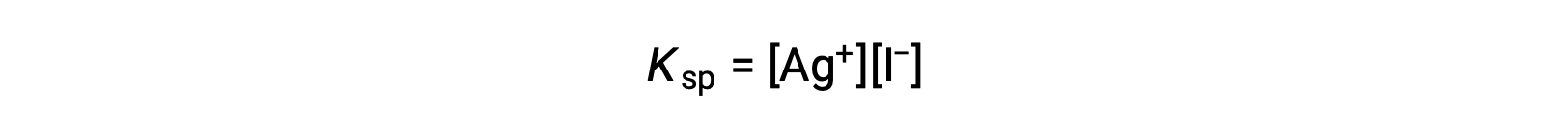
Le produit mathématique des molarités des ions argent(I) et iodure est constant dans un mélange en équilibre quelle que soit la source des ions, et donc une augmentation de la concentration d'un ion doit être équilibrée par une diminution proportionnelle de l'autre.
Effet d'ion commun sur la solubilité
L'ion commun influence la solubilité du composé dans une solution. Par exemple, Mg(OH)2 solide se dissocie en ions Mg2+ et OH− comme suit;
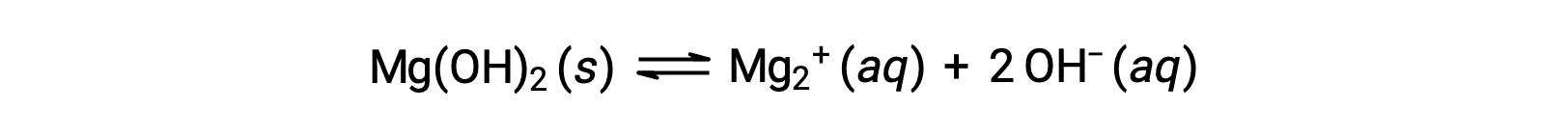
Si du MgCl2 est ajouté à une solution saturée de Mg(OH)2, la réaction se déplace vers la gauche pour soulager la contrainte produite par l'ion Mg2+ supplémentaire, conformément au principe de Le Châtelier. En termes quantitatifs, l'ajout de Mg2+ entraîne une augmentation du quotient de la réaction par rapport au produit de solubilité (Q > Kps), et du Mg(OH)2 se forme jusqu'à ce que le quotient de la réaction soit à nouveau égal à Kps. Au nouvel équilibre, [OH–] est inférieur et [Mg2+] est supérieur à celui de la solution de Mg(OH)2 dans l'eau pure.
Si KOH est ajouté à une solution saturée de Mg(OH)2, la réaction se déplace vers la gauche pour soulager la contrainte de l'ion OH– supplémentaire. Du Mg(OH)2 se forme jusqu'à ce que le quotient de la réaction soit à nouveau égal à Kps. Au nouvel équilibre, [OH–] est plus grand et [Mg2+] est moins élevé que dans la solution de Mg(OH)2 dans l'eau pure.
Ce texte est adapté de Openstax, Chimie 2e, Section 15.1 : Précipitation et dissolution.
Du chapitre 16:

Now Playing
16.1 : Effet d'ion commun
Réactions acido-basiques et produit de solubilité
40.7K Vues

16.2 : Solutions tampons
Réactions acido-basiques et produit de solubilité
163.1K Vues

16.3 : Équation de Henderson-Hasselbalch
Réactions acido-basiques et produit de solubilité
67.8K Vues

16.4 : Calcul des changements de pH dans une solution tampon
Réactions acido-basiques et produit de solubilité
52.3K Vues

16.5 : Efficacité d'un tampon
Réactions acido-basiques et produit de solubilité
48.3K Vues

16.6 : Calculs de titrage : acide fort - base forte
Réactions acido-basiques et produit de solubilité
28.8K Vues

16.7 : Calculs de titrage : acide faible - base forte
Réactions acido-basiques et produit de solubilité
43.6K Vues

16.8 : Indicateurs de pH
Réactions acido-basiques et produit de solubilité
47.6K Vues

16.9 : Titrage d'un polyacide
Réactions acido-basiques et produit de solubilité
95.5K Vues

16.10 : Équilibre de solubilité
Réactions acido-basiques et produit de solubilité
51.4K Vues

16.11 : Facteurs affectant la solubilité
Réactions acido-basiques et produit de solubilité
32.8K Vues

16.12 : Formation d'ions complexes
Réactions acido-basiques et produit de solubilité
23.0K Vues

16.13 : Précipitation d'ions
Réactions acido-basiques et produit de solubilité
27.3K Vues

16.14 : Analyse qualitative inorganique
Réactions acido-basiques et produit de solubilité
19.9K Vues

16.15 : Courbes de titrage acide-base
Réactions acido-basiques et produit de solubilité
125.8K Vues