Em comparação com a água pura, a solubilidade de um composto iónico é menor em soluções aquosas contendo um ião comum (um também produzido por dissolução do composto iónico). Este é um exemplo de um fenómeno conhecido como efeito de ião comum, que é uma consequência da lei de ação de massas que pode ser explicada utilizando o princípio de Le Châtelier. Considere a dissolução do iodeto de prata:
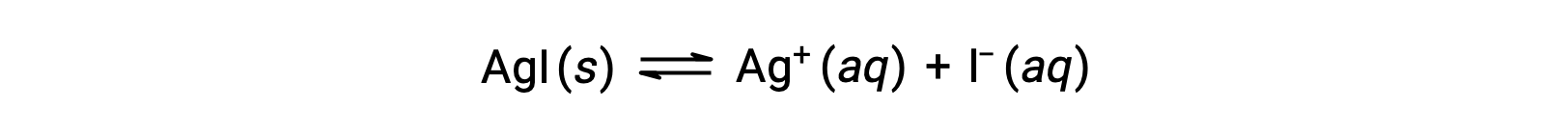
Este equilíbrio de solubilidade pode ser deslocado pela adição de iões de prata(I) ou iodeto, resultando na precipitação de AgI e na diminuição das concentrações de Ag+ e I– dissolvidos. Em soluções que já contêm qualquer destes iões, menos AgI pode ser dissolvido do que em soluções sem estes iões.
Este efeito pode também ser explicado em termos de ação de massas, tal como representado na expressão do produto de solubilidade:
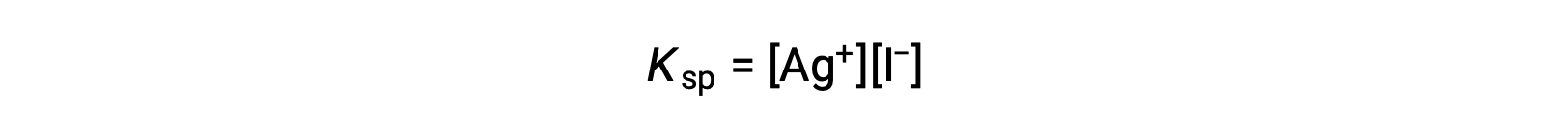
O produto matemático das molaridades dos iões de prata(I) e iodeto é constante em uma mistura de equilíbrio, independentemente da fonte dos iões, e assim um aumento na concentração de um ião deve ser equilibrado por uma diminuição proporcional no outro.
Efeito de Ião Comum na Solubilidade
O ião comum afeta a solubilidade do composto em uma solução. Por exemplo, Mg(OH)2 dissocia-se em iões Mg2+ e OH− da seguinte forma:
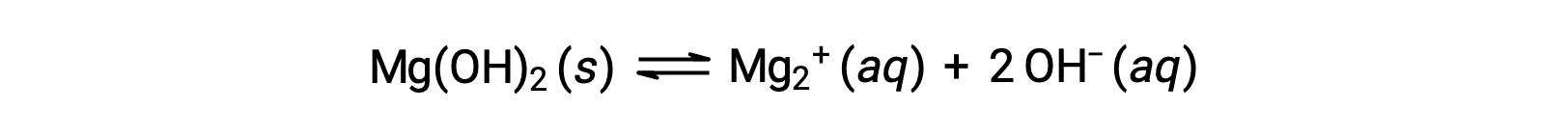
Se MgCl2 for adicionado a uma solução saturada de Mg(OH)2, a reação muda para a esquerda para aliviar o stress produzido pelo ião Mg2+ adicional, de acordo com o princípio de Le Châtelier. Em termos quantitativos, o Mg2+ adicionado faz com que o quociente de reação seja maior do que o produto de solubilidade (Q > Ksp), e forma-se Mg(OH)2 até que o quociente de reação seja novamente igual a Ksp. No novo equilíbrio, [OH–] é menor e [Mg2+] é maior do que na solução de Mg(OH)2 em água pura.
Se KOH for adicionado a uma solução saturada de Mg(OH)2, a reação muda para a esquerda para aliviar o stress do ião OH– adicional. Forma-se Mg(OH)2 até que o quociente de reação seja novamente igual a Ksp. No novo equilíbrio, [OH–] é maior e [Mg2+] é menor do que na solução de Mg(OH)2 em água pura.
Este texto é adaptado de Openstax, Chemistry 2e, Section 15.1: Precipitation and Dissolution.
Do Capítulo 16:

Now Playing
16.1 : Efeito de Íon Comum
Equilíbrio Ácido-Base e Solubilidade
40.7K Visualizações

16.2 : Tampões
Equilíbrio Ácido-Base e Solubilidade
163.1K Visualizações

16.3 : Equação de Henderson-Hasselbalch
Equilíbrio Ácido-Base e Solubilidade
67.8K Visualizações

16.4 : Cálculo de Alterações de pH em uma Solução Tampão
Equilíbrio Ácido-Base e Solubilidade
52.3K Visualizações

16.5 : Eficácia dos Tampões
Equilíbrio Ácido-Base e Solubilidade
48.3K Visualizações

16.6 : Cálculos de Titulação: Ácido Forte - Base Forte
Equilíbrio Ácido-Base e Solubilidade
28.8K Visualizações

16.7 : Cálculos de Titulação: Ácido Fraco - Base Forte
Equilíbrio Ácido-Base e Solubilidade
43.6K Visualizações

16.8 : Indicadores
Equilíbrio Ácido-Base e Solubilidade
47.6K Visualizações

16.9 : Titulação de um Ácido Poliprótico
Equilíbrio Ácido-Base e Solubilidade
95.5K Visualizações

16.10 : Equilíbrio de Solubilidade
Equilíbrio Ácido-Base e Solubilidade
51.4K Visualizações

16.11 : Fatores que Afetam a Solubilidade
Equilíbrio Ácido-Base e Solubilidade
32.8K Visualizações

16.12 : Formação de Íons Complexos
Equilíbrio Ácido-Base e Solubilidade
23.0K Visualizações

16.13 : Precipitação de Íons
Equilíbrio Ácido-Base e Solubilidade
27.3K Visualizações

16.14 : Análise Qualitativa
Equilíbrio Ácido-Base e Solubilidade
19.9K Visualizações

16.15 : Curvas de Titulação Ácido-Base
Equilíbrio Ácido-Base e Solubilidade
125.8K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados