Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
La moelle épinière électrophysiologie II: fabrication des électrodes extracellulaires d'aspiration
Dans cet article
Résumé
Une démonstration de la fabrication et l'utilisation d'une électrode extracellulaire aspiration utilisés pour mesurer des enregistrements électrophysiologiques des cordons de rongeur néonatal épinière In vitro
Résumé
Développement des circuits de neurones et la locomotion peut être étudiée à l'aide de la moelle épinière des rongeurs néonatale centrale générateur de pattern (CPG) de comportement. Nous démontrons une méthode pour fabriquer des électrodes d'aspiration qui sont utilisés pour examiner l'activité CPG, ou de la locomotion fictive, dans les cordons de rongeurs disséqué épinière. Les cordons de rongeurs épinière sont placés dans le liquide céphalorachidien artificiel et les racines ventrales sont entraînés dans l'électrode d'aspiration. L'électrode est construit en modifiant une électrode d'aspiration disponible commercialement. Un fil plus lourd argent est utilisé au lieu du fil standard donné par l'électrode disponibles commercialement. La pointe de verre sur l'électrode commercial est remplacé par un embout en plastique pour une durabilité accrue. Nous préparons la main électrodes dessinés et fabriqués à partir d'électrodes spécifiques tailles de tubes, ce qui permet la cohérence et la reproductibilité. Les données sont recueillies au moyen d'un amplificateur et un logiciel d'acquisition neurogram. Les enregistrements sont effectués sur une table de l'air intérieur d'une cage de Faraday pour éviter les interférences électriques et mécaniques, respectivement.
Protocole
Enregistrements électrophysiologiques de la moelle épinière isolée peut révéler des changements génétiques et développementales de neurones de circuits 1. Nous avons précédemment démontré une méthode de disséquer les cordons de souris néonatales vertébrale 2. Nous présentons ici une méthode pour préparer les électrodes d'aspiration utile dans l'enregistrement de locomotion fictive dans les régions isolées de la moelle épinière 3.
La pointe d'une électrode de tubes en plastique peuvent être tirées d'une pointe très fine à la main en utilisant une lampe à alcool à basse température 3-5. Le tube de plastique (PE90, Clay Adams Intramedic TM) est détenu sur la flamme pour adoucir le tube dans une forme malléable. Comme le tube commence à fondre et devient plus translucide, il est retiré de la source de chaleur et les extrémités sont doucement tiré à part. Le moment de retirer le tube de la flamme est important pour assurer le plastique ne s'effondre ou divisé en cours d'élaboration. La partie mince du tube est coupé avec une lame de rasoir en fonction du diamètre interne désirée, comme dicté par l'âge de l'échantillon ou le niveau segmentaire de la moelle. Pour plus de facilité de placer un joint torique sur le tuyau, une coupe de 45 ° est faite à l'extrémité la plus épaisse de la tubulure avec une lame de rasoir. Une bague et le joint torique sont installés sur la fin d'épaisseur pour fixer le bout de l'électrode sur le canon de l'électrode.
Pour permettre électrodes spécifiquement dimensionnés et éviter les difficultés de la main-conseils en tirant des électrodes, électrodes peuvent être construits en utilisant des tubes insérés dans une petite épais tubes (PE90). Les longueurs de la tubulure sont spécifiques aux exigences de la configuration d'enregistrement et sont variables. Nous présentons les mesures utilisées dans nos expériences 1-3,5. Une longueur de 1 cm de tube PTFE fines (Zeus, petites pièces) et une longueur de 10cm du tube PE90 sont coupés avec une lame de rasoir. Les extrémités du tube petits devraient être examinés pour s'assurer qu'ils ne sont pas écrasés ou fermé. Ils peuvent être ouverts à l'aide d'une broche d'insectes (Outils Fine Science). Une goutte de colle (JB Weld) est placée sur le milieu du tube PTFE. Le tube de PTFE et de l'adhésif sont aspirés dans le tuyau d'aspiration en utilisant PE90 bouche sur le tube PE90. Une coupe de 45 ° est faite à l'issue d'épaisseur du tube et un embout et joint torique sont attachés, comme précédent.
Le connecteur BNC virole et sont dévissés partir d'une électrode d'aspiration commerciales. Le connecteur BNC est trempé dans du xylène pendant une heure pour enlever le sceau de cire. Le connecteur est ensuite rincé à l'eau et séché.
Un port latérale inférieure inclinée doit être faite sur le côté du canon. Une tige de métal est chauffé à l'aide d'un brûleur Bunsen et pressé dans le trou existant du côté du baril à un angle faible. Une longueur de 15cm de 0,010 pouces de fil d'argent (AM Systems) est coupé et imbibé d'eau de javel pendant quinze minutes. Ceci est fait pour créer un revêtement de chlorure d'argent qui aide à 6 de la conduction du signal. Le fil est rincé à l'eau, séché, puis soudé sur le connecteur BNC. Le fil connecteur BNC et l'argent sont insérés dans le canon d'électrodes d'aspiration avec assez de place pour le connecteur BNC de rester sur le côté du canon. Tuyau d'aspiration est insérée dans le port du côté 2-3cm. Mastic silicone est injecté dans le cylindre d'environ 2-3cm. Le connecteur BNC est vissé dans le canon de l'électrode de pousser le mastic avant.
La pointe de l'électrode est désormais vissé dans la partie avant de l'électrode. Gaine thermorétractable peuvent également être ajoutés pour renforcer la ligne d'aspiration du côté bâbord.
Les électrodes sont montées sur micromanipulateurs qui sont attachés aux stands magnétique, et placé près de l'antenne d'enregistrement. BNC câbles coaxiaux sont attachés à un headstage qui est relié à un amplificateur. L'amplificateur est connecté à un adaptateur (Polyview) qui est connecté à une carte de l'analogique au numérique (National Instruments) dans un ordinateur PC avec le logiciel d'acquisition de données (Polyview).
Lors de l'enregistrement des données électrophysiologiques, il est nécessaire d'éliminer toutes les interférences extérieures. Le plat d'enregistrement, un amplificateur, et le stade de la tête sont placés sur une table de l'air intérieur d'une cage de Faraday pour éviter les interférences électriques et mécaniques, respectivement.
Les résultats représentatifs:
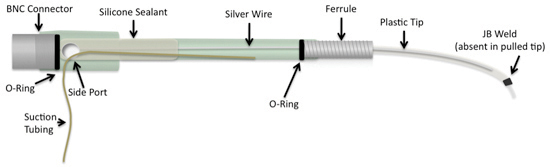
Figure 1. Une électrode d'aspiration disponibles dans le commerce peuvent être modifiés par l'ajout d'un fil de plus gros calibre d'argent et un bout de plastique qui est dessiné à la main sur une lampe à alcool, ou construits avec des tubes en plastique disponibles dans le commerce de formats spécifiques. En outre, l'étanchéité de paraffine est remplacé avec plus de mastic silicone calfeutrage durable.
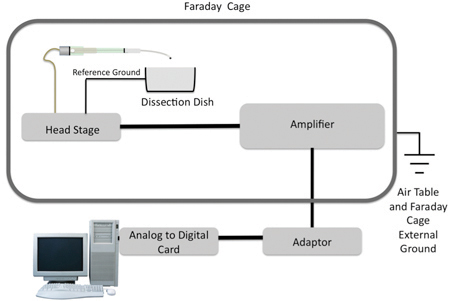
Figure 2. Un schéma de l'électrode d'aspiration par rapport à la table de l'air (pour l'isolation mécanique), cage de Faraday (électrique isolatile), un amplificateur et un ordinateur. Il faut noter qu'il ya un terrain référencé à l'antenne d'enregistrement et un deuxième motif qui est référencé à la table de l'air et la cage de Faraday.
Discussion
Développement du système nerveux peut être étudiée en utilisant des cordons rongeurs isolés épinière. En présence de neurotransmetteurs, la locomotion fictive peut être généré à partir de la moelle épinière dans la forme de motifs activité électrique 1,3. Ces bouffées rythmiques sont produites à 0,2 à 0,5 Hz et sont modelés en alternances gauche-droite et fléchisseurs-extenseurs. A différents stades de développement, la robustesse et les modèles de cette activité varie 1....
Déclarations de divulgation
Remerciements
Samuel L. Pfaff est un professeur dans les laboratoires de l'expression génique au Salk Institute for Biological Studies et un chercheur à l'Institut médical Howard Hughes. Ce travail a été soutenu par la Christopher Reeve et Dana Foundation. Joe Belcovson, Kent et Mike Sullivan Schnoeker de Ressources Multimédia à l'Institut Salk a fourni une aide à la photographie et l'édition.
matériels
| Name | Company | Catalog Number | Comments |
| PTFE Sub Lite Wall Tubing (Small tubing) | Zeus | 36AWG | 0.005”ID x 0.003” Wall (Small Parts) Also available in 0.003” to 0.006” |
| Large tubing (0.86mm (0.34”)) | BD Biosciences | 427420 | 0.86mm (0.34”) O.D. 1.27mm (.050”) |
| Electrode Barrel | A-M Systems | 573000 | |
| Adhesive | JB Weld | ||
| Adhesive: Silicone caulk | |||
| Solder and soldering iron | |||
| Bleach | |||
| Xylene | |||
| Silver wire: 0.010” | A-M Systems | ||
| Insect pins: Austerlitz 0.1mm | Fine Science Tools | 26002-10 | |
| Magnetic Stand | Narishige International | GJ-8 | |
| Micromanipulator | Narishige International | MN 151 | |
| Miniboard (Headstage) | Grass Technologies | F-15EB/B1 | |
| Polyview Adaptor Unit | Grass Technologies | PVA 8 | |
| Bipolar Portable Physiodata Amplifier System | Grass Technologies | 15LT | |
| ANALOG TO DIGITAL CARD | National Instruments | 6035E | |
| Air Table; Vibraplane | Kinetic Systems |
Références
- Gallarda, B. W., Sharpee, T. O., Pfaff, S. L., Alaynick, W. A. Defining rhythmic locomotor burst patterns using a continuous wavelet transform. Ann N Y Acad Sci. 1198, 133-139 (2010).
- Meyer, A., Gallarda, B. W., Pfaff, S., Alaynick, W. Spinal cord electrophysiology. J Vis Exp. , (2010).
- Gallarda, B. W. Segregation of axial motor and sensory pathways via heterotypic trans-axonal signaling. Science. 320, 233-236 (2008).
- Landmesser, L. The development of motor projection patterns in the chick hind limb. J Physiol. 284, 391-414 (1978).
- Myers, C. P. Cholinergic input is required during embryonic development to mediate proper assembly of spinal locomotor circuits. Neuron. 46, 37-49 (2005).
- Chanin, M. The determination of chloride by use of the silver-silver chloride electrode. Science. 119, 323-324 (1954).
- Goulding, M. Circuits controlling vertebrate locomotion: moving in a new direction. Nat Rev Neurosci. 10, 507-518 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon