Method Article
Time-lapse de microscopie du début de l'embryogenèse dans les Caenorhabditis elegans
Dans cet article
Résumé
Cet article décrit une technique pour la visualisation des événements précoces de l'embryogenèse chez le nématode Caenorhabditis elegans.
Résumé
Caenorhabditis elegans a souvent été utilisé comme système modèle dans les études du début du processus de développement. La transparence des embryons, les ressources génétiques, et la relative facilité de transformation sont des qualités qui font de C. elegans un excellent modèle pour l'embryogenèse précoce. À base de laser microscopie confocale et les étiquettes marquées par fluorescence permettent aux chercheurs de suivre les structures cellulaires spécifiques et des protéines dans l'embryon en développement. Par exemple, on peut suivre des organites spécifiques, comme les lysosomes ou les mitochondries, utilisant des colorants marqués par fluorescence. Ces colorants peuvent être livrés à l'embryon précoce au moyen de micro-injection dans la gonade adulte. En outre, la localisation des protéines spécifiques peuvent être suivis en utilisant les balises protéine fluorescente. Des exemples sont présentés ici, montrant l'utilisation d'un colorant fluorescent lysosomale ainsi que par fluorescence taggés protéines histones et l'ubiquitine. Les histones étiquetées est utilisée pour visualiser l'ADN et ainsi d'identifier le stade du cycle cellulaire. GFP-taggés ubiquitine révèle la dynamique des vésicules ubiquitinées dans l'embryon précoce. Observations des lysosomes étiquetés et GFP:: ubiquitine peut être utilisé pour déterminer s'il ya colocalisation entre les vésicules ubiquitinées et des lysosomes. Une technique pour la micro-injection du colorant lysosomale est présenté. Techniques pour générer des souches transgenenic sont présentées ailleurs (1, 2). Pour l'imagerie, les embryons sont découpées dans des nématodes adultes et hermaphrodites monté sur coussinets d'agarose 2% suivie par la microscopie time-lapse sur un laser standard microscope confocal à balayage ou un microscope confocal à disque rotatif. Cette méthodologie fournit pour la visualisation haute résolution de l'embryogenèse précoce.
Protocole
1. Cultures nématode
- Obtenir le appropriée C. elegans souche à partir du Centre de Caenorhabditis Genetics Stock (CCG) ou d'un collègue.
- Cultivez les nématodes sur gélose NGM ensemencé avec une pelouse OP50 bactérienne (3). Pour l'analyse de la GFP souches de croissance à 25 ° C est recommandée.
- La veille de votre expérience de microscopie, ramasser au moins 40 larves L4 sur les plaques ensemencées et placer les plaques à 25 ° C pendant la nuit. Ces vers seront de jeunes adultes pour l'expérience.
2. Injections
S'il est souhaitable de voir des structures comme les lysosomes ou les mitochondries, les adultes peut être injecté par un colorant fluorescent avant la visualisation.
- Préparer séchées coussinets d'injection d'agarose. (Cela peut être fait un à plusieurs jours d'avance)
- Préparer fondue agarose à 2% dans de l'eau. Avec une pipette Pasteur mettre 2 gouttes sur une lamelle 22X54 mm. Placez un autre lamelle Croix-sage sur le dessus de la goutte. Afin d'obtenir l'épaisseur correcte, appuyez sur la lamelle supérieure jusqu'à ce que le diamètre de la plaquette est d'environ 1,5 cm. Laisser reposer pendant 5-10 minutes.
- Retirer lamelle supérieure. Déshydrater le pad agarose en le plaçant dans une four à 80 ° C pendant 1 heure ou permettre de s'asseoir sur paillasse pendant la nuit.
- Préparer Mitotracker ou une solution Lysotracker.
- Diluer agent fluorescent dans le tampon d'œufs. Nous utilisons généralement une dilution 1:10 de Mitotracker ou Lysotracker.
- L'aiguille d'injection est faite à partir d'un verre de 1,2 OD capillaire. Retirez l'aiguille d'injection à l'aide d'un tire-aiguille.
- Utiliser une pipette Pastuer tiré vers l'arrière de remplir l'aiguille avec le colorant dilué.
- L'aiguille Placez dans une lumière sans, chambre humide jusqu'à utilisation.
- Pré-injection: Mise en place du microscope et de l'aiguille.
- Mont aiguille d'injection sur l'appareil d'injection. Notre appareil est un micromanipulateur Narishige entraînement direct monté sur la platine d'un microscope inversé Nikon TE200 équipés capacité d'imagerie DIC.
- Connectez l'aiguille à un tube de 1,2 mm de diamètre qui est relié au régulateur de pression. Soit de l'air comprimé ou d'azote peut être utilisé comme une source de pression externe. Réglez le régulateur à 20-25 psi.
- Déposer 2 gouttes d'huile minérale lourde (huile de paraffine) sur le tampon d'injection.
- Placez le tampon d'injection sur le microscope et abaisser l'aiguille dans l'huile. Assurez-vous que les flux de fluides librement de l'aiguille lorsque la pression est appliquée. Appliquer une pression d'injection et d'observer si du liquide s'écoule de l'aiguille. Si non, vous aurez besoin de casser doucement l'extrémité de l'aiguille. L'aiguille peut être rompu par la conduite en douceur la pointe dans un petit morceau de lamelle cassée mis sur le pavé d'injection. Une fois l'aiguille qui coule, passez à l'étape suivante.
- Injection.
- Environ 1 heure avant le visionnement des embryons, le transfert vers adultes jeunes dans la goutte d'huile sur le tampon d'injection. Effectuer ce transfert en utilisant le microscope à dissection. Utilisez un pick ver fil de platine avec un bout pointu pour les vers de transfert.
- Disposer de 3 à 10 des vers afin qu'ils mentent directement sur le pad. Pour l'injection, il est plus facile si les vers sont alignés parallèlement les uns aux autres et un peu moins d'une longueur de vis de l'autre. Une fois que les vers sont sur le pavé d'injection, il est important de travailler rapidement et terminer le processus d'injection avant les vers périssent de la dessiccation.
- Placez la lamelle avec des vers sur la platine du microscope du microscope injection. Concentrer dans la partie centrale (rachis) du tube distal des gonades. Ensuite, utilisez le micromanipulateur de déplacer la pointe de l'aiguille dans le même plan focal. Déplacer la scène horizontalement de sorte que le ver est percé par l'aiguille. Une fois la pointe de l'aiguille est à l'intérieur du rachis, appliquer la pression et permettent la gonade à remplir avec le mélange de colorant. Injecter deux bras gonades de tous les vers sur le pavé d'injection.
- Après l'injection, l'utilisation d'une pipette Pasteur tiré pour livrer environ 0,5 ml de tampon d'œufs aux vers. Cela va les empêcher de mourir de déshydratation et de leur permettre de récupérer de la procédure d'injection.
- Autoriser les vers de récupérer pendant 1-2 heures à température ambiante dans une lumière libre, chambre humidifiée.
3. Agarose pad pour la visualisation des embryons
- Préparer fondue agarose à 2% dans le tampon d'œufs.
- Avec une pipette Pasteur, mettre 3 gouttes d'agarose fondu sur une lame de microscope propre.
- Placer la lame entre deux autres diapositives qui ont une couche de l'étiquetage des bandes qui les recouvre. Celles-ci servent entretoises qui assureront que votre pad agarose est la bonne épaisseur.
- Placer une lame de microscope propre secondes perpendiculairement vers le bas sur les gouttes d'agarose. Appuyez jusqu'à ce chariot supérieur repose sur bande à partir de diapositives guide.
- Juste avant que vous soyez prêt à monter embryons d'observation, de retirer la lame supérieure.
4. Embryons de montage pour la visualisation
- Si les vers n'ont pas été injectés, suivez les deux étapes suivantes. Sinon les sauter.
- Choisissez les vers adultes jeunes de la plaque qui a été préparé la veille. Vous devriez être capable de voir l'intérieur de l'embryon chez les jeunes adultes.
- Choisissez les vers 50-20 sur une plaque non ensemencée NGM. Autoriser les vers à ramper sur la plaque non ensemencée pendant quelques minutes afin que les vers vont perdre la plupart des bactéries qui est collé à eux.
- D'obtenir des embryons jeunes de vers adultes
- Déposer une goutte de 50 à 20 pi de tampon d'œufs au milieu d'une lamelle de verre de 18 mm 2 (d'une épaisseur de 1,5 lamelle est préférable).
- Déplacer vers de la plaque non ensemencée ou un tampon d'injection dans la goutte de tampon Egg.
- Couper Worms Open avec une aiguille hypodermique de calibre 26. Couper le ver près de la vulve. Vous devriez voir embryons déborder du ver.
- Monter sur lame de microscope
- Inverser la lame de microscope qui a été préparé avec le pad agarose et l'abaisser sur la lamelle avec des embryons.
- Si laps de temps prolongé est nécessaire, utiliser de la vaseline pour sceller les bords de la lamelle pour éviter la dessiccation.
5. Microscopie
- Trouver les embryons appropriés.
- Placer la lame sur la platine du microscope. Scan avec lentille de 10X à trouver des embryons.
- Pour trouver embryons au stade précoce, la recherche des embryons qui sont en train de terminer la méiose maternelle. Embryons méiotique peuvent être distinguées à partir d'embryons plus tard parce qu'elles n'ont pas subi un raccourcissement. (Après avoir terminé la méiose embryons, vous pouvez voir un écart important entre la membrane cellulaire et la coquille d'oeuf à l'extrémité antérieure.)
- Lorsque vous avez identifié une mise en scène de façon appropriée l'embryon, se déplacer à une lentille de grossissement plus élevé pour l'enregistrement de l'embryogenèse.
- Imagerie
- Dans cet exemple, nous imaginons des embryons qui expriment les mCherry:: H2B et GFP:: Ub protéines marquées. Nous utilisons le Zeiss LSM700 microscope classique à balayage laser.
- Les images sont recueillies à l'aide de la lentille 63X 1.4NA. Les 488 et 555 lasers sont utilisés avec la puissance laser minimale et un gain maximum. Pile AZ sont collectées tous les 10-15 secondes. Selon l'ampleur de photoblanchiment, 30-60 points de temps sont recueillies. Images pile Z sont regroupées en une image de projection maximale pour la finale time-lapse vidéo.
6. Les résultats représentatifs:
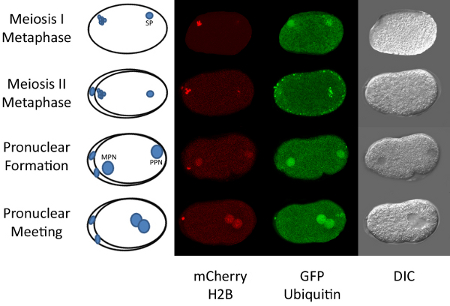
Figure 1. Fécondation à première mitose en C. elegans.
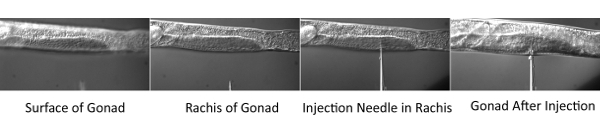
Figure 2. Procédure de micro-injection.
Vidéo complémentaires 1 Time-lapse vidéo de la GFP:.. Bleu ubiquitine ainsi Lysotracker dans un embryon méiotique Cliquez ici pour visionner la vidéo.
Discussion
Après la fusion avec le spermatozoïde, le zygote subit une série d'événements dynamiques. Ces événements transforment l'ovocyte d'une cellule relativement statique dans l'embryon qui se développe rapidement. Dans de nombreux organismes, des réarrangements cytoplasmiques sont essentielles pour l'établissement de la polarité embryonnaire et pour l'activation de l'œuf. Le C. embryons elegans fournit une excellente occasion d'observer ces événements précoces de l'activation de l'œuf et l'embryogenèse. L'embryon est transparent et le début des événements de développement se produisent assez rapidement après la fécondation. C. chercheurs elegans ont généré de nombreuses souches utiles transgéniques qui expriment des protéines marquées par fluorescence impliqués dans le développement précoce. L'utilisation de ces souches ainsi que l'ARNi ou mutants fournit un système puissant pour disséquer les voies moléculaires qui sous-tendent le développement d'un organisme multicellulaire (5, 6, 7, 8). Cet article présente la vidéo d'une approche pratique à l'utilisation de ces outils et techniques pour enregistrer les événements pendant l'embryogenèse au début de C. elegans.
La maturité C. ovocyte elegans est arrêté en prophase de la méiose I et est fécondé dans la spermathèque de l'hermaphrodite adulte. Après la fécondation, l'ovocyte produit à travers le reste de la méiose I et II. Ces étapes peuvent être observées à l'aide marqué par fluorescence histone H2B (5). Durant le processus de la méiose maternelle, l'ADN du sperme reste condensée (voir Figure 1). Après l'achèvement de la méiose, l'ADN maternel et paternel devient décondensée et la forme deux pronuclei. Le pronucleus maternel migre vers le pronucleus paternel et ils se réunissent près du centre de l'embryon. Mitose s'ensuit rapidement après la rencontre pronucléaire. Tous ces événements se produisent dans moins d'une heure. Ainsi, la microscopie time-lapse de cette séquence d'événements peut être facilement accompli. L'exécution de cette technique nécessite certaine facilité à la culture de nématodes ainsi que des compétences de base dans la microscopie Outre l'accès à un microscope confocal.
L'exemple présenté ici utilise une transgéniques C. elegans souche qui exprime deux protéines fluorescentes, GFP:: ubiquitine et mCherry:: H2B. Un microscope confocal à balayage laser est utilisé pour observer la localisation dynamique de ces deux protéines. En outre, nous montrons que l'injection de Lysotracker marqué par fluorescence peut être utilisée pour suivre le devenir des lysosomes dans l'embryon après la fécondation. L'injection d'un traceur marqué peut également être effectuée pour la visualisation des concentrations de calcium mitochondries ou locale (9). En théorie, le protocole d'injection pourrait être utilisé pour afficher tout type de molécule marquée par fluorescence dans l'embryon. Cela pourrait inclure de petites molécules étiquetées, protéines, lipides, etc Dans certains cas, il peut ne pas être nécessaire d'injecter des trackers réalité étiquetés comme les vers volontiers absorption des colorants tels que Mitotracker (10). Cependant, nous avons essayé les deux trempage et l'injection de Lysotracker et ont trouvé des résultats bien meilleurs avec une injection pour la visualisation dans les embryons.
Considérations techniques:
Les défis techniques présentées avec cette procédure incluent la technique de microinjection ainsi que la difficulté en imagerie très jeunes embryons. Concernant microinjections, l'épaisseur de la plaquette d'injection d'agarose est critique pour des injections de succès. Si le tampon est trop épaisse, les vers et les dessécher meurent rapidement. Si le tampon est trop mince, les vers ne colle pas au pad pendant le processus d'injection.
Les embryons peuvent être sensibles aux conditions environnementales comme la température et les conditions de tampon. Embryons de type sauvage devrait lancer décondensation de l'ADN des spermatozoïdes et de la migration au sein pronucléaire une minute ou deux de terminer la méiose II (4). Dans les 20 minutes, le premier devrait commencer à la cytokinèse. Si les embryons sont exposés à l'intensité du laser sont très élevés ou trop chaud ou écrasés lors du montage, ce processus peut être perturbé. Ces embryons seront arrêter le développement. Si cela se produit, l'expérience devrait être répétée avec la puissance du laser ou une diminution plus épais tapis d'agarose.
C. elegans embryons ne sécrètent pas de leur coquille d'œuf jusqu'à peu de temps après la fécondation. Pendant la courte période entre la fécondation et la sécrétion de la coquille d'œuf, les embryons ne sont pas viables en dehors de la mère (11). Certains laboratoires ont évité ce problème en imagerie embryons in utero (5, 12). In utero imagerie offre certains avantages comme la possibilité de capturer les événements qui se produisent pendant ou juste après la fécondation. Cependant, cette technique nécessite l'utilisation d'un système de microscopie qui permet pour l'imagerie des tissus profonds. Les systèmes tels que deux photons ou multi-photons sont particulièrement adaptés pour cela (13, 14). Lorsque vous utilisez un conventionnels à balayage laser ou la filature de microscope confocal à disque, les meilleures images sont obtenues à partir d'embryons qui haai été coupé du ver adulte comme décrit ici.
Considérations Système d'imagerie:
Le type de système d'imagerie confocale utilisée dépend des besoins des utilisateurs. En général, les systèmes laser à balayage sont recommandés si l'on souhaite acquérir des images avec la meilleure résolution possible. D'autre part, les systèmes à disque rotatif sont mieux adaptés pour les procédés d'imagerie hautement dynamiques comme l'acquisition d'image est relativement rapide et photoblanchiment / phototoxicité est réduite.
Les paramètres d'imagerie spécifiques varieront selon le modèle expérimental et le système d'imagerie confocale employés. En imagerie multidimensionnelle, il faut considérer le nombre de canaux, plans focaux, et le temps des points recueillis. En raison des effets limitatifs de photoblanchiment et de phototoxicité, un nombre fini d'images peuvent être acquises en toute expérience donnée. Ainsi, si vous choisissez d'augmenter le nombre de canaux devant être acquis, vous aurez probablement besoin de réduire le nombre de plans focaux et / ou des points de temps et vice versa. Le nombre total d'images pouvant être acquises sera influencée par l'intensité du fluorophore étant imagé ainsi que la sensibilité du microscope confocal utilisé. Fluorophores plus intense et plus des instruments sensibles, il faudra le temps d'exposition plus courte et donc produire moins de photoblanchiment et de phototoxicité.
Un grand nombre ou de systèmes d'imagerie sont disponibles. Nous vous donnerons des détails sur les systèmes qui ont été utilisées dans nos propres laboratoires. Pour les embryons vers l'imagerie par microscopie à filer le disque confocale, nous utilisons un microscope inversé Nikon TE2000U équipé d'un 60X/1.4 NA plan objectif Apo. Le microscope est relié à une unité de Yokogawa CSU10 disque rotatif, un Hamamatsu C9100-13 EM caméra CCD et un Spectral Applied Research LMM5 laser module de fusion contenant quatre lasers à solide avec une production à 405, 491, 561 et 655 nm. Grâce à ce système nous pouvons capturer un ou deux canaux, six à douze plans focaux, 25 à 50 points dans le temps (30 à 60 secondes d'intervalle). Un temps d'exposition typique est de 100 à 200 millisecondes.
Pour les embryons d'imagerie à balayage laser microscopie confocale, nous utilisons un Zeiss LSM700 équipé de 2 canaux et quatre lasers à semi-conducteurs (405, 488, 555 et 635 nm). Ce système est relié à un microscope inversé Zeiss Axio Observer avec un objectif de Plan-Apo 63X/1.4NA utilisés pour l'imagerie embryon. Le système utilise le logiciel Zeiss ZEN pour l'acquisition d'image qui fournit également le traitement d'image limitée et d'analyse. Lorsque l'imagerie par deux fluorochromes, nous avons généralement de recueillir 1-5 plans focaux (~ 0,5 um d'intervalle) et de recueillir une pile Z toutes les 15 secondes. Les collections sont poursuivie jusqu'en photoblanchiment significatif n'est intervenu. Pour générer la finale time-lapse vidéo, images pile Z sont consolidées en utilisant l'outil de projection maximale dans le logiciel ZEN. Les vidéos sont exportées à partir du logiciel en tant que fichiers AVI.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Nous tenons à souligner le financement des National Institutes of Health (R15-03 à GM065444 LB) et du Programme de recherche intra-muros des National Institutes of Health (NIH) et l'Institut national du diabète et des maladies digestives et rénales (KO). Une sentence NSF (DBI-0923402) a financé l'acquisition d'un microscope confocal LSM700. Nous tenons également à remercier l'assistance générale et des commentaires utiles sur le manuscrit du Dr Andy Or. Le crédit va à l'ensemble de la communauté C. elegans de partage des ressources, des protocoles et des idées.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | Composition |
|---|---|---|---|
| Egg Tampon | 5mM pH 7,2 Hepes, 110mm de NaCl, 4mm KCl, 5 mM acétate de Mg, CaCl 2 5mM | ||
| Mitotracker | Invitrogen | M-7512 | |
| Lysotracker | Invitrogen | L-7525 | |
| Pipet injection capillaire | Harvard Apparatus, Kent, Royaume-Uni | GC120F-10 | |
| Extracteur d'aiguilles | Kopf | Modèle 700C | |
| Appareil microinjecteur | Tritech recherche | MINj-1 régulateur de microinjection |
Références
- Berkowitz, L. A., Knight, A. L., Caldwell, G. A., Caldwell, K. A. Generation of stable transgenic C. elegans using microinjection. J Vis Exp. (18), e833-e833 (2008).
- Hochbaum, D., Ferguson, A. A., Fisher, A. L. Generation of Transgenic C. elegans by Biolistic Transformation. J Vis Exp. (42), e2090-e2090 (2010).
- Brenner, S. The Genetics of Caenrohabditis elegans. Genetics. 77, 71-94 (1974).
- Oegema, K., Hyman, A. A. Cell division WormBook. , (2006).
- McNally, K. L., McNally, F. J. Fertilization initiates the transition from anaphase I to metaphase II during female meiosis in C. elegans. Dev Biol. 282, 218-230 (2005).
- Sato, K., Sato, M., Audhya, A., Oegema, K., Schweinsberg, P., Grant, B. D. Dynamic regulation of caveolin-1 trafficking in the germ line and embryo of Caenorhabditis elegans. Mol Biol Cell. 17, 3085-3094 (2006).
- Stitzel, M. L., Pellettieri, J., Seydoux, G. The C. elegans DYRK Kinase MBK-2 Marks Oocyte Proteins for Degradation in Response to Meiotic Maturation. Curr Biol. 16, 56-62 (2006).
- Schetter, A., Askjaer, P., Piano, F., Mattaj, I., Kemphues, K. Nucleoporins NPP-1, NPP-3, NPP-4, NPP-11 and NPP-13 are required for proper spindle orientation in C. elegans. Dev. Biol. 289, 360-371 (2006).
- Samuel, A. D., Murthy, V. N., Hengartner, M. O. Calcium dynamics during fertilization in C. elegans. BMC Dev Biol. 1, (2001).
- Badrinath, A. S., White, J. S. Contrasting patterns of mitochondrial redistribution in the early lineages of Caenorhabditis elegans and Acrobeloides sp. PS1146. Dev. Biol. 258, 270-275 (2003).
- Johnston, W. L., Krizus, A., Dennis, J. W. The eggshell is required for meiotic fidelity, polar-body extrusion and polarization of the C. elegans embryo. BMC Biol. 4, 35-35 (2006).
- Parry, J. M., Velarde, N. V., Lefkovith, A. J., Zegarek, M. H., Hang, J. S., Ohm, J., Klancer, R., Maruyama, R., Druzhinina, M. K., Grant, B. D., Piano, F., Singson, A. EGG-4 and EGG-5 Link Events of the Oocyte-to-Embryo Transition with Meiotic Progression in C. elegans. Curr Biol. 19, 1752-1757 (2009).
- Centonze, V. E., White, J. G. Multiphoton excitation provides optical sections from deeper within scattering specimens than confocal imaging. Biophys J. 75, 2015-2024 (1998).
- Zinselmeyer, B. H., Dempster, J., Wokosin, D. L., Cannon, J. J., Pless, R., Parker, I., Miller, M. J. Two-photon microscopy and multidimensional analysis of cell dynamics. Methods Enzymol. 461, 349-378 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon