Method Article
Покадровый Микроскопия раннего эмбриогенеза в Caenorhabditis Элеганс
В этой статье
Резюме
В этой статье описывается методика визуализации ранних событий эмбриогенеза в нематода Caenorhabditis Элеганс.
Аннотация
Caenorhabditis Элеганс часто используется в качестве модельной системы для изучения ранних процессов развития. Прозрачность эмбрионов, генетических ресурсов, и относительная легкость трансформации качества, которые делают C. Элеганс отличной моделью для раннего эмбриогенеза. Лазерная основе конфокальной микроскопии и флуоресцентно меченных теги позволяют исследователям следить специфических клеточных структур и белков в развивающемся эмбрионе. Например, можно проследить конкретные органелл, таких как лизосомы и митохондрии, используя флуоресцентно меченных красителями. Эти красители могут быть доставлены раннего эмбриона с помощью микроинъекции во взрослую гонады. Кроме того, локализация специфических белков может сопровождаться использованием флуоресцентных меток белка. Примеры, представленные здесь, демонстрирующие использование флуоресцентных красителей лизосомальных а также флуоресцентно меткой гистонов и убиквитин белков. Помечены гистонов используется для визуализации ДНК и таким образом определить стадию клеточного цикла. GFP с метками убиквитин раскрывает динамику ubiquitinated пузырьков в начале эмбриона. Наблюдения меченых лизосомы и GFP:: убиквитин могут быть использованы, чтобы определить, есть ли между колокализации ubiquitinated пузырьков и лизосом. Методика микроинъекции лизосомальных красителя представлена. Методы для создания transgenenic штаммов представлены в другом месте (1, 2). Для обработки изображений, эмбрионов, вырезанных из взрослых нематод гермафродит и установлен на 2% агарозном колодки следует покадровой микроскопии на стандартной лазерной сканирующей конфокальной микроскопии или вращающийся диск конфокальной микроскопии. Эта методология предусматривает высокую визуализации разрешение раннего эмбриогенеза.
протокол
1. Нематоды культур
- Получить соответствующие C. Элеганс напряжение от Caenorhabditis генетики сток центр (CGC), либо из коллег.
- Расти нематод на NGM пластин агара с присадками OP50 бактериальных газон (3). Для анализа роста GFP штаммов при 25 ° С рекомендуется.
- День до микроскопии эксперимента, подобрать не менее 40 L4 личинок на тарелки посеяны и место пластин при 25 ° С в течение ночи. Эти черви будут молодые люди для эксперимента.
2. Инъекции
Если желательно, чтобы посмотреть в структурах, таких как лизосомы и митохондрии, взрослые могут быть введены с флуоресцентным красителем до визуализации.
- Подготовка сушеных инъекции агарозном колодки. (Это можно сделать от одного до многих дней заранее)
- Подготовка расплавленного 2% агарозном в воде. С пипетки Пастера положить по 2 капли на покровного стекла 22X54 мм. Место другой покровного стекла крест-накрест на вершине капли. Для достижения необходимой толщины, нажмите на верхнюю покровного стекла, пока диаметр площадки составляет около 1,5 см. Дайте настояться в течение 5-10 минут.
- Снимите верхнюю покровного стекла. Дегидрировать площадку агарозы, поместив его в 80 ° С духовке в течение 1 часа и не допускайте, чтобы сидеть на настольный ночь.
- Подготовка Mitotracker или Lysotracker решение.
- Развести флуоресцентный агент в яйцо буфера. Обычно мы используем 1:10 разбавление Mitotracker или Lysotracker.
- Инъекционной иглой выполнена из 1,2 OD стеклянный капилляр. Вытяните инъекционной иглой с помощью иглы съемника.
- Используйте вытащил Pastuer пипетки, чтобы заполнить назад иглу с разбавленной краской.
- Место иголку в свет без, влажной камере до момента использования.
- Предварительная инъекция: Настройка микроскопа и иглы.
- Горы инъекционной иглой на инъекции аппарата. Наш аппарат Narishige прямой микроманипулятора привод установлен на стадии Nikon TE200 инвертированный микроскоп оснащен DIC возможности визуализации.
- Подключите иглы 1,2 мм ID трубка, которая подключается к регулятор давления. Либо сжатого воздуха или азота может быть использован в качестве внешнего источника давления. Установите регулятор на 20-25 фунтов на кв.
- Место 2 капли тяжелых нефтепродуктов (Парафиновые масла) на инъекцию площадку.
- Место инъекции площадку на микроскоп и нижней иглы в масле. Убедитесь, что потоки жидкости свободно от иглы, когда под давлением. Применять давление впрыска и наблюдать ли жидкость вытекает из иглы. Если нет, то вам необходимо аккуратно разорвать конце иглы. Игла может быть нарушена, осторожно вождения наконечник в маленький кусочек сломанной покровного стекла размещены на инъекции площадку. После иглы течет, переходите к следующему шагу.
- Injection.
- Примерно за 1 час до просмотра эмбрионов, передача молодых взрослых червей в нефть падают на инъекции площадку. Выполните эту передачу, которая использует рассекает микроскопом. Используйте червя платиновой проволоки забрать с заостренным концом для передачи червей.
- Организовать 3 - 10 червей, так что они лежат прямо на площадке. Для инъекций, проще всего, если черви выстроились параллельно друг другу и чуть менее червь длиной друг от друга. Как только черви на инъекции площадки важно работать быстро и полное введение процесса, прежде чем черви погибают от высыхания.
- Место покровного стекла с червями на столике микроскопа инжекции микроскопом. Фокус в центральной части (осью) дистального трубки гонады. Затем с помощью микроманипулятора для перемещения кончика иглы в той же фокальной плоскости. Перемещение этапе горизонтально, так что червь проткнуть иглой. Как только кончик иглы в позвоночник, давление и позволит гонады заполнить красителя смеси. Inject как гонады оружие всех червей на инъекции площадку.
- После инъекции, использование пипетки Пастера вытащил поставлять около 0,5 мл Яйцо буфера для червей. Это позволит сохранить их от смерти в результате обезвоживания и дать им возможность оправиться от введения процедуры.
- Разрешить червей восстановить в течение 1-2 часов при комнатной температуре в свет без, влажной камере.
3. Агарозном площадку для просмотра эмбрионов
- Подготовка расплавленного 2% агарозном в яйцо буфера.
- С помощью пипетки Пастера, положить 3 капли расплавленного агарозы на чистую слайд микроскопом.
- Место слайда между двумя другими слайдами, которые имеют один слой маркировки ленту, закрывающую их. Они служат прокладками, которые обеспечат ваш агарозном прокладка правильной толщины.
- Место второго чистой микроскопический слайд перпендикулярно вниз на агарозном капель. Пресс вниз, пока верхний слайд покоится на ленту с руководством слайдов.
- Просто, прежде чем вы готовы монтировать эмбрионов для наблюдения, снимите верхнюю слайд.
4. Монтаж эмбрионов для просмотра
- Если черви не были введены, выполните следующие два шага. В противном случае их пропустить.
- Выберите молодых взрослых червей от пластины, который был подготовлен накануне. Вы должны быть в состоянии видеть эмбрионами внутри молодых взрослых.
- Выберите 5-20 червей на unseeded пластины NGM. Разрешить черви ползают по unseeded пластине в течение нескольких минут, так что черви теряют большую часть бактерий, которые привязаны к ним.
- Получить молодые эмбрионы от взрослых червей
- Место 5-20 мкл капли Яйцо буфер в середине 18 мм 2 стекла покровного стекла (покровного стекла толщиной 1,5 предпочтительнее).
- Перемещение червей unseeded пластины или инъекции площадку в капле Яйцо буфера.
- Разрежьте черви с 26 иглы подкожных колеи. Разрежьте червь возле вульвы. Вы должны увидеть эмбрионы высыпался из червя.
- Горы на предметное стекло микроскопа
- Обратить стекло микроскопа, который был подготовлен с площадкой агарозы и опустите его на покровного стекла с эмбрионами.
- Если расширенные промежуток времени требуется, используйте вазелин, чтобы запечатать края покровного стекла для предотвращения высыхания.
5. Микроскопия
- Поиск соответствующих эмбрионов.
- Место слайд на предметный столик микроскопа. Сканирование с 10х объектив, чтобы найти эмбрионов.
- Чтобы найти ранней стадии эмбрионы, поиск эмбрионов, которые находятся в процессе завершения материнской мейоза. Мейотического эмбрионы можно отличить от более поздних эмбрионов, поскольку они не подверглись сокращению. (После того, эмбрионы завершили мейоза, можно увидеть значительный разрыв между клеточной мембраны и яичной скорлупы на переднем конце.)
- После того как вы определили надлежащим поставил эмбриона, перейти к более высоким увеличением линзы для записи эмбриогенеза.
- Изображений
- В этом примере мы воображая эмбрионов, которые выражают mCherry:: H2B и GFP:: Ub меткой белков. Мы используем Zeiss LSM700 обычного микроскопа сканирующего лазера.
- Изображения получены с помощью 63x 1.4NA линзы. 488 и 555 используются лазеры с минимальной мощности лазера и максимальное усиление. Я стек собирается каждые 10-15 секунд. В зависимости от степени фотообесцвечивания, 30-60 моменты времени собираются. Изображений Z стека рухнул в максимальной проекции изображения для окончательного покадровой видео.
6. Представитель Результаты:
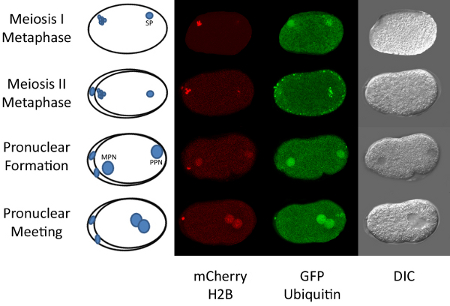
Рисунок 1. Оплодотворение с первого митоза в C. Элеганс.
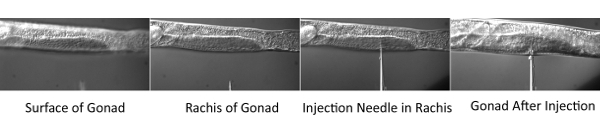
Рисунок 2. Микроинъекция процедуры.
Справочная Видео 1 Покадровый видео GFP:.. Убиквитин плюс Lysotracker синего в мейотических эмбриона Щелкните здесь для просмотра видео.
Обсуждение
После слияния с сперма, зиготы претерпевает ряд динамических событий. Эти события трансформировать яйцеклетки из относительно статичные клетки в быстро развивающемся эмбрионе. Во многих организмов, цитоплазматические перестановки являются критически важными для создания эмбриональных полярности и яйца активации. C. Элеганс эмбрионов дает прекрасную возможность для наблюдения этих ранних событий активации яйца и эмбриогенеза. Эмбрион является прозрачной и на ранних стадиях развития событий относительно быстро после оплодотворения. C. Элеганс исследователи вызвали много полезных трансгенных линий, которые выражают флуоресцентно меченых белков, участвующих в раннем развитии. С помощью этих штаммов, а также РНК-интерференции или мутанты обеспечивает мощная система для вскрытия молекулярных путей, которые лежат в основе развития многоклеточного организма (5, 6, 7, 8). Это видео статье представлен практический подход к использованию этих средств и методов для записи событий во время раннего эмбриогенеза в C. Элеганс.
Зрелая С. Элеганс ооцитов арестован в профазе мейоза I и оплодотворяется в сперматекой из взрослых гермафродитом. После оплодотворения яйцеклетки происходит через оставшуюся часть мейоза I и II. Эти этапы можно наблюдать с помощью флуоресцентно меченных гистонов H2B (5). Во время завершения материнской мейоз, ДНК спермы остается конденсированных (см. Рисунок 1). После завершения мейоза, материнской и отцовской ДНК становится деконденсированных и два пронуклеусы форме. Материнской пронуклеус мигрирует к отцовской пронуклеус и они объединяются недалеко от центра зародыша. Митоз быстро наступает после пронуклеусов встречи. Все эти события происходят в меньше чем за час. Таким образом, замедленная микроскопии этой последовательности событий может быть легко достигнута. Выполнение этой техники требует определенного объекта в нематода культивирования, а также основные навыки микроскопии в дополнение к доступу к конфокальной микроскопии.
Например, представленные здесь используются трансгенные C. Элеганс штамм, который выражает две флуоресцентные белки, GFP:: убиквитин и mCherry:: H2B. Конфокальной лазерной сканирующей микроскопии используется для наблюдения динамической локализации этих двух белков. Кроме того, мы показали, что инъекции флуоресцентно меченных Lysotracker могут быть использованы для проследить судьбу лизосом у эмбриона после оплодотворения. Введение меченых трекер может быть выполнена для визуализации митохондрий или местные концентрации кальция (9). В теории, введение протокол может быть использован для просмотра любого типа флуоресцентно меченных молекул в зародыше. Это могут быть помечены малых молекул, белков, липидов и т.д. В некоторых случаях она может и не понадобиться, чтобы фактически вводят помечены трекеры, как черви легко поглощение некоторых красителей, таких как mitotracker (10). Тем не менее, мы постарались как замачивания и инъекции lysotracker и нашли намного лучшие результаты с впрыском для визуализации в эмбрионы.
Технические соображения:
Технических проблем, возникающих с помощью этой процедуры включают микроинъекции техники, а также трудности в области обработки изображений очень ранних эмбрионов. Что касается микроинъекции, толщина площадки инъекции агарозном имеет решающее значение для успешного инъекций. Если подушка слишком толстый, черви осушать и быстро погибают. Если подушка слишком тонкий, черви не будет прилипать к площадке во время процесса впрыска.
Ранние эмбрионы могут быть чувствительны к условиям окружающей среды, таких как температура и буферных условиях. Дикие эмбрионов типа должны инициировать деконденсации ДНК спермы и пронуклеусов миграции в минуту или около завершения мейоза II (4). В течение 20 минут, первый цитокинеза должна начаться. Если эмбрионы подвергаются воздействию очень высокой интенсивности лазерного излучения или перегреве или измельченные в период монтажа, этот процесс может быть сорван. Такие эмбрионы будут ареста развития. Если это происходит, эксперимент должен быть повторен с пониженной мощности лазера или толще агарозном площадку.
C. Элеганс эмбрионов не выделяют их яичной скорлупы, пока вскоре после оплодотворения. В течение короткого времени между оплодотворением и секрецию яичной скорлупы, эмбрионы не являются жизнеспособными вне матери (11). Некоторые лаборатории бы избежать этой проблемы путем изображения эмбрионов внутриутробно (5, 12). Внутриутробное изображений дает определенные преимущества, такие как возможность захвата событий, которые происходят во время или сразу после оплодотворения. Однако этот метод требует использования микроскопии система, которая позволяет производить глубокое изображение ткани. Такие системы, как двухфотонной или многофотонной особенно подходят для этого (13, 14). При использовании обычного лазерного сканирования или вращающийся диск конфокальной микроскопии, лучшие изображения получаются из эмбрионов, которые гапосетили вырезанных из взрослого червя, как описано здесь.
Соображения Imaging System:
Тип конфокальной системы визуализации используется, зависит от потребностей пользователей. В общем, лазерные сканирующие системы, рекомендуется, если мы хотим получать изображения с максимально возможным разрешением. С другой стороны, спиннинг дисковые системы лучше подходят для работы с изображениями высокой динамичностью процессов, как получение изображений является относительно быстрым и фотообесцвечивания / фототоксичности снижается.
Конкретные параметры съемки будут варьироваться в зависимости от опытно-конструкторских и конфокальной системы визуализации работу. В многомерной визуализации, необходимо рассмотреть количество каналов, фокальные плоскости и временных точках собираются. Из-за предельной эффекты фотообесцвечивания и фототоксичности, конечное количество изображений может быть приобретен в той или иной эксперимент. Таким образом, если вы решили увеличить количество каналов приобретается, вы, вероятно, необходимо сократить число фокальных плоскостей и / или временных точках, и наоборот. Общее количество изображений, которые могут быть приобретены будет зависеть от интенсивности флуорофора время отображаемого, а также чувствительность конфокальной микроскопии используется. Более интенсивный флуорофоров и более чувствительных приборов потребует сокращения времени воздействия и, следовательно, производить меньше фотообесцвечивания и фототоксичности.
Большое количество изображений или системы имеются. Мы дадим подробную информацию о системах, которые были использованы в наших собственных лабораториях. Для визуализации червя эмбрионов на вращающийся диск конфокальной микроскопии, мы используем Nikon TE2000U инвертированный микроскоп оснащен 60X/1.4 Н. А. Plan Apo цели. Микроскоп подключен к Yokogawa CSU10 вращающийся диск устройства, Hamamatsu C9100-13 EM ПЗС-камеры, и спектральные прикладных исследований LMM5 лазерных модуля слияния, содержащий четыре твердотельных лазеров с выходной при 405, 491, 561 и 655 нм. С помощью этой системы мы можем захватить один или два канала, от шести до двенадцати фокальных плоскостях, а также от 25 до 50 timepoints (на 30 до 60 секундными интервалами). Типичное время экспозиции составляет от 100 до 200 миллисекунд.
Для изображения эмбрионов с лазерной сканирующей конфокальной микроскопии, мы используем Zeiss LSM700 оснащен 2 канала и четыре твердотельных лазеров (405, 488, 555 и 635 нм). Эта система крепится к наблюдатель Zeiss Axio инвертированный микроскоп с планом-Апо 63X/1.4NA цели используются для эмбриона изображений. Система использует Zeiss ZEN программное обеспечение для получения изображений, который также предоставляет ограниченную обработки и анализа изображений. При визуализации с двумя флуорохромами, мы обычно собирают 1-5 фокальных плоскостях (~ 0,5 мкм друг от друга) и собрать стек Z каждые 15 секунд. Коллекции продолжалось до значительных фотообесцвечивания произошло. Для формирования окончательной покадровой видео, изображения Z стека консолидированного использованием максимального инструмент проектирования в ZEN программного обеспечения. Видео вывозятся с программным обеспечением в виде файлов AVI.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Мы хотели бы выразить признательность финансирование от Национального института здоровья (R15 GM065444-03 Л. Б.) и Внутренние программы исследований Национального института здоровья (NIH) и Национального института диабета, желудочно-кишечных и почечных заболеваний (KO). Награда NSF (DBI-0923402), финансируемых приобретение LSM700 конфокальной микроскопии. Мы также хотели бы отметить общую помощь и полезные замечания по рукописи от доктора Энди Голден. Заслуга всей C. Элеганс сообщества для совместного использования ресурсов, протоколов и идей.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | Композиция |
|---|---|---|---|
| Яйцо буфера | 5 мМ рН Hepes 7.2, 110 мм NaCl, KCl 4мм, 5мм ацетат магния, 5 мМ CaCl 2 | ||
| Mitotracker | Invitrogen | M-7512 | |
| Lysotracker | Invitrogen | L-7525 | |
| Инъекция капиллярной пипеткой | Гарвардский аппарата, графство Кент, Великобритания | GC120F-10 | |
| Иглы Puller | Kopf | Модель 700C | |
| Аппарат Microinjector | Tritech исследований | MINJ-1 микроинъекции регулятора |
Ссылки
- Berkowitz, L. A., Knight, A. L., Caldwell, G. A., Caldwell, K. A. Generation of stable transgenic C. elegans using microinjection. J Vis Exp. (18), e833-e833 (2008).
- Hochbaum, D., Ferguson, A. A., Fisher, A. L. Generation of Transgenic C. elegans by Biolistic Transformation. J Vis Exp. (42), e2090-e2090 (2010).
- Brenner, S. The Genetics of Caenrohabditis elegans. Genetics. 77, 71-94 (1974).
- Oegema, K., Hyman, A. A. Cell division WormBook. , (2006).
- McNally, K. L., McNally, F. J. Fertilization initiates the transition from anaphase I to metaphase II during female meiosis in C. elegans. Dev Biol. 282, 218-230 (2005).
- Sato, K., Sato, M., Audhya, A., Oegema, K., Schweinsberg, P., Grant, B. D. Dynamic regulation of caveolin-1 trafficking in the germ line and embryo of Caenorhabditis elegans. Mol Biol Cell. 17, 3085-3094 (2006).
- Stitzel, M. L., Pellettieri, J., Seydoux, G. The C. elegans DYRK Kinase MBK-2 Marks Oocyte Proteins for Degradation in Response to Meiotic Maturation. Curr Biol. 16, 56-62 (2006).
- Schetter, A., Askjaer, P., Piano, F., Mattaj, I., Kemphues, K. Nucleoporins NPP-1, NPP-3, NPP-4, NPP-11 and NPP-13 are required for proper spindle orientation in C. elegans. Dev. Biol. 289, 360-371 (2006).
- Samuel, A. D., Murthy, V. N., Hengartner, M. O. Calcium dynamics during fertilization in C. elegans. BMC Dev Biol. 1, (2001).
- Badrinath, A. S., White, J. S. Contrasting patterns of mitochondrial redistribution in the early lineages of Caenorhabditis elegans and Acrobeloides sp. PS1146. Dev. Biol. 258, 270-275 (2003).
- Johnston, W. L., Krizus, A., Dennis, J. W. The eggshell is required for meiotic fidelity, polar-body extrusion and polarization of the C. elegans embryo. BMC Biol. 4, 35-35 (2006).
- Parry, J. M., Velarde, N. V., Lefkovith, A. J., Zegarek, M. H., Hang, J. S., Ohm, J., Klancer, R., Maruyama, R., Druzhinina, M. K., Grant, B. D., Piano, F., Singson, A. EGG-4 and EGG-5 Link Events of the Oocyte-to-Embryo Transition with Meiotic Progression in C. elegans. Curr Biol. 19, 1752-1757 (2009).
- Centonze, V. E., White, J. G. Multiphoton excitation provides optical sections from deeper within scattering specimens than confocal imaging. Biophys J. 75, 2015-2024 (1998).
- Zinselmeyer, B. H., Dempster, J., Wokosin, D. L., Cannon, J. J., Pless, R., Parker, I., Miller, M. J. Two-photon microscopy and multidimensional analysis of cell dynamics. Methods Enzymol. 461, 349-378 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены