Method Article
Détection des modifications des histones dans les feuilles des plantes
Dans cet article
Résumé
Une approche fiable et utile pour détecter les modifications des histones sur les gènes de plantes spécifiques est décrite. L'approche combine immunoprécipitation de la chromatine (ChIP) et en temps réel de PCR quantitative. Elle permet la détection des modifications des histones sur des gènes spécifiques avec un rôle dans divers processus physiologiques.
Résumé
Structure de la chromatine est importante pour la régulation de l'expression des gènes chez les eucaryotes. Dans ce processus, les modifications remodelage de la chromatine, la méthylation de l'ADN, et covalente sur la queue amino-terminale des histones H3 et H4 jouent des rôles essentiels 1-2. Modifications des histones H3 et H4 comprennent la méthylation de la lysine et l'arginine, l'acétylation de la lysine, et la phosphorylation de 1-2 résidus sérine. Ces modifications sont liées soit à l'activation des gènes, la répression, ou un état apprêté du gène qui favorise l'activation plus rapide et robuste d'expression après la perception des signaux appropriés (microbe motifs moléculaires associés, la lumière, hormones, etc) 3-7.
Ici, nous présentons une méthode pour la détection fiable et sensible de certaines modifications de la chromatine sur les gènes de la plante choisie. La technique est basée sur la réticulation du (modifié) histones et l'ADN avec le formaldéhyde 8,9, l'extraction et sonication de la chromatine, immunoprécipitation de la chromatine (ChIP) avec modification des anticorps spécifiques 9,10, de réticulation de l'histone-ADN, et spécifiques du gène en temps réel de PCR quantitative. L'approche s'est avérée utile pour détecter les modifications des histones spécifiques associés à la photosynthèse en C 4 à 5,11 maïs et l'immunité systémique en 3 Arabidopsis.
Protocole
1. La réticulation de la matière végétale
- Récolte 1-2g de feuilles d'Arabidopsis (6 à 10cm de diamètre rosette) dans un tube en plastique de 50 ml et compléter à 40 mL avec le tampon de réticulation.
- Assurez-vous que les feuilles restent immergés, par exemple en farce d'un droit adapté filtre éponge dessus de la surface du tampon. Ensuite, placez les tubes dans un dessiccateur.
- Vide infiltrer pour 10min. Pour chaque tube 2,5 ml de glycine 2M pour arrêter de réticulation, et inverser les tubes pour justifier la dispersion égale de la glycine.
- Vide d'infiltrer pour une autre 5min et jeter fluide pendant la récolte des feuilles sur un tamis.
- Laver les feuilles à deux reprises avec 1 litre d'eau dans un récipient en verre, puis le laisse sécher avec des serviettes en papier.
- Ramasser les feuilles dans un tube en plastique douce et geler dans l'azote liquide. Magasin de feuilles à -80 ° C jusqu'à ce que l'isolement chromatine.
2. Isolement de la chromatine
- Feuilles ont été broyées avec du mortier et pistil qui ont été conservés dans l'azote liquide jusqu'à leur utilisation.
- Transfert de poudre pour un tube en plastique de 50 ml et de suspendre dans 30mL de tampon d'extraction n ° 1.
- Incuber pendant 15min à 4 ° C sur un agitateur vertical.
- Filtrat à travers la suspension de quatre couches de miracloth dans un tube en plastique de 50 ml fraîche.
- Spin pour 20min à 2800 xg à 4 ° C.
- Retirer le surnageant et suspendre culot avec un pinceau dans le tampon d'extraction 1ml # 2. Ajouter d'abord un petit volume de tampon n ° 2, puis de suspendre culot avec un pinceau, puis ajoutez le reste de la mémoire tampon.
- Transfert de suspension pour un tube de micro et de 1,5 ml de spin pour 10min à 12.000 xg à 4 ° C.
- Pendant ce temps, préparez-2mL microcentrifugeuse tubes contenant 1,5 ml de tampon d'extraction n ° 3.
- Retirer le surnageant du tube filé (étape 2.7) et de suspendre le culot dans 300μL de tampon d'extraction n ° 3. Ajouter d'abord un petit volume de tampon n ° 3, suspendre culot avec un pinceau, puis ajoutez le tampon restant.
- Soigneusement pipette le culot en suspension (étape 2.9) sur le dessus de la mémoire tampon de 1,5 ml d'extraction n ° 3 préparé à l'étape 2.8. Assurez-vous que les deux phases se mélangent pas. Spin pour 1h à 16 000 xg à 4 ° C.
- Retirer le surnageant et suspendre la chromatine culot avec un pinceau dans 300μL de tampon de sonication.
- Soniquer chromatine avec une sonotrode, ou dans un bain à ultrasons, à une taille d'ADN d'environ 400bp. Lorsque sonication, assurez-vous que la chromatine ne sera pas chauffé au-dessus d'environ 30 ° C pour protéger sensibles à la chaleur réticule. La durée de la sonication doit être déterminée expérimentalement, car il varie significativement entre les appareils sonication différents. Pour obtenir des conseils, des paramètres pour deux appareils différents sont prévus:
Pour sonication avec une marque de Bandelin sonotrode chromatine exposer dans le tube 0.6ml microcentrifugeuse cinq fois à 20 coups avec les paramètres de 25% de puissance, cycle = 50. Ce faisant, l'échantillon fraîche après chaque 20 ème éclate dans un bain de glace.
Pour sonication avec un bain à ultrasons Bioruptor Diagenode, remplissez salle de bain avec eau et la glace et soniquer dix fois pendant 30 secondes en microtubes de 1,5 ml avec réglage «élevé». Après toutes les 30 secondes, les échantillons au frais pendant 30 secondes.
- Spin soniqué échantillon pour 5min à 16.000 g à 4 ° C pour précipiter matière non dissoute. Le surnageant peut être directement utilisé pour l'immunoprécipitation. Alternativement, les échantillons peuvent être un choc congelés dans l'azote liquide et stockés à -80 ° C jusqu'à utilisation ultérieure.
3. Immunoprécipitation
- Préparer microtubes de 2 ml contenant la protéine A 40μL. Agarose et 1,8 ml d'anticorps contraignant tampon Ajouter 200 ul de la préparation de chromatine (étape 2.13).
- Incuber les tubes pour 1h sur un agitateur vertical.
- Jeter la protéine A billes d'agarose et l'utilisation surnageant pour immunoprécipitation.
- Supprimer une partie aliquote 40μL-pour déterminer la concentration de chromatine ('input').
- Ajouter 30μL protéines-A. Agarose et le montant de la modification d'anticorps spécifique qui est indiqué dans le tableau ci-dessous des réactifs et équipements spécifiques à la suspension chromatine soniquée 400μL
- Incuber pendant 2.5h ou toute la nuit sur un agitateur vertical à 4 ° C.
- Isoler perles pour 2min à 440 x g.
- Lavez perles culot avec 900μL de chaque tampon de lavage (voir la liste ci-dessous). Pour chaque tampon, perles incubation dans le tampon pendant 10 minutes sur un agitateur vertical à 4 ° C, puis de spin pour 2min à 440 xg, éliminer le surnageant et ajouter le tampon suivant.
- Faible tampon de lavage du sel
- Haute tampon de lavage du sel
- LiCl tampon de lavage
- TE tampon de lavage
- Après le lavage final, enlever complètement toute tampon restant.
4. De-réticulation des histones et l'ADN, et la purification de l'ADN précipité
- Ajouter 100 pi de tampon de-réticulation au culot d'agarose et de l'échantillon «d'entrée» du 40μl de l'étape 3.4, mélanger pendant 5min sur un vortex, les échantillons de spin, et incubateursBate à 65 ° C pendant la nuit.
- Purifier l'ADN avec un ADN commercial ou kit de purification de PCR.
- Typiquement 5uL de la dilution 1:05 de l'éluat de la colonne finale sont suffisants pour effectuer conventionnelles spécifiques de locus en temps réel RT-PCR quantitative (RT-qPCR).
5. Table des tampons
| Mémoire tampon de réticulation | |
| Butyrate de sodium | 10mM |
| Saccharose | 400mm |
| Tris-HCl, pH 8,0 | 10mM |
| β-mercaptoéthanol | 5mM |
| Formaldéhyde | 3% (v / v) |
| Tampon d'extraction n ° 1 | |
| Butyrate de sodium | 10mM |
| Saccharose | 400mm |
| Tris-HCl, pH 8,0 | 10mM |
| β-mercaptoéthanol | 5mM |
| Inhibiteur de protéase complète | 1x |
| Tampon d'extraction n ° 2 | |
| Butyrate de sodium | 10mM |
| Saccharose | 250mm |
| Tris-HCl, pH 8,0 | 10mM |
| β-mercaptoéthanol | 5mM |
| MgCl 2 | 10mM |
| Triton X-100 | 1% (p / v) |
| Inhibiteur de protéase complète | 1x |
| Tampon d'extraction n ° 3 | |
| Butyrate de sodium | 10mM |
| Saccharose | 1,7 M |
| Tris-HCl, pH 8,0 | 10mM |
| β-mercaptoéthanol | 5mM |
| MgCl 2 | 2mM |
| Triton X-100 | 0,15% (p / v) |
| Inhibiteur de protéase complète | 1x |
| Tampon de sonication | |
| Tris-HCl, pH 8,0 | 25mM |
| EDTA-NaOH, pH 8,0 | 5mM |
| SDS | 0,5% (p / v) |
| Inhibiteur de protéase complète | 1x |
| Buffer fixation des anticorps | |
| Tris-HCl, pH 8,0 | 50mM |
| EDTA-NaOH, pH 8,0 | 1mM |
| NaCl | 150 mM |
| Triton X-100 | 0,1% (p / v) |
| Faible tampon de lavage du sel | |
| NaCl | 150 mM |
| SDS | 0,1% (p / v) |
| Triton X-100 | 1% (p / v) |
| EDTA-NaOH, pH 8,0 | 2mM |
| Tris-HCl, pH 8,0 | 20 mM |
| Haute tampon de lavage du sel | |
| NaCl | 500mm |
| SDS | 0,1% (p / v) |
| Triton X-100 | 1% (p / v) |
| EDTA-NaOH, pH 8,0 | 2mM |
| Tris-HCl, pH 8,0 | 20 mM |
| LiCl tampon de lavage | |
| Le chlorure de lithium | 250mm |
| Nonidet-P40 | 1% (v / v) |
| Désoxycholate de sodium | 1% (p / v) |
| EDTA-NaOH, pH 8,0 | 1mM |
| Tris-HCl, pH 8,0 | 20 mM |
| TE tampon de lavage | |
| EDTA-NaOH, pH 8,0 | 10mM |
| Tris-HCl, pH 8,0 | 1mM |
| Buffer Decrosslinking | |
| Tris-HCl, pH 6,8 | 62.5mm |
| NaCl | 200 mM |
| SDS | 2% (p / v) |
| TNT | 10mM |
6. Les résultats représentatifs:
L'expression du gène de la défense d'Arabidopsis thaliana codant pour une β PR2-1,3-glucanase ayant une activité antimicrobienne 12, a été induite par benzothiadiazole (BTH), un analogue synthétique de l'acide salicylique, hormone végétale 3. La figure 1 montre que l'activation du PR2 expression est associée à une augmentation de l'acétylation des résidus lysine des histones H3 et H4 sur le promoteur PR2. Comme la densité diminue au cours de 13 nucléosome activation des gènes, les valeurs ont été normalisées acétylation des histones pour le signal obtenu avec un anticorps à une région invariante de 3 histones.
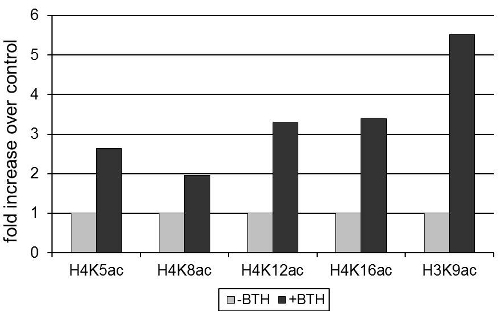
Figure 1 BTH induit l'acétylation des histones sur le promoteur PR2 chez Arabidopsis. Les plantes ont été traitées avec 100 microns BTH ou un contrôle de poudre mouillable. Après 72h, les feuilles ont été recueillies et de la chromatine a été isolé. Le signal obtenu après précipitation avec l'acétylation des anticorps spécifiques (comme indiqué dans la figure) a été normalisé au signal obtenu par précipitation avec un anticorps à un domaine invariant de l'histone H3. Chromatine précipité a été quantifiée par RT-qPCR. Les données sont normalisées pour les niveaux modification des histones, en l'absence de traitement BTH.
Discussion
Étapes les plus critiques dans le protocole sont la réticulation de l'ADN et les histones, le type et la quantité de matériau de feuilles, broyage de la matière, et la sonication de la chromatine. Pour une discussion plus détaillée de ces questions, voir refs. 9 et 10.
Sonication et réticulation:
Il est important de perturber la chromatine pendant la sonication à des fragments d'environ 400bp. Sonication exhaustive va détruire la chromatine en perturbant l'ADN et les histones, alors que la sonication insuffisante va laisser des fragments de chromatine longtemps. Ceux-ci affectent la spécificité de la méthode, parce que les modifications des histones distale du locus testés ne peuvent être discriminés par des modifications locales. L'efficacité sonication est mieux testée par 20 pi de la chromatine collecte des échantillons avant et après traitement par ultrasons, de réticulation de l'ADN et les histones, isoler l'ADN et de déterminer la longueur de l'ADN cisaillé par électrophorèse sur gel. RNAse devraient être ajoutés aux échantillons avant l'électrophorèse, parce que la préparation de chromatine contient encore de grandes quantités d'ARN à ce stade de la purification qui pourraient interférer avec la visualisation de l'ADN fragmenté. Les échantillons sont utiles pour immunoprécipitation de la chromatine, si l'ADN de la non-cisaillée chromatine est plus long que 10kbp, tandis que l'ADN de la chromatine cisaillé formes d'un frottis avec une intensité maximale du signal autour de 400bp de l'ADN.
Nous utilisons régulièrement de 3% (v / v) de formaldéhyde réticulation chromatine dans des feuilles intactes, mais 1% (v / v) de formaldéhyde pourrait être suffisant dans la plupart des cas. Dans nos mains, les concentrations de formaldéhyde permettent des temps de sonication plus courtes et les signaux de fond dans des réactions PCR conséquente. Cependant, des quantités insuffisantes de formaldéhyde aboutissent souvent à faible reproductibilité du signal PCR entre expériences indépendantes. Ceci pourrait être dû à la pénétration insuffisante de feuilles avec du formaldéhyde à des concentrations faibles. Assurez-vous d'échanger votre stock de formaldéhyde souvent que le composé a tendance à se polymériser avec le temps. Les solutions de formaldéhyde ne sont stables que pendant un mois environ, et cette période est à peine prolongée par une stabilisation du méthanol. Il est conseillé de tester différentes concentrations de formaldéhyde lors de la création des conditions expérimentales.
Montant de la matière végétale et de rectification:
Il est important d'infiltrer de faibles quantités de matière végétale dans un grand volume de tampon pour éviter les feuilles collent les unes aux autres. Feuille coller aboutit souvent à une infiltration insuffisante de formaldéhyde. Par ailleurs, du matériel végétal trop de bloquer les pores du tissu miracloth. L'efficacité du broyage dépend considérablement de l'aide d'un mortier et un pilon avec une coupe parfaite. Nous avons régulièrement moudre avec un liquide refroidi à l'azote pilon et un mortier en l'absence de l'azote liquide supplémentaire de trois fois pendant 50 secondes jusqu'à ce que le matériel est broyé en une fine poudre.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Ce travail a été financé par la Fondation allemande des sciences (DFG) et l'Initiative d'excellence des gouvernements fédéral allemand et l'Etat.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Société | Numéro de catalogue | Commentaires |
|---|---|---|---|
| Protéine A-agarose | Roche | 11 134 515 001 | dépend de la classe d'anticorps |
| Protéine G-agarose | Roche | 11 243 233 001 | dépend de la classe d'anticorps |
| Anti-hyperacetyl-H4 | Millipore | 06-946 | nous avons utilisé 5uL |
| Anti-acétyl-H4K5 | Millipore | 07-327 | nous avons utilisé 5uL |
| Anti-acétyl-H4K8 | Millipore | 07-328 | nous avons utilisé 5uL |
| Anti-acétyl-H4K12 | Millipore | 07-595 | nous avons utilisé 5uL |
| Anti-acétyl-H4K16 | Millipore | 07-329 | nous avons utilisé 5uL |
| Anti-acétyl-H4K18 | Millipore | 07-354 | nous avons utilisé 1 microlitre |
| Anti-acétyl-H3K9 | Millipore | 07-352 | nous avons utilisé 5uL |
| Anti-acétyl-H3K14 | Millipore | 07-353 | nous avons utilisé 1 microlitre |
| Anti-triméthyl-H3K4 | Diagenode | PAB-003-50 | nous avons utilisé 5uL |
| Anti-diméthyl-H3K4 | Millipore | 07-030 | nous avons utilisé 5uL |
| Anti-monométhyl-H3K4 | Abcam | ab8895 | 2,5-10 ul |
| Anti-H3 | Abcam | ab1791 | nous avons utilisé pour vérifier la densité 1 microlitre d'histone |
| Bioruptor | Diagenode | UCD-200 à | |
| Sonotrode MS72 | Bandelin | ||
| Miracloth | Calbiochem | 475855 | |
| Inhibiteur de protéase complète | Roche | 11836145001 |
Références
- Eberharter, A., Becker, P. B. Histone acetylation: a switch between repressive and permissive chromatin. EMBO rep. 3, 224-229 (2002).
- Ruthenburg, A. J. Methylation of lysine 4 on histone H3: intricacy of writing and reading a single epigenetic. 25, 15-30 (2007).
- Jaskiewicz, M. Chromatin modification acts as a memory for systemic acquired resistance in the plant stress response. EMBO rep. 12, 50-55 (2011).
- Ng, D. W. Ordered histone modifications are associated with transcriptional poising and activation of the phaseolin promoter. Plant Cell. 18, 119-132 (2006).
- Offermann, S. Illumination is necessary and sufficient to induce histone acetylation independent of transcriptional activity at the C4-specific phosphoenolpyruvate carboxylase promoter in maize. Plant Physiol. 141, 1078-1088 (2006).
- Deng, W. Involvement of the histone acetyltransferase AtHAC1 in the regulation of flowering time via repression of FLOWERING LOCUS C in Arabidopsis. Plant Physiol. 143, 1660-1668 (2007).
- Benhamed, M. Arabidopsis GCN5, HD1, and TAF1/HAF2 interact to regulate histone acetylation required for light-responsive gene expression. Plant Cell. 18, 2893-2903 (2006).
- Bowler, C. Chromatin techniques for plant cells. Plant Journal. 39, 776-789 (2004).
- Orlando, V. Mapping chromosomal proteins in vivo by formaldehyde decrosslinked-chromatin immunoprecipitation. Trends Biochem. Sci. 25, 99-104 (2000).
- Haring, M. Chromatin immunoprecipitation: optimization, quantitative analysis and data normalization. Plant Meth. 3, 11-11 (2007).
- Danker, T. Developmental information but not promoter activity controls the methylation state of histone H3 lysine 4 on two photosynthetic genes in maize. Plant J. 53, 465-474 (2008).
- Uknes, S. Acquired resistance in Arabidopsis. Plant Cell. 4, 645-656 (1992).
- Workman, J. L. Nucleosome displacement in transcription. Genes Develop. 20, 2009-2017 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon