Method Article
Méthylation de l'ADN: bisulfite de modification et d'analyse
Dans cet article
Résumé
L'étalon-or pour l'analyse de la méthylation de l'ADN est le séquençage génomique de l'ADN au bisulfite convertis. Cette méthode tire parti de la sensibilité accrue de la cytosine par rapport à 5-méthylcytosine (5-MeC) au bisulfite désamination dans des conditions acides. Cytosines non méthylées peuvent être distingués des cytosines méthylées après amplification par PCR de l'ADN génomique cible.
Résumé
L'épigénétique décrit les changements héréditaires dans la fonction des gènes qui se produisent indépendamment de la séquence d'ADN. Les bases moléculaires de la régulation des gènes épigénétique est complexe, mais implique essentiellement des modifications de l'ADN lui-même ou les protéines avec lesquelles les associés d'ADN. La modification principale épigénétiques de l'ADN dans les génomes de mammifères est la méthylation des nucléotides cytosine (5-MeC). Méthylation de l'ADN donne des instructions aux machines d'expression génique de savoir où et quand le gène doit être exprimé. La séquence cible primaire pour méthylation de l'ADN chez les mammifères est 5'-CpG-3 'dinucléotides (figure 1). Dinucléotides CpG sont pas uniformément réparties dans tout le génome, mais sont concentrées dans les régions de séquences génomiques répétitives et de CpG «îlots» communément associés avec les promoteurs des gènes (figure 1). Méthylation de l'ADN sont établis au début du développement, modulée au cours différenciation des tissus spécifiques et perturbée dans de nombreux états pathologiques, y compris le cancer. Pour uomprendre le rôle biologique de méthylation de l'ADN et son rôle dans la maladie humaine, précise, efficace et reproductible méthodes sont nécessaires pour détecter et quantifier individuels 5-mecs.
Ce protocole pour la conversion au bisulfite est le «gold standard» pour l'analyse de méthylation de l'ADN et facilite l'identification et la quantification de la méthylation de l'ADN à la résolution seul nucléotide. La chimie de la désamination cytosine par le bisulfite de sodium comporte trois étapes (figure 2). (1) Sulfonation: L'addition de bisulfite au lien 5-6 double de la cytosine (2) La désamination Hydrolic: désamination hydrolytique de la cytosine-bisulfite résultant dérivés pour donner un dérivé de l'uracile-bisulfite (3) Desulphonation Alcali: Retrait du sulfonate groupe par un traitement alcalin, pour donner l'uracile. Bisulfite désamine préférentiellement cytosine en uracile dans l'ADN simple brin, alors que 5-MEC, est réfractaire à bisulfite médiée par désamination. Après amplification par PCR, l'uracile est amplifiéque la thymine, alors que 5-MeC résidus restent en cytosines, permettant CpG méthylés d'être distingué de CpG méthylés par la présence d'une cytosine "C" contre la thymine "T" de résidus au cours de séquençage.
Modification de l'ADN par la conversion au bisulfite est un protocole bien établi qui peut être exploité pour de nombreuses méthodes d'analyse de la méthylation d'ADN. Depuis la détection de la 5-MeC par la conversion au bisulfite a d'abord été démontré par Frommer et al. 1 et Clark et al. 2, les méthodes de conversion basé autour de bisulfite de compte ADN génomique pour la majorité des nouvelles données sur la méthylation de l'ADN. Différentes méthodes de post analyse PCR peut être utilisée, selon le degré de spécificité et de la résolution de la méthylation nécessaire. Le clonage et le séquençage est encore la méthode la plus facilement disponible qui peut donner seule résolution pour la méthylation de nucléotides dans la molécule d'ADN.
Protocole
Bisulfite de conversion de protocole
Un protocole standard pour la conversion de 2 ug d'ADN génomique est décrit ci-dessous. Quantités plus ou moins grande de l'ADN génomique (100 pg-200 pg) peuvent également être traités avec succès au bisulfite. Ces conditions de réaction suite à une conversion complète (de 99,5 à 99,7%) de presque toutes les séquences d'ADN cibles 3.
1. Préparation d'ADN
Préparer des échantillons par incubation de l'ADN génomique avec le tampon de lyse ADN au bisulfite (2 ug d'ARN t, 280 ng / ul protéinase K, SDS 1%) dans un volume total de 18 ul pendant 1 heure à 37 ° C. Note: Ceci est important pour atteindre la conversion au bisulfite maximale, en particulier avec l'ADN isolé à partir d'échantillons cliniques où il ya peut-être encore des protéines associées à l'ADN.
2. Dénaturation ADN
- ADN Dénaturer mg 2 dans un volume de 20 ul en ajoutant 2 ul de NaOH 3M fraîchement préparés à une finale Concentration de 0,3 M.
- Incuber les échantillons à 37 ° C pendant 15 min dans un bain d'eau, suivie d'une incubation à 90 ° C pendant 2 min dans un bloc thermique. Placez immédiatement les tubes sur la glace pendant 5 min.
- Centrifuger les tubes à 4 ° C pendant 10 s à 10 000 g, pour assurer l'ADN est au fond du tube.
3. Désamination bisulfite
Sulfonation & désamination hydrolytique
- Préparer des solutions fraîches de 10 mM Quinol et saturés 5,0 métabisulfite de sodium pH (7,6 g de Na 2 S 2 O 5 avec 464 ul de 10 M NaOH, composé à 15 ml avec de l'eau). La solution de bisulfite de sodium saturée est obtenue en retournant doucement le réactif / H 2 O mélange, avec un mélange minimum et d'aération. Si nécessaire, ajuster le pH avec NaOH 10 M, pour la dissolution complète de la Note métabisulfite:. Comme il s'agit d'une solution saturée, de petits morceaux peut rester non dissous.
- Ajouter 208ul du métabisulfite saturés et 12 pl d'Quinol 10mm à l'ADN dénaturé (20 pi), dans un volume final de 240 ul à une concentration finale de 2.31m bisulphite/0.5mM Quinol, pH 5,0. Mélanger délicatement tous les réactifs et centrifuger pendant 10 secondes afin d'assurer toutes les gouttelettes sont au fond du tube.
- Superposition des échantillons avec 200 ul d'huile minérale. Incuber les échantillons à 55 ° C dans un bain d'eau, pour 4-16 heures. La durée du traitement au bisulfite est dépendante de la quantité et la qualité de l'ADN à se convertir. Pour l'ADN de mauvaise qualité ou de l'ADN dégradé, limiter le temps d'incubation de 4 heures. Note: il est important que que la conversion au bisulfite a lieu dans l'obscurité pour éviter l'oxydation, donc si ce n'est pas possible, enveloppez dans du papier les tubes avant l'incubation .
- A la fin de la période d'incubation appropriée, centrifuger les tubes brièvement dans une microcentrifugeuse pour s'assurer que tout le liquide est au fond du tube.
- Récupérer l'ADN au bisulfite traitéssous la couche d'huile en prenant soin de pipetage à la solution d'ADN à partir du bas du tube, sans prendre aucune des huiles minérales.
Dessalage
- Retirez tous les ions libres bisulfite en passant par une colonne de dessalage et élution dans 50 pi de l'eau milli-Q (MQH 2 O). Selon la quantité et la qualité de l'ADN génomique et comment il est préparé, les différentes colonnes de dessalement peuvent être utilisés. Nous utilisons régulièrement Promega Wizard Nettoyer colonnes, comme ces colonnes sont appropriées pour éliminer le SDS utilisés dans la préparation de l'ADN avant la conversion.
Desulphonation Alkali
- L'adduit de bisulfite est retiré de l'anneau uracile par desulphonation. Desulphonate en ajoutant 5,5 ul de NaOH 3M fraîchement préparées à une concentration finale de 0,3 M, puis incuber les échantillons à 37 ° C pendant 15 min.
- Centrifuger brièvement et ajouter 1 l de t ARN (10 mg / ml).
- Neutraliser la solution par l'ajout de 33 ul d'acétate d'ammonium (NH 4 O Ac), pH 7,0 à une concentration finale de 3M.
- L'éthanol-précipiter l'ADN en ajoutant 330 pl d'éthanol à 100% de la glace froide, bien mélanger par inversion. Laisser au-20μC pendant 1 heure pour une nuit. Centrifuger à 14000 g pendant 15 min à 4 ° C. Enlever toute trace de surnageant et sécher à l'air l'ADN précipité pour ~ 20 min.
- Re-suspendre le culot d'ADN dans 50 ul / pg de 0,1 TE O. (10 mM Tris-HCl, 0,1 mM EDTA, pH 8,0) ou H 2 Laisser à température ambiante pendant environ 2 heures. Parfois les tubes vortex pour s'assurer que l'ADN est dissous, suivie par une centrifugeuse rapide.
- Utiliser immédiatement pour l'amplification PCR, ou conserver à -20 ° C pour les 1-10 ans en fonction de la quantité et la qualité de l'ADN.
4. Amplification PCR
Conception d'amorce
- La conception efficace de conversion au bisulfite PCR des amorces spécifiques sont Crucial pour s'assurer que l'efficacité, l'amplification de l'ADN impartiale complètement converti survient. Les directives suivantes sont utilisées pour faciliter la conception d'amorces.
Directives de conception d'amorce

Thermocyling
- Pour tester l'amplification par PCR de l'ADN méthylé proportionnelle et non méthylé, utilisez un méthylées 50:50 / non méthylé échantillon pleinement bisulfite de contrôle et d'amplifier convertis avec le bisulfite de conversion des amorces spécifiques dans les conditions optimisées de réaction PCR (figure 3). Pour l'50:50 méthylées: non méthylé de contrôle, l'utilisation in vitro de l'ADN méthylé et SISP, soit du génome entier amplifié (WGA) ADN ou ADN du sang total. S'il vous plaît être conscient que certains gènes seront naturellement méthylé dans le sang et donc dans ces cas il est préférable de n'utiliser que WGA ADN en tant que "non méthylé« contrôle.
- Préparer des mélanges réaction d'amplification par PCR dans 100 & mu; aliquotes l contenant 2 ul de bisulfite de l'ADN génomique convertis, 200 uM de dNTP, 1 uM amorces, 1,5 mM MgCl2, KCl 50 mM, 10 mM Tris-HCL, pH 8,3 et 0,15 polymérase Taq ul.
- Dans un thermocycleur gradient de température, réglez la réaction s'exécuter dans un gradient de + / - 3 ° C de la Tm prédit de l'amorce à travers 10 tubes

- Pour vérifier que les amplicons méthylé et non méthylé ont été amplifiés en proportion, l'amplicon peut être digéré par une enzyme de restriction informatif, telles que la Taq 1 (TCGA), qui va digérer l'ADN méthylé, mais ne sera pas digérer l'ADN non méthylé où le site d'enzyme de restriction est modifié après la conversion au bisulfite à TTGA. L'étendue de la digestion peuvent être visualisés par électrophorèse sur gel (figure 3A). Alternativement, SybrGreen (0,2 l de dilution de 1:1000) peuvent être ajoutés à la réaction de PCR et del'ampleur de la méthylation peut être évaluée en effectuant la chaleur de dissociation des parcelles dans un thermocycleur PCR en temps réel (figure 3B).
- Mélange de PCR dont MgCl2 conditions de concentration et de thermocyclage peut-être besoin d'être ajustée pour augmenter l'efficacité de PCR ou d'assurer proportionnelle amplification par PCR de méthylées et non méthylées fragments PCR.
- Une fois les conditions de PCR sont optimisées, l'amplification par PCR peut être effectuée sur des échantillons de bisulfite de convertis. Remarque: Une fois que le Tm est optimisé un gradient de température PCR ne doivent pas être utilisés.
5. Les résultats représentatifs:
Un exemple d'optimisation de bisulfite de l'amplification par PCR est indiquée dans la Figure 3. Les conditions optimales de l'amplification par PCR devrait amplifier amplicons méthylé et non méthylé dans la proportion et sans préjugé. La figure 3A montre un gel d'agarose avec un profil de gradient de température amplification par PCR à partir d'un mélange d'ADN méthylé et 50% non méthylés. Th.e amplicons de PCR ont été traités avec une enzyme de restriction, la Taq 1 (TCGA), qui digèrent méthylé (M) d'ADN, mais ne sera pas digérer non méthylé (U) l'ADN comme le site d'enzyme de restriction est altérée par la conversion au bisulfite à TTGA. Une quantité égale de coupés et non coupés produit de PCR est prévu si l'ADN méthylé et non méthylé est amplifié en proportion. On peut voir sur ce gel que les conditions optimales pour thermocyling non biais d'amplification est à 56,1 ° C (T). La conversion complète de l'ADN au bisulfite peuvent également être analysés par digestion avec la cytosine place enzyme spécifique tels que HPA III (CCBG). Hpa III ne digèrent si la conversion a échoué, comme le site de restriction seront maintenues. Si la conversion est terminée, le site de restriction seront convertis en TCGG ou TTGG fonction de l'état de méthylation de l'ADN. Remplissez la conversion au bisulfite d'ADN peut être vu dans la figure 3A (H).
La figure 3B montre un tracé en temps réel de dissociation que lespeut également être utilisé comme un outil pour déterminer s'il existe un biais d'amplification basée sur la température à laquelle les différentes molécules se dissocient. Dans cette figure, on peut voir que le PCR a amplifié méthylé (M) et non méthylé (U) de l'ADN dans la proportion d'un mélange de l'ADN méthylé et de 50% par rapport à non méthylé de l'amplification de l'ADN de contrôle totalement dénaturé et non méthylé qui se dissocient au 82.1μC et 78.9μC respectivement.
Après l'optimisation des conditions de réaction et de thermocyling Bisulfite échantillons traités peuvent être amplifiées avec volet spécifique et le bisulfite amorces spécifiques soit dans une seule réaction de PCR nichée ou semi. Les fragments PCR résultants peuvent être visualisés par électrophorèse sur gel et séquencées, soit directement (figure 4A) ou par clonage et séquençage. Après clonage et séquençage de l'état de méthylation des molécules individuelles peuvent être totalisées, dans une carte de bisulfite (figure 4B), de visualiser l'hétérogénéité desméthylation.
Haute analyse de la méthylation débit quantitatives peuvent être préformées en utilisant une telle technologie que celle utilisée par la méthode EpiTYPER Sequenom. En utilisant cette méthode, le bisulfite de l'ADN converti est amplifié avec des amorces spécifiques de bisulfite PCR et suivie par un processus de clivage exclusive d'. Les fragments résultants sont quantifiés par spectrométrie de masse MALDI-TOF avec le spectre spécifique dépendant de la présence de cytosines méthylées (figure 5A). Un résumé des rapports de la méthylation de l'échantillon peut ensuite être extrapolées sous la forme d'une épigramme (figure 5B) ou de la parcelle méthylation (figure 5C).
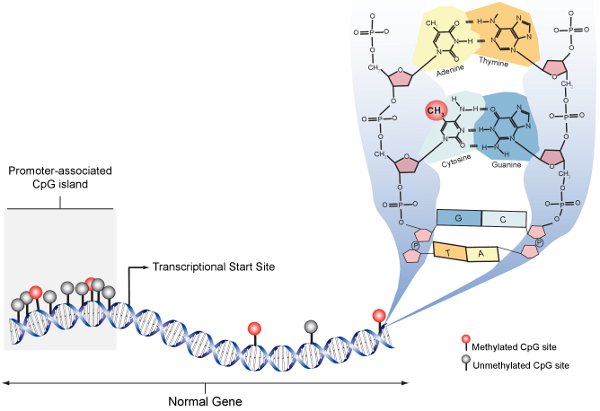
Figure 1. Méthylés CpG schématique. Dans la cellule normale, promoteur-associé îlots CpG non méthylés sont majoritairement (gris), alors que les sites CpG au sein des instances du gène sont rares et généralement méthylé (rouge). Le panneau sur la droite étend la structure moléculaireUre de l'ADN à un site individuel CpG et montre la méthylation avec une molécule CH3 au carbone 5 de la cytosine.
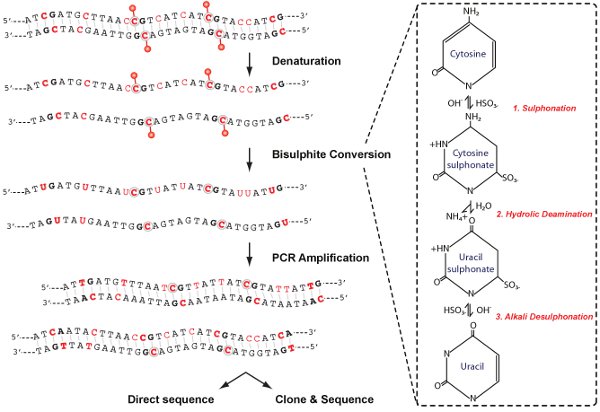
Figure 2. . Conversion chimique schéma d'analyse de la méthylation de l'ADN comprend quatre étapes principales, comme indiqué; dénaturation, la conversion au bisulfite, l'amplification par PCR et d'analyse. Dans le panneau de droite, des modifications à la molécule de cytosine qui se produisent lors de la conversion au bisulfite sont représentés.
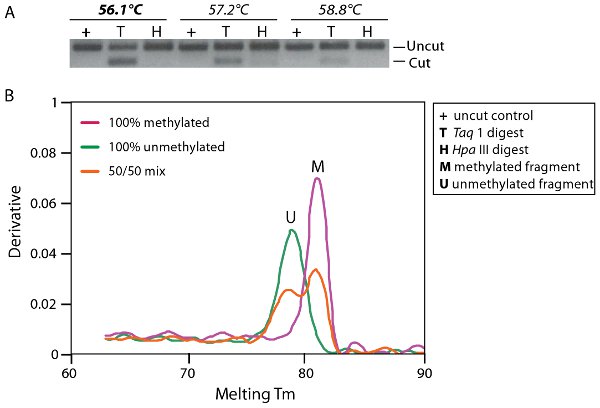
Figure 3. Optimisation de l'amplification par PCR. A. Électrophorèse sur gel avec un profil de gradient de température amplification par PCR à partir d'un mélange d'ADN méthylé et 50% non méthylés. Des fragments ont été digérés avec soit Taq1 (T) ou HpaIII (H) qui digèrent l'ADN méthylé et non l'ADN au bisulfite convertis respectivement. B. Chauffer l'analyse montre une courbe de dissociation équationla proportion de l 'ADN méthylé et non méthylé (ligne rouge mélange 50/50) par rapport à l'amplification totalement le contrôle de méthylé (ligne rose, M) et de l'ADN non méthylé (ligne verte, U) qui se dissocient à 82,1 ° C et 78,9 ° C respectivement.
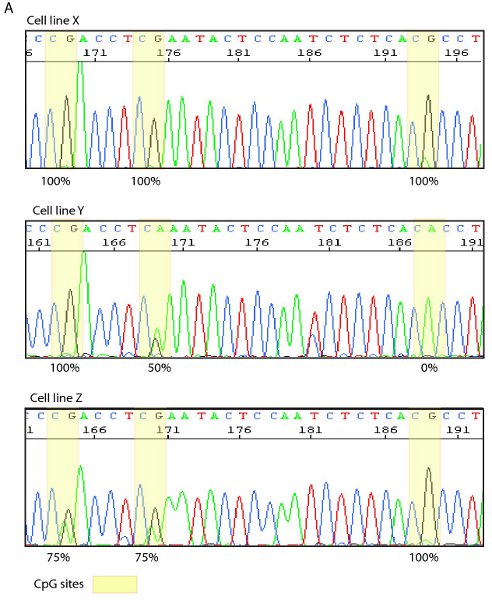
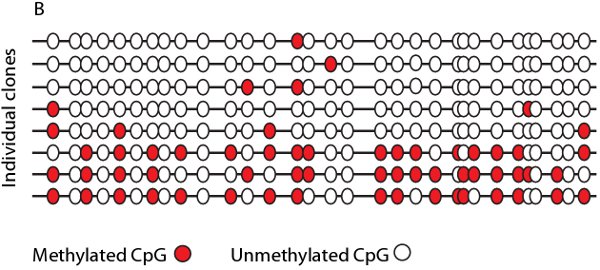
Figure 4. Exemple de séquençage direct et d'une carte de bisulfite. A. Traces de séquence de trois lignées cellulaires différentes avec des sites CpG surlignés en jaune. Cellule ligne X affiche méthylation de 100% sur les trois sites CpG alors des lignées de cellules Y et Z montrent des degrés variables de méthylation tel que vu par chevauchement G / A des signaux. B. Représentant bisulfite carte montrant la densité de la méthylation (points rouges) à chacun des sites CpG, tel que déterminé par séquençage direct des clones individuels.
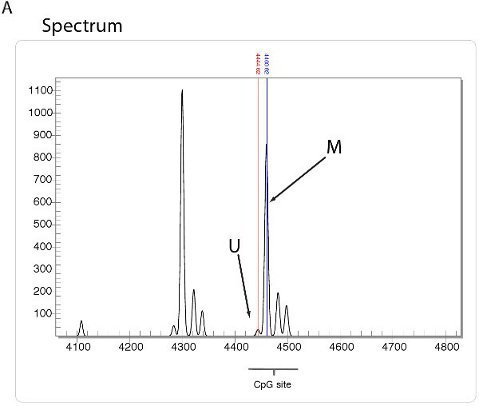
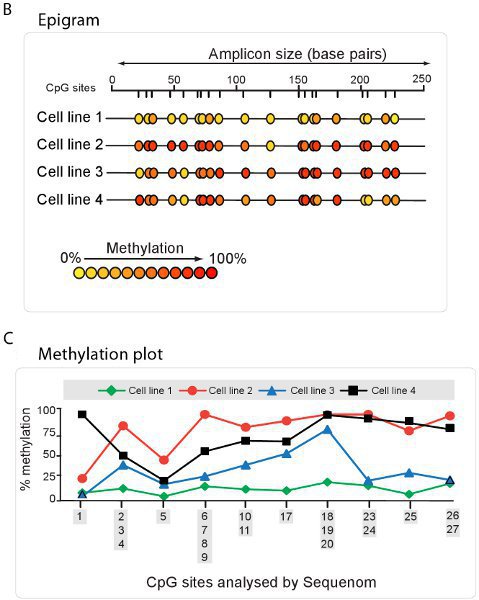
Figure 5. Haute analyse de la méthylation d'ADN à l'aide de Sequenom. A. Vue du spectre à l'aide de Sequenom EpiTYPER technologie. Des fragments d'ADN d'affichage des spectres spécifiques, en fonction de la quantité de méthylation de l'ADN présents. B. Epigram résumé du pourcentage de méthylation de l'ADN de chaque site CpG pour quatre différentes lignées cellulaires. C. Résumé complot méthylation issus de l'épigramme de Sequenom.
Discussion
Analyse de la méthylation de l'ADN par séquençage génomique de l'ADN transformé bisulfite est une méthode bien établie et polyvalent qui facilite l'identification et la quantification de la méthylation de l'ADN à la résolution seul nucléotide. Toutefois, la conversion au bisulfite et l'analyse ultérieure repose sur la prémisse que l'ADN a été entièrement transformé avec chaque cytosine non méthylée en uracile étant désaminée et seulement cytosines méthylées restent non-réactive. Si la conversion est incomplète, des problèmes peuvent survenir avec l'analyse depuis inconvertis cytosines non méthylées peut être interprétée à tort comme cytosines méthylées. La conversion au bisulfite peut être optimisée à différents stades de maximiser le pourcentage de conversion. Pour l'ADN pour être entièrement transformée elle doit d'abord être simple brin de sorte que les résidus cytosine sont exposés à des ions bisulfite. La première étape, la dénaturation de l'ADN, est critique et peut être la source de la conversion incomplète si l'ADN n'est pas complètement dénaturé. Pour assurerque l'ADN est complètement dénaturé, il est important que les paramètres de la réaction, y compris l'enlèvement de toutes les protéines associées, la concentration en sel échéant, la température d'incubation et le temps sont adaptés pour maintenir l'ADN de conformation simple brin. Il est important d'utiliser des frais NaOH 3M et de permettre un temps d'incubation adéquate. Si l'ADN est résistant à la dénaturation, quelques modifications au protocole, y compris l'extension du temps d'incubation à 30 minutes ou de fragmenter l'ADN avant la dénaturation peut faciliter dénaturation de l'ADN. En outre, l'ADN simple brin (ADNsb) peut re-recuit d'ADN double brin (ADNdb) lors de la réaction de conversion au bisulfite. Réaliser la réaction à une température plus élevée (90-95 ° C) soit périodiquement, soit en continu pendant la réaction au bisulfite peut aider au maintien de ADNsb. Cependant, il est important d'être conscient que la dégradation de l'ADN est fortement accélérée à ces températures plus élevées. Différents réactifs peuvent également être ajoutés à perturber re-recuit de ebrins d'ADN e, tels que l'urée.
La concentration de l'ADN et sa qualité peut également affecter l'efficacité de la réaction au bisulfite et ultime de rendement PCR. Dégradation de l'ADN est une limitation du protocole de conversion au bisulfite. Le traitement chimique de l'ADN introduit dans les différentes cassures simple brin et une partie des dures conditions nécessaires pour la conversion au bisulfite complète y compris la concentration de bisulfite de haut, les temps d'incubation est longue peuvent accélérer la dégradation de l'ADN. Dans les conditions réactionnelles standard décrit, la dégradation de l'ADN n'est pas un problème commun cependant, si des modifications du protocole sont introduits, tels que des séquences qui sont réfractaires à la conversion, pour les matrices d'ADN qui sont dégradés ou de mauvaise qualité tels que des échantillons FFPE, puis la dégradation de l'ADN peut devenir une limitation importante.
Le formol fixes, inclus en paraffine (FFPE) et des échantillons d'ADN dégradé peut être efficacement converti au bisulfite et amplifiée en utilisant ce protocoleCependant des modifications pour s'assurer que l'ADN n'est pas encore dégradé sont conseillés. L'utilisation d'un ARN porteur tel que le t ARN est recommandée. Aussi glycogène peut être ajouté en tant que transporteur lorsque la concentration en ADN est faible (<200 ng). Parce que l'ADN isolé à partir des tissus FFPE est déjà fragmenté et fragmentation a lieu pendant la désamination, des précautions doivent être prises pour minimiser la dégradation de l'autre. Ne pas le fragment d'ADN plus loin avant dénaturation et de limiter le temps d'incubation pour la réaction au bisulfite à 4 heures. Conception amplicons pas dépasser 300 pb en raison de l'ADN fragmenté.
Un autre facteur qui peut affecter l'amplification par PCR que la conversion au bisulfite de cytosines non méthylées réduit la complexité de la matrice d'ADN. Le protocole d'amorces suivantes de conception présentés dans la section 4.1, longueur de l'amorce accrue et PCR nichée pouvons tous contribuer à accroître la spécificité et le rendement de PCR.
Enfin, puisque la matrice d'ADN est altéré au cours bisulphite de conversion, le biais d'amplification peut être un sujet de préoccupation. Assurez-vous que l'amplification par PCR des modèles proportionnels méthylé et non méthylé est vérifié avec un contrôle 50/50 M / U mélange d'ADN, tel que décrit dans le protocole, voir la figure 3. Assurez-vous également que l'amplification de modèles seulement converti qui se passe à l'aide d'enzymes de restriction et électrophorèse sur gel HpaIII (figure 3). Les conditions de PCR peuvent avoir besoin d'être optimisé en faisant varier la concentration de température et / ou de magnésium ou l'allongement du temps de prolongation. Certains modèles semblent être particulièrement problématique et de la position primaire peut être nécessaire d'ajuster ou d'amorces dégénérées peut-être besoin d'être utilisé.
Suivant les techniques de séquençage de nouvelle génération sont en évolution rapide pour parvenir à une résolution semblable à bisulfite séquençage génomique, et la troisième séquençage molécule seule génération a le potentiel pour permettre l'analyse de l'ADN à la fois primaire et la méthylation sans la nécessité pour le séquençage au bisulfite. Cependant, une grande disponibilité et spécificationsificity de ces techniques restent un certain temps loin. Séquençage génomique au bisulfite est le gold standard en matière d'analyse de méthylation et est un protocole robuste. La méthode a progressé au point où les problèmes communs et les limites ont été résolus et les applications se sont développées à partir d'analyses des gènes individuels à haut débit et d'analyse du génome entier décrit par Clark et al. 2006 4. Dépannage des directives et des recommandations additionnelles, sont décrits dans le tableau 1. Il est suggéré que l'approche optimale consiste à d'abord suivre le protocole standard et seulement introduire de modification si et quand un problème survient.
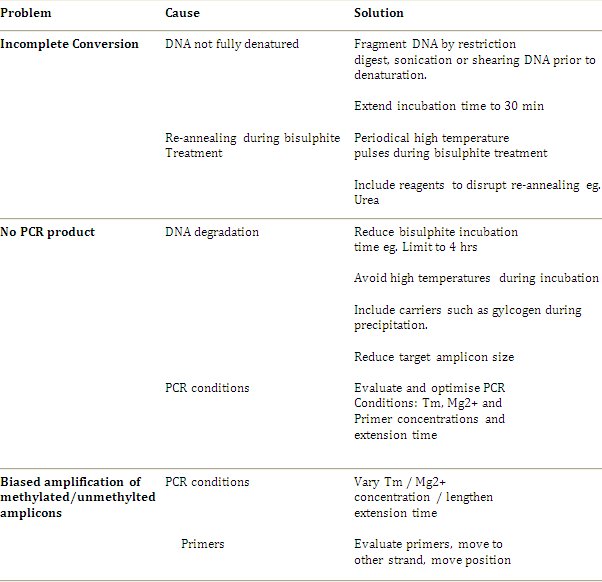
Tableau 1. Instructions de dépannage
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
matériels
- Métabisulfite de sodium (Ajax Finechem)
- L'hydroquinone (Merck)
- Assistant ADN système de nettoyage (Promega)
Références
- Frommer, M. A genomic sequencing protocol that yields a positive display of 5-methylcytosine residues in individual DNA strands. Proc. Natl. Acad. Sci. U. S. A. 89, 1827-1831 (1992).
- Clark, S. J. High sensitivity mapping of methylated cytosines. Nucleic. Acids. Res. 22, 2990-2997 (1994).
- Grunau, C., Clark, S. J., Rosenthal, A. Bisulfite genomic sequencing: systematic investigation of critical experimental parameters. Nucleic. Acids. Res. 29, E65-E65 (2001).
- Clark, S. J. DNA methylation: bisulphite modification and analysis. Nat. Protoc. 1, 2353-2364 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon