Method Article
Metilazione del DNA: Modifica bisolfito e analisi
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Il gold standard per l'analisi di metilazione del DNA è il sequenziamento del DNA genomico di bisolfito convertito. Questo metodo sfrutta l'accresciuta sensibilità della citosina rispetto ai 5-metilcitosina (5-MEC) di bisolfito deaminazione in condizioni acide. Cytosines non metilato può essere distinto dal cytosines metilato dopo amplificazione del DNA genomico di destinazione.
Abstract
Epigenetica descrive le modifiche ereditabili nella funzione del gene che si verificano in modo indipendente per la sequenza del DNA. Le basi molecolari della regolazione genica epigenetica è complessa, ma riguarda essenzialmente modifiche alla stessa DNA o le proteine con che associa DNA. La modifica predominante epigenetici del DNA nei genomi dei mammiferi è metilazione di nucleotidi citosina (5-MEC). Metilazione del DNA fornisce istruzioni alle macchine di espressione genica da dove e quando il gene deve essere espresso. La sequenza target primario per la metilazione del DNA nei mammiferi è 5'-CpG-3 'dinucleotidi (Figura 1). Dinucleotidi CpG non sono distribuite uniformemente in tutto il genoma, ma sono concentrati nelle regioni di sequenze genomiche CpG ripetitivi e "isole", comunemente associato con i promotori dei geni (Figura 1). Metilazione del DNA sono nelle prime fasi di sviluppo, modulato durante la differenziazione dei tessuti specifici e interrotto in molti stati patologici tra cui il cancro. Per understand il ruolo biologico della metilazione del DNA e del suo ruolo nelle malattie umane, preciso, efficace e riproducibile i metodi sono necessari per rilevare e quantificare i singoli 5-MEC.
Questo protocollo per la conversione di bisolfito è il "gold standard" per l'analisi di metilazione del DNA e facilita l'identificazione e quantificazione di metilazione del DNA a singolo nucleotide risoluzione. La chimica della citosina deaminazione da bisolfito di sodio comporta tre fasi (Figura 2). (1) solfonazione: L'aggiunta di bisolfito al legame doppio 5-6 della citosina (2) Hydrolic deaminazione: deaminazione idrolitica del conseguente citosina-bisolfito derivati per dare un uracile-bisolfito derivati (3) Desulphonation Alcali: La rimozione del solfonato gruppo da un trattamento alcalino, per dare l'uracile. Bisolfito deamina preferenzialmente citosina a uracile nel DNA a singolo filamento, mentre la 5-MEC, è refrattario al bisolfito-mediata deaminazione. Su PCR, uracile è amplificatocome timina mentre 5-MEC residui permangono come cytosines, permettendo CpG metilati deve essere distinta da CpG non metilato dalla presenza di una "C" contro citosina timina residuo "T" durante la sequenza.
Modificazione del DNA mediante conversione bisolfito è una consolidata protocollo che può essere sfruttato per molti metodi di analisi di metilazione del DNA. Dal momento che la rilevazione di 5-MEC di conversione bisolfito per la prima volta dimostrato da Frommer et al. 1 e Clark et al. 2, basati su metodi di conversione bisolfito di conto DNA genomico per la maggior parte dei nuovi dati sulla metilazione del DNA. Diversi metodi di analisi post-PCR può essere utilizzata, a seconda del grado di specificità e risoluzione di metilazione richiesto. La clonazione e il sequenziamento è ancora il metodo più facilmente disponibile che può dare singolo nucleotide risoluzione per metilazione attraverso la molecola di DNA.
Protocollo
Bisolfito di conversione di protocollo
Un protocollo standard per la conversione di 2 mg di DNA genomico è descritto di seguito. Quantità più piccole o più grandi di DNA genomico (100 pg-200 mg) può essere trattata con successo bisolfito. Queste condizioni di reazione risultato in completa conversione (99,5-99,7%) di quasi tutte le sequenze di DNA 3.
1. Preparazione del DNA
Preparare i campioni di DNA genomico incubazione con tampone Lysis bisolfito DNA (2 mg t RNA, 280 ng / mL proteinasi K, 1% SDS) in un volume totale di 18 microlitri per 1 ora a 37 ° C. Nota: Questo è importante da raggiungere bisolfito di conversione massimo, soprattutto con DNA isolato da campioni clinici in cui ci possono essere ancora delle proteine associate al DNA.
2. Denaturazione del DNA
- Denaturare il DNA 2 mg in un volume di 20 l, aggiungendo 2 ml di NaOH 3M appena preparati ad un finale concentration di 0.3M.
- Incubare i campioni a 37 ° C per 15 minuti in un bagno d'acqua, seguita da incubazione a 90 ° C per 2 minuti in un blocco di calore. Immediatamente posto i tubi in ghiaccio per 5 min.
- Centrifugare le provette a 4 ° C per 10 s a 10.000 g, per garantire il DNA è alla base del tubo.
3. Deaminazione bisolfito
Solfonazione e deaminazione idrolitica
- Preparare soluzioni fresche di 10 mm Quinol e saturi pH 5,0 metabisolfito di sodio (7,6 g di Na 2 S 2 O 5 con 464 ml di NaOH 10 M, composta da 15 ml con acqua). La soluzione di bisolfito di sodio saturo si ottiene capovolgendo delicatamente il reagente / miscela H 2 O, con minimo di miscelazione e l'aerazione. Se necessario, regolare il pH con NaOH 10 M, per la dissoluzione completa del metabisolfito. Nota: Trattandosi di una soluzione satura, grumi di piccole dimensioni può ancora indisciolto.
- Aggiungere 208microlitri della metabisolfito saturi e 12 ml di Quinol 10mM al DNA denaturato (20 l), in un volume finale di 240 microlitri di una concentrazione finale di 2.31M bisulphite/0.5mM Quinol, pH 5.0. Mescolare delicatamente tutti i reagenti e centrifugare per 10 secondi per assicurare tutte le goccioline sono alla base del tubo.
- Sovrapposizione dei campioni con 200 ml di olio minerale. Incubare i campioni a 55 ° C in un bagno d'acqua, per 4-16 ore. La durata del trattamento bisolfito dipende dalla quantità e qualità del DNA da convertire. Per il DNA di scarsa qualità o DNA degradato, limitare il tempo di incubazione di 4 ore. Nota: è importante che che la conversione bisolfito si svolge al buio per evitare l'ossidazione, quindi se questo non è possibile avvolgere i tubi in un foglio prima di incubazione .
- Al termine del periodo di incubazione del caso, girare i tubi brevemente in una microcentrifuga utilizzata per assicurare tutto il liquido è al fondo della provetta.
- Recuperare il DNA bisolfito trattatida sotto lo strato di petrolio con attenzione pipettamento la soluzione di DNA dalla parte inferiore del tubo, senza occupare uno degli oli minerali.
Dissalazione
- Rimuovere eventuali ioni liberi bisolfito passando attraverso una colonna di dissalazione e di eluizione in 50 ml di acqua Milli-Q (MQH 2 O). A seconda della quantità e qualità del DNA genomico e come si è preparato, diverse colonne di dissalazione possono essere utilizzati. Noi abitualmente uso Promega Wizard Clean up colonne, come queste colonne sono adatti per rimuovere le SDS utilizzate nella preparazione del DNA prima della conversione.
Desulphonation alcali
- L'addotto bisolfito viene rimosso dal ring da uracile desulphonation. Desulphonate con l'aggiunta di 5,5 ml di NaOH 3M appena preparati ad una concentrazione finale di 0,3 M, poi incubare i campioni a 37 ° C per 15 minuti.
- Centrifugare brevemente e aggiungere 1 l di t RNA (10 mg / ml).
- Neutralizzare la soluzione con l'aggiunta di 33 ml di acetato di ammonio (NH 4 O Ac), pH 7.0 a una concentrazione finale di 3M.
- Etanolo-precipitare il DNA con l'aggiunta di 330 ml di etanolo freddo ghiaccio al 100%, mescolare bene per inversione. Lasciare a-20μC per 1 ora a notte. Centrifugare a 14.000 g per 15 minuti a 4 ° C. Rimuovere tutte le tracce di surnatante e asciugare il DNA precipitato per circa 20 min.
- Risospendere il pellet in 50 microlitri di DNA / mg di 0,1 TE (10mM Tris-HCL, 0.1mm EDTA, pH 8,0) o H 2 O. Lasciate a temperatura ambiente per circa 2 ore. Occasionalmente vortice i tubi per garantire il DNA è disciolto, seguito da una centrifuga veloce.
- Utilizzare immediatamente per l'amplificazione PCR, o conservare a -20 ° C per 1-10 anni a seconda della quantità e qualità del DNA.
4. PCR di amplificazione
Primer di progettazione
- La progettazione efficace di PCR bisolfito di conversione specifici primer è Crucial per assicurare efficienti, imparziali di amplificazione del DNA completamente convertito verifica. Le seguenti linee guida sono utilizzati per facilitare la progettazione primer.
Primer Linee guida di progettazione

Thermocyling
- Per verificare proporzionale amplificazione del DNA metilato e non metilato, utilizzare un metilato 50:50 / non metilato campione completamente bisolfito controllo convertiti e amplificare con il bisolfito di conversione specifici primer sotto l'ottimizzazione delle condizioni di reazione PCR (Figura 3). Per le 50:50 metilato: non metilato di controllo, l'uso in vitro del DNA metilato e SSSI sia interi genomi amplificati (WGA) DNA o DNA sangue intero. Si prega di essere consapevole del fatto che alcuni geni saranno naturalmente metilato nel sangue e quindi in questi casi è meglio usare solo WGA DNA come il controllo "non metilato".
- Preparare miscele di reazione PCR di amplificazione a 100 & mu; aliquote l contenente 2 ml di bisolfito di DNA genomico convertito, 200 mM dNTP, 1 primer mM, 1,5 mM MgCl 2, 50 mM KCl, 10mM Tris-HCL, pH 8,3 e 0,15 microlitri di Taq polimerasi.
- In un termociclatore gradiente di temperatura, impostare la reazione eseguito in un gradiente di + / - 3 ° C previsto dalla Tm del primer in 10 tubi

- Per verificare che la ampliconi metilato e non metilato sono stati amplificati in proporzione, il amplicone può essere digerito con un enzima di restrizione informativo, come Taq 1 (TCGA), che si digeriscono il DNA metilato, ma non digerire il DNA metilato quando il sito enzima di restrizione è alterato dopo la conversione al bisolfito TTGA. L'entità della digestione possono essere visualizzati mediante elettroforesi su gel di agarosio (Figura 3a). In alternativa, SYBRGreen (0,2 ml di diluizione 1:1000) possono essere aggiunti alla reazione PCR eil grado di metilazione può essere valutata effettuando calore trame dissociazione in real-time PCR termociclatore (Figura 3B).
- Miscela di reazione PCR compresi MgCl2 condizioni di concentrazione e termici aver bisogno di essere regolata per aumentare l'efficienza della PCR o per garantire proporzionale amplificazione dei frammenti di PCR metilato e non metilato.
- Una volta che le condizioni di PCR sono ottimizzati, PCR può essere eseguita su campioni di bisolfito di conversione. Nota: Una volta che il Tm è ottimizzato un gradiente di temperatura PCR non devono essere utilizzati.
5. Rappresentante dei risultati:
Un esempio di ottimizzazione bisolfito di amplificazione PCR è mostrata in Figura 3. Condizioni ottimali di PCR dovrebbe amplificare ampliconi metilato e non metilato in proporzione e senza pregiudizi. La figura 3A mostra un gel di agarosio con un profilo di temperatura di amplificazione gradiente di PCR da una miscela di DNA metilato 50% e non metilato. The ampliconi della PCR sono stati trattati con un enzima di restrizione, Taq 1 (TCGA), che si digeriscono metilato (M) del DNA, ma non digerire non metilato (U) del DNA come il sito enzima di restrizione è alterato dalla conversione bisolfito di TTGA. Una pari quantità di taglio e non tagliato prodotto di PCR è previsto se il DNA metilato e non metilato è amplificato in proporzione. Esso può essere visto su questo gel che le condizioni ottimali per thermocyling non pregiudizi amplificazione è a 56,1 ° C (T). Conversione completa del DNA bisolfito possono anche essere analizzati mediante digestione con la citosina-site specifico enzima, come Hpa III (CCGG). Hpa III digerire solo se la conversione non è riuscita, in quanto il sito di restrizione sarà mantenuto. Se la conversione è completa il sito di restrizione verrà convertito in TCGG o TTGG a seconda dello stato di metilazione del DNA. Conversione totale del DNA bisolfito può essere visto in Figura 3A (H).
Figura 3B mostra un vero e proprio complotto dissociazione tempopuò essere utilizzato anche come strumento per determinare se vi siano pregiudizi amplificazione in base alla temperatura alla quale le diverse molecole si dissociano. In questa figura si può notare che la PCR ha amplificato metilato (M) e non metilato (U) del DNA in proporzione da un mix di DNA metilato 50% e non metilato rispetto al controllo di amplificazione del DNA completamente metilato e non metilato che si dissociano in 82.1μC e 78.9μC rispettivamente.
Dopo l'ottimizzazione delle condizioni di reazione e thermocyling bisolfito campioni trattati può essere amplificato con filamento primer specifici e bisolfito specifico in un singolo o semi reazione di nested PCR. I frammenti di PCR risultante può essere visualizzato mediante elettroforesi su gel di agarosio e sequenziato in modo diretto (Figura 4A) o con la clonazione e il sequenziamento. Dopo la clonazione e il sequenziamento lo stato di metilazione delle singole molecole possono essere tabulati, in una mappa bisolfito (Figura 4B), di visualizzare l'eterogeneità deimetilazione.
Alta velocità di analisi quantitativa di metilazione può essere eseguita utilizzando la tecnologia come quella utilizzata dal metodo EpiTYPER Sequenom. Utilizzando questo metodo, bisolfito DNA convertito con bisolfito viene amplificato specifico primer PCR e seguita da un processo di scissione proprietry. I frammenti risultanti sono quantificato mediante MALDI-TOF spettrometria di massa con lo spettro specifico dipende dalla presenza di cytosines metilata (Figura 5A). Una sintesi dei rapporti di metilazione nel campione può quindi essere estrapolati sotto forma di un epigramma (Figura 5B) o la trama di metilazione (Figura 5C).
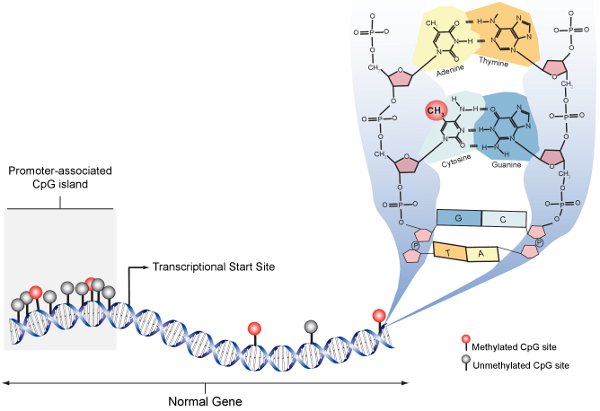
Figura 1. CpG metilati schematica. Nella cella normale, promotore associati isole CpG sono prevalentemente non metilato (grigio), mentre i siti CpG in seno agli organi geni sono scarsi e generalmente metilato (rosso). Il pannello a destra espande la struttura molecolareure di DNA in un singolo sito di metilazione CpG e mostra con una molecola CH3 al carbonio 5 della citosina.
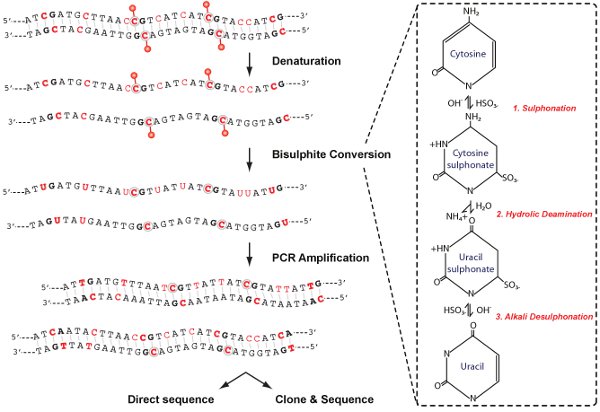
Figura 2. . Chimici schematica conversione analisi della metilazione del DNA comprende quattro fasi principali, come mostrato, denaturazione, bisolfito di conversione, amplificazione PCR e analisi. Nel pannello di destra, le modifiche alla molecola citosina che si verificano durante la conversione bisolfito sono raffigurati.
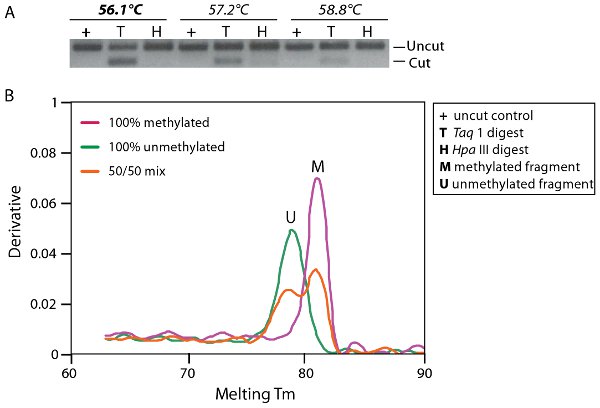
Figura 3. Ottimizzazione della PCR di amplificazione. A. Elettroforesi su gel di agarosio con un profilo di gradiente di temperatura amplificazione PCR da una miscela di 50% di DNA metilato e non metilato. Frammenti sono stati digeriti con uno Taq1 (T) o HpaIII (H) che digeriscono il DNA metilato e non DNA bisolfito convertiti rispettivamente. B. Calore analisi mostra una curva di dissociazione equazioneproporzione l di DNA metilato e non metilato (linea rossa mix 50/50) rispetto al controllo di amplificazione completamente metilati (linea rosa, M) e il DNA metilato (linea verde, U), che si dissociano a 82,1 ° C e 78,9 ° C rispettivamente.
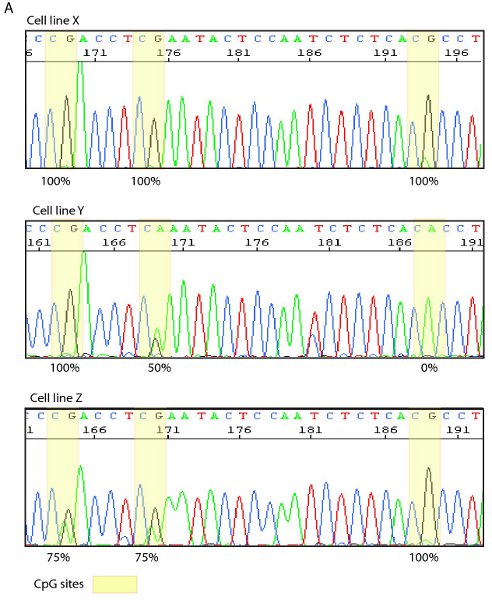
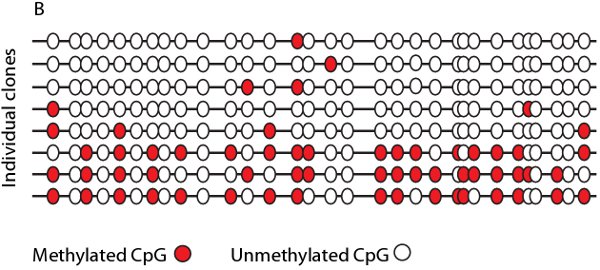
Figura 4. Esempio di sequenziamento diretto e una mappa bisolfito. A. Tracciare la sequenza di tre diverse linee cellulari con i siti CpG evidenziato in giallo. Linea cellulare X visualizza il 100% di metilazione in tutti e tre i siti CpG mentre linee cellulari Y e Z mostrano vari gradi di metilazione come si vede dalla sovrapposizione G / A segnali. B. Rappresentante bisolfito mappa che mostra la densità di metilazione (punti rossi) a singoli siti CpG, come determinato dal sequenziamento diretto dei singoli cloni.
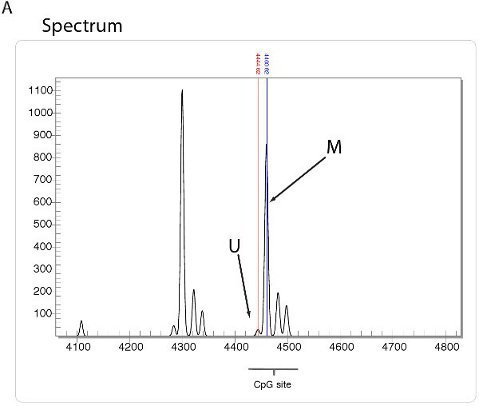
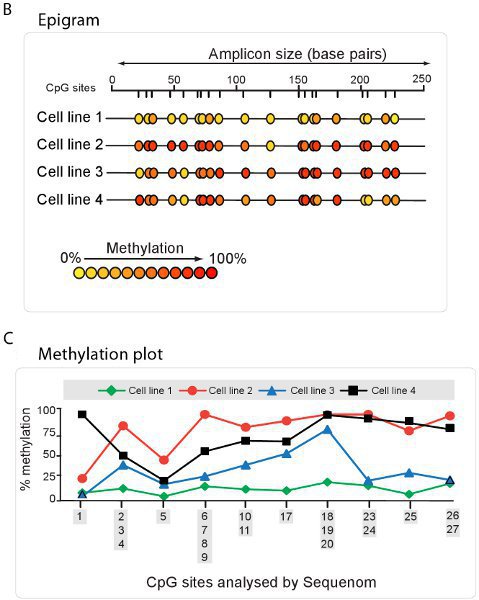
Figura 5. Un elevato throughput di metilazione del DNA utilizzando Sequenom. A. Spettro vista utilizzando la tecnologia Sequenom epiTYPER. Frammenti di DNA visualizzare spettri specifici, a seconda della quantità di DNA presente metilazione. B. Epigramma sintesi della percentuale di metilazione del DNA in ogni sito CpG per quattro diverse linee cellulari. Riassunto metilazione C. trama deriva dalla Epigramma Sequenom.
Discussione
Metilazione del DNA mediante sequenziamento del DNA genomico di bisolfito convertito è un metodo ben definito e versatile che facilita l'identificazione e quantificazione di metilazione del DNA a singolo nucleotide risoluzione. Tuttavia, la conversione bisolfito e successiva analisi si basa sulla premessa che il DNA è stato completamente convertito, con ogni citosina non metilato essere deaminata a uracile e solo cytosines metilato rimanente non-reattivi. Se la conversione è incompleta, possono sorgere problemi con l'analisi in quanto non convertito cytosines non metilato può essere erroneamente interpretato come cytosines metilato. Bisolfito di conversione può essere ottimizzato in varie fasi di massimizzare la percentuale di conversione. Per DNA per essere pienamente convertito prima deve essere a singolo filamento in modo che i residui di citosina sono esposti agli ioni bisolfito. Il primo passo, denaturazione del DNA, è critica e può essere fonte di conversione incompleta se il DNA non è completamente denaturato. Per garantireche il DNA è completamente denaturato, è importante che i parametri di reazione compresi l'allontanamento di tutte le proteine associate, concentrazione salina del caso, temperatura di incubazione e il tempo sono adatti a mantenere il DNA a singolo filamento conformazione. E 'importante usare fresca NaOH 3M e per consentire un tempo adeguato di incubazione. Se il DNA sta resistendo denaturazione, alcune modifiche al protocollo compresi l'estensione del tempo di incubazione di 30 minuti o frammentazione del DNA prima di denaturazione può facilitare la denaturazione del DNA. Inoltre, DNA a singolo filamento (ssDNA), può ri-tempra di DNA a doppio filamento (dsDNA) durante la reazione di conversione bisolfito. Effettuare la reazione a una temperatura più alta (90-95 ° C) in modo periodico, o continuamente durante la reazione bisolfito può aiutare il mantenimento di ssDNA. Tuttavia, è importante essere consapevoli che la degradazione del DNA è notevolmente accelerato a queste temperature superiori. Reagenti diversi può anche essere aggiunto per interrompere la ricottura del secolofilamenti di DNA e, come l'urea.
La concentrazione del DNA e la sua qualità può colpire anche l'efficienza della reazione bisolfito ed ultima resa PCR. Degradazione del DNA è una limitazione del protocollo di conversione bisolfito. Il trattamento chimico del DNA presenta rotture di filamenti diversi ssDNA e alcune delle dure condizioni necessarie per la completa conversione bisolfito compresa la concentrazione bisolfito alta, lunghi tempi di incubazione possono accelerare la degradazione del DNA. Nelle condizioni di reazione standard descritto, la degradazione del DNA non è un problema comune però, se le modifiche del protocollo vengono introdotti, come per le sequenze che sono refrattari alla conversione, per i modelli di DNA che sono degradati o di scarsa qualità, come campioni FFPE, allora la degradazione del DNA può diventare una limitazione significativa.
Formalina fisso, paraffina (FFPE) e campioni di DNA degradato può essere efficacemente bisolfito convertita ed amplificata utilizzando questo protocolloTuttavia modifiche per garantire che il DNA non è ulteriormente degradata si consiglia. L'uso di un vettore RNA come t RNA è raccomandato. Anche glicogeno può essere aggiunto come un vettore quando la concentrazione di DNA è bassa (<200 ng). Perché il DNA isolato nei tessuti FFPE è già frammentata e ulteriore frammentazione avviene durante deaminazione, bisogna fare attenzione a ridurre al minimo un ulteriore degrado. Non frammenti di DNA ulteriormente prima di denaturazione e limitare il tempo di incubazione per la reazione bisolfito a 4 ore. Progettazione ampliconi non più grande di 300 bp a causa di DNA frammentato.
Un altro fattore che può influenzare l'amplificazione PCR che la conversione bisolfito di cytosines non metilato riduce la complessità del modello di DNA. Il seguente protocollo di progettazione fondo di cui al punto 4.1, lunghezza innesco aumentato e nested PCR possono contribuire ad aumentare la specificità e la resa della PCR.
Infine, poiché il modello del DNA è alterato durante bisulphite di conversione, il bias di amplificazione può essere una preoccupazione. Assicurarsi che l'amplificazione proporzionale PCR di modelli metilato e non metilato è verificata con un controllo 50/50 M / U mix di DNA, come indicato nel protocollo, si veda la Figura 3. Assicurarsi inoltre che l'amplificazione dei modelli convertiti solo si sta verificando con enzima di restrizione HpaIII e elettroforesi su gel (Figura 3). Le condizioni di PCR può avere bisogno di essere ottimizzato variando la concentrazione di temperatura e / o magnesio o allungando il tempo di estensione. Alcuni modelli sembrano essere particolarmente problematico e la posizione del primer può essere necessario regolare o degenerare primer può essere necessario utilizzare.
Prossima generazione di tecniche di sequenziamento sono in rapida evoluzione per ottenere una risoluzione simile a bisolfito di sequenziamento genomico, e la terza sequenza molecola singola generazione ha il potenziale per permettere l'analisi di entrambe le primarie e la metilazione del DNA senza la necessità di sequenziamento bisolfito. Tuttavia, ampia disponibilità e specificheificity di queste tecniche rimangono ancora molto tempo. Sequenziamento genomico bisolfito è il gold standard per l'analisi di metilazione ed è un protocollo robusto. Il metodo è progredita al punto in cui i problemi più comuni ed i limiti sono stati risolti e le applicazioni si sono ampliate dalle analisi di geni singoli throughput elevato e l'analisi dell'intero genoma descritta da Clark et al. 2006 4. Linee guida risoluzione dei problemi e ulteriori raccomandazioni sono riportate nella Tabella 1. Si suggerisce che l'approccio migliore è quello di seguire inizialmente il protocollo standard e solo introdurre la modifica se e quando sorge un problema.
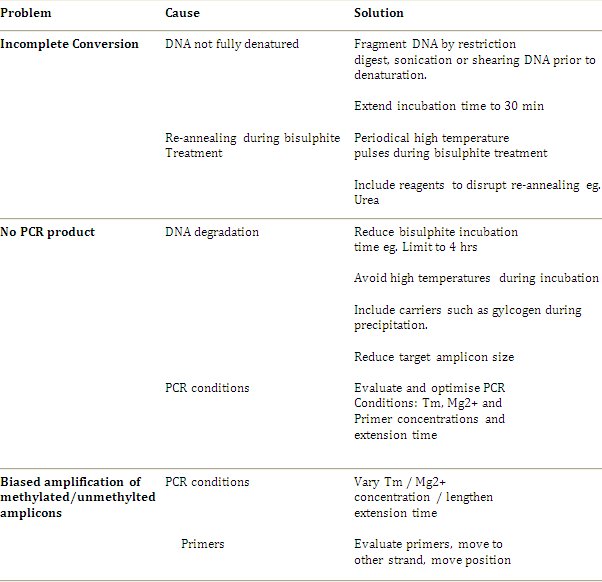
Tabella 1. Linee Guida alla risoluzione dei problemi
Divulgazioni
Nessun conflitto di interessi dichiarati.
Materiali
- Di sodio metabisolfito (Ajax Finechem)
- Idrochinone (Merck)
- Wizard DNA-clean-up del sistema (Promega)
Riferimenti
- Frommer, M. A genomic sequencing protocol that yields a positive display of 5-methylcytosine residues in individual DNA strands. Proc. Natl. Acad. Sci. U. S. A. 89, 1827-1831 (1992).
- Clark, S. J. High sensitivity mapping of methylated cytosines. Nucleic. Acids. Res. 22, 2990-2997 (1994).
- Grunau, C., Clark, S. J., Rosenthal, A. Bisulfite genomic sequencing: systematic investigation of critical experimental parameters. Nucleic. Acids. Res. 29, E65-E65 (2001).
- Clark, S. J. DNA methylation: bisulphite modification and analysis. Nat. Protoc. 1, 2353-2364 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon