Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Analyse phénotypique et isolement de cellules souches hématopoïétiques murines et Lineage-engagés progéniteurs
Dans cet article
Résumé
Une méthode pour analyser la distribution des progéniteurs hématopoïétiques dans la moelle osseuse par cytométrie en flux ainsi que d'isoler efficacement hautement purifiées de cellules souches hématopoïétiques (CSH) est décrite. La procédure d'isolement est essentiellement basée sur l'enrichissement magnétique des cellules + c-kit et de tri cellulaire pour purifier CSH pour des études cellulaires et moléculaires.
Résumé
La moelle osseuse est le site principal où les CSH et progéniteurs plus matures du sang lignée de cellules résident et de se différencier dans un organisme adulte. CSH constituent une population de cellules minute de cellules pluripotentes, capables de générer toutes les lignées de cellules sanguines pour une durée de vie 1. La dissection moléculaire de l'homéostasie CSH dans la moelle osseuse a des implications importantes dans l'hématopoïèse, l'oncologie et la médecine régénérative. On décrit le protocole de marquage avec des anticorps fluorescents et la procédure de déclenchement électronique de cytométrie de flux à marquer sous-ensembles progénitrices hématopoïétiques et de distribution CSH chez la souris individuels (fig. 1). En outre, nous décrivons une méthode pour enrichir largement progéniteurs hématopoïétiques ainsi que à long terme (LT) et à court terme (ST) de reconstituer les CSH à partir de suspensions de cellules de moelle osseuse regroupées par enrichissement magnétique des cellules exprimant c-Kit. Préparation cellulaire obtenu peut être utilisé pour trier des sous-ensembles sélectionnés pour in vitro etin vivo des études fonctionnelles (Fig. 2).
Les deux ostéoblastes trabéculaires 2,3 et 4 endothélium sinusoïdal constituent des niches fonctionnelles de soutien CSH dans la moelle osseuse. Plusieurs mécanismes de la niche ostéoblastique, y compris un sous-ensemble de N-cadhérine + de 3 ostéoblastes et l'interaction de l'Tie2 récepteur tyrosine kinase exprimée en CSH avec son angiopoïétine-1 ligand 5 accord pour déterminer la quiescence CSH. "Hibernation" dans la moelle osseuse est cruciale pour protéger les CSH de la réplication et l'épuisement éventuel sur l'activité vélo excessive 6. Stimuli exogènes agissant sur les cellules du système immunitaire inné comme ligands du récepteur Toll-like 7 et l'interféron-alpha 6 peut également induire la prolifération et la différenciation des cellules souches hématopoïétiques dans la lignée progéniteurs engagés. Récemment, une population de cellules souches hématopoïétiques de souris dormants dans le lin - c-Kit + Sca-1 + CD150 + CD48 - CD34 - la population a été décrite 8. Le tri des cellules CD34 sur la base de l'expression de la suspension cellulaire des progéniteurs hématopoïétiques enrichi tel que décrit ici permet l'isolement de deux repos d'auto-renouvellement LT-HSC et ST-HSC 9. Une procédure similaire basée sur l'épuisement des lignées de cellules positives et de tri de LT-HSC avec CD48 et FLK2 anticorps a été décrit précédemment 10. Dans le présent rapport, nous fournir un protocole pour la caractérisation phénotypique et ex vivo du cycle cellulaire analyse des progéniteurs hématopoïétiques, qui peuvent être utiles pour surveiller l'hématopoïèse dans différentes conditions physiologiques et pathologiques. En outre, nous décrivons un tri par FACS procédure de CSH, qui peuvent être utilisés pour définir les facteurs et les mécanismes régissant leur auto-renouvellement, l'expansion et la différenciation en biologie cellulaire et des dosages de transduction du signal, ainsi que pour la transplantation.
Protocole
1. Préparation de la suspension cellulaire de la moelle osseuse
- Euthanasier la souris et placer l'animal dans une casserole inox et de l'éthanol de pulvérisation de 70% sur son abdomen et le dos. Recueillir fémur et le tibia de pattes de derrière, et la colonne vertébrale.
- Précision enlever tous les résidus des tissus mous de la colonne vertébrale avec des ciseaux pointu et à partir d'os des jambes avec une gaze. Os magasin dans un tube Falcon de 50 ml avec 30 ml de milieu RPMI contenant 10% inactivé par la chaleur de sérum bovin foetal (FBS), supplémenté avec 50 β-mercaptoéthanol uM, 100 uM MEM non-acides aminés essentiels, 1 mM pyruvate de sodium MEM, 2 mM de L-glutamine, 100 pg / ml de streptomycine et 100 U / ml de pénicilline.
- Couvrir le fond d'un mortier préalablement stérilisé avec des filtres stériles.
- Transfert des os dans le mortier et les couvrir d'une couche de filtres afin d'assembler une surface de frottement.
- Préparer un tube de 50 ml Falcon équipé d'un filtre Falcon.
- Brisez les osà l'aide d'un pilon jusqu'à obtention d'une suspension cellulaire homogène.
- Transférer la suspension dans le tube.
- Ajouter au mortier 5 ml de milieu RPMI complet frais à laver et à récolter les cellules restantes.
- Répétez les deux derniers points jusqu'à ce que les os homogénéisés semblent claires.
- Transférer et filtrer dans un nouveau tube de la suspension cellulaire en vue d'éliminer les débris de tissu restant.
- Centrifuger le tube à 1500 rpm pendant 5 min et retirez soigneusement le surnageant par aspiration. Assurez-vous de ne pas perturber le culot cellulaire.
2. Analyse phénotypique
- Remettre en suspension et laver les cellules de souris individuelles dans 15 ml de PBS et 2% FBS.
- Centrifuger le tube à 1500 rpm pendant 5 min et retirez soigneusement le surnageant par aspiration. Veillez à ne pas perturber le culot.
- Suspendre le culot dans 5 ml de PBS et 2% de FBS et les cellules de comptage.
- Transfert 1 × 10 6 cellules / puits dans un fond de 96 puits rondPlaque.
- Centrifuger la plaque à 1500 rpm pendant 5 min.
- Préparer un mélange d'anticorps monoclonaux dirigés contre les marqueurs de surface suivantes. Diluez-les comme indiqué dans le PBS et 2% de FBS pour colorer les cellules.
- CD4, CD8, CD3, CD45R, CD19, Gr1, Ter119, NK1.1 conjugués à PE-Cy5 1:200
- c-Kit conjugué à APC 1:100
- SCA1 conjugué à la biotine 1:50
- CD34 conjugué à 1:50 FITC
- FcγR conjugué à PE 1:100
- IL-7R conjugué à PE-Cy7 1:100
- Jeter le surnageant et ajouter 50 ul de mélange anticorps monoclonaux à chaque puits. Dissocier dans des cellules individuelles par pipetage.
- Incuber les cellules pendant 20 min dans l'obscurité à 4 ° C.
- Laver les cellules deux fois avec 150 ul de PBS et 2% de FBS.
- Centrifuger la plaque à 1500 rpm pendant 5 min et éliminer le surnageant par retournement de la plaque.
- Diluer la streptavidine dans du PBS et 2% de FBS, comme indiqué à colorer les cellules.
- Streptavidin conjuguégated à APC-Cy7 1:300
- Ajouter 50 ul de la solution dans chaque puits. Dissocient en suspension cellulaire unique par pipetage.
- Incuber les cellules pendant 10 min dans l'obscurité à 4 ° C.
- Laver les cellules deux fois avec 150 ul de PBS et 2% de FBS.
- Centrifuger la plaque à 1500 rpm pendant 5 min et éliminer le surnageant.
- Remettre en suspension les cellules dans 100 ul de PBS et 2% FBS.
- Acquérir des échantillons à FACS.
3. Enrichissement magnétique de c-Kit + Cellules
- Préparer une solution tampon contenant du PBS, pH 7,2, 0,5% d'albumine sérique bovine (BSA), et 2 mM d'EDTA.
- Remettre en suspension le culot de cellules de moelle osseuse de dérivé d'au moins 10 souris dans 1 ml de solution tampon contenant c-kit conjugué à APC Acm diluée 1:50.
- Incuber les cellules pendant 20 min dans l'obscurité à 4 ° C.
- Laver deux fois les cellules avec 40 ml de solution tampon.
- Centrifuger le tube à 1500 rpm pendant 5 min et retirez soigneusement til surnageant par aspiration. Veillez à ne pas perturber le culot.
- Resuspendre culot cellulaire et ajouter 50 ul d'anticorps anti-APC Microbilles pour chaque souris euthanasiés directement à la pastille.
- Bien mélanger et incuber pendant 20 min dans l'obscurité à 4 ° C.
- Laver les cellules en ajoutant 40 ml de solution tampon et centrifuger à 1500 rpm pendant 5 min. Aspirer le surnageant complètement.
- Resuspendre culot cellulaire dans multiple de 4 ml de solution tampon tous les trois souris euthanasié.
- Placer les colonnes LS MACS dans le champ magnétique d'un séparateur approprié MACS. Utilisez la colonne 1 tous les trois souris euthanasié.
- Préparer les colonnes d'un rinçage avec 4 ml de solution tampon.
- Appliquer suspension cellulaire sur les colonnes.
- Recueillir cellules non marquées qui traversent et laver la colonne avec 4 ml de solution tampon. Effectuer les étapes de lavage en ajoutant 4 ml de solution tampon à trois reprises. Ajouter un nouveau tampon lorsque le réservoir de la colonne est vidée.
- Supprimer les colonnes du séparateur et place chacun au-dessus de 15 tubes de faucon mL.
- Introduire à la pipette 4 ml de solution tampon sur chaque colonne. Rincer immédiatement les cellules marquées magnétiquement en poussant le piston dans la colonne.
- Centrifuger les tubes à 1500 rpm pendant 5 min et retirez soigneusement le surnageant par aspiration.
- Remettre en suspension chaque culot avec 1 ml de solution tampon et de boulettes de groupe dans un seul tube Falcon de 15 ml.
4. Le tri des cellules souches hématopoïétiques et progéniteurs engagés Lineage
- Préparer un mélange d'anticorps monoclonaux dirigés contre les marqueurs de surface suivantes. Diluez-les comme indiqué dans 500 ul de PBS et de 2% FBS pour colorer les cellules.
- CD4, CD8, CD3, CD45R, CD19, Gr1, Ter119, NK1.1 conjugués à PE-Cy5 1:200
- c-Kit conjugué à APC 1:100
- Sca-1 conjugué à la biotine 1:50
- CD34 conjugué à 1:50 FITC
- FcγR conjugué à PE 1:100
- Centrifuger le tube de la previoula section s à 1500 rpm pendant 5 min et retirez soigneusement le surnageant par aspiration.
- Ajouter le mélange anticorps monoclonaux dirigés contre le culot. Dissocient en suspension cellulaire unique par pipetage.
- Incuber les cellules pendant 20 min dans l'obscurité à 4 ° C.
- Laver deux fois les cellules avec 14 ml de PBS et 2% FBS.
- Centrifuger le tube à 1500 rpm pendant 5 min et éliminer le surnageant.
- Diluer la streptavidine comme indiqué dans 500 ul de PBS et 2% de FBS pour colorer les cellules.
- Streptavidine conjuguée à APC-Cy7 1:300
- Ajouter la solution au tube. Dissocient en suspension cellulaire unique par pipetage.
- Incuber les cellules pendant 10 min dans l'obscurité à 4 ° C.
- Laver deux fois les cellules avec 14 ml de PBS et 2% de FBS.
- Centrifuger le tube à 1500 rpm pendant 5 min et éliminer le surnageant.
- Remettre en suspension les cellules dans 500 ul de PBS et 2% FBS.
- Transfert et de filtrer la suspension de cellules dans un tube de 5 ml nouvelle pour EliMINATE agrégats cellulaires qui peuvent interférer avec la procédure de tri.
- Ajouter 5 pi de 7-AAD (l'utiliser dilué 1:100) à la suspension cellulaire afin d'exclure 7-AAD + cellules mortes des populations triées.
- Trier les cellules avec un FACSAria BD selon les phénotypes suivants:
- Cellules LKS: LIN - c-Kit + Sca-1 +
- LT-HSC: LKS CD34 -
- ST-HSC: LKS CD34 +
- BPF: lin - c-Kit + Sca-1 faible FcγR haute CD34 +
- Les députés: lin - c-Kit + Sca-1 faible FcγR faible CD34 -
- CMP: lin - c-Kit + Sca-1 faible FcγR faible CD34 +
5. Les résultats représentatifs
La figure 1 montre et l'exemple de la procédure de déclenchement électronique àmarquer communes progéniteurs lymphoïdes (CLP) que Lin - / c-Kit lo / interleukine (IL)-7R + de cellules; Lin - / c-Kit + / Sca-1 + (LKS) et Lin - / c-Kit + / Sca -1 lo (c-kit +) des cellules; de la c-Kit + porte, progéniteurs myéloïdes communs (CMP) sont identifiés comme FcγR lo cellules CD34 +, les progéniteurs des granulocytes / monocytes (BPF) FcγR hi cellules CD34 + et mégacaryocytes / progéniteurs érythrocytaires (députés) que FcγR lo CD34 - cellules; de la porte LKS, LT-HSC et ST-HSC sont identifiés comme CD34 - et CD34 + cellules, respectivement. Cette suspension cellulaire de la moelle osseuse peut être enrichi pour le c-Kit + cellules avec des billes magnétiques (Fig. 2); LT-HSC et ST-HSC peuvent ensuite être triés en fonction de CD34 expression, ainsi que d'autres progéniteurs selon le phénotype décrit ci-dessus.
CSH peuvent être analysées lysées dans la microscopie confocale imagerie en temps réel comme le montre la figure 4, où CD34 - cellules ont été colorées avec le composé de fixation des nucléotides quinacrine 11 ainsi que l'énergie nucléaire rouge (DRAQ5). Dans les CSH, mais pas les BPF, la quinacrine-positifs vésicules sont visibles dans les 12 cytoplasme. En outre, les CSH triés peuvent être utilisés dans des expériences fonctionnelles comme le montre la figure 5, qui montre l'augmentation de la Ca 2 + cytosolique dans LT-HSC par l'activation des récepteurs purinergiques P2 lors de l'exposition à l'adénosine-triphosphate (ATP) et de l'ionomycine 12.
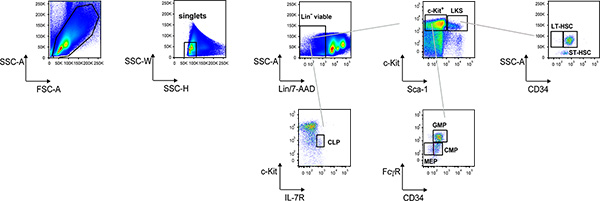
Figure 1. Analyse Représentant dot plot de Lin-BM cellules. Procédure de déclenchement électronique au cytomètre de flux pour identifier et marquer des progéniteurs hématopoïétiques et cellules souches hématopoïétiques à partir de suspension cellulaire de la moelle osseuse colorées comme décrit dans le texte du protocole.
pload/3736/3736fig2.jpg "/>
Figure 2. Un schéma pour l'enrichissement sélectif de c-Kit + cellules de la moelle osseuse.
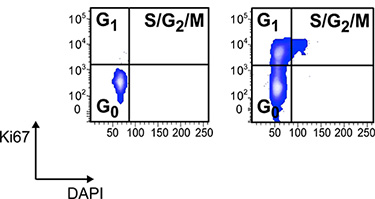
Figure 3: Analyse du cycle cellulaire de la voie électronique LKS gated CD34 -. CSH dans les contrôles sains et les souris atteintes d'une MII colorées avec Ki-67 anticorps et DAPI. Les cellules ont été fixées et perméabilisées avec Lyse / Fix et Perm tampons suivie d'une coloration avec les verbes conjugués au FITC Ki-67 et DAPI à 1 ug / ml. Cyclisme cellules sont à peine voire pas du tout détectable dans le LKS CD34 - compartiment CSH des contrôles sains âgés de 12.

. Figure 4 Live microscopie imagerie confocale de la FACS triés CD34 - CSH et les BPF colorées avec la quinacrine composé de fixation des nucléotides et le nucléaire rouge (DRAQ5). Les quadrants petits montrent pos quinacrinevésicules itive détecté dans le cytoplasme des cellules souches hématopoïétiques, mais pas les BPF.

Figure 5. Ca 2 + cytosolique des élévations de CSH triés chargés de Fura-2 et stimulées par l'ATP et de l'ionomycine. Traces partir de cellules uniques sont présentés. Toutes les cellules étaient sensibles à l'ATP extracellulaire montrant augmentation importante dans Ca 2 + cytosolique après addition de l'ATP.
Discussion
La méthode décrite ici permet une analyse rapide et précise de l'hématopoïèse chez la souris individuels (Figure 1). Cette analyse dans divers contextes expérimentaux, y compris des modèles murins de l'inflammation, l'auto-immunité, l'immunodéficience, les maladies dégénératives, les troubles métaboliques et du cancer, permet l'adressage de l'impact des conditions pathologiques sur l'hématopoïèse. La figure 3 montre l'analyse de l'act...
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Nous remercions Nobuyuki Onai, Hitoshi Takizawa et Markus Manz pour obtenir des conseils précieux. Ce travail a été financé par la National Science Foundation suisse, la Ligue suisse contre le cancer et la Fondazione per la Ricerca tessinois sul Cancro.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | |
| RPMI 1640 | Gibco | 42401 | |
| MEM NEAA 100X | Gibco | 11140 | |
| Pyruvate de sodium | Gibco | 11360 | |
| Penstrep | Gibco | 15070 | |
| PBS | Gibco | 20012 | |
| FBS | Gibco | 16000 | |
| Crépine portable 40 pm | BD Falcon | 352340 | |
| Solution de coloration 7-AAD | BD Pharmingen | 559925 | |
| Lyse / Fix tampon | BD Pharmingen | 558049 | |
| Perm tampon III | BD Pharmingen | 558050 | |
| Ki-67 | BD Pharmingen | 556026 | |
| DAPI | Invitrogen | D21490 | |
| CD4 (GK1.5) | eBioscience | 150041 | |
| CD8 (53 à 6,7) | eBioscience | 150081 | |
| CD3 (145-2C11) | eBioscience | 150031 | |
| CD45R (RA3-6B2) | eBioscience | 150452 | |
| CD19 (6D5) | eBioscience | 150193 | |
| Gr1 (RB6-8C5) | eBioscience | 155931 | |
| Tre119 (TER-119) | eBioscience | 155921 | |
| NK-1.1 (PK136) | eBioscience | 455941 | |
| c-Kit (2B8) | eBioscience | 171171 | |
| Sca-1 (D7) | eBioscirence | 135981 | |
| CD34 (RAM34) | eBioscience | 110341 | |
| FcγR (2.4G2) | eBioscience | 553145 | |
| Anti-APC Microbilles | Miltenyi Biotec | 130-090-855 | |
| Colonnes LS | Miltenyi Biotec | 130-042-401 |
Références
- Weissman, I. L. Stem cells: units of development, units of regeneration, and units in evolution. Cell. 100, 157-168 (2000).
- Calvi, L. M. Osteoblastic cells regulate the haematopoietic stem cell niche. Nature. 425, 841-846 (2003).
- Zhang, J. Identification of the haematopoietic stem cell niche and control of the niche size. Nature. 425, 836-841 (2003).
- Kiel, M. J., Yilmaz, O. H., Iwashita, T., Terhorst, C., Morrison, S. J. SLAM family receptors distinguish hematopoietic stem and progenitor cells and reveal endothelial niches for stem cells. Cell. 121, 1109-1121 (2005).
- Arai, F. Tie2/angiopoietin-1 signaling regulates hematopoietic stem cell quiescence in the bone marrow niche. Cell. 118, 149-161 (2004).
- Essers, M. A. IFNalpha activates dormant haematopoietic stem cells in vivo. Nature. 458, 904-908 (2009).
- Nagai, Y. Toll-like receptors on hematopoietic progenitor cells stimulate innate immune system replenishment. Immunity. 24, 801-812 (2006).
- Wilson, A. Hematopoietic stem cells reversibly switch from dormancy to self-renewal during homeostasis and repair. Cell. 135, 1118-1129 (2008).
- Osawa, M., Hanada, K., Hamada, H., Nakauchi, H. Long-term lymphohematopoietic reconstitution by a single CD34-low/negative hematopoietic stem cell. Science. 273, 242-245 (1996).
- Lo Celso, C., Scadden, D., D, . Isolation and Transplantation of Hematopoietic Stem Cells (HSCs. J. Vis. Exp. (2), e157 (2007).
- Romanello, M. Autocrine/paracrine stimulation of purinergic receptors in osteoblasts: contribution of vesicular ATP release. Biochem. Biophys. Res. Commun. 331, 1429-1438 (2005).
- Casati, A. Cell-autonomous regulation of hematopoietic stem cell cycling activity by ATP. Cell Death Differ. 18, 396-404 (2011).
- Bouma, G., Strober, W. The immunological and genetic basis of inflammatory bowel disease. Nat. Rev. Immunol. 3, 521-533 (2003).
- Takizawa, H., Regoes, R. R., Boddupalli, C. S., Bonhoeffer, S., Manz, M. G. Dynamic variation in cycling of hematopoietic stem cells in steady state and inflammation. J. Exp. Med. 208, 273-284 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon