JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
Murine 조혈 줄기 세포와 리니지 - 헌신 Progenitors의 Phenotypic 분석 및 절연
요약
유동세포계측법의 골수 조혈 progenitors의 유통뿐만 아니라 효율적으로 분리 고도 정화 조혈 줄기 세포 (HSCs)를 분석하는 방법을 설명합니다. 분리 절차는 본질적으로 세포 및 분자 연구를위한 HSCs를 정화 정렬 C-키트 + 세포와 세포의 자성 농축에 근거한다.
초록
골수는 HSCs보다 성숙한 혈액 세포 가계 progenitors가 거주하고 성인 유기체에서 차별 교장 사이트입니다. HSCs는 삶의 시간을 1 모든 혈액 세포 lineages을 생성할 수있는 pluripotent 세포 분 세포 인구를 구성합니다. 골수에서 HSCs 항상성의 분자 해부는 조혈, 종양학 및 재생 의료에서 중요한 의미를 가지고 있습니다. 우리는 형광 항체 및 개별 생쥐의 조혈 전구 하위 집합 및 HSCs 분포 (그림 1) 득점하기 유동세포계측법의 전자 게이팅 절차 라벨 프로토콜을 설명합니다. 또한 광범위하게 조혈 progenitors뿐 아니라 장기 (LT) 및 C-Kit를 표현하는 세포의 자성 농축하여 풀링된 골수 세포 현탁액에서 HSCs를 reconstituting 단기 (ST)를 풍부하게하는 방법을 설명합니다. 그 결과 세포 준비는 체외에 대해 선택한 하위 집합을 정렬하는 데 사용할 수 있습니다생체내 기능 연구에 대하여 (그림 2).
두 trabecular osteoblasts 2,3 및 sinusoidal 내피의 4 골수에서 HSCs을 지원하는 기능성 틈새를 구성합니다. N-cadherin + osteoblasts 3의 하위 집합과 그 리간드 angiopoietin-1 5 HSCs로 표현 수용체 티로신 키나제의 Tie2의 상호 작용을 포함 osteoblastic 틈새에서 몇몇 메커니즘은 HSCs의 정지를 결정하는데 동의합니다. 골수에서 "최대 절전 모드"는 과도한 사이클링 활동 6시 복제 및 최종 피로로부터 HSCs을 보호하기 위해 중요합니다. 이러한 수신자 같은 수용체 리간드 7, 인터페론-α 6 등 타고난 면역 계통의 세포에 따르고 외인성 자극에도 혈통이 커밋된 progenitors으로 확산 및 HSCs의 분화를 유도하실 수 있습니다. 최근 린 내에서 휴면 마우스 HSCs의 인구 - C-키트 + 무서-1 + CD150 + CD48 - CD34 - 인구가 8을 설명했습니다. 세포 정렬 여기에 설명된대로 조혈 progenitors 강화 세포 현탁액에서 CD34 표현에 따르면 허용 정지 자체 갱신 LT-HSCs과 ST-HSCs 9 모두의 고립. 혈통 긍정적인 세포의 고갈과 CD48와 Flk2 항체와 LT-HSC의 분류를 기반으로 유사한 절차는 이전에 10을 설명했습니다. 현재 보고서에서는 phenotypic 특성화 및 다른 생리 및 병리 학적 조건에서 조혈을 모니터하는 데 유용할 수 있습니다 조혈 progenitors의 전직의 생체내 세포주기 분석을 위해 프로토콜을 제공합니다. 더욱이, 우리는 요인 및 세포 생물학 및 신호 전달 장치 assays에서뿐만 아니라 이식에 대한 그들의 자기 갱신, 확장 및 분화를 조절 메커니즘을 정의하는 데 사용할 수 HSCs를위한 절차를 정렬 FACS에 대해 설명합니다.
프로토콜
1. 골수의 세포 현탁액의 준비
- 마우스를 안락사와 복부 뒤로 향해 스테인리스 냄비와 스프레이 70 % 에탄올에 동물을 배치하십시오. 대퇴골과 경골 뒷다리에서, 그리고 척추를 수집합니다.
- 정확하게 날카로운 팁 가위로와 거즈로 다리 뼈에서 척추에서 모든 연조직 잔류물을 제거합니다. 50 μm의 β-메르 캅 토 에탄올, 100 μm의 제품 MEM 비 필수 아미노산과 보충 10% 열 inactivated 태아 소 혈청 (FBS),, 1 밀리미터 MEM 나트륨 Pyruvate, 2를 포함하는 RPMI 매체 30 ML과 50 ML 팔콘 튜브의 상점 뼈 MM L-글루타민, 100 μg / ML의 스트렙토 마이신 및 100 U / ML 페니실린.
- 무균 필터와 이전에 소독을 절구의 바닥을 커버.
- 절구에 뼈를 전송 및 마찰 표면을 조립하기 위해 필터 계층으로 그들을 포괄합니다.
- 팔콘 필터와 함께 제공되는 50 ML 팔콘 튜브를 준비합니다.
- 뼈를 부술균일한 세포 현탁액을 얻기까지 유봉의 도움으로.
- 튜브로 정학을 전송합니다.
- 남아있는 세포를 씻고 기증 신선한 RPMI 전체 매체의 박격포 5 ML에 추가합니다.
- 균질 뼈를 확실히 나타날 때까지 마지막 두 포인트를 반복합니다.
- 나머지 조직 파편을 제거하기 위해 세포 현탁액을 전송하고 새 튜브로 필터링합니다.
- 5 분을위한 1,500 rpm으로 튜브를 원심 조심스럽게 흡인에 의해 뜨는을 제거합니다. 세포 펠렛을 방해하지 않도록하십시오.
2. Phenotypic 분석
- Resuspend 및 PBS와 2% FBS의 15 ML에서 개별 생쥐의 세포를 씻는다.
- 5 분을위한 1,500 rpm으로 튜브를 원심 조심스럽게 흡인에 의해 뜨는을 제거합니다. 펠렛을 방해하지 않도록하십시오.
- 5 ML PBS와 2퍼센트 FBS 및 카운트 세포에 펠렛을 일시 중지합니다.
- 이전 1 × 10 6 세포 /도 96 라운드 우물 밑바닥에서판.
- 5 분을위한 1,500 rpm으로 번호판을 원심 분리기.
- 다음과 같은 표면 마커 향한 mAbs의 혼합을 준비합니다. 그들을 희석은 PBS에 표시된 및 2퍼센트 FBS가 세포를 얼룩.
- CD4, CD8, 인 경우에는 3 번 CD, CD45R, CD19, Gr1, Ter119, NK1.1 PE-Cy5 1:200으로 복합
- APC 1:100으로 C-키트 복합
- 비오틴 1시 50분에 복합 Sca1
- FITC 1시 50분에 복합 CD34
- PE 1:100으로 복합 FcγR
- PE-Cy7 1:100으로 IL-7R 복합
- 뜨는을 무시하고 각 잘으로 mAbs 믹스의 50 μL를 추가합니다. pipetting하여 단일 세포로 분열시키다.
- 4 ° C.에 어둠 속에서 20 분 동안 세포를 품어
- PBS 150 μL 및 2% FBS로 두 번 세포를 씻으십시오.
- 5 분을위한 1,500 rpm으로 접시를 원심 분리기와 반전 판에 의해 뜨는 버리고.
- PBS에 streptavidin을 희석하고 2 % FBS는 세포를 얼룩이 지적했다.
- Streptavidin conjuAPC-Cy7 1:300으로 문이
- 각도에 대한 해결책 50 μL를 추가합니다. pipetting하여 단일 세포 현탁액으로 교제를 끊다.
- 4 ° C.에 어둠 속에서 10 분 대한 세포를 품어
- PBS 150 μL 및 2% FBS로 두 번 세포를 씻으십시오.
- 5 분을위한 1,500 rpm으로 접시를 원심 분리기와 뜨는 버리고.
- PBS와 2% FBS 100 μL의 세포를 Resuspend.
- FACS에서 샘플을 습득.
3. C-키트 + 세포의 자성 농축
- PBS, 산도 7.2, (BSA) 0.5 % 소 혈청 알부민, 2 밀리미터 EDTA (에틸렌 다이아 민 테트라 초산)를 포함하는 완충 용액을 준비한다.
- APC에 복합 C-키트 mAb를 포함하는 완충 용액의 1 ML에서 최소 10 생쥐에서 추출한 뼈 marrows의 세포 펠렛을 Resuspend은 1시 50분을 희석.
- 4 ° C.에 어둠 속에서 20 분 동안 세포를 품어
- 완충 용액의 40 ML로 두 번 세포를 씻으십시오.
- 5 분을위한 1,500 rpm으로 튜브를 원심 조심스럽게 T를 제거그는 흡인에 의해 뜨는. 펠렛을 방해하지 않도록하십시오.
- Resuspend 세포 펠렛은하고 펠릿 직접 각 euthanized 마우스에 대한 안티 - APC의 MicroBeads 50 μl를 추가합니다.
- 잘 섞어서 4 ° C.에 어둠 속에서 20 분 동안 품어
- 5 분을위한 1,500 rpm으로 완충 용액 및 원심 분리기 40 ML을 추가하여 세포를 씻으십시오. 완전히 뜨는 기음.
- 사흘에 마우스 euthanized 완충 용액 4 ML의 여러 관련 Resuspend 세포 펠릿.
- 적당한 맥에서 구분 기호의 자기장의 장소는 맥에서 LS 열을. 사흘에 마우스 euthanized 한 컬럼을 사용합니다.
- 완충 용액 4 ML과 rinsing하여 컬럼을 준비합니다.
- 컬럼에 세포 현탁액을 적용합니다.
- 통과 및 완충 용액 4 ML로 칼럼을 씻고 레이블이 지정되지 않은 세포를 수집합니다. 완충 용액 4 ML 세 번 추가하여 세척 단계를 수행합니다. 열 저수지가납니다 새로운 버퍼를 추가합니다.
- 구분 및 plac에서 열 제거전자 15 ML 팔콘 튜브 위에 각각.
- 각 열에 진입 완충 용액의 피펫 4 ML. 즉시 열에 플런저를 밀어 자기 (磁 气)라고 표시된 전지를 살아가기.
- 5 분을위한 1,500 rpm으로 튜브를 원심 조심스럽게 흡인에 의해 뜨는을 제거합니다.
- 한 15 ML 팔콘 튜브의 완충 용액 및 그룹 알약 1 ML 각 펠렛을 Resuspend.
4. 조혈 줄기 세포와 리니지 헌신 Progenitors으로 정렬
- 다음과 같은 표면 마커 향한 mAbs의 혼합을 준비합니다. 그들을 희석은 세포를 얼룩이 500 μL PBS와 2% FBS에 표시된.
- CD4, CD8, 인 경우에는 3 번 CD, CD45R, CD19, Gr1, Ter119, NK1.1 PE-Cy5 1:200으로 복합
- APC 1:100으로 C-키트 복합
- 비오틴 1시 50분로 SCA-1 복합
- FITC 1시 50분에 복합 CD34
- PE 1:100으로 복합 FcγR
- previou에서 튜브를 원심 분리기님의 5 분을위한 1,500 rpm으로 섹션을 조심스럽게 흡인에 의해 뜨는을 제거합니다.
- 펠렛에 mAbs 믹스를 추가합니다. pipetting하여 단일 세포 현탁액으로 교제를 끊다.
- 4 ° C.에 어둠 속에서 20 분 동안 세포를 품어
- PBS의 14mL 및 2% FBS로 두 번 세포를 씻으십시오.
- 5 분을위한 1,500 rpm으로 튜브를 원심 분리기와 뜨는 버리고.
- streptavidin을 희석은 500 μL PBS에 표시된와 2 %의 FBS 세포를 얼룩.
- APC-Cy7 1:300으로 복합 Streptavidin
- 튜브에 솔루션을 추가합니다. pipetting하여 단일 세포 현탁액으로 교제를 끊다.
- 4 ° C.에 어둠 속에서 10 분 대한 세포를 품어
- PBS의 14 ML 및 2% FBS로 두 번 세포를 씻으십시오.
- 5 분을위한 1,500 rpm으로 튜브를 원심 분리기와 뜨는 버리고.
- PBS와 2% FBS 500 μL의 세포를 Resuspend.
- 엘리를 위해 새로운 5 ML 관의 세포 현탁액을 전송 및 필터링분류 절차를 방해할 수 세포 집계를 minate.
- 정렬 인구에서 7-AAD + 죽은 세포를 제외하기 위해 세포 현탁액에 7-AAD 5 μL를 (이것은 1:100 희석 사용) 추가합니다.
- 다음 phenotypes에 따라 BD FACSAria로 정렬 세포 :
- LKS 세포 : 린 - C-키트 + 무서-1 +
- LT-HSCs : LKS CD34 -
- ST-HSCs : LKS CD34 +
- GMPs : 린 - C-키트 + 무서-1 낮은 FcγR 높은 CD34 +
- MEPs : 린 - C-키트 + 무서-1 낮은 FcγR 낮은 CD34 -
- CMPs : 린 - CD34 C-키트 + 무서-1 낮은 FcγR 낮음 +
5. 대표 결과
한 쇼 및 전자 게이팅 절차의 예제와 그림린과 같은 점수를 일반적인 림프 progenitors (CLPs) - / C - 키트 싸다 / 인터루킨 (IL)-7R + 세포, 린 - / C-키트 + / 무서-1 + (LKS) 및 린 - / C-키트 + / 무서 -1 이오 (C-키트 +) 세포, C-키트 + 게이트에서, 일반적인 골수양 progenitors (CMPs)는 FcγR 싸다, CD34 + 세포, FcγR 하이 CD34 + 세포 및 / megakaryocyte 같은 과립 / 단핵세포 progenitors (GMPs)로 식별됩니다 FcγR 싸다, CD34와 같은 적혈구 progenitors (MEPs) - 세포, LKS 게이트, LT-HSC와 ST-HSC에서는 CD34으로 식별됩니다 - 그리고 CD34 + 세포, 각각. 그러면 위에서 설명한 표현형에 따라 CD34 표현뿐만 아니라 다른 progenitors에 따라 정렬하실 수 있습니다 LT-HSC와 ST-HSC,이 골수 세포 현탁액은 자기 구슬 (그림 2)와 C-키트 + 세포에 대해 풍부하게 할 수 있습니다.
HSCs 아나 수 세포가 염기 결합 화합물 quinacrine 11뿐만 아니라 핵 빨간색 (DRAQ5) 물들일되었습니다 - CD34는 그림 4와 같이 라이브 이미징 공촛점 현미경으로 lyzed. HSCs에 있지만 GMPs 아닌 quinacrine - 긍정 vesicles는 세포질 12 볼 수 있습니다. + LT-HSC에 노출시 purinergic P2 수용체의 활성화에 의한 cytosolic 칼슘 2의 증가를 보여주는 그림 5에서 보여준대로 더욱이, 정렬 HSCs는 기능적 실험에 사용할 수 아데노신-triphosphate (ATP)와 ionomycin 12.
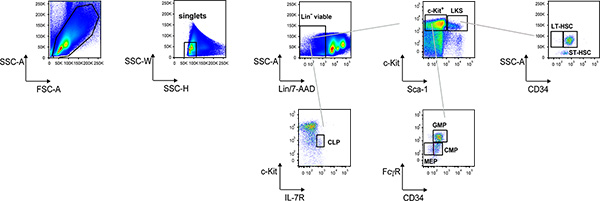
그림 1. 린 - BM 전지의 대표 점 플롯 분석. 프로토콜 텍스트에 설명된대로 골수 세포 현탁액에서 조혈 progenitors과 HSCs를 파악하고 채점하는 흐름 cytometer에서 전자 게이팅 절차 묻다.
pload/3736/3736fig2.jpg "/>
그림 2. 골수에서 C-키트 + 세포의 선택적 농축을위한 제도.
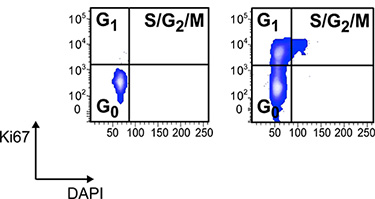
그림 3 전자 문이 LKS CD34의 세포주기 분석 -. 건강한 컨트롤 및 KI-67 항체와 DAPI 물들일 IBD와 생쥐의 HSCs. 세포가 수정 및 / Lyse 고정 및 1 μg / ML에서 FITC KI-67 복합 및 DAPI로 더럽히는 것 다음에 버퍼를 파마로 permeabilized되었다. 사이클링 세포들은 거의 LKS CD34의 모든 감지의 경우 - 건강한 컨트롤 12 HSCs 구획.

. 뉴클레오 티드 결합 화합물 quinacrine 및 핵 빨간색 (DRAQ5) 물들일 HSCs과 GMPs - 그림 4는 CD34을 정렬 FACS의 이미징 공촛점 현미경을 살고 있습니다. 작은 quadrants는 quinacrine POS를 보여itive vesicles는 HSCs의 세포질에서 발견되지만 GMPs 없습니다.

그림 5. Cytosolic 칼슘 2 + Fura-2로로드되고 ATP와 ionomycin으로 자극 정렬 HSCs의 고도. 단일 세포의 성분이 표시됩니다. 모든 세포는 + ATP가 추가 후 cytosolic 칼슘 2의 현저한 증가를 보여주는 세포외 ATP에 반응했다.
토론
여기서 설명한 방법은 개별 생쥐 (그림 1) 조혈의 신속하고 정확한 분석을 가능하게합니다. murine 염증의 모델, autoimmunity, 면역 결핍, 퇴행성 질환, 대사 질환 및 암 등 다양한 실험적 설정,이 분석은 조혈에 대한 병리 학적 조건의 영향을 해결하실 수 있습니다. 그림 3은 전자 문이 LKS의 세포 사이클링 활동의 분석을 보여줍니다 CD34 - KI-67 mab 및 DAPI로 더럽?...
공개
관심의 어떠한 충돌 선언 없습니다.
감사의 말
우리는 귀중한 조언을 Nobuyuki Onai, 히토시 타키자와 마르쿠스 Manz 감사드립니다. 이 작품은 스위스 국립 과학 재단, 스위스 암 리그와 Fondazione Ticinese마다 라 RIcerca ㅡ Cancro에 의해 재정 지원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | |
| RPMI 1640 | Gibco | 42,401 | |
| MEM NEAA 100X | Gibco | 11,140 | |
| 나트륨 Pyruvate | Gibco | 11,360 | |
| PenStrep | Gibco | 15,070 | |
| PBS | Gibco | 20,012 | |
| FBS | Gibco | 16,000 | |
| 셀 스트레이너 40 μm의 | BD 팔콘 | 352,340 | |
| 7-AAD의 염색법 솔루션 | BD Pharmingen | 559,925 | |
| 버퍼를 Lyse / 수정 | BD Pharmingen | 558,049 | |
| 버퍼 III를 파마 | BD Pharmingen | 558,050 | |
| KI-67 | BD Pharmingen | 556,026 | |
| DAPI | Invitrogen | D21490 | |
| CD4 (GK1.5) | eBioscience | 150,041 | |
| CD8 (53-6.7) | eBioscience | 150,081 | |
| 인 경우에는 3 번 CD (145-2C11) | eBioscience | 150,031 | |
| CD45R (RA3-6B2) | eBioscience | 150,452 | |
| CD19 (6D5) | eBioscience | 150,193 | |
| Gr1 (RB6-8C5) | eBioscience | 155,931 | |
| Tre119 (TER-119) | eBioscience | 155,921 | |
| NK-1.1 (PK136) | eBioscience | 455,941 | |
| C-키트 (2B8) | eBioscience | 171,171 | |
| SCA-1 (D7) | eBiosci줬어 | 135,981 | |
| CD34 (RAM34) | eBioscience | 110,341 | |
| FcγR (2.4G2) | eBioscience | 553,145 | |
| 안티 APC의 MicroBeads | Miltenyi Biotec | 130-090-855 | |
| LS 열 | Miltenyi Biotec | 130-042-401 |
참고문헌
- Weissman, I. L. Stem cells: units of development, units of regeneration, and units in evolution. Cell. 100, 157-168 (2000).
- Calvi, L. M. Osteoblastic cells regulate the haematopoietic stem cell niche. Nature. 425, 841-846 (2003).
- Zhang, J. Identification of the haematopoietic stem cell niche and control of the niche size. Nature. 425, 836-841 (2003).
- Kiel, M. J., Yilmaz, O. H., Iwashita, T., Terhorst, C., Morrison, S. J. SLAM family receptors distinguish hematopoietic stem and progenitor cells and reveal endothelial niches for stem cells. Cell. 121, 1109-1121 (2005).
- Arai, F. Tie2/angiopoietin-1 signaling regulates hematopoietic stem cell quiescence in the bone marrow niche. Cell. 118, 149-161 (2004).
- Essers, M. A. IFNalpha activates dormant haematopoietic stem cells in vivo. Nature. 458, 904-908 (2009).
- Nagai, Y. Toll-like receptors on hematopoietic progenitor cells stimulate innate immune system replenishment. Immunity. 24, 801-812 (2006).
- Wilson, A. Hematopoietic stem cells reversibly switch from dormancy to self-renewal during homeostasis and repair. Cell. 135, 1118-1129 (2008).
- Osawa, M., Hanada, K., Hamada, H., Nakauchi, H. Long-term lymphohematopoietic reconstitution by a single CD34-low/negative hematopoietic stem cell. Science. 273, 242-245 (1996).
- Lo Celso, C., Scadden, D., D, . Isolation and Transplantation of Hematopoietic Stem Cells (HSCs. J. Vis. Exp. (2), e157 (2007).
- Romanello, M. Autocrine/paracrine stimulation of purinergic receptors in osteoblasts: contribution of vesicular ATP release. Biochem. Biophys. Res. Commun. 331, 1429-1438 (2005).
- Casati, A. Cell-autonomous regulation of hematopoietic stem cell cycling activity by ATP. Cell Death Differ. 18, 396-404 (2011).
- Bouma, G., Strober, W. The immunological and genetic basis of inflammatory bowel disease. Nat. Rev. Immunol. 3, 521-533 (2003).
- Takizawa, H., Regoes, R. R., Boddupalli, C. S., Bonhoeffer, S., Manz, M. G. Dynamic variation in cycling of hematopoietic stem cells in steady state and inflammation. J. Exp. Med. 208, 273-284 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유