Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Cartographie des séquelles de Theta Burst Stimulation sur le cortex auditif humain à l'imagerie fonctionnelle
Dans cet article
Résumé
Traitement auditif est à la base de la parole et de la musique liés transformation. Stimulation magnétique transcrânienne (TMS) a été utilisée avec succès pour étudier cognitifs, systèmes sensoriels et moteurs, mais a rarement été appliquée à l'audition. Ici, nous avons étudié TMS associés à l'imagerie par résonance magnétique fonctionnelle pour comprendre l'organisation fonctionnelle du cortex auditif.
Résumé
Auditory cortex pertains to the processing of sound, which is at the basis of speech or music-related processing1. However, despite considerable recent progress, the functional properties and lateralization of the human auditory cortex are far from being fully understood. Transcranial Magnetic Stimulation (TMS) is a non-invasive technique that can transiently or lastingly modulate cortical excitability via the application of localized magnetic field pulses, and represents a unique method of exploring plasticity and connectivity. It has only recently begun to be applied to understand auditory cortical function 2.
An important issue in using TMS is that the physiological consequences of the stimulation are difficult to establish. Although many TMS studies make the implicit assumption that the area targeted by the coil is the area affected, this need not be the case, particularly for complex cognitive functions which depend on interactions across many brain regions 3. One solution to this problem is to combine TMS with functional Magnetic resonance imaging (fMRI). The idea here is that fMRI will provide an index of changes in brain activity associated with TMS. Thus, fMRI would give an independent means of assessing which areas are affected by TMS and how they are modulated 4. In addition, fMRI allows the assessment of functional connectivity, which represents a measure of the temporal coupling between distant regions. It can thus be useful not only to measure the net activity modulation induced by TMS in given locations, but also the degree to which the network properties are affected by TMS, via any observed changes in functional connectivity.
Different approaches exist to combine TMS and functional imaging according to the temporal order of the methods. Functional MRI can be applied before, during, after, or both before and after TMS. Recently, some studies interleaved TMS and fMRI in order to provide online mapping of the functional changes induced by TMS 5-7. However, this online combination has many technical problems, including the static artifacts resulting from the presence of the TMS coil in the scanner room, or the effects of TMS pulses on the process of MR image formation. But more importantly, the loud acoustic noise induced by TMS (increased compared with standard use because of the resonance of the scanner bore) and the increased TMS coil vibrations (caused by the strong mechanical forces due to the static magnetic field of the MR scanner) constitute a crucial problem when studying auditory processing.
This is one reason why fMRI was carried out before and after TMS in the present study. Similar approaches have been used to target the motor cortex 8,9, premotor cortex 10, primary somatosensory cortex 11,12 and language-related areas 13, but so far no combined TMS-fMRI study has investigated the auditory cortex. The purpose of this article is to provide details concerning the protocol and considerations necessary to successfully combine these two neuroscientific tools to investigate auditory processing.
Previously we showed that repetitive TMS (rTMS) at high and low frequencies (resp. 10 Hz and 1 Hz) applied over the auditory cortex modulated response time (RT) in a melody discrimination task 2. We also showed that RT modulation was correlated with functional connectivity in the auditory network assessed using fMRI: the higher the functional connectivity between left and right auditory cortices during task performance, the higher the facilitatory effect (i.e. decreased RT) observed with rTMS. However those findings were mainly correlational, as fMRI was performed before rTMS. Here, fMRI was carried out before and immediately after TMS to provide direct measures of the functional organization of the auditory cortex, and more specifically of the plastic reorganization of the auditory neural network occurring after the neural intervention provided by TMS.
Combined fMRI and TMS applied over the auditory cortex should enable a better understanding of brain mechanisms of auditory processing, providing physiological information about functional effects of TMS. This knowledge could be useful for many cognitive neuroscience applications, as well as for optimizing therapeutic applications of TMS, particularly in auditory-related disorders.
Protocole
Le protocole est divisé en une session de deux jours (pas nécessairement consécutifs). La première journée se compose d'une piste composée d'une IRMf anatomique et quelques balayages IRM fonctionnelle pour définir pour chaque participant les zones à cibler avec TMS. Le deuxième jour consiste en des sessions IRMf pré-et post-TMS TMS où est appliquée à l'intérieur du scanner à l'aide d'une bobine spéciale MR compatible TMS (Magstim Ltd, Pays de Galles, Royaume-Uni) et un système stéréotaxique sans cadre (Brainsight). Ce dernier est utilisé à la position en temps réel de la bobine TMS sur les aires corticales par rapport aux données anatomiques et fonctionnelles de chaque participant.
1. Session Localizer
- Commencez par l'acquisition d'une image anatomique haute résolution de votre participant.
- Ensuite, acquérir des images fonctionnelles qui utilisent un écho de gradient EPI impulsion et un paradigme échantillonnage clairsemé afin de minimiser tout effet BOLD ou masquage auditif dû au bruit de numérisation IRM 14,15. Dans notre cas, l'IRMf est effectuée dendant une tâche mélodie dans laquelle les participants doivent déterminer si deux mandats consécutifs de 5-notes mélodies sont l'2,16 identiques ou différents. Une tâche de contrôle non-discrimination auditive est également inclus, dans lesquelles les sujets entendre deux de longueur égale modes de cinq notes, tous à la même hauteur de C5 et demande de cliquer sur le bouton gauche en suivant le second stimulus. Périodes de silence sont également insérés au hasard parmi les essais des tâches dans chaque série. Au total, 72 sont des essais présentés dans un ordre aléatoire: 24 essais de discrimination mélodie, 24 essais de contrôle auditif et 24 périodes de silence, pour une durée totale de 12 min 16 sec.
- Définir le site de stimulation à l'aide anatomiques et / ou fonctionnelles repères. Il faut être conscient que la TMS est limitée en ce qui concerne la profondeur du site de stimulation en raison de l'atténuation de l'intensité du champ électrique en profondeur et ne peut pas s'attendre à atteindre les zones les plus profondes de 3 cm 6,17. Une étape cruciale consiste à utiliser des repères similaires pour chaque partieicipant, ce qui pourrait s'avérer difficile en raison des différences dans l'anatomie et la fonction entre les participants. Ici, nous ciblons gyrus Heschl à chaque participant, situé utilisant deux repères anatomiques et fonctionnelles. Nous utilisons des masques de gyrus Heschl fournies par les atlas Harvard-Oxford structurelles ( http://www.fmrib.ox.ac.uk/fsl/data/atlas-descriptions.html ) et la cible TMS est définie individuellement par le pic de activation dans le gyrus l'Heschl 2. En outre, nous avons également définir la position du sommet, qui sera utilisé comme site de contrôle pour contrôler les effets non spécifiques des TMS tels que des artefacts acoustiques et somato-sensoriel. Le sommet est défini comme anatomiquement point milieu de l'inion et l'arête du nez, et à égale distance des encoches droite et gauche intertragal. L'ordre du site de stimulation (gyrus dire Heschl ou un sommet) est contrebalancée dansindividus.
2. Pré-et post-TMS expérience IRMf
Pré-session de TMS IRMf
- Préparer le participant pour aller directement dans le scanner. Cela comprend l'enlèvement de métal et de remplir le formulaire de sélection TMS et MR.
- Lancement de l'acquisition MR avec un anatomiques et fonctionnelles quelques balayages (identique à celle effectuée lors de la session de piste, voir la section 1).
Stéréotaxie sans cadre et TMS dans l'environnement IRM
Le système de stéréotaxie sans cadre est composé d'une caméra infrarouge (Polaris Spectra), des outils et des pisteurs (Brainsight) utilisés pour la procédure d'enregistrement et un ordinateur. L'ordinateur est situé à l'extérieur de la chambre scanner, mais placée à l'entrée de la chambre et la porte du scanner scanner est maintenu ouvert pendant l'application TMS. Les outils et les trackers sont compatibles MR, ainsi que le trépied (fait maison) supportant la caméra infrarouge et sont eerefore utilisé à l'intérieur de la chambre du scanner. La caméra infrarouge n'est pas compatible IRM, et par conséquent est positionné à l'intérieur de la salle du scanner, près de la porte du scanner à environ deux mètres de la vitre du scanner (voir la discussion de procédure de sécurité). Le système TMS stimulateur est situé dans une pièce adjacente à la salle du scanner IRM. On utilise une bobine MRI compatible TMS situé à l'intérieur de la chambre et du scanner relié au système TMS par un câble 7-m dans un tube filtre RF.
- Charger des images anatomiques et fonctionnelles votre participant et les objectifs de stimulation dans le logiciel stéréotaxique (Brainsight par exemple). Ici, nous allons cibler le gyrus Heschl de droite.
- Après l'acquisition IRMf pré-TMS, enlever la partie supérieure MR bobine tête de la bobine de tête 32-canal (si vous utilisez le scanner 3T Siemens et la configuration à 32 canaux tête de bobine).
- Ensuite, faites glisser vers le bas le participant sur la vitre du scanner.
- Fixez le serre-tête et jeu de tracker sur la participant la tête.
- Montez le bras à plusieurs articulations à la vitre du scanner et de fixer le MR bobine compatible TMS sur le bras.
- Vérifiez que tous les trackers et de la bobine sont dans le champ de vision de la caméra. Ici, la caméra est légèrement déplacé vers le côté droit du participant pour permettre un suivi plus facile des déplacements de bobine lorsque le ciblage de l'hémisphère droit.
- Calibrer tête de votre sujet avec les outils de stéréotaxie (c.-à-outil pointeur). Cela se fait en plusieurs points de repère coregistering sur la tête du participant (par exemple, dans notre cas, le bout du nez, le nasion et le tragus des deux oreilles) avec les points de repère sur les mêmes données anatomiques. Dans cette procédure, deux expérimentateurs sont nécessaires, l'une près de la tête du participant pour positionner l'outil pointeur sur la tête du participant, et l'expérimentateur autre à l'entrée de la salle du scanner pour effectuer l'enregistrement sur l'ordinateur.
- Placez le MR bobine TMS compatible tangente à til cuir chevelu, et les suiveurs de bobine orientée vers la caméra infrarouge. La bobine est orienté avec la poignée bobine pointant vers l'arrière et parallèle à la ligne médiane 2. Fixer la position de la bobine à l'aide des vis sur le bras à plusieurs articulations.
- Dans la chambre à côté de l'appareil d'IRM, mettez le système TMS et de commencer la stimulation. TMS est appliquée suivant un protocole motifs, c'est à dire, continue la stimulation thêta burst (CTBS) consistant à 3 impulsions à 50 Hz, répétée à 5Hz pour 40s. On utilise une intensité de stimulation fixe (41%), définie par le stimulateur de sortie 18,19. Nous avons choisi ce protocole, il a été montré pour moduler la plasticité corticale pour une durée allant jusqu'à 30 minutes après l'arrêt de la stimulation à la santé des populations 20, (voir la section de discussion pour les procédure de sécurité).
Session de l'IRMf post-TMS
- Une fois que la stimulation est terminée, il est important d'obtenir le sujet dans le scanner le plus tôt possible. Retirez le TMS bobine de la salle du scanner et retirez le bras à plusieurs articulations. Faire glisser la tête du participant dans la bobine tête MR. Assurez votre scanner est préparé et prêt à partir. Notre conseil est de garder la plate-forme corporelle élevée pendant toute la session de TMS, et de réduire le nombre et la durée de l'analyse d'alignement de piste à un minimum.
- Parce que les effets de la SMTr sont transitoires, la session de numérisation définitive devrait commencer par l'analyse fonctionnelle. Encore une fois, nous avons procédé à l'IRMf pendant un cycle de 12 min de la tâche mélodie.
- Après la numérisation finale est terminée, terminez par une analyse anatomique.
3. Les résultats représentatifs
L'analyse des données d'IRMf sont effectuées séparément pour la session IRMf pré-et post-TMS. Pour chaque session IRMf (ie, pré et post-TMS), le contraste entre les mélodies et la tâche de contrôle auditif montre les tâches liées à l'activité de la gauche et la droite gyri Heschl, supérieur gyri temporal, frontal inférieur gyri et precentrale gyri (figure 1 A, B). Pour évaluer les différences entre les sessions IRMf pré-et post-TMS, nous effectuons une analyse aléatoire effet à l'aide de Student t-test apparié. L'importance est déterminée en utilisant les clusters identifiés par az> seuil de 2 et un seuil de cluster corrigée de p = 0,05. Figure 1 C représente le contraste post-moins pré-CTBS pour un seul participant. Les données suggèrent que CTBS ciblant le droit gyrus Heschl (cercle noir) induit une augmentation de la réponse IRMf dans le cortex (à gauche) auditive, y compris le gyrus gauche Heschl. Changements dans la réponse IRMf se trouvent également dans le gyrus post-central gauche, gauche insula et le cortex occipital latéral bilatéral. Toutefois, aucune modification significative de la réponse IRMf est vu sous la bobine. En outre, même combinée TMS-IRMf protocole est répété pour stimuler l'(site témoin) sommets. Comparaison des séances de pré-et post-IRMf avec CTBS appliquées sur le sommet n'a montré aucune significaeffet nt (données non présentées).
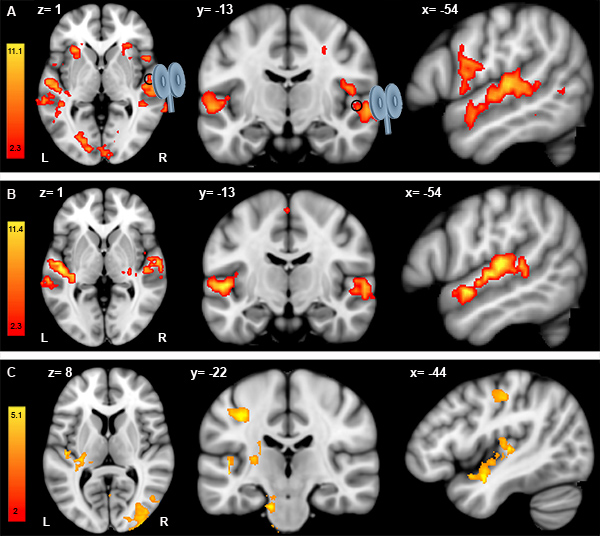
Figure 1. Analyse des données individuelles IRMf pré-TMS (A), post-TMS IRMf données (B) et post-moins pré-TMS données IRMf (C). A. Résultats de la discrimination mélodie revanche moins les essais contrôlés auditifs pour un seul participant à la session IRMf pré-TMS (A) et à la session de l'après-TMS IRMf (B). De gauche à droite: coupes axiales, coronales et sagittales. Dans les deux cas (A) et (B), la bobine TMS vise le droit gyrus Heschl (cercle noir) situé à x = 54, y = -13, z = 1 (MNI152 espace standard). Pour les deux sessions de pré-et post-TMS IRMf, les coordonnées sont affichées en x = -54, y = -13, z = 1 (MNI152 espace standard) pour montrer les changements dans l'hémisphère gauche sur le site de stimulation (gyrus droit soit Heschl ). C. Résultats de l'opposition post-moins sessions IRMf pré-TMS à l'aide de Student t-test apparié.
Discussion
Nous décrivons un protocole combinant TMS hors ligne et l'IRMf pour étudier l'organisation fonctionnelle du cortex auditif. Dans les sections suivantes, nous allons étudier les facteurs méthodologiques à considérer lors de la réalisation de ces approches.
Acquisition et le calendrier de l'après-TMS session de l'IRMf
Afin d'acquisition et de contrebalancer les analyses de sessions IRMf pré-et post-TMS
...
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
CIBC bourse (JA) et subvention du CRSNG (RZ). Nous sommes reconnaissants à M. Roch Comeau (Brainsight) pour son aide en ce qui concerne la caméra infrarouge, les trackers compatibles IRM et le soutien d'autres matériels. Nous sommes également reconnaissants à Brian Hynes (Hybex Innovations Inc) qui a conçu le bras multi-articulé pour porte-bobine et a fourni quelques-uns des chiffres qui s'affichent dans la vidéo. Et un grand merci à tous les techniciens MR et M. Ferreira du Centre d'imagerie cérébrale McConnell de l'Institut neurologique de Montréal qui nous ont aidés optimisation de la conception de l'expérience.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du produit | Type | Entreprise | |
| La stimulation magnétique transcrânienne | Magstim super-Rapid2 stimulateur, Rapid-2 Plus One Module | Magstim Ltd, Pays de Galles, Royaume-Uni | |
| Bobine de stimulation magnétique | Compatible avec l'IRM 70 mm figure en huit-bobine | Magstim Ltd, Pays de Galles, Royaume-Uni | |
| Imagerie par résonance magnétique | 3-T scanner Trio Siemens, Bobine Head à 32 canaux | Siemens, Inc, Allemagne | |
| La stéréotaxie sans cadre | Brainsight | Rogue Research Inc, Montréal, Canada | |
| Système de mesure optique | Polaris Spectra | Northern Digital Inc, Ontario, Canada | |
| Multi-bras articulé pour porte-bobine | Standard | Hybex Innovations Inc, Anjou, Canada | |
| Écouteurs Insérer compatible avec l'IRM | Sensimetrics, modèle S14 | Sensimetrics Corporation, MA, USA |
Références
- Winer, J. A., Schreiner, C. E. . The Auditory Cortex. , (2011).
- Andoh, J., Zatorre, R. J. Interhemispheric Connectivity Influences the Degree of Modulation of TMS-Induced Effects during Auditory Processing. Frontiers in psychology. 2, 161 (2011).
- Siebner, H. R., Hartwigsen, G., Kassuba, T., Rothwell, J. C. How does transcranial magnetic stimulation modify neuronal activity in the brain? Implications for studies of cognition. Cortex. 45, 1035-1042 (2009).
- Ruff, C. C., Driver, J., Bestmann, S. Combining TMS and fMRI: from 'virtual lesions' to functional-network accounts of cognition. Cortex; a journal devoted to the study of the nervous system and behavior. 45, 1043-1049 (2009).
- Bestmann, S. Mapping causal interregional influences with concurrent TMS-fMRI. Exp. Brain Res. 191, 383-402 (2008).
- Bohning, D. E. BOLD-fMRI response to single-pulse transcranial magnetic stimulation (TMS. Journal of magnetic resonance imaging : JMRI. 11, 569-574 (2000).
- de Vries, P. M. Changes in cerebral activations during movement execution and imagery after parietal cortex TMS interleaved with 3T MRI. Brain research. 1285, 58-68 (2009).
- Cardenas-Morales, L., Gron, G., Kammer, T. Exploring the after-effects of theta burst magnetic stimulation on the human motor cortex: a functional imaging study. Human brain mapping. 32, 1948-1960 (2011).
- Grefkes, C. Modulating cortical connectivity in stroke patients by rTMS assessed with fMRI and dynamic causal modeling. NeuroImage. 50, 233-242 (2010).
- O'shea, J., Johansen-Berg, H., Trief, D., Gobel, S., Rushworth, M. F. S. Functionally specific in human premotor reorganization cortex. Neuron. 54, 479-490 (2007).
- Pleger, B. Repetitive transcranial magnetic stimulation-induced changes in sensorimotor coupling parallel improvements of somatosensation in humans. The Journal of neuroscience : the official journal of the Society for Neuroscience. 26, 1945-1952 (2006).
- Tegenthoff, M. Improvement of tactile discrimination performance and enlargement of cortical somatosensory maps after 5 Hz rTMS. Plos Biology. 3, 2031-2040 (2005).
- Andoh, J., Paus, T. Combining functional neuroimaging with off-line brain stimulation: modulation of task-related activity in language areas. Journal of cognitive neuroscience. 23, 349-361 (2011).
- Belin, P., Zatorre, R. J., Hoge, R., Evans, A. C., Pike, B. Event-related fMRI of the auditory cortex. Neuroimage. 10, 417-429 (1999).
- Hall, D. A. "Sparse" temporal sampling in auditory fMRI. Human Brain Mapping. 7, 213-223 (1999).
- Foster, N. E., Zatorre, R. J. A role for the intraparietal sulcus in transforming musical pitch information. Cereb Cortex. 20, 1350-1359 (2010).
- Bohning, D. E. Mapping transcranial magnetic stimulation (TMS) fields in vivo with MRI. Neuroreport. 8, 2535-2538 (1997).
- Corthout, E., Uttl, B., Walsh, V., Hallett, M., Cowey, A. Timing of activity in early visual cortex as revealed by transcranial magnetic stimulation. Neuroreport. 10, 2631-2634 (1999).
- Lewald, J., Foltys, H., Topper, R. Role of the posterior parietal cortex in spatial hearing. The Journal of neuroscience : the official journal of the Society for Neuroscience. 22, RC207 (2002).
- Huang, Y. Z., Edwards, M. J., Rounis, E., Bhatia, K. P., Rothwell, J. C. Theta burst stimulation of the human motor cortex. Neuron. 45, 201-206 (2005).
- Loubinoux, I. Within-session and between-session reproducibility of cerebral sensorimotor activation: a test--retest effect evidenced with functional magnetic resonance imaging. Journal of cerebral blood flow and metabolism : official journal of the International Society of Cerebral Blood Flow and Metabolism. 21, 592-607 (2001).
- Lisanby, S. H., Gutman, D., Luber, B., Schroeder, C., Sackeim, H. A. Sham TMS: intracerebral measurement of the induced electrical field and the induction of motor-evoked potentials. Biological psychiatry. 49, 460-463 (2001).
- Loo, C. K. Transcranial magnetic stimulation (TMS) in controlled treatment studies: are some "sham" forms active. Biological psychiatry. 47, 325-331 (2000).
- Robertson, E. M., Theoret, H., Pascual-Leone, A. Studies in cognition: the problems solved and created by transcranial magnetic stimulation. J. Cogn. Neurosci. 15, 948-960 (2003).
- Puschmann, S., Uppenkamp, S., Kollmeier, B., Thiel, C. M. Dichotic pitch activates pitch processing centre in Heschl's gyrus. NeuroImage. 49, 1641-1649 (2010).
- Johnsrude, I. S., Penhune, V. B., Zatorre, R. J. Functional specificity in the right human auditory cortex for perceiving pitch direction. Brain : a journal of neurology. 123, 155-163 (2000).
- Di Lazzaro, V. The physiological basis of the effects of intermittent theta burst stimulation of the human motor cortex. The Journal of physiology. 586, 3871-3879 (2008).
- Stagg, C. J. Neurochemical effects of theta burst stimulation as assessed by magnetic resonance spectroscopy. Journal of neurophysiology. 101, 2872-2877 (2009).
- Todd, G., Flavel, S. C., Ridding, M. C. Priming theta-burst repetitive transcranial magnetic stimulation with low- and high-frequency stimulation. Experimental brain research. Experimentelle Hirnforschung. Experimentation cerebrale. 195, 307-315 (2009).
- Bestmann, S., Baudewig, J., Siebner, H. R., Rothwell, J. C., Frahm, J. Subthreshold high-frequency TMS of human primary motor cortex modulates interconnected frontal motor areas as detected by interleaved fMRI-TMS. Neuroimage. 20, 1685-1696 (2003).
- Bungert, A. TMS combined with fMRI. , (2010).
- Bestmann, S., Baudewig, J., Frahm, J. On the synchronization of transcranial magnetic stimulation and functional echo-planar imaging. Journal of magnetic resonance imaging : JMRI. 17, 309-316 (2003).
- Wassermann, E. M. Use and safety of a new repetitive transcranial magnetic stimulator. Electroencephalogr. Clin. Neurophysiol. 101, 412-417 (1996).
- Oberman, L. M., Pascual-Leone, A. Report of seizure induced by continuous theta burst stimulation. Brain stimulation. 2, 246-247 (2009).
- Rossi, S., Hallett, M., Rossini, P. M., Pascual-Leone, A. Safety, ethical considerations, and application guidelines for the use of transcranial magnetic stimulation in clinical practice and research. Clin. Neurophysiol. 120, 2008-2039 (2009).
- Wassermann, E. M. Risk and safety of repetitive transcranial magnetic stimulation: report and suggested guidelines from the International Workshop on the Safety of Repetitive Transcranial Magnetic Stimulation, June 5-7, 1996. Electroencephalography and clinical neurophysiology. , 1-16 (1998).
- Yamaguchi-Sekino, S., Sekino, M., Ueno, S. Biological effects of electromagnetic fields and recently updated safety guidelines for strong static magnetic fields. Magn. Reson. Med. Sci. 10, 1-10 (2011).
- Bestmann, S. Mapping causal interregional influences with concurrent TMS-fMRI. Experimental brain research. Experimentelle Hirnforschung. Experimentation cerebrale. 191, 383-402 (2008).
- Oberman, L., Edwards, D., Eldaief, M., Pascual-Leone, A. Safety of theta burst transcranial magnetic stimulation: a systematic review of the literature. Journal of clinical neurophysiology: official publication of the American Electroencephalographic Society. 28, 67-74 (2011).
- Kangarlu, A. Cognitive, cardiac, and physiological safety studies in ultra high field magnetic resonance imaging. Magn. Reson. Imaging. 17, 1407-1416 (1999).
- Schenck, J. F. Safety of strong, static magnetic fields. Journal of magnetic resonance imaging : JMRI. 12, 2-19 (2000).
- Lee, V. S. . Cardiovascular MRI: physical principles to practical protocols. , 175 (2006).
- Paus, T. Transcranial magnetic stimulation during positron emission tomography: a new method for studying connectivity of the human cerebral cortex. The Journal of neuroscience: the official journal of the Society for Neuroscience. 17, 3178-3184 (1997).
- Sack, A. T., Linden, D. E. Combining transcranial magnetic stimulation and functional imaging in cognitive brain research: possibilities and limitations. Brain Res. Brain Res. Rev. 43, 41-56 (2003).
- Ilmoniemi, R. J. Neuronal responses to magnetic stimulation reveal cortical reactivity and connectivity. Neuroreport. 8, 3537-3540 (1997).
- Thiel, A. From the left to the right: How the brain compensates progressive loss of language function. Brain Lang. 98, 57-65 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon