Method Article
Livraison intraventriculaire directe des médicaments pour le système nerveux central rongeurs
Dans cet article
Résumé
Nous décrivons une méthode pour cibler les médicaments pour le système nerveux central soit par l'implantation d'un cathéter ou d'effectuer une injection en bolus dans le ventricule latéral droit chez la souris. Nous nous concentrons particulièrement sur la prestation des oligonucléotides antisens. Cette technique est facilement adaptable à d'autres médicaments et à des rats.
Résumé
En raison de l'impossibilité de traverser la barrière hémato-encéphalique, certains médicaments doivent être livrés directement dans le système nerveux central (SNC). Notre laboratoire se concentre spécifiquement sur des oligonucléotides antisens (OAS), bien que les techniques présentées dans la vidéo ici peuvent également être utilisés pour fournir une pléthore d'autres médicaments pour le système nerveux central. Les oligonucléotides antisens (OAS) ont la capacité de cibles spécifiques d'une séquence knockdown 1 ainsi que des ratios de gènes spécifiques 2 isoformes de quart. Pour atteindre inactivation génique généralisée ou épissage dans le SNC de la souris, les OSS peuvent être livrés dans le cerveau en utilisant deux voies distinctes de l'administration, à la fois dont nous faisons preuve dans la vidéo.
Les premières utilisations de pompes osmotiques ALZET, relié à un cathéter qui est implantée chirurgicalement dans le ventricule latéral. Cela permet aux OLS à infuser en continu dans le système nerveux central pour une période de temps déterminée. Le second implique une injection en bolus unique d'un salutgh concentration de ASO dans le ventricule latéral droit. Les deux méthodes utilisent le système ventriculaire cérébral de la souris pour livrer l'ASO à l'ensemble du cerveau et la moelle épinière, mais en fonction des besoins de l'étude, une méthode peut être préféré à l'autre.
Introduction
Certains médicaments ne peuvent pas traverser la barrière hémato-encéphalique (BHE), nécessitant Système Nerveux Central directe (CNS) de livraison. Pour contourner le Bureau, les médicaments peuvent être livrés directement dans le cerveau en utilisant les méthodes décrites. Alors que notre laboratoire et le papier focus détaillé ici sur oligonucléotides antisens (OAS), d'autres médicaments, tels que les petites molécules, des anticorps, des vecteurs de thérapie génique, etc., Peuvent également être fournis par la même approche exacte.
Certaines protéines jouent un rôle clé dans la pathogenèse des maladies neurodégénératives. Ces protéines forment souvent des espèces toxiques et s'accumulent pour former des agrégats, conduisant à la mort neuronale et une éventuelle maladie neurologique ultérieure 3-4. Dans un effort pour ralentir ou même stopper la progression de ces maladies, une option thérapeutique peut être de cibler directement et diminuer la protéine en cause. Cependant, ces protéines se trouvent souvent omniprésente à travers le système nerveux central, ce qui rend difficile pour e cibler ffectively eux à l'échelle mondiale.
Afin de cibler les gènes tout au long du CNS, nous administrons OLS en souris liquide céphalo-rachidien (LCR) via le ventricule latéral pour contourner le Bureau. Cette méthode spécifique profite du système ventriculaire de la souris qui baigne l'ensemble du cerveau et la moelle épinière, ce qui permet une large diffusion des OLS. Nous utilisons les OLS qui sont 18-20 mer molécules d'ARN-like qui se lient directement la séquence d'ARNm cible et, en fonction des modifications chimiques ASO, soit a) recruter RNase-H à dégrader l'ARNm conduit à knockdown ou B) déplacer l'épissage alternatif 1 , 2,16,17. Il convient de noter que plusieurs molécules existent pour abattre une protéine spécifique in vivo, y compris shRNA. Étant donné que ces molécules ne sont pas l'objet de cet article, nous dirigeons le lecteur à consulter des articles que mieux détailler les mécanismes de knockdown de l'action et les avantages / inconvénients de chacune 5-6.
jove_content "> Dans des travaux antérieurs, nous avons utilisé les OLS pour cibler le superoxyde de la protéine superoxyde 1 (SOD1) dans un modèle de rat transgénique de la sclérose latérale amyotrophique (SLA) 7 (figure 4). mutations SOD1 se produire chez environ 2% de l'ensemble des SLA 8 cas, si elle a été récemment émis l'hypothèse que la SOD1 peut jouer un rôle important dans la SLA sporadique et 9-10. En diminuant total des SOD1 niveaux dans le transgénique rat SLA, la survie après le début a été augmenté de façon significative 7. Ces données importantes ont été les premiers de montrer qu'un traitement ASO dans le SNC pourrait avoir un impact positif considérable sur un modèle de maladie neurologique. Depuis lors, OLS ciblées pour SOD1 humains sont entrés et terminé avec succès un essai de phase I clinique humaine avec des effets secondaires minimes (Clnicaltrails.gov NCT01041222) , tel que présenté à l'horizon 2012 64 e Annual Academy of Neurology américain. plans pour déplacer les OLS impatience essais de phase II sont actuellement en cours. tout en ciblant SOD1 était la première démonstration de l'utilisation OLS pour traiter une maladie neurologique, plusieurs autres études ont depuis été réalisées en regardant les différentes maladies et leurs cibles protéiques respectifs. En 2010 et 2011, OLS que l'épissage de décalage de la survie de la protéine de neurone moteur 2 (SMN2) ont été utilisés dans les modèles de souris transgéniques de l'atrophie musculaire spinale (SMA) et ont abouti à une amélioration significative dans les phénotypes de la maladie 11,12. Ces OLS d'épissage sont actuellement en phase I des essais cliniques chez les enfants atteints SMA (Clinicaltrails.gov NCT01494701). En outre, il a été récemment montré que l'administration transitoire des OLS ciblées contre le gène huntingtine ont pu sauver de façon spectaculaire le modèle de la souris de Huntington, même après que les niveaux de protéine huntingtine retour à la normale 13.Dans toutes ces études, les OLS ont été livrés au ventricule latéral pour réduire les niveaux de gènes totales ou modifier l'épissage de gènes parla totalité du système nerveux central. Les deux pompes osmotiques et une seule injection d'un bolus peuvent être utilisés pour délivrer OLS à la CSF. Pompes permettent une lente, livraison continue, alors que le intracérébroventriculaire (ICV) est un bolus, injection rapide une fois. Nous avons utilisé ces deux méthodes avec succès, même si nous n'avons pas rapporté la comparaison directe entre la pompe et le bolus en une seule lignée transgénique.
En utilisant OLS dans le SNC est un puissant moyen de diminuer les niveaux de protéines totales et / ou changement épissage de plusieurs protéines. Bien que nous utilisions OLS exclusivement pour le traitement de troubles neurologiques, nous reconnaissons que d'autres domaines peuvent également bénéficier de cette technique. Tant que la protéine d'intérêt est exprimé dans le système nerveux central et le but ultime est de parvenir à des changements CNS à l'échelle de l'expression génique, en utilisant Asos dans les techniques démontrées peuvent être très utiles.
Protocole
Le protocole ci-dessous a été approuvé par l'Institutional Animal Care et comités utilisation à l'Université Washington à St Louis et est en conformité avec les Instituts de lignes directrices de Santé pour l'utilisation des animaux de laboratoire national. Si c'est votre première fois, des opérations chirurgicales, nous vous conseillons d'examiner l'article JoVE sur les chirurgies de rongeurs en guise d'introduction avant de commencer 14.
OSS peuvent être livrés à la CNS de souris à la fois par perfusion de la pompe osmotique et une injection en bolus unique ICV. Pour cette raison, la procédure décrite ci-dessous est divisée en deux segments. Avantages et inconvénients de chaque méthode seront abordés dans la section Discussion. Les coordonnées utilisées dans les protocoles sont pour adultes C57BL6 et B6C3 souris. Coordonnées correspondantes de rat peuvent être trouvés dans le tableau 1.
Pompe osmotique ALZET
1. Préparation des pompes osmotiques Alzet
- Fixer un drap stérilee et déposez soigneusement les éléments suivants sur elle tout en prenant soin de ne pas toucher directement quelque chose pour maintenir la stérilité: pompe osmotique (s), le débit modulateur (s), 1 ml seringue stérile (s), lame de scalpel, et des sections de tubes (1 morceau de tube = 5 pompes). Pour les souris, il ya trois options pour les pompes: 14 jours, 28 jours et 42 jours (figure 2A).
- Déboucher et remplir tubes coniques de 50 ml stériles avec une solution saline ml 15-20. Jusqu'à 6 pompes assemblées peuvent être ajoutés par tube conique.
- Remplir un plat p60 Petri avec de l'éthanol à 100%. Ajoutez nombre approprié de cathéters à l'éthanol. Pour les souris, la longueur du cathéter est de 2,5 mm.
- Filtrer chaque ASO en autant de tubes Eppendorf de 1,5 ml, si nécessaire. Inclure un tube Eppendorf stérile rempli de solution saline 0,9% pour remplir le tube avec.
- Une fois que tout est prêt, mettre des gants stériles. Assurez-vous de ne pas toucher tout ce qui n'est pas stérile. Changer de gants si nécessaire.
- Pour chaque ASO à être utilisé, remplir une seringue de 1 mlet loadpumps en plaçant l'aiguille dans le trou supérieur et en remplissant lentement jusqu'à l'excès s'échappe. Continuez jusqu'à ce que toutes les pompes sont remplis.
- Déboucher le Flow-modulateurs et l'insérer dans les pompes. Poussez le flux modulateur quasi-totalité de la manière, en laissant un espace de 3-5 mm.
- Utilisation de la lame de scalpel, couper chaque morceau de tube en 5 segments égaux. Prenez un morceau de tube, remplir avec du sérum physiologique stérile en utilisant une seringue de 1 ml, et insérez le haut du modulateur de débit dans une extrémité de la tubulure. Ensuite, prendre une canule à partir de l'éthanol et de le connecter à l'autre extrémité de la tubulure. La pompe est maintenant entièrement assemblé.
- Placez la pompe complètement montée dans le tube conique stérile de 50 ml avec une solution saline pour l'amorçage. L'amorçage permet aux pompes pour s'imprégner de liquide pour amorcer la livraison de la drogue ainsi que venir à la bonne température. temps d'amorçage: 14 pompes à jour: 4-6 h, 28 pompes à jour: 40 h, 42 pompes à jour: 60 h. Lorsque vous avez terminé le montage des pompes, plafonner les tubes coniques et les placer dans un endroit propre37 ° C bain d'eau jusqu'à ce que la chirurgie.
2. Procédure de pré-chirurgicale
- Tout essuyer avec 70% d'éthanol pour stériliser la région et établir des draps stériles sur le dessus de table et stereotax pour créer un champ stérile. Il est important de tenir compte du champ stérile pendant toute la chirurgie. Allumez le suivant: stérilisateur à billes, plaquettes de chauffage, lumière, affichage numérique et de l'oxygène / System isoflurane (Figure 1).
- Les éléments suivants seront nécessaires si cela soit une simple intervention chirurgicale ou tout un lot de chirurgies comme nous le faisons régulièrement: 1 paire de pinces, 1 pince hémostatique courbe, 1 paire de petits ciseaux, 1 paire de petits ciseaux émoussés courbes, 1 rat coupe d'os , 1 pince hémostatique droite, 5-0 fils de nylon, 1 tubes coniques avec 70% d'éthanol, 1 tube conique avec de l'éthanol à 95%, 1 tube conique avec de l'iode, 1 tube conique avec du peroxyde d'hydrogène, paquet de cotons-tiges stériles, 1 bouteille de super colle, 1 tube de pommade antibiotique, 1 tube de l'œilun lubrifiant, et une rasoir électrique.
- Placez les pointes des deux paires de ciseaux, pinces, et hémostatique courbe dans le stérilisateur à billes pendant 15 secondes. Retirer et placer dans l'éthanol à 70%. Lorsque vous effectuez plus d'une intervention chirurgicale, re-stériliser les pointes des instruments entre les animaux.
- Tourner la isoflurane à 4% et de O 2 à 0,4 l / min et le débit de gaz directement vers la chambre. Nous avons notre système oxygène / isoflurane étalonné au moins une fois par an pour s'assurer que nous fournissons la quantité appropriée de l'anesthésie. Placez la souris dans la chambre et d'attendre jusqu'à ce que la respiration est considérablement ralenti. Retirez la souris et effectuer un pincement de l'orteil pour assurer la souris est complètement inconscient.
- Raser les poils de la partie supérieure de l'épaule jusqu'à entre les yeux. Si la souris commence à se réveiller, placez la souris de nouveau dans la chambre jusqu'à ce que la souris est complètement inconscient de nouveau, confirmant avec un pincement de l'orteil. Placez la souris anesthésiée sur le stereotax et pousser le cône de nez sur le nez.Soyez doux comme les dents et les os sont fragiles.
- Diriger le flux de gaz vers le stereotax pour maintenir la souris anesthésiées. Il est important de vérifier de temps en temps pour s'assurer que la souris est complètement inconscient avec un pincement de l'orteil tout au long de l'opération. Fixer la tête avec les barres d'oreilles. Nous préférons nivellement barres d'oreilles, mais de cibler le ventricule latéral, un crâne parfaitement de niveau n'est pas nécessaire en raison de la grande taille du ventricule.
- Tournez le niveau isoflurane en baisse à 2,0% pour l'entretien. Dab pommade sur chaque œil. Comme on le voit dans la vidéo, mettre un champ stérile sur la souris de sorte que seule la base du cou et la tête sont exposés. Puis désinfectez la zone chirurgicale en essuyant le sommet de la tête et du cou dans un mouvement circulaire en partant du centre de la zone rasée et vers l'extérieur premières avec un coton-tige trempé dans de l'éthanol à 95%, suivie par un coton-tige trempé dans de l'iode en mouvement.
- Nous vous recommandons d'utiliser un système de sonde rectale de retour à température contrôlée de chauffage qui assurela température de la souris reste à un niveau stable 37 ° C. Si la température de la souris diminue au cours de la chirurgie, le rétablissement post-opératoire peut prendre plus de temps et l'hypothermie résulte peut conduire à l'activité de la protéine aberrante, y compris hyperphosphorylation de la protéine Tau associée aux microtubules 15. Après la mise en place du système de chauffage, vous êtes maintenant prêt à commencer l'opération.
3. Implantation de pompe osmotique Alzet
- Avant de commencer l'opération, mettre sur une nouvelle paire de gants stériles. Ensuite, l'aide de pinces et d'une petite paire de ciseaux, faire une incision dans la peau de la base du cou au-dessus du crâne de l'animal à un maximum entre les yeux
- Prenez les ciseaux émoussés avec la courbe vers le haut et glisser sous la peau à la base du dos du cou vers le membre postérieur gauche. Il devrait y avoir aucune résistance. Si c'est le cas, enlever les ciseaux et essayez à nouveau. Cela constitue la poche sous-cutanée de la pompe osmotique.
- Wipe le crâne propre avec des cotons-tiges stériles, suivie d'un coton-tige trempé dans du peroxyde d'hydrogène pour améliorer bregma.
- Essuyer les 50 ml tubes coniques qui contiennent des pompes pour maintenir la stérilité de la pompe. Prendre soin d'une pompe du tube conique en utilisant la pince hémostatique courbe, en prenant soin supplémentaire que la pompe ne touche pas les parois du tube conique. Maintenir la base de la pompe avec une pince et enfoncez le modulateur de débit dans le reste de la voie avec la pince hémostatique courbe.
- Maintenez la pompe où le modulateur et tubes flux rencontrer la pince hémostatique courbe. Introduire la pompe sous la peau à la base du cou et de le repousser vers le membre postérieur gauche aussi loin qu'il peut aller sans résistance. Soyez prudent de ne pas laisser toucher quoi que ce soit du cathéter.
- Avec la pince hémostatique courbe, prenez la canule à la gorge, où le sommet se réunit le piédestal. Déplacez le conducteur canule en place et fixez en place.
- Placez une seule goutte de super glue sur la base de la canule. Push en haut de la canule dans le pilote et la position de sorte que le tube est pointé vers l'arrière.
- Touchez l'extrémité du cathéter à bregma et zéro les coordonnées sur l'écran numérique. Soulever et déplacer le cathéter de 1,1 mm latéralement vers la droite et de 0,5 mm en arrière (figure 2B). Maintenez la peau de la route avec la pince hémostatique courbe.
- Pousser la sonde métallique mince à travers le crâne jusqu'à ce que le fond de la canule en matière plastique est bien pressé contre le sommet du crâne. Le cathéter de métal peut être conduit directement à travers le crâne chez la souris en raison du crâne mince relative. Si vous utilisez des rats, percer un trou dans le crâne avant d'abaisser le cathéter.
- Retirez toute la peau qui a de la colle sur l'éloigner du crâne. Avec le pilote canule tenant la canule / cathéter en place, attendre 1-2 minutes pour que la colle sécher complètement.
- Lors de la pratique, afin d'évaluer la pose du cathéter, injecter ul 20-40 de 2,5% Dye FastGreen travers le tube (figure 2C). Attendez 2-3 min, perfuse la souris avec du PBS 1X 0,03% héparine, et enlever le cerveau. Couper coronaire au niveau du site de cathéter. Si le cathéter a été placé dans le ventricule, le colorant sera perfusée dans le système ventriculaire de la souris (figure 2D).
- Maintenir le cathéter en place avec la pince hémostatique courbe tout en augmentant le conducteur. Relâchez doucement la pince hémostatique pour s'assurer que la canule est correctement fixé sur le crâne.
- Avec un coton-tige, appuyez sur le haut de la canule. Monter les tondeuses osseuse de rat dans le bosquet entre le sommet et la base de la canule. Coupez le haut de la canule tout en appuyant avec le coton-tige. Essayez de garder le niveau de coupe afin de ne pas détacher la canule du crâne. Si la canule ne se décolle, rapidement re-colle et appliquer une pression avec un coton-tige pour 2 min de plus.
- Utilisation du fil de suture 5-0, hémostatique régulière, et forceps, suture le long de l'ouverture complète, en accordant une attention particulière à droite sur la canule. Nous utilisons un Running horizontal suture matelas (voir figure 5) en raison de la plus grande incision sur le crâne.
- Appliquer une noisette de pommade antibiotique sur la tête et le cou. Dévissez les bars de l'oreille et desserrer le cône de nez. Débranchez la souris de l'stereotax et les placer sur un coussin chauffant pour la récupération. Surveiller étroitement les souris pendant toute la durée de la récupération, allant généralement de 10-30 minutes. Consultez toutes les 2-3 minutes jusqu'à ce que la souris commence à marcher autour et se toiletter.
4. Soins post-opératoires
- Surveiller les souris quotidiens après la chirurgie pour la première semaine.
- Si une souris semble être dans la douleur ou de détresse, nous recommandons de prévoir la souris avec un mg / kg par injection sous-cutanée de 5 Carprofen une fois tous les 24 heures pour 5 jours afin de soulager la douleur.
- Si il semble y avoir une infection, appliquez généreusement une pommade antibiotique à la zone jour et consulter un vétérinaire traitant pour s'assurer que la plaie se cicatrise correctement.
- REDéplacez le fil de nylon 5-0 7-10 jours après la chirurgie pour éviter l'irritation de fil de suture.
5. Modification ou suppression pompe osmotique Alzet
Après la pompe se fait infuser activement ASO, il peut être modifié ou complètement enlevé.
- Suivez la même procédure pré-opératoire que ci-dessus avec les modifications suivantes: 1) vous n'aurez pas besoin de ciseaux courbes, hémostatique courbe, coupe osseuse de rat, ni l'affichage numérique, et 2) à la place d'apprêter la tête de la souris, le rasage ou l' désinfecter le dos de la souris, à la jonction de la pompe et la tubulure.
- Faire une incision cm 1.5 à l'arrière de la souris, perpendiculaire à la jonction pompe / tuyau, l'aide de pinces et de ciseaux. Retirez soigneusement la pompe hors de l'incision sans tirer de façon significative / poussant sur le tube que cela puisse ébranler le cathéter.
- Pour retirer la pompe, couper le tuyau d'environ 0,5 cm au-dessus du modulateur de débit et de toucher la colle au tube to joint la fermer. Attendez 1-2 min pour que la colle sèche. Remettre le tube dans l'incision et suture fermée. Dab onguent antibiotique sur la peau suturée et le lieu de la souris sur un tapis de récupération chauffée.
- Pour changer la pompe, sont fraîchement préparés pompes prête aussi d'un plat de 10 cm remplie par de l'éthanol à 95%. Les cathéters sont pas nécessaires avec les nouvelles pompes.
- Prenez une nouvelle pompe avec la pince. Trempez vos doigts dans de l'éthanol, s'emparer de la pompe, et jeter le flux modulateur. Puis, lentement et avec précaution retirer l'ancienne pompe à partir du modulateur de débit fixé à la tubulure et de la canule. Dès qu'il est éteint, faites glisser lentement la nouvelle pompe, veiller à ce que le modulateur de débit ne touche jamais à l'extérieur de la souris.
- Remettez la nouvelle pompe à travers l'incision de nouveau dans le paquet sous-cutanée et suture la peau. Dab onguent antibiotique sur la plaie et le lieu souris sur le bloc de récupération.
- Tout comme avec l'implantation de la pompe, contrôler les souris tous les jours après l'opération pour vérifier pain / inconfort et infections. Traiter avec Carprofen et des antibiotiques lorsque cela est jugé nécessaire.
ICV BOLUS
6. Procédure de pré-chirurgicale
- Suivez la même procédure de pré-chirurgie de l'article 2 ci-dessus avec les modifications suivantes: 1) vous n'aurez pas besoin de ciseaux courbes, hémostatique courbe ou des couteaux en os de rat; 2) Nettoyez à 10 ul seringue Hamilton et l'aiguille avec de l'eau stérilisée et charge avec ASO et 3) fixer la seringue et l'aiguille de l'appareil de stéréotaxie où se trouvait le conducteur canule.
Sept. Injection d'un bolus d'ASO
- En utilisant des pinces et une petite paire de ciseaux, faire une incision de la base du cou jusqu'à entre les yeux.
- Essuyez le crâne propre avec des cotons-tiges stériles, suivie d'un coton-tige trempé dans du peroxyde d'hydrogène pour améliorer bregma.
- Déplacez la seringue / aiguille en place et le fixer. Assurez-vous que la partie biseautée de l'aiguille face postérieure. Baissezl'aiguille jusqu'à ce qu'elle touche bregma. Zéro toutes les coordonnées. Déplacer l'aiguille latéralement vers la droite 1,0 mm et 0,3 mm antérieur (figure 3A).
- Conduisez lentement l'aiguille dans le crâne jusqu'à ce que le trou de l'aiguille est aligné sur le haut du crâne. Encore une fois, cela peut être fait en raison de la minceur du crâne de la souris. Zéro la coordonnée z et abaisser l'aiguille à -3,0 mm à une vitesse de 1 mm / s (figure 3B). Attendez 2-3 min pour le cerveau pour sceller autour de l'aiguille.
- Livrer le plein 10 pi de ASO à un taux de 1 pl par seconde. Attendez 2-3 min. Nous utilisons un ul débit de perfusion 1 pour OLS dans le ventricule, mais ce taux peut varier entre différents médicaments. Lors de la pratique, vérifier le bon positionnement de l'aiguille en livrant 10-20 ul de 2,5% Dye FastGreen. Perfuser la souris avec du PBS 1X 0,03% héparine peu après perfusion de colorant et de faire des coupes coronales du cerveau afin de vérifier que le colorant se trouve dans le système ventriculaire (figure 3C).
- Maintenir un coton-tige sur le crâne à la base de l'aiguille. Relever l'aiguille à une vitesse de 1 mm par seconde. Dès que l'aiguille est en dehors de la boîte crânienne, rouler le coton-tige sur le trou de l'aiguille et maintenir pendant 1 minute afin d'éviter toute fuite de ASO.
- Suturer la peau fermé, appliquer un onguent antibiotique, et le lieu souris sur le bloc de récupération chauffée. Selon concentration ASO, il peut prendre 20 min pour quelques heures pour se remettre complètement.
- Tout comme avec l'implantation de la pompe, contrôler les souris tous les jours après l'opération pour vérifier la douleur / gêne et les infections. Traiter avec Carprofen et des antibiotiques lorsque cela est jugé nécessaire.
Résultats
Après la perfusion de la pompe ou un temps désigné après l'injection ICV bolus (nous utilisons couramment quatre semaines), il est important de tester l'efficacité des OLS. Nous recommandons de prendre différentes régions du cerveau et la moelle épinière pour mesurer les niveaux / isoformes du gène cible, tant au niveau de l'ARNm par PCR quantitative en temps réel ainsi que le niveau de protéines en utilisant soit le Western Blot ou ELISA (Figure 4 pour un exemple publié ). Cela aidera à déterminer ASO efficacité dans les différentes régions du système nerveux central. Si la demi-vie de la protéine ciblée est longue, nous vous conseillons attendre plus longtemps après ASO perfusion afin d'évaluer knockdown protéines maximum ou épissage.
Il est également important de tester la distribution oligo. infusions de pompes résultent de la distribution à travers les deux hémisphères ipsilatéraux et controlatéral, mais une concentration plus élevée ASO est souvent vu dans des zones plus proches du système ventriculaire 16. ICV bolus injections donner un plus équipemrm répartition des oligo travers le CNS 16, même si les effets peuvent ne pas durer aussi longtemps. Nous demandons au lecteur de Southwell et al. Pour voir une comparaison directe de la pompe par rapport à la distribution bolus oligo 16.
Nous vous recommandons également de tester des doses multiples ainsi que la durée d'action des OLS puisque chaque ASO se comporte un peu différemment in vivo. OLS ont généralement une assez longue durée d'action, avec knockdown cible ou l'épissage de plusieurs mois après la livraison ASO. En outre, certains OSS fonctionnent mieux que d'autres et certains gènes cibles seront plus faciles à effet de choc que d'autres. Pour cette raison, lorsque le dépistage Asos pour déterminer le candidat de plomb, nous recommandons de tester au moins 3-5 ASO in vivo avec un n = 4-6 souris adultes par ASO en tant que premier passage.
Si vous utilisez un autre médicament que OLS, il sera également important pour piloter la concentration idéale du médicament, la durée de la drogue de l'action, et SNC droguela distribution de ce composé spécifique.
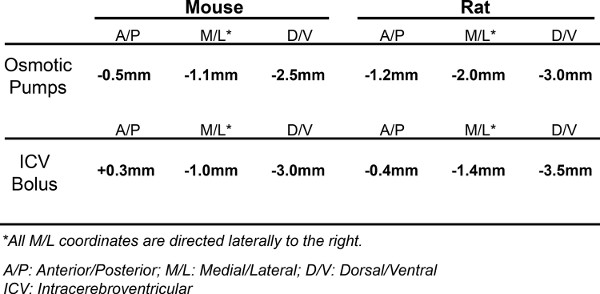
Tableau 1. Chirurgie des coordonnées. Coordonnées utilisées pour frapper le ventricule latéral droit chez les souris et les rats lors de l'implantation des pompes osmotiques ainsi que l'exécution d'une intracérébroventriculaire (ICV) bolus. Les deux coordonnées, des pompes et des bolus ICV, cibler le ventricule latéral droit. Nous utilisons deux ensembles différents parce que c'est ce dont nous avons le plus d'expérience et de savoir à fournir une excellente répartition de ASO.

Figure 1. Configuration stéréotaxique. (A) L'équipement stéréotaxique nécessaire pour la pompe Alzet et les chirurgies d'injection en bolus. I) Glass Bead Stériliserr. ii) lecture numérique. iii) de base stéréotaxique avec des bras mobiles. iv) Température de plaquettes de chauffage contrôlé. v) L'isoflurane / système d'oxygène. vi) Chambre isoflurane. (B) Gros plan sur le cône de nez et barres d'oreilles. (C) Deux fixations nécessaires. Gauche: Seringue / porte-aiguille pour injections en bolus ICV. Droite: Driver canule pour l'implantation de la pompe osmotique.
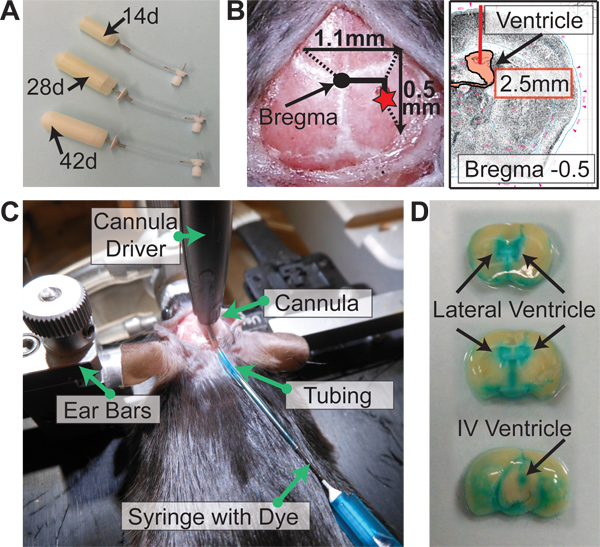
Figure 2. Alzet Implantation de pompe osmotique. (A) Alzet options de pompe osmotique pour les souris. . 14 pompes par jour (0,25 pi / h), 28 pompes par jour (0,25 pi / h), 42 pompes par jour (0,15 pi / h) (b) les coordonnées pour l'implantation de la pompe du bregma: -0.5 mm postérieur, -1.1 mm latéral ( droite), et -2,5 mm ventrale (longueur de cathéter). (C) Après avoir conduit le cathéter à travers lecrâne et le collage de la canule, le colorant est balayé à travers le cathéter pour évaluer un placement correct de la sonde dans le ventricule latéral. (D) cerveau perfusé immédiatement après teinture administré comme dans (C). Si cathéter est placé correctement dans le ventricule, le colorant sera distribuée dans tout le système ventriculaire de la souris.

Figure 3. Bolus intracérébro. (A) les coordonnées pour injection bolus de bregma: +0,3 mm antérieure, -1.0 mm latéral (à droite), et -3,0 mm ventrale (B) Après avoir conduit l'aiguille dans le crâne -3.0 mm ventral, colorant est poussé à travers la seringue. à évaluer un placement correct de l'aiguille à la fin du ventricule. (C) cerveau perfusé peu après teinture administré comme dans (B). Si l'aiguille est placée avec succès dans le ventricule, l'colorant sera distribuée dans tout le système ventriculaire de la souris.
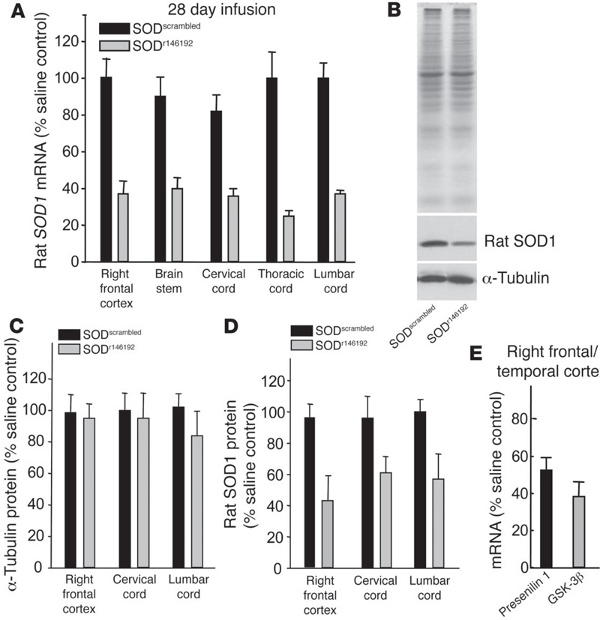
Figure 4. oligonucléotides antisens réduire SOD1 chez le rat in vivo (figure prises directement à partir de Smith et al. 7). (AD) antisens SOD1 oligonucléotides SOD r146192 ou SOD brouillés ont été perfusés pendant 28 jours dans le ventricule latéral droit de rats normaux à 100 ug / jour. (A) endogènes SOD1 les niveaux d'ARNm de cerveau et la moelle épinière, telle que mesurée par qRT-PCR. ( B) SOD1 et A-tubuline taux de protéines suite ASO perfusion. (C et D) Les teneurs en protéines pour la tubuline et SOD1 quantifiés pour les différentes régions du cerveau après la perfusion. (E) OLS contre la préséniline 1 ou GSK-3 et beta, Ont été perfusé pendant 2 semaines dans le ventricule latéral droit de souris non transgéniques et les niveaux d'ARNm évaluées dans le cortex frontal droit / temporel. Reproduit avec la permission de l'American Society for Clinical Investigation. Cliquez ici pour agrandir la figure .
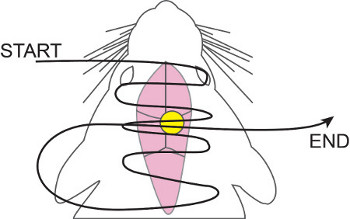
Figure 5. Suture de roulement horizontale matelas. 5-0 nylon fil de suture est tissé dans et hors de la peau, à partir antérieure et postérieure de travail, en se concentrant plus sur la canule. Une fois après avoir atteint le point le plus postérieur, le fil de suture est ensuite remonté et enfilée sur la canule une fois de plus. Ceci assure la fermeture de la plaie et évite correcte de la canule / tube de travail à travers la peau.
Discussion
La capacité à délivrer des médicaments au niveau mondial dans le SNC, comme indiqué dans la vidéo est une technique extrêmement puissante qui est facile à la fois apprendre et à utiliser. Avec la pratique, une seule implantation de la pompe ou un ICV bolus peut être complété en 10 min, ce qui permet de grandes cohortes de souris d'être traités en même temps. Ceci est particulièrement utile pour les études avec un affichage de comportement, comme un plus grand nombre de comportement de la souris sont essentiels pour aider à voir des différences significatives.
Basé sur nos expériences livrant OLS via des pompes et des injections en bolus, nous avons observé quelques avantages et inconvénients de chaque méthode. Il convient de noter que ce sont les opinions dans notre laboratoire et peuvent ne pas être vrai pour tous les modèles de souris et de rat.
Nous trouvons un avantage de l'utilisation des pompes est leur capacité à fournir une grande quantité d'ASO depuis l'ASO est répartie sur une période beaucoup plus longue. Cela équivaut généralement à knockdown plus soutenue ou après épissage actifASO perfusion, si ce n'est pas toujours le cas. Les pompes permettent aussi d'un calendrier précis de livraison ASO (14 jours, 28 jours, ou 42 jours) et les pompes peuvent être changés une fois pour permettre une perfusion ASO encore plus actif. Cependant, nous avons remarqué que le changement de pompes plus d'une fois augmente la variabilité due à la formation de poches fibreux autour de la pompe qui empêchent la pompe de bien absorber le fluide. Un inconvénient des pompes est que certaines souris ne tolèrent pas la pompe ainsi que d'autres. Si la lignée transgénique vous travaillez avec est plus fragile, une pompe peut être trop lourd. Les pompes doivent également être supprimés après la dernière perfusion, en soumettant des souris à une autre chirurgie et l'anesthésie ajoutée. Si faire le travail de comportement, il est particulièrement important d'enlever la pompe et permettre au moins 1-2 semaines de récupération, car la présence de la pompe aura une incidence sur certains comportements chez les souris.
Avec ICV bolus injections, un avantage est le coût. Il s'agit d'uneinvestissement initial pour acheter les seringues et les aiguilles, mais au fil du temps, les injections en bolus sont plus rentables car il n'y a pas de pompes / tubes / cathéters à acheter. Dans l'ensemble, il ya moins de place-garde avec les injections en bolus ICV en raison du manque de canules et des pompes. Nous constatons également que bolus ICV peuvent être utilisés pour délivrer OLS à des souris jeunes fragiles et / ou plus. Un inconvénient de l'ICV bolus, c'est que c'est une seule injection. Pas autant globale ASO peut être livré par cette voie, et si la durée d'action de l'ASO utilisé est courte, les effets de knockdown / d'épissage sera également de courte durée.
Les deux pompes osmotiques ainsi que les bolus ICV ont la capacité de fournir des OLS qui peuvent protéines knockdown ou d'en altérer l'épissage des gènes dans tout le système nerveux central des rongeurs, une technique qui a de larges applications dans de multiples domaines liés aux neurosciences. Nous vous suggérons pilotons les deux méthodes de livraison si vous n'êtes pas sûr de la voie d'administration est le mieux adapté pour votre sétude pécifique.
Déclarations de divulgation
Les auteurs reçoivent leurs oligonucléotides antisens d'Isis Pharmaceuticals.
Remerciements
Nous tenons à remercier Curt Mazer d'Isis Pharmaceuticals pour fournir des conseils relatifs à la chirurgie bolus ICV, ainsi que Isis Pharmaceuticals dans son ensemble pour fournir notre laboratoire avec ASOS. En outre, nous tenons à remercier Carey Shaner de révision de cet article. TMM et SLD sont pris en charge par des subventions du NIH P50AG005681, K08NS074194 et R01NS078398.
matériels
| Name | Company | Catalog Number | Comments |
| PREPARING ALZET OSMOTIC PUMPS | |||
| Alzet Osmotic Pump 14 days | DURECT | Model 1002 | |
| Alzet Osmotic Pump 28 days | DURECT | Model 2004 | |
| Alzet Osmotic Pump 42 days | DURECT | Model 2006 | |
| 2.5 mm Catheters | PlasticsOne | 3280PM/SPC | Custom ordered to 2.5 mm Catheter Length |
| Vinyl Catheter Tubing | DURECT | 7760 | ID: 0.027", OD: 0.045" |
| 0.9% Sodium Chloride, Irrigation, USP | Baxter | 2F7124 | NOT to be used in pumps or tubing |
| 0.9% Sodium Chloride, Injection, USP | Hospira | NDC 0409-4888-10 | |
| p60 Petri Dish (Sterilized) | TRP | 93060 | |
| Surgical Blades (Sterile) | Butler Schein | #007319 | |
| Latex Surgical Gloves (Sterile) | Micro-Touch | CatNo will depend on size of the gloves needed | |
| Sterile Towel Drape | Dynarex | 4410 | |
| .2um Syringe Filters | PALL | 4192 | |
| 1 ml Syringe (Sterile) | BD | 309625 | |
| 50 ml Conical Tubes | |||
| 100% Ethanol | |||
| PUMP & BOLUS SURGERY PROTOCOLS | |||
| Curved Forceps | Fine Science Tools | 11001-12 | |
| Curved Hemostat | Fine Science Tools | 13009-12 | |
| Fine Sharp Scissors | Fine Science Tools | 14060-09 | |
| Curved Blunt Scissors | Fine Science Tools | 14029-10 | |
| Bone Cutter | Fine Science Tools | 16104-14 | |
| Straight Hemostat | Fine Science Tools | 12002-12 | |
| Syringe | Hamilton | 7653-01 | 10 μl gas-tight with removable needles |
| Needles | Hamilton | 7758-04 | 26 gauge, Point Style: 2 |
| 5-0 Nylon Suture Thread | Covidient | SN-871 | |
| Alcohol Pads | Select | #521 | |
| Cotton Swabs (sterile) | Puritan | REF 806-WC | |
| Super Glue | Loctite | Longneck Bottles | |
| CAUTION: FastGreen Dye | Sigma | F7252-5G | Wear Eyeshields and Gloves when handling this product |
| Antibiotic Cream | |||
| Eye Ointment | |||
| Electric Shaver | |||
| 70% Ethanol | |||
| 10% Provadone Iodine | |||
| 3% Hydogen Peroxide | |||
| Warming Pad | |||
| Bead Sterilizer | SouthPointe Surgical | GRM5-1450 | |
| Small Animal Stereotaxic | Kopf | Model 940 | |
| Nose Cone | Kopf | Model 923-B | |
| Ear Bars | Kopf | Model 921 | This model is optional |
| Cannula Driver | Kopf | Model 1966 | |
| Syringe Holder | Kopf | Model 1972 | |
| Temperature Control System | Kopf | Model TCAT-2LV | Optional |
| Oxygen/Isoflurane System | |||
Références
- Crooke, S. T., Bennett, C. F. Progress in antisense oligonucleotide therapeutics. Annual Review of Pharmacology and Toxicology. 36, 107-129 (1996).
- Sazani, P., Kole, R. Therapeutic potential of antisense oligonucleotides as modulators of alternative splicing. The Journal of Clinical Investigation. 112 (4), 481-486 (2003).
- Taylor, J. P., Hardy, J., Fischbeck, K. H. Toxic Proteins in Neurodegenerative Disease. Science. 296 (5575), 1991-1995 (2002).
- Ross, C. A., Poirier, M. A. Protein aggregation and neurodegenerative disease. Nature Medicine. 10, S10-S17 (2004).
- Miller, T. M., Smith, R. A., Kordasiewicz, H., Kaspar, B. K. Gene-Targeted Therapies for the Central Nervous System. Archives of Neurology. 65 (4), 447-451 (2008).
- Vickers, T. A., Koo, S., Bennett, C. F., Crooke, S. T., Dean, N. M., Baker, B. F. Efficient Reduction of Target RNAs by Small Interfering RNA and RNase H-dependent Antisense Agents. The Journal of Biological Chemistry. 278, 7108-7118 (1074).
- Smith, R. A., Miller, T. M., et al. Antisense Oligonucleotide therapy for neurodegenerative disease. The Journal of Clinical Investigation. 116 (8), 2290-2296 (2006).
- Rosen, D. R., Siddique, T., et al. Mutations in Cu/Zn superoxide disumutase gene are associated with familial amyotrophic lateral sclerosis. Nature. 362, 6415-62 (1993).
- Haidet-Phillips, A. M., Hester, M. E., et al. Astrocytes from familial and sporadic ALS patients are toxic to motor neurons. Nature Biotechnology. 29, 824-828 (2011).
- Furukawa, Y. Pathological roles of wild-type Cu,Zn-superoxide dismutase in Amyotrophic Lateral Sclerosis. Neurology Research International. 2012, 1-6 (2012).
- Hua, Y., Sahashi, K., et al. Antisense correction of SMN2 splicing in the CNS rescues necrosis in a type III SMA mouse model. Genes and Development. 24, 1634-1644 (2010).
- Passini, M. A., Bu, J., et al. Antisense Oligonucleotide Delivered to the Mouse CNS Ameliorate Symptoms of Severe Spinal Muscular Atrophy. Science Translational Medicine. 3 (72), (2011).
- Kordasiewicz, H. B., Stanek, L. M., et al. Sustained Therapeutic Reversal of Huntington's Disease by Transient Repression of Huntingtin Synthesis. Neuron. 74 (6), 1031-1044 (2012).
- Pritchett-Corning, K. R., Mulder, G. B., Luo, Y., White, W. J. Principles of Rodent Surgery for the New Surgeon. J. Vis. Exp. (47), e2586 (2011).
- Planel, E., Richter, K. E. G., et al. Anesthesia Leads to Tau Hyperphosphorylation through Inhibition of Phosphatase Activity by Hypothermia. The Journal of Neuroscience. 27 (12), 3090-3097 (2007).
- Southwell, A. L., Skotte, N. H., Bennett, C. F., et al. Antisense oligonucleotide therapeutics for inherited neurodegenerative diseases. Trends in Molecular Medicine. , (2012).
- Kole, R., Krainer, A. R., Altman, S. RNA therapeutics: beyond RNA interference and antisense oligonucleotides. Nature Reviews Drug Discovery. 11, 125-140 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon