Method Article
Entrega intraventricular direta de medicamentos para o Sistema Nervoso Central Rodent
Neste Artigo
Resumo
Descreve-se um método para alvejar fármacos para o sistema nervoso central por qualquer implante de um cateter ou realizar uma injecção de bolus no ventrículo lateral direito de ratos. Nós nos concentramos especificamente na entrega de oligonucleotídeos antisense. Esta técnica é facilmente adaptável a outros fármacos e a ratos.
Resumo
Devido à incapacidade de atravessar a barreira hemato-encefálica, certas drogas têm de ser entregue directamente no sistema nervoso central (SNC). O nosso laboratório foca especificamente oligonucleótidos anti-sentido (ASOs), embora as técnicas apresentadas no vídeo aqui também podem ser usadas para entregar uma infinidade de outras drogas para o SNC. Oligonucleótidos anti-sentido (ASOs) têm a capacidade de knockdown alvos específicos de sequência 1, bem como índices de isoformas de transferência de genes específicos 2. Para alcançar knockdown gene generalizado ou splicing no SNC de camundongos, os ASOs podem ser entregues no cérebro usando duas rotas distintas de administração, sendo que ambos demonstramos no vídeo.
As primeiras utilizações bombas osmóticas Alzet, ligados a um cateter que é implantado cirurgicamente dentro do ventrículo lateral. Isto permite que os ASO para ser infundida continuamente para o SNC, por um período de tempo designado. A segunda envolve uma única injeção bolus de um oigh concentração de ASO no ventrículo lateral direito. Ambos os métodos utilizam o sistema do ventrículo cerebral do rato para entregar o ASO para todo o cérebro e na medula espinal, embora, dependendo das necessidades do estudo, um método pode ser preferido em detrimento do outro.
Introdução
Alguns medicamentos não são capazes de atravessar a barreira hemato-encefálica (BHE), exigir Sistema Nervoso Central directa (CNS) de entrega. Para contornar a certificação, os fármacos podem ser entregues directamente para o cérebro, utilizando os métodos descritos. Enquanto o nosso laboratório e o papel detalhado aqui em foco oligonucleótidos anti-sentido (ASOs), outras drogas, tais como pequenas moléculas, anticorpos, vectores de terapia genética, etc., Pode também ser fornecido através da mesma abordagem.
Certas proteínas desempenham um papel fundamental na patogênese de doenças neurodegenerativas. Tais proteínas muitas vezes formam espécies tóxicas e se acumulam em agregados, levando à eventual morte neuronal e doença neurológica subseqüente 3-4. Num esforço para reduzir ou mesmo parar a progressão destas doenças, uma opção terapêutica pode ser diretamente alvo e diminuir a proteína causador. No entanto, estas proteínas são frequentemente encontrados ubíqua através do CNS, o que torna difícil a e ffectively orientá-las em uma escala global.
A fim de orientar genes em todo o CNS, que administramos ASOs em rato líquido cefalorraquidiano (LCR), através do ventrículo lateral para ignorar o BBB. Este método tira vantagem específica do sistema ventricular do rato que banha todo o cérebro e na medula espinal, permitindo a distribuição generalizada dos ASO. Usamos ASO que são 18-20 mer-RNA como moléculas que se ligam directamente a sequência de mRNA-alvo e, em função das modificações químicas em ASO, quer A) recruta RNase H degrada o ARNm que conduz a knockdown ou B), deslocar um splicing alternativo , 2,16,17. Deve notar-se que múltiplas moléculas existem para derrubar uma proteína específica in vivo, incluindo shRNA. Uma vez que estas moléculas não são o foco deste artigo, vamos direcionar o leitor a rever os artigos que melhores mecanismos knockdown detalhes da ação e as vantagens / desvantagens de cada um 5-6.
jove_content "> Em trabalhos anteriores, que usaram ASO para segmentar o superóxido dismutase de proteína 1 (SOD1) num modelo de rato transgénico de esclerose lateral amiotrófica (ELA), 7 (Figura 4). Mutações em SOD1 ocorrem em aproximadamente 2% de todos os ALS 8 casos, no entanto, foi recentemente SOD1 hipótese que pode desempenhar um papel importante na forma esporádica, bem 9-10. Diminuindo os níveis totais de SOD1 no rato transgénico ALS, a sobrevivência após o início foi significativamente aumentada 7. Estes dados importantes foram os primeiros para mostrar que um tratamento de ASO no SNC pode ter um profundo impacto positivo sobre um modelo de doença neurológica. Desde então, ASO orientadas para SOD1 humanos ter entrado e concluído com êxito uma Fase I de ensaios clínicos em humanos, com efeitos colaterais mínimos (Clnicaltrails.gov NCT01041222) , conforme apresentado no 2012 64 º Annual Academy Americana de Neurologia. Planos para mover os ASOs para a frente para ensaios de Fase II estão em andamento. Enquanto segmentação SOD1 foi a primeira demonstração de utilização de ASO para o tratamento de uma doença neurológica, vários outros estudos já foram realizados olhando para diferentes doenças e suas respectivas proteínas alvo. Em 2010 e 2011, ASOs essa mudança splicing da proteína sobrevivência do neurônio motor 2 (SMN2) foram usados em modelos de camundongos transgênicos de atrofia muscular espinhal (AME) e resultou em uma melhora significativa nos fenótipos da doença 11,12. Estes ASOs splicing estão agora em fase I de ensaios clínicos em crianças com SMA (Clinicaltrails.gov NCT01494701). Adicionalmente, foi recentemente mostrado que a administração transiente de ASO dirigidas contra o gene de huntingtina foram capazes de resgatar dramaticamente o modelo de ratinho de Huntington, mesmo após os níveis de proteína huntingtina retornou à linha de base 13.Em todos estes estudos, o ASO foram entregues ao ventrículo lateral para diminuir os níveis totais do gene ou combinação de genes através de alterartodo o CNS. Ambas as bombas osmóticas e uma única injecção de bolo pode ser utilizada para entregar ASO para o CSF. Bombas para permitir uma entrega lenta, contínua, enquanto a intracerebroventricular (ICV) em bolus é um, a injecção rápida de uma só vez. Usámos estes dois métodos com sucesso, embora não tenham relatado a comparação directa entre a bomba eo bolo em uma única linha transgénica.
Usando ASOs no SNC é uma poderosa forma de diminuir os níveis de proteína total e / ou mudança de emenda de várias proteínas. Enquanto usamos ASOs exclusivamente como um tratamento para distúrbios neurológicos, reconhecemos que outras áreas também podem se beneficiar desta técnica. Contanto que a proteína de interesse é expressa no sistema nervoso central e o objectivo final é o de alcançar o SNC largas variações na expressão de genes, utilizando ASO nas técnicas demonstradas pode ser muito útil.
Protocolo
O protocolo a seguir foi aprovada pelo Animal Care Institucional e Comissões de Uso da Universidade de Washington em St. Louis e está em conformidade com os Institutos Nacionais de Saúde para o uso de animais de experimentação. Se esta é a sua primeira vez a realização de cirurgias, recomendamos olhando para o artigo Jove em cirurgias de roedores como uma introdução antes de começar a 14.
ASO pode ser entregue para o SNC do rato, tanto através de infusão de bomba osmótica e uma única injecção de bolo ICV. Devido a isso, o processo detalhado a seguir é dividida em dois segmentos. Prós e contras de cada método será abordado na seção Discussão. As coordenadas utilizadas nos protocolos são para adultos C57BL6 e B6C3 camundongos. Coordenadas correspondentes de rato pode ser encontrada na Tabela 1.
Bomba osmótica ALZET
1. Preparação de bombas osmóticas Alzet
- Estabelecer um Drap estérile e solte cuidadosamente os seguintes itens para ele, tendo o cuidado de não tocar nada diretamente, a fim de manter a esterilidade: bomba osmótica (s), o fluxo de modulador (s), 1 ml seringa estéril (s), lâmina de bisturi, e as seções de tubulação (um pedaço de tubo = 5 bombas). Para ratinhos, há três opções para as bombas de 14 dias, 28 dias, e 42 dias (Figura 2A).
- Retire a tampa e preencha estéreis de 50 ml tubos cônicos com soro fisiológico 15-20 ml. Até 6 bombas montadas podem ser adicionados por tubo cónico.
- Encher uma placa de Petri p60 com etanol 100%. Adicionar número apropriado de cateteres para o etanol. Para ratos, comprimento do cateter é de 2,5 mm.
- Filtrar cada ASO em tantos tubos Eppendorf de 1,5 ml, tal como necessário. Incluir um tubo Eppendorf estéril cheio com 0,9% de solução salina para encher o tubo com.
- Depois que tudo estiver preparado, colocar luvas estéreis. Certifique-se de não tocar em nada que não seja estéril. Mudar de luvas, se necessário.
- Para cada ASO a ser utilizada, encher uma seringa de 1 mle loadpumps, colocando a agulha no orifício superior e enchendo lentamente até que o excesso de vazamentos para fora. Continuar até que todas as bombas são cheias.
- Destampe o fluxo-moduladores e inserir as bombas. Empurrar o modulador de fluxo quase todo o caminho, deixando um intervalo de 3-5 mm.
- Usando a lâmina de bisturi, corte cada pedaço de tubo em cinco segmentos iguais. Tomar um pedaço de tubo, encher com solução salina estéril usando uma seringa de 1 ml, e inserir a parte superior do modulador de fluxo em uma das extremidades do tubo. Então, uma cânula do etanol e ligá-la para a outra extremidade do tubo. A bomba agora está totalmente montado.
- Coloque a bomba totalmente montado no tubo de 50 ml com solução salina estéril para priming. A iniciação permite que as bombas de absorver fluido para iniciar a entrega da droga, bem como de vir a temperatura adequada. Tempo priming: 14 bombas dias: 4-6 hr, 28 bombas dias: 40 h, 42 bombas dias: 60 hr. Quando terminar a montagem das bombas, tampar os tubos cônicos e coloque em um pano limpo37 ° C, banho de água até à cirurgia.
2. O processo pré-cirúrgico
- Limpe tudo para baixo com etanol 70% para esterilizar a área e estabelecer campos estéreis em cima da mesa e stereotax para criar um campo estéril. É importante estar consciente do campo estéril durante toda a cirurgia. Ligue o seguinte: Sterilizer Bead, Aquecimento Pad, Luz, Leitura Digital, e Oxigênio / System isoflurano (Figura 1).
- Os seguintes itens serão necessários se fazer uma única cirurgia ou um lote inteiro de cirurgias como rotineiramente fazer: 1 par de fórceps, uma pinça hemostática curva, uma tesoura pequena, um par de pequenas tesouras embotadas curvas, um rato cortador de osso , uma pinça hemostática reta, 5-0 suturas de nylon, uma tubos cônicos com etanol 70%, um tubo cônico com 95% de etanol, um tubo cônico com iodo, um tubo cônico com peróxido de hidrogênio, o pacote de cotonetes estéreis, uma garrafa de super- cola, pomada antibiótica um tubo, um tubo de olholubrificante, e uma máquina de barbear eléctrica.
- Coloque as pontas dos dois pares de tesouras, pinças, e hemostática curva no esterilizador talão por 15 s. Retire e coloque em etanol 70%. Ao realizar mais de uma cirurgia, re-esterilizar as pontas dos instrumentos entre animais.
- Gire o isoflurano a 4% e O 2-0,4 L / min e fluxo de gás direto para a câmara. Temos o nosso sistema de isoflurano / oxigênio calibrado pelo menos uma vez por ano para garantir que estamos entregando a quantidade adequada de anestesia. Coloque o rato na câmara e aguarde até que a respiração é significativamente mais lento. Retire o mouse e executar uma pitada dedo do pé para garantir o mouse é completamente inconsciente.
- Raspar o cabelo a partir da parte superior do ombro até entre os olhos. Se o rato começa a acordar, coloque o mouse de volta para a câmara até que o mouse é completamente inconsciente novamente, confirmando com uma pitada dedo do pé. Coloque o rato anestesiado no stereotax e empurre o cone do nariz sobre o nariz.Seja gentil como os dentes e os ossos são frágeis.
- Dirigir o fluxo de gás para o stereotax para manter o rato anestesiado. É importante verificar ocasionalmente para certificar-se de que o mouse está completamente inconsciente com uma pitada dedo do pé durante toda a cirurgia. Proteja a cabeça com as barras de ouvido. Nós preferimos nivelamento barras de ouvido, que para atingir o ventrículo lateral, um crânio perfeitamente nivelada não é necessário, devido ao grande tamanho do ventrículo.
- Vire o nível de isoflurano até 2,0% para a manutenção. Dab pomada em cada olho. Como pode ser visto no vídeo, colocar uma cortina estéril sobre o mouse de forma que apenas a base do pescoço e da cabeça estão expostos. Em seguida, desinfectar a zona cirúrgica, limpando a parte superior da cabeça e do pescoço em um movimento circular começando no centro da área raspada e movendo-se para fora em primeiro lugar com um algodão embebido em etanol a 95%, seguido por um algodão embebido em iodo.
- Recomendamos o uso de um sistema de sonda retal feedback de temperatura controlada de aquecimento que garantea temperatura do rato permanece num estável de 37 ° C. Se a temperatura do rato diminui durante a cirurgia, a recuperação pós-cirurgia pode levar mais tempo e a hipotermia resultante pode conduzir a actividade da proteína aberrante, incluindo hiperfosforilação da proteína associada a microtúbulos tau 15. Depois de configurar o sistema de aquecimento, agora você está pronto para começar a cirurgia.
3. Implantação de bomba osmótica Alzet
- Antes de iniciar a cirurgia, colocar em um novo par de luvas estéreis. Em seguida, utilizando um fórceps e uma pequena tesoura, fazer uma incisão na pele a partir da base do crânio acima do pescoço do animal para cima entre os olhos
- Aqui a tesoura embotadas com a curva virada para cima e deslizar por baixo da pele da base da parte de trás do pescoço para o membro posterior esquerdo. Não deve haver qualquer resistência. Se houver, remova a tesoura e tente novamente. Isto constitui a bolsa subcutânea para a bomba osmótica.
- Wiep o crânio limpo com cotonetes de algodão estéril, seguido de uma mecha de algodão embebida em peróxido de hidrogénio para aumentar a bregma.
- Limpar abaixo os tubos cónicos de 50 ml que contêm bombas para manter a esterilidade das bombas. Recolher cuidadosamente uma bomba a partir do tubo cónico usando a hemostática curvo, tendo o cuidado extra que a bomba não tocar as paredes do tubo cónico. Segurar a base da bomba com uma pinça e empurrar o modulador de fluxo do que no resto do caminho com a hemostática curvo.
- Segurar a bomba quando o modulador de fluxo e tubo reunir com a hemostática curvo. Insira a bomba sob a pele na base do pescoço e empurrá-lo de volta para o membro posterior esquerdo, tanto quanto ele vai sem resistência. Tenha cuidado para não deixar o cateter toque em nada.
- Com a pinça hemostática curva, pegue a cânula no sulco onde a parte superior se encontra com o pedestal. Mova o motorista cânula para a posição e assegurar no lugar.
- Colocar uma única gota de supercola sobre a base da cânula. Push o topo da cânula para o condutor e a posição de modo a que o tubo está apontado para trás.
- Toque a ponta do cateter para bregma e zerar as coordenadas no visor digital. Elevar o cateter de 1,1 milímetros e mover lateralmente para a direita e 0,5 mm posterior (Figura 2B). Segure a pele para fora do caminho com a pinça hemostática curva.
- Dirigir o cateter de metal fino através do crânio até que a base da cânula de plástico está firmemente pressionado contra o topo do crânio. O cateter de metal pode ser conduzido directamente através do crânio no ratinho, devido à relativamente fina do crânio. Se utilizando ratos, perfurar um orifício no crânio antes de baixar o cateter.
- Puxar qualquer pele que tem cola nele longe do crânio. Com o driver cânula segurando a cânula / cateter no lugar, espere 1-2 minutos para a cola secar totalmente.
- Quando se pratica, para avaliar a colocação do cateter, injecta-se 20-40 mL de 2,5% Corante FastGreen através do tubo (Figura 2C). Espere 2-3 min, perfuse o rato com 1X PBS 0,03% de heparina, e remover o cérebro. Corte coronal no local do cateter. Se o catéter foi colocado no ventrículo, o corante serão perfundidos por todo o sistema ventricular do rato (Figura 2D).
- Segure o cateter no lugar com a pinça hemostática curva, aumentando simultaneamente o condutor. Lentamente, liberte a hemostática para assegurar que a cânula é adequadamente fixada ao crânio.
- Com uma mecha de algodão, pressionar para baixo sobre a parte superior da cula. Coloque os clippers óssea de ratos no bosque entre o topo ea base da cânula. Clipe fora do topo da cânula enquanto ainda pressionando para baixo com o chumaço de algodão. Tentar e manter o nível de cortadores de modo a não retirar a cânula do crânio. Se a cânula não desgrudar, rapidamente re-cola e aplique pressão com um cotonete para um adicional de 2 min.
- Usando o fio de sutura 5-0, pinça hemostática regular, e fórceps, sutura ao longo da abertura total, com especial atenção para a direita sobre a cânula. Nós usamos a correrg sutura colchão horizontal (ver Figura 5), devido à maior incisão sobre o crânio.
- Aplique um pouco de pomada antibiótica na cabeça e no pescoço. Desapertar bares da orelha e soltar o cone do nariz. Remover o rato da stereotax e coloque sobre uma almofada de aquecimento para a recuperação. Monitorizar os ratinhos perto durante o período de recuperação, tipicamente variando de 10-30 minutos. Verifique a cada 2-3 minutos, até que o mouse começa a andar em volta e prepara-se.
4. Cuidados pós-operatórios
- Monitorizar os ratinhos diariamente após a cirurgia para a primeira semana.
- Se um rato parece estar com dor ou angústia, recomendamos fornecendo o mouse com um mg / kg de injeção subcutânea de 5 Carprofen uma vez a cada 24 horas para até 5 dias, a fim de aliviar a dor.
- Se parece existir uma infecção, generosamente aplicar pomada antibiótica para a área diariamente e consultar um médico veterinário responsável para assegurar que a ferida cicatriza adequadamente.
- Remove o náilon 5-0 7-10 dias após a cirurgia para evitar a irritação do fio de sutura.
5. Alterando ou removendo bomba osmótica Alzet
Após a bomba é feita a infusão activamente ASO, pode ser alterado ou completamente removida.
- Siga o mesmo procedimento de pré-cirurgia, como acima, com as seguintes alterações: 1) Você não vai precisar de uma tesoura curva, pinça hemostática curva, cortadores óssea de ratos, nem o mostrador digital, e 2) em vez de preparar a cabeça do rato, fazer a barba e desinfectar a parte traseira do rato, na junção da bomba e da tubagem.
- Adicione uma incisão de 1,5 cm na parte traseira do rato, perpendicular à bomba / tubo de junção, utilizando fórceps e tesouras. Puxar cuidadosamente a bomba para fora da incisão sem puxar significativamente / empurrando o tubo, uma vez que pode unir o cateter.
- Para retirar a bomba, cortar o tubo de cerca de 0,5 cm acima do modulador de fluxo e tocar o supercola para a tubagem to selo fechada. Espera 1-2 min para a cola secar. Colocar o tubo em volta da incisão e sutura fechada. Dab pomada antibiótica para a pele suturada e coloque o mouse sobre uma almofada de recuperação aquecida.
- Para mudar a bomba, ter acabado de fazer bombas imediata junto com um prato de 10 cm cheia com 95% de etanol. Cateteres não são necessários com as novas bombas.
- Pegue uma nova bomba com a pinça. Mergulhe os dedos no etanol, tomar posse da bomba, e descartar o modulador de fluxo. Então, com cuidado e lentamente retirar a antiga bomba do modulador de fluxo ligado ao tubo e cânula. Assim que estiver desligado, deslize lentamente a nova bomba, assegurando que o modulador de fluxo nunca toca o exterior do rato.
- Insira novamente a nova bomba através da incisão em volta do pacote subcutânea e sutura da pele. Dab pomada antibiótica na ferida e lugar do mouse no bloco de recuperação.
- Assim como com a implantação da bomba, monitorar os ratos diariamente após a cirurgia para verificar se há pain / desconforto e infecções. Tratar com carprofeno e antibióticos se for considerado necessário.
ICV BOLUS
6. O processo pré-cirúrgico
- Siga o mesmo procedimento de pré-cirurgia, na Seção 2 acima com as seguintes alterações: 1) Você não vai precisar de tesoura curva, pinça hemostática curva, ou cortadores óssea de ratos; 2) Limpe a seringa Hamilton de 10 mL e agulha com água esterilizada e de carga com ASO, e 3) se ligam a seringa e a agulha para o aparelho estereotáxico onde o condutor cânula foi localizado.
7. Bolus de ASO
- Usando fórceps e uma pequena tesoura, fazer uma incisão a partir da base do pescoço até entre os olhos.
- Limpe o crânio limpo com cotonetes estéril, seguido de um cotonete embebido em água oxigenada para aumentar bregma.
- Mova a seringa / agulha no lugar e prenda. Certifique-se de que a parte do bisel da agulha enfrenta posterior. Abaixea agulha até tocar bregma. Zero todas as coordenadas. Mover a agulha lateralmente para a direita 1,0 milímetros e 0,3 milímetros anterior (Figura 3A).
- Lentamente conduzir a agulha através do crânio apenas até que o furo da agulha é nivelado com o topo do crânio. Novamente, isto pode ser feito devido à finura do crânio rato. Zero a coordenada z e abaixar a agulha a -3,0 mm, a uma taxa de 1 mm / seg (Figura 3B). Espera 2-3 min para o cérebro para selar em torno da agulha.
- Entregar o total de 10 ul de ASO a uma taxa de 1 ml por segundo. Espere 2-3 min. Nós usamos uma taxa de infusão de 1 ml para ASOs para o ventrículo, embora esta taxa pode variar entre diferentes drogas. Ao praticar, para verificar a colocação correta da agulha através da apresentação de 10-20 mL de 2,5% FastGreen Dye. Perfundir o rato com 1X PBS 0,03% de heparina, logo após a infusão de corante e fazer cortes coronais do cérebro para verificar se a tinta se encontra no sistema ventricular (Figura 3C).
- Mantenha um cotonete contra o crânio na base da agulha. Elevar a agulha a uma velocidade de 1 mm por segundo. Assim que a agulha está fora do crânio, role o cotonete em cima do buraco da agulha e segure por 1 min para evitar qualquer ASO vaze.
- Suturar a pele fechada, aplique pomada antibiótica, e lugar do mouse sobre aquecida pad recuperação. Dependendo da concentração de ASO, pode demorar 20 min a algumas horas para se recuperar totalmente.
- Assim como com a implantação da bomba, monitorar os ratos diariamente após a cirurgia para verificar se há dor / desconforto e infecções. Tratar com carprofeno e antibióticos se for considerado necessário.
Resultados
Após a infusão de bomba ou de um tempo designado após a injecção ICV de bolus (rotineiramente utilizar quatro semanas), é importante para testar a eficácia dos ASO. Recomendamos tomar várias regiões do cérebro e da medula espinal para medir os níveis / isoformas do gene alvo, quer ao nível de ARNm utilizando PCR quantitativo em tempo real, bem como o nível de proteína usando ELISA ou Western Blot (Figura 4 para um exemplo publicada ). Isto irá ajudar a determinar a eficácia de ASO ao longo das diferentes regiões do SNC. Se a meia-vida da proteína alvo é longa, aconselha esperar mais tempo após a infusão de ASO, de modo a avaliar o knockdown máximo proteína ou splicing.
Também é importante testar distribuição oligo. Bomba de infusão resultar na distribuição através de ambos os hemisférios ipsilateral e contralateral, apesar de uma concentração de ASO superior é muitas vezes observada em regiões mais próximas no sistema ventricular 16. ICV bolus injeções de produzir um mais unifodistribuição rm de oligo através do SNC 16, embora os efeitos podem não durar tanto tempo. Nós direcionar o leitor para Southwell et al. Ver uma comparação direta de bomba contra bolus distribuição oligo 16.
Recomenda-se também testes de doses múltiplas, assim como a duração da acção de cada vez que os ASO ASO irá comportar-se de forma ligeiramente diferente in vivo. ASOs normalmente têm uma duração relativamente longa de ação, com knockdown alvo ou splicing durando vários meses pós-parto ASO. Além disso, alguns ASO irá funcionar melhor do que outros, e alguns genes alvos, será mais fácil para o knockdown do que outros. Devido a isso, o rastreio asos para determinar o candidato chumbo, recomendamos testar pelo menos 3-5 ASO in vivo com um n = 4-6 ratinhos adultos por ASO, numa primeira passagem.
Se você estiver usando uma droga diferente de ASOs, também será importante para pilotar a concentração ideal de drogas, duração de drogas de ação e CNS drogadistribuição para esse composto específico.
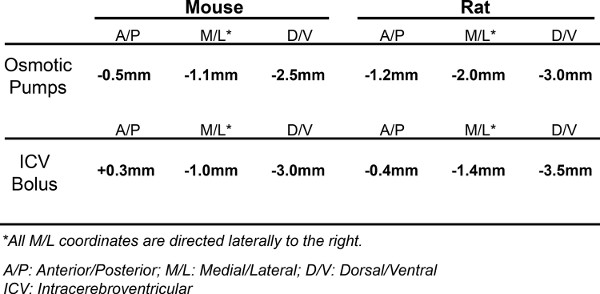
Tabela 1. Cirurgia Coordenadas. As coordenadas usado para bater o ventrículo lateral direita em ambos os camundongos e ratos quando implantando bombas osmóticas, bem como realizar uma intracerebroventricular (ICV) bolus. Ambas as coordenadas, para bombas e ICV bolus, o alvo do ventrículo lateral direito. Usamos dois conjuntos diferentes, porque estes são o que temos mais experiência e saber proporcionam excelente distribuição de ASO.

Figura 1. Setup estereotáxica. (A) O equipamento estereotáxico necessário para a bomba Alzet e cirurgias bolus. I) Glass Bead Esterilizarr. ii) Leitura Digital. iii) Base estereotáxica com braços móveis. iv) Temperatura controlada Aquecimento Pad. v) Isoflurane / System Oxygen. vi) Câmara isoflurano. (B) Feche acima do cone do nariz e barras de ouvido. (C) Dois anexos necessários. Esquerda: Seringa / porta-agulha para ICV injeções em bolus. Direita: Driver cânula para implantação da bomba osmótica.
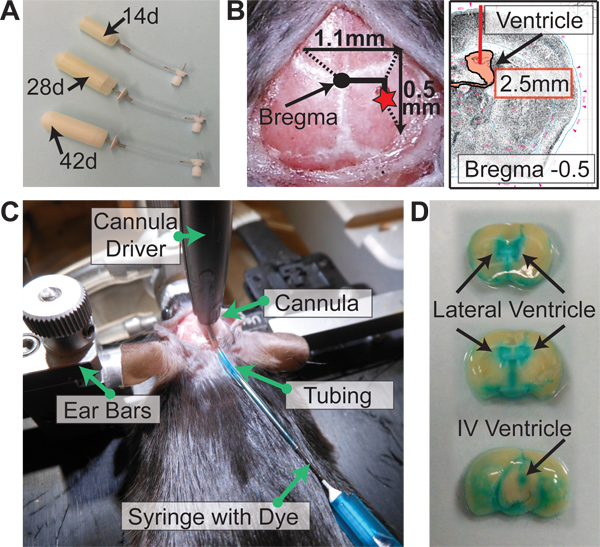
Figura 2. Alzet osmótica Implantação da bomba. (A) Alzet opções bomba osmótica para camundongos. 14 bombas. Dias (0,25 mL / hr), 28 bombas dias (0,25 mL / hr), 42 bombas dias (0,15 mL / hr) (B) Coordenadas para implantação da bomba de bregma: -0,5 mm Posterior, -1,1 mm Lateral ( direita), e ventral -2,5 mm (comprimento do cateter). (C) após a condução do cateter através dacrânio e colagem da cânula, corante é descarregado através do cateter para avaliar a colocação correcta do cateter no ventrículo lateral (D). perfundidos cérebro imediatamente após corante administrado como em (C). Se o cateter é colocado no ventrículo com sucesso, o corante será distribuído por todo o sistema ventricular do rato.

Figura 3. Injeção intracerebroventricular Bolus. (A) Coordenadas para o bolus de bregma: 0,3 milímetros anterior, -1,0 mm Lateral (Direito) e -3,0 mm ventral (B) Depois de dirigir a agulha através do crânio -3,0 mm ventral, corante é empurrado através da seringa. para avaliar a colocação apropriada da agulha no ventrículo posterior. (C) cérebro perfundidos logo após corante administrado como em (B). Se a agulha é colocada com sucesso no ventrículo, acorante será distribuído por todo o sistema ventricular do rato.
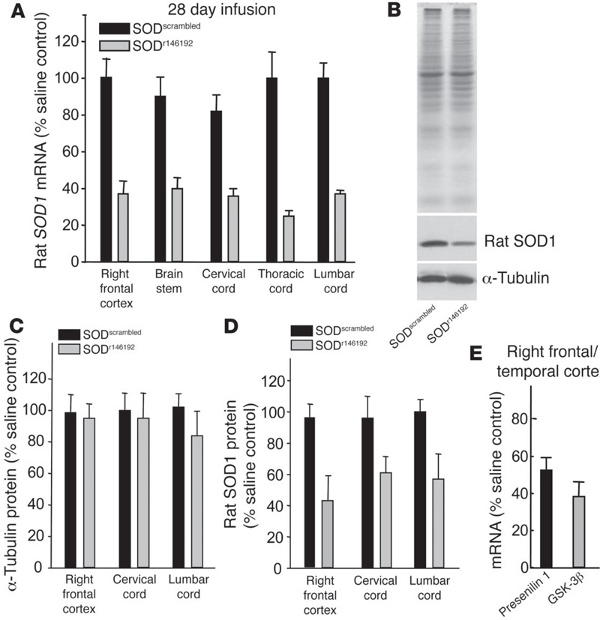
Figura 4. Os oligonucleótidos anti-sentido reduzem SOD1 rato in vivo (figura feita directamente a partir de Smith et ai. 7). (AD), os oligonucleótidos anti-sentido SOD1 r146192 SOD ou SOD mexidos foram infundidos durante 28 dias no ventrículo lateral direito de ratos normais a 100 ug / dia. (A) endógenos SOD1 níveis de mRNA de cérebro e medula espinal como medido por qRT-PCR. ( B) SOD1 e a-tubulina de níveis de proteína após infusão de ASO. (C e D), os níveis de proteína para a tubulina e SOD1 quantificados para diferentes regiões do cérebro após a infusão. (E) ASOs contra presenilina 1 ou a GSK-3 e beta, Foram infundidas por 2 semanas no ventrículo lateral direito não transgênicas de camundongos e os níveis de mRNA avaliadas no córtex frontal / temporal direito. Reproduzido com permissão da American Society for Clinical Investigation. Clique aqui para ver a figura maior .
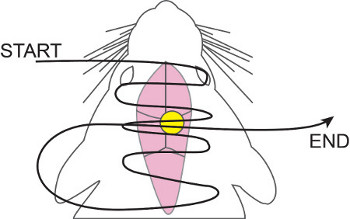
Figura 5. Execução Horizontal Sutura colchão. 5-0 nylon fio de sutura é tecida dentro e fora da pele, começando anterior e posterior trabalho, concentrando-se mais sobre a cânula. Uma vez tendo atingido o ponto mais posterior, o fio de sutura é então levado de volta para cima e enfiada pela cânula mais uma vez. Isto assegura o fechamento da ferida adequada e impede a cânula / tubo de trabalho através da pele.
Discussão
A capacidade para entregar drogas globalmente no SNC, como mostrado no vídeo é uma técnica poderosa que é fácil de aprender e utilizar. Com a prática, uma única bomba ou por uma implantação ICV em bolus pode ser completada em 10 min, permitindo grandes grupos de ratinhos a ser tratada ao mesmo tempo. Isto é especialmente útil para estudos com uma leitura comportamental, como números maiores para o comportamento do mouse são fundamentais para ajudar a ver diferenças significativas.
Com base em nossas experiências entregando ASO através de bombas e injeções em bolus, temos observado alguns prós e contras de cada método. Deve-se notar que estas são as opiniões em nosso laboratório e não pode ser verdadeiro para todos os modelos de rato e de ratazana.
Encontramos uma vantagem da utilização das bombas é a sua capacidade para proporcionar uma quantidade elevada de ASO desde o ASO é distribuído ao longo de um período mais longo de tempo. Isso geralmente equivale a knockdown mais sustentada ou splicing após ativoASO infusão, embora isso não seja sempre o caso. As bombas também permitem um prazo preciso de entrega ASO (14 dias, 28 dias ou 42 dias) e as bombas podem ser alterados uma vez para permitir a infusão ASO ainda mais ativo. No entanto, verificamos que a mudança bombeia mais do que uma vez aumenta a variabilidade devido à formação de bolsas fibrosas à volta da bomba para evitar que o da bomba de absorver adequadamente fluido. Uma desvantagem das bombas é que alguns ratinhos não toleram a bomba, bem como outros. Se a linhagem transgênica que você está trabalhando é mais frágil, uma bomba pode ser muito complicado. As bombas também precisam de ser removidos após a infusão final, submetendo os ratinhos a outra cirurgia e anestesia adicional. Se fazer trabalho comportamento, é especialmente importante para remover a bomba e para permitir que, pelo menos, 1-2 semanas de recuperação uma vez que a presença da bomba irá afectar alguns comportamentos nos ratinhos.
Com ICV bolus injeções, uma vantagem é o custo. Existe umainvestimento inicial para comprar as seringas e agulhas, mas ao longo do tempo, as injeções em bolus são mais custo-efetiva, pois não existem bombas / tubulação / cateteres para comprar. Em geral, há menos manter-se-com as injecções de bolus ICV, devido à falta de cânulas e bombas. Nós também descobrimos que ICV bolo pode ser utilizada para entregar ASO a ratinhos jovens frágeis e / ou mais. Uma desvantagem do ICV bolus é que é de uma única injecção. Não tanto ASO geral podem ser entregues por esta via, e se a duração da acção do ASO ser utilizado é curto, o efeito do knockdown / splicing também será de curta duração.
Ambas as bombas osmóticas, bem como os bolus ICV tem a capacidade de entregar o ASO que pode proteínas knockdown ou alteram de splicing de genes em todo o sistema nervoso central de roedores, uma técnica que tem larga aplicação em vários campos neuroscience relacionados. Sugerimos que pilotar os dois métodos de entrega, se você não souber qual a via de administração é o mais adequado para o seu sestudo ESPECÍFICAS.
Divulgações
Os autores recebem seus oligonucleotídeos antisense da Isis Pharmaceuticals.
Agradecimentos
Gostaríamos de agradecer a Curt Mazer da Isis Pharmaceuticals para prestação de consultoria pertencente à cirurgia bolus ICV, bem como Isis Pharmaceuticals como um todo para o fornecimento de nosso laboratório com ASO. Além disso, gostaríamos de agradecer Carey Shaner pela revisão deste artigo. TMM e SLD são suportados pelo NIH concede P50AG005681, K08NS074194 e R01NS078398.
Materiais
| Name | Company | Catalog Number | Comments |
| PREPARING ALZET OSMOTIC PUMPS | |||
| Alzet Osmotic Pump 14 days | DURECT | Model 1002 | |
| Alzet Osmotic Pump 28 days | DURECT | Model 2004 | |
| Alzet Osmotic Pump 42 days | DURECT | Model 2006 | |
| 2.5 mm Catheters | PlasticsOne | 3280PM/SPC | Custom ordered to 2.5 mm Catheter Length |
| Vinyl Catheter Tubing | DURECT | 7760 | ID: 0.027", OD: 0.045" |
| 0.9% Sodium Chloride, Irrigation, USP | Baxter | 2F7124 | NOT to be used in pumps or tubing |
| 0.9% Sodium Chloride, Injection, USP | Hospira | NDC 0409-4888-10 | |
| p60 Petri Dish (Sterilized) | TRP | 93060 | |
| Surgical Blades (Sterile) | Butler Schein | #007319 | |
| Latex Surgical Gloves (Sterile) | Micro-Touch | CatNo will depend on size of the gloves needed | |
| Sterile Towel Drape | Dynarex | 4410 | |
| .2um Syringe Filters | PALL | 4192 | |
| 1 ml Syringe (Sterile) | BD | 309625 | |
| 50 ml Conical Tubes | |||
| 100% Ethanol | |||
| PUMP & BOLUS SURGERY PROTOCOLS | |||
| Curved Forceps | Fine Science Tools | 11001-12 | |
| Curved Hemostat | Fine Science Tools | 13009-12 | |
| Fine Sharp Scissors | Fine Science Tools | 14060-09 | |
| Curved Blunt Scissors | Fine Science Tools | 14029-10 | |
| Bone Cutter | Fine Science Tools | 16104-14 | |
| Straight Hemostat | Fine Science Tools | 12002-12 | |
| Syringe | Hamilton | 7653-01 | 10 μl gas-tight with removable needles |
| Needles | Hamilton | 7758-04 | 26 gauge, Point Style: 2 |
| 5-0 Nylon Suture Thread | Covidient | SN-871 | |
| Alcohol Pads | Select | #521 | |
| Cotton Swabs (sterile) | Puritan | REF 806-WC | |
| Super Glue | Loctite | Longneck Bottles | |
| CAUTION: FastGreen Dye | Sigma | F7252-5G | Wear Eyeshields and Gloves when handling this product |
| Antibiotic Cream | |||
| Eye Ointment | |||
| Electric Shaver | |||
| 70% Ethanol | |||
| 10% Provadone Iodine | |||
| 3% Hydogen Peroxide | |||
| Warming Pad | |||
| Bead Sterilizer | SouthPointe Surgical | GRM5-1450 | |
| Small Animal Stereotaxic | Kopf | Model 940 | |
| Nose Cone | Kopf | Model 923-B | |
| Ear Bars | Kopf | Model 921 | This model is optional |
| Cannula Driver | Kopf | Model 1966 | |
| Syringe Holder | Kopf | Model 1972 | |
| Temperature Control System | Kopf | Model TCAT-2LV | Optional |
| Oxygen/Isoflurane System | |||
Referências
- Crooke, S. T., Bennett, C. F. Progress in antisense oligonucleotide therapeutics. Annual Review of Pharmacology and Toxicology. 36, 107-129 (1996).
- Sazani, P., Kole, R. Therapeutic potential of antisense oligonucleotides as modulators of alternative splicing. The Journal of Clinical Investigation. 112 (4), 481-486 (2003).
- Taylor, J. P., Hardy, J., Fischbeck, K. H. Toxic Proteins in Neurodegenerative Disease. Science. 296 (5575), 1991-1995 (2002).
- Ross, C. A., Poirier, M. A. Protein aggregation and neurodegenerative disease. Nature Medicine. 10, S10-S17 (2004).
- Miller, T. M., Smith, R. A., Kordasiewicz, H., Kaspar, B. K. Gene-Targeted Therapies for the Central Nervous System. Archives of Neurology. 65 (4), 447-451 (2008).
- Vickers, T. A., Koo, S., Bennett, C. F., Crooke, S. T., Dean, N. M., Baker, B. F. Efficient Reduction of Target RNAs by Small Interfering RNA and RNase H-dependent Antisense Agents. The Journal of Biological Chemistry. 278, 7108-7118 (1074).
- Smith, R. A., Miller, T. M., et al. Antisense Oligonucleotide therapy for neurodegenerative disease. The Journal of Clinical Investigation. 116 (8), 2290-2296 (2006).
- Rosen, D. R., Siddique, T., et al. Mutations in Cu/Zn superoxide disumutase gene are associated with familial amyotrophic lateral sclerosis. Nature. 362, 6415-62 (1993).
- Haidet-Phillips, A. M., Hester, M. E., et al. Astrocytes from familial and sporadic ALS patients are toxic to motor neurons. Nature Biotechnology. 29, 824-828 (2011).
- Furukawa, Y. Pathological roles of wild-type Cu,Zn-superoxide dismutase in Amyotrophic Lateral Sclerosis. Neurology Research International. 2012, 1-6 (2012).
- Hua, Y., Sahashi, K., et al. Antisense correction of SMN2 splicing in the CNS rescues necrosis in a type III SMA mouse model. Genes and Development. 24, 1634-1644 (2010).
- Passini, M. A., Bu, J., et al. Antisense Oligonucleotide Delivered to the Mouse CNS Ameliorate Symptoms of Severe Spinal Muscular Atrophy. Science Translational Medicine. 3 (72), (2011).
- Kordasiewicz, H. B., Stanek, L. M., et al. Sustained Therapeutic Reversal of Huntington's Disease by Transient Repression of Huntingtin Synthesis. Neuron. 74 (6), 1031-1044 (2012).
- Pritchett-Corning, K. R., Mulder, G. B., Luo, Y., White, W. J. Principles of Rodent Surgery for the New Surgeon. J. Vis. Exp. (47), e2586 (2011).
- Planel, E., Richter, K. E. G., et al. Anesthesia Leads to Tau Hyperphosphorylation through Inhibition of Phosphatase Activity by Hypothermia. The Journal of Neuroscience. 27 (12), 3090-3097 (2007).
- Southwell, A. L., Skotte, N. H., Bennett, C. F., et al. Antisense oligonucleotide therapeutics for inherited neurodegenerative diseases. Trends in Molecular Medicine. , (2012).
- Kole, R., Krainer, A. R., Altman, S. RNA therapeutics: beyond RNA interference and antisense oligonucleotides. Nature Reviews Drug Discovery. 11, 125-140 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados