Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
L'imagerie de fluorescence avec un nanomètre Précision (FIONA)
Dans cet article
Résumé
Fluorophores simples peuvent être localisés avec une précision nanométrique en utilisant FIONA. Voici un résumé de la technique FIONA est rapporté, et comment réaliser des expériences Fiona est décrit.
Résumé
imagerie de fluorescence avec une précision d'un nanomètre (FIONA) est une technique simple mais utile pour localiser fluorophores simples avec une précision nanométrique dans le plan xy. Voici un résumé de la technique FIONA est rapporté et des exemples de recherches qui ont été effectuées en utilisant FIONA sont brièvement décrits. Tout d'abord, comment mettre en place l'équipement nécessaire pour les expériences FIONA, c'est à dire, une microscopie de fluorescence à réflexion interne totale (TIRFM), avec plus de détails sur l'alignement de l'optique, est décrit. Alors comment réaliser une expérience FIONA simples sur la localisation de molécules simples Cy3 ADN immobilisé à l'aide des protocoles appropriés, suivis par l'utilisation de FIONA pour mesurer la taille de l'étape 36 nm d'un moteur Va myosine tronqué unique marqué par un point quantique, est illustré. Enfin, l'effort récent pour étendre l'application de FIONA à des échantillons d'épaisseur est rapporté. Il est montré que, en utilisant un objectif à immersion d'eau et les points quantiques trempé profondément dans sol-gels et les cornées l'œil de lapin (>200 um), la précision de localisation de 3.2 nm peut être obtenue.
Introduction
Autour de 1882, Ernst Abbe a constaté que la résolution d'un microscope à lumière visible est d'environ λ / 2NA, ou ~ 200 nm (où λ est la longueur d'onde et NA est l'ouverture numérique) 1,2. Par conséquent un objet plus petit que cette dimension apparaît comme une tache de diffraction limitée à un microscope optique. Cependant, il est possible de déterminer le centre de la tache, qui est la position de l'objet, avec une précision beaucoup plus élevée 3. imagerie de fluorescence avec une précision d'un nanomètre (FIONA) est une technique simple mais utile pour localiser fluorophores simples avec une précision nanométrique dans le plan xy 4. La précision de la localisation, σ μ (ie, l'erreur-type de la moyenne), dépend du nombre total de photons collectés, 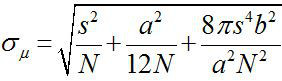 , Où N est le nombre de photons, s est l'écart-type de la tache fluorescente, est unla taille de pixel du détecteur de formation d'image, et b est l'écart type de la base de 3,4. Pour un fluorophore émettant de ~ 10 000 photons, FIONA peut atteindre 1 ~ 4 nm précision.
, Où N est le nombre de photons, s est l'écart-type de la tache fluorescente, est unla taille de pixel du détecteur de formation d'image, et b est l'écart type de la base de 3,4. Pour un fluorophore émettant de ~ 10 000 photons, FIONA peut atteindre 1 ~ 4 nm précision.
FIONA peut être utilisée pour déterminer avec précision la position d'un émetteur stationnaire, ou un un déplacement (en supposant que les images peuvent être prises assez rapidement). FIONA peut être appliqué séquentiellement aux images du film et donc de suivre le mouvement de la molécule unique 4 8. réactifs photo-protection peuvent être nécessaires pour s'assurer que l'échantillon ne photodégrader pas. En outre, l'objet lui-même fluorescent peut être de n'importe quelle taille, plus petite ou plus grande que la diffraction LIMIT- par exemple, il peut consister en un organite (~ 1 um) avec de nombreuses protéines fluorescentes dispersées sur sa membrane. Utilisation FIONA peut encore donner un très précise (nanomètre) moyenne de sa moyenne centre de masse. La grande amélioration de la précision de localisation par FIONA permet de résoudre nanomemouvements ter-échelle au fil du temps. Cela a poussé la microscopie dans l'échelle de longueur moléculaire du 4 au 8.
Depuis son invention, des variantes de FIONA ont été développés. Par exemple, l'imagerie à champ lumineux avec une précision d'un nanomètre (bFIONA) 9, une légère variante de FIONA, images et localise les objets denses tels que les mélanosomes vivo (objets sombres contenant les pigments de mélanine) dans avec la lumière transmise. En outre, FIONA a été utilisée pour résoudre plusieurs colorants. Par exemple, une seule molécule imagerie à haute résolution avec photoblanchiment (crevettes) 10,11 ou une seule molécule à haute résolution colocalisation (SHREC) 12 ont été développées pour résoudre deux colorants dans environ 10 nm. (Notez que c'est la résolution, c'est à dire avec quelle précision on peut dire colorants identiques à part.) Plus récemment, l'analyse FIONA a contribué au processus de localisation de certains microscopie de super-résolution comme reco optique stochastiquemicroscopie nstruction (STORM) du 13 au 15 et la localisation microscopie photo-activé (PALM) 16, dans lequel fluorophores sombres temporaires sont excités, puis la fluorescence est localisée. Par plusieurs reprises excitant assez faible densité de colorants (moins d'un par diffraction de place limité), puis à recueillir la fluorescence, analyse chacun d'eux par FIONA, on peut construire une carte à haute résolution. La résolution est alors seulement limité par le nombre de photons chaque colorant éteint, ainsi que des choses comme le maintien de l'échantillon fixe (y compris, par exemple, la platine du microscope) lors de l'acquisition.
Dans cet article, un résumé de la technique FIONA et décrire brièvement des exemples de recherches qui ont été effectuées à l'aide FIONA est rapporté. Tout d'abord, comment mettre en place l'équipement nécessaire pour les expériences FIONA, c'est à dire, une microscopie de fluorescence à réflexion interne totale (TIRFM), avec plus de détails sur l'alignement de l'optique, est décrit. Alors commentréaliser une expérience FIONA simples sur la localisation de molécules simples Cy3 ADN immobilisé à l'aide des protocoles appropriés, est illustré. Après cela, l'utilisation de FIONA pour mesurer la taille de pas de 36 nm d'un moteur de myosine Va tronqué unique marqué par un point quantique est présentée. Myosine Va est une protéine essentielle du moteur processive qui transporte des marchandises le long de la translocation cellulaire alors que les filaments d'actine. Voici une myosine Va construire tronquée est utilisée pour supprimer des domaines sans rapport avec la taille de l'étape, et avec une étiquette FLAG ajouté à l'extrémité C-terminale pour permettre la facilité d'étiquetage avec des points quantiques fonctionnalisés avec des anticorps anti-FLAG. Cette expérience est réalisée sous faible ATP pour ralentir la myosine et de permettre l'utilisation de longs temps d'exposition suffisant pour obtenir un bon nombre de photons dans chaque trame. Toute étiquette fluorescente suffisamment lumineuse pourrait être substitué dans le protocole suivant. Enfin, dernier effort d'étendre l'application de FIONA à des échantillons d'épaisseur est rapporté. Comme une preuve de principe, les points quantiques ont été trempésen sol-gel et les cornées l'œil de lapin puis imagé et localisée à l'aide FIONA. Pour l'imagerie, un objectif à immersion 60X d'eau avec NA = 1.2 a été utilisé parce que cet objectif a une distance plus de travail que précédemment utilisé 100X objectif à immersion d'huile. Pour compenser la perte dans le grossissement de l'objectif, une lentille supplémentaire grossissement (3.3X 4.0X ou) a été inséré dans le chemin d'émission. En outre, l'épi-fluorescence (pas TIR) microscopie doit être utilisé pour accéder à des régions profondes dans les échantillons épais. Il est démontré que les points quantiques trempés profonde dans sol-gels et cornées l'œil de lapin (Z> 200 um) peuvent être localisés avec précision 2-3 nm.
Access restricted. Please log in or start a trial to view this content.
Protocole
Déclaration d'éthique: Le tissu de la cornée de lapins ont été recueillis en conformité avec l'Université de l'Illinois institutionnel de protection des animaux et l'utilisation des lignes directrices.
Configuration 1 TIRFM
REMARQUE: Porter des lunettes de sécurité laser tout le temps.
- Assurez-vous que tous les composants optiques nécessaires énumérés dans la liste des matériaux sont disponibles et prêts pour l'alignement. Si nécessaire, utiliser des substituts aux fonctionnalités équivalentes d'autres sociétés. Assurez-vous que miroirs et lentilles doivent avoir des propriétés anti-reflets (AR) revêtements correspondant au laser utilisé.
- Régler les hauteurs de tous les éléments optiques à la hauteur du centre de l'orifice de retour microscope.
- Monter le laser, l'obturateur laser et filtre (s) ND. Utiliser des filtres ND pour atténuer la puissance du laser aussi bas que possible tout en gardant le faisceau visible. Serrer les vis avec les clés hexagonales appropriées.
- Planifier un trajet de faisceau et marquer avec du ruban adhésif ou un marqueur sur la table optique (pointTED lignes bleues dans la figure 1). Pour plus de simplicité, garder des voies droites le long des lignes de trous sur la table optique.
- Lieu miroir M1 (Figure 1) au premier virage à angle droit. Placer les deux iris le long de la seconde section rectiligne de la trajectoire de faisceau prévu. Régler à la fois la position et l'inclinaison de M1 telle que le laser passe à travers l'iris.
- Lieu miroir M2 (Figure 1) au deuxième tour de l'angle droit. Placer le dispositif d'expansion de faisceau 10X (L1 & L2, figure 1) le long de la troisième section linéaire de la trajectoire. Ajuster l'inclinaison de telle sorte que le dilatateur de faisceau est parallèle à la fois à la table optique et le trajet de faisceau prévu.
- Régler M1 et M2 de manière itérative de sorte que le laser fonctionne en ligne droite à travers les centres des deux lentilles de l'expanseur de faisceau. Répétez cette étape jusqu'à ce que le profil du faisceau du faisceau élargi est non tondue gaussienne.
- Régler M1 pour centrer le faisceau sur L1 (Figure 1) et M2 pour centrer le faisceau sur L2 (figure 1) de manière itérative. Un mauvais profil du faisceau signifie généralement que le laser est coupé; utiliser un morceau de papier blanc pour bloquer le faisceau après l'élargisseur de faisceau à vérifier le profil du faisceau avec les yeux. Pour une analyse de haute précision, utiliser un profileur de faisceau optique.
- Ajuster la distance entre L1 et L2 de telle sorte que le faisceau est collimaté. Répétez l'étape 1.8 et 1.9 si nécessaire.
NOTE: Lorsque la taille du faisceau ne change pas avec la distance, le faisceau est assez collimaté pour une configuration TIRFM. Pour améliorer encore la collimation du faisceau, des outils tels qu'un interféromètre de cisaillement peuvent être utilisés. Une taille typique du faisceau après expansion est ~ 20 mm. - Shutter le laser. Dévissez l'objectif du microscope et visser une cible d'alignement fluorescent. Lieu miroirs M3 et M4 (figure 1) pour diriger le faisceau élargi dans le port de microscope et sur le miroir dichroïque à l'intérieur de la tourelle. Assurez-vous que le faisceau laser rebondit til dichroïque et vers le plafond.
- Ajuster M3 pour centrer la partie brillante du faisceau sur la cible fluorescente et M4 pour ajuster l'inclinaison du faisceau à la verticale.
- Shutter le laser et visser l'objectif avant. Si l'alignement à l'étape précédente est bien fait, il devrait y avoir une place symétrique sortant de l'objectif. D'affiner les inclinaisons de M3 et M4 pour optimiser la puissance du laser et le profil du faisceau sur l'objectif.
- Monter une caméra EMCCD au microscope et connecter l'appareil photo à un ordinateur. Lancez le logiciel de la caméra.
- Monter un échantillon fluorescent (solution de fluorophores) sur le microscope. Regardez le spot fluorescent lumineux sur l'appareil photo. Assurez-vous que l'endroit ne se déplace pas sur l'écran, comme le focus est modifié.
- Placer la lentille TIR (L3, figure 1) sur l'étage de translation XYZ à une certaine distance du plan focal arrière de l'objectif qui est égale à la distance focale de L3 (~ 30 cm). Ajustez la position de L3de telle sorte que le laser passe par le centre de la lentille.
- Traduire L3 le long de la trajectoire du faisceau pour régler la collimation du faisceau. Assurez-vous que le faisceau est toujours centré sur le moniteur et de forme symétrique.
NOTE: La zone d'éclairement sur le plan de l'échantillon augmente avec la diminution de lentille TIR focale. En général, utilisez la plus petite longueur focale qui pourraient tenir sur le set-up. - Traduire L3 perpendiculaire à la trajectoire du faisceau pour incliner le faisceau sur l'objectif. Gardez la traduction de la lentille TIR tels que TIR est atteint. Observez un échantillon de billes fluorescentes à travers la caméra EMCCD, et d'affiner L3 pour obtenir un bon SNR.
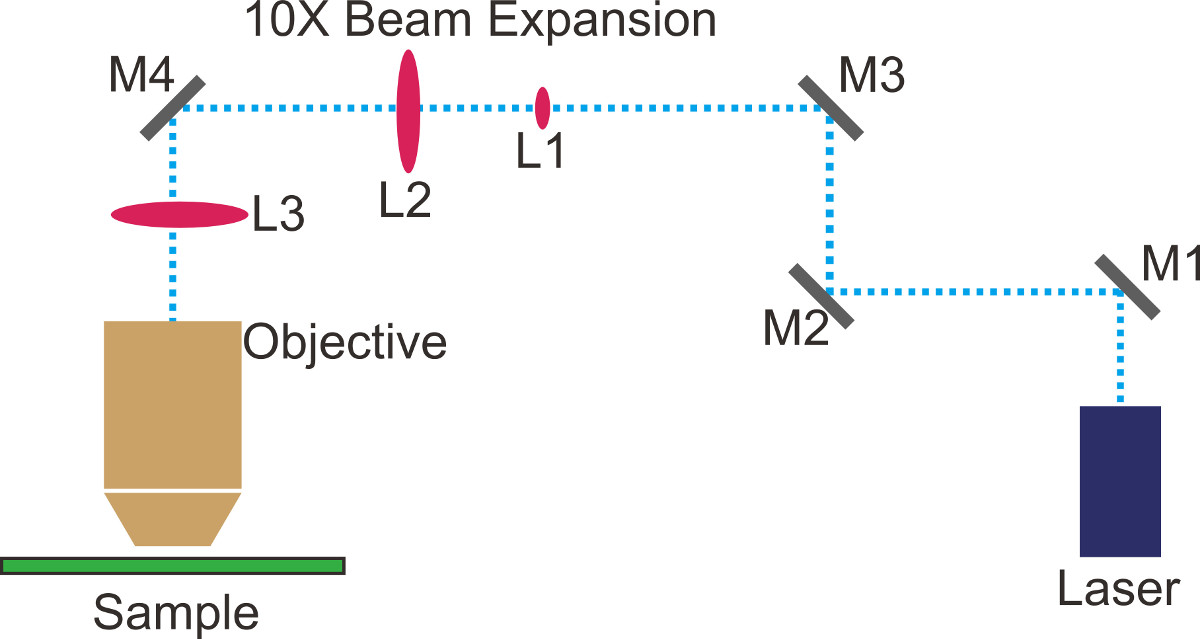
Figure 1: Configuration optique pour la microscopie de fluorescence par réflexion interne totale (TIRFM).
2 FIONA sur ADN-Cy3
- Cdiapositives maigres de microscope et lamelles: Rincer les lames de microscope et lamelles avec le trou DDH 2 O et l'isopropanol et les sécher avec de l'azote; Placer les lames et lamelles dans le nettoyeur à plasma pendant 5 min sous argon plasma.
- Construire chambres d'échantillons (comme esquissé dans la figure 2).
- Placez un tissu sur le banc et puis mettre un morceau de papier de verre sur le dessus du tissu. Placer la lame sur le papier de verre. Assurez-vous que le côté propre de la lame est à la hausse.
- Appliquer deux bandes de ruban adhésif double face sur la lame le long des bords longs, en laissant un espace de 3-5 mm au centre. Placer la lamelle couvre-objet nettoyé au-dessus de la glissière. Assurez-vous que le côté propre de la lamelle est confrontée à la diapositive.
- Utiliser un embout de pipette pour appuyer sur le ruban adhésif double face. Utilisez un rasoir pour enlever le ruban excès de la diapositive de sorte que la bande reste que sous la lamelle.
REMARQUE: Les extrémités ouvertes de la chambre et sont laissées ouvertes servent d'entrée et à la sortielaisser. Le volume de la chambre est plusieurs microlitres.

Figure 2: Croquis d'une chambre d'échantillon typique (a) Vue d'en haut. (B) Vue de côté de la droite; (C) Vue de côté de l'avant.
- Cy3 immobiliser l'ADN sur des surfaces intérieures des chambres d'échantillon.
- Préparer T-50 tampon (10 mM Tris-HCl pH 8,0, NaCl 50 mM). Préparation de BSA-biotine en T-50 à une concentration finale de 1 mg / ml. Préparer le tampon T50-BSA BSA par dissolution dans le T-50 à une concentration finale de 10 mg / ml.
- Préparer 0,5 mg / ml dans un tampon neutravidine T50-BSA. Préparer l'ADN biotinylé marqué au Cy3 (Cy3-ADN) en T50-BSA à une concentration finale de 5 à 10 pM.
- Introduire à la pipette 10 ul de BSA-biotine (1 mg / ml) dans la chambre de mesure. Attendez 5 min.
- Lavez la chambre avec 40 ul T50-BSA. Introduire à la pipette 10 ul de la neutravidine (0,5 mg / ml) dans la chambre de mesure. Incuber pendant 5 min.
- Laver la chambre avec 40 ul T50-BSA. Introduire à la pipette 20 ul d'ADN-Cy3 dans la chambre de mesure. Incuber pendant 5 min, puis laver la chambre avec 80 ul T50-BSA.
- Image Cy3 ADN des molécules simples sous TIRFM.
- Préparer le tampon d'image (100 pi) en mélangeant 1 ul protocatéchuate-3,4-dioxygénase (PCD, 5 uM) 4 ul d'acide protocatéchique (APC, 62,5 mM), 50 pl de 6-hydroxy-2,5,7,8- tetramethylchromane-2-carboxylique (Trolox, 2 mM en T-50), et 45 pi de BSA-T50.
- Pipette dans un tampon d'imagerie de 30 pi et attendre 8-10 min.
- Placer l'échantillon de formation d'image sur un TIRFM qui est équipé d'un laser vert (532 nm), un objectif 100X à immersion dans l'huile (1,45 NA), et une caméra EMCCD.
- Réglez le temps d'exposition à 100 à 500 ms et un gain EM de 25 à 100 Acquérir un film de l'échantillon pour 1,000 cadres.
- Procéder à l'analyse de données FIONA sur les images enregistrées de Cy3-ADN.
- Déterminer la taille effective des pixels (par exemple, le facteur de conversion de pixels à nanomètres) en divisant la taille physique de pixel (lu à partir du cahier des charges de la caméra EMCCD) par le grossissement total (le grossissement de l'objectif de microscope, multiplié par des grossissements d'appoint).
- Déterminer le facteur de conversion à partir des intensités des pixels de photons nombres en divisant la sensibilité du capteur CCD (c'est-à-électrons par comptage analogique / numérique, lu à partir de la feuille de spécification de la caméra CCD) par le multiplicateur d'électrons (EM) de gain utilisé lors de l'acquisition d'image.
- Compiler et exécuter FIONA.pro pour l'analyse FIONA. Utiliser ce programme IDL pour importer l'image acquise, à l'entrée de la taille de pixel effectif (étape 2.5.1) et le facteur de conversion de l'intensité de nombre de photons (étape 2.5.2), et de choisir pour l'analyse des taches FIONA.
NOTE: À la fin, le program affichera les résultats de montage avec des fonctions 2D gaussiennes, ainsi que les numéros de photons totales et la précision de la localisation. Un résultat typique est montré dans la section des résultats et chiffres représentatifs 4c-4d. - Compiler et exécuter phcount.pro pour caractériser comptage de photons. Utilisez ce programme IDL pour mesurer le nombre moyen de photons émis par un fluorophore avant photoblanchiment, d'importer l'image acquise et à l'entrée du facteur de conversion de l'intensité de nombre de photons (de l'étape 2.5.2).
REMARQUE: Le programme va alors détecter les points fluorescents automatiquement (sélection manuelle est une option), calculer comptages de photons en fonction du numéro de l'image, et la sortie des traces de comptages de photons.- Jeter mauvaises traces et spécifier des plages de cadre après photoblanchiment pour la correction de base. A la fin, le programme va afficher une liste de numéros de photons totaux pour toutes les taches et non pas abandonné. Ensuite, tracer la distribution des nombres de photons et s'adapter à la distrition avec une décroissance exponentielle pour obtenir le nombre moyen de photons. Un résultat typique est montré dans la section des résultats représentatifs et les figures 4e-4f.
3. FIONA appliquée pour quantifier moteur (par exemple, la myosine sur l'actine) Dynamics à l'échelle nanométrique
- Polymériser l'actine (c'est à dire préparer la F-actine) un jour avant l'expérience FIONA.
- Reconstituer G-actine (monomère) et de la biotine d'actine G (monomère) à 10 mg / ml avec un tampon général d'actine. Remuer pour s'assurer que les deux sont complètement dissous, et garder à la fois sur la glace.
- Mélanger 10 pi G-actine (monomère) avec 1,7 ul biotine G-actine dans un tube de 1,5 ml. Ajouter tampon de polymérisation de l'actine glacé de 100 ul.
- Laisser le mélange pendant une nuit à 4 ° C (F-actine formé), puis ajouter le trou DDH 2 O pour un volume total de 1 ml.
- Stocker les filaments d'actine (actine F) à 4 ° C pour une utilisation ultérieure dans des expériences.
NOTE: Filaments va se désintégrer et de raccourcir le temps, mais peut être utilisé pour au moins deux semaines.
- Préparer l'échantillon pour l'imagerie.
- Faire une chambre d'échantillon (comme décrit dans le protocole 2.1 et 2.2). Introduire à la pipette 20 ul de BSA biotinylé à 1 mg / ml dans le trou DDH 2 O. Incuber pendant 10 min. Rincer à 30 pi ddH 2 O.
NOTE: Cela bloque la surface de verre et fixe la biotine pour la liaison des filaments d'actine. Biotinylé poly-L-lysine - polyéthylène glycol (PEG-PLL) peut remplir la même fonction. - Pipette à 0,5 mg / ml neutravidine. Incuber pendant 2 min, puis laver la chambre avec un tampon M5 de 30 pi.
- Introduire à la pipette dans la F-actine préparé dilué 25 fois dans un tampon général d'actine, à une concentration finale de ~ 0,004 mg / ml. Attendez 10 minutes, rincer la chambre avec 30 pi de tampon.
- Diluer la myosine Va avec des étiquettes FLAG 30 fois dans du tampon M5 (HEPES 20 mM (pH 7,6), 2 mM de MgCl2, 25 mM de KCl, 1 mM EGTA) à une concentration finale of 250 nM. Mélanger 1 pl myosine avec 1 pl Anti-FLAG-Qdot705 (~ 1 uM, conjugué d'anticorps anti-FLAG et Qdot705 utilisant le Conjugaison Kit Qdot705 Anticorps selon le manuel d'instructions du fabricant). Ajouter à 8 pi M5 à remplir à 10 pi. Introduire à la pipette de haut en bas pour bien mélanger. Incuber pendant 10 min sur la glace.
NOTE: Cela donne un mélange de 1 moteur à 4 points quantiques, à ~ 25 nM concentration de la myosine.
- Faire une chambre d'échantillon (comme décrit dans le protocole 2.1 et 2.2). Introduire à la pipette 20 ul de BSA biotinylé à 1 mg / ml dans le trou DDH 2 O. Incuber pendant 10 min. Rincer à 30 pi ddH 2 O.
- Imagerie de la myosine marcher sur l'actine.
- Préparer le tampon d'image (100 pi) en mélangeant 84 ul M5-BSA (tampon M5 avec 1 mg / ml BSA), 1 ul d'ATP (50 uM dans le trou DDH 2 O), 2 ul de DTT (500 mM dans le trou DDH 2 O), 1 CK pi (500 U / ml), 5 ul de CP (200 mM), 1 pi de PCD, 4 ul de PCA, 1 ul de la myosine-Qdot dilué après un autre facteur de 10 concentration de 2,5 nM de la myosine, et 1 ul de BME.
- Pipette dans un tampon d'imagerie de 20 pi de goûter chambre et incuber pendant 8-10 min.
- L'image de l'échantillon sur TIRF microscope à 30 ms exposition. Acquérir au moins 1000 images. Réglez le volume de la myosine-Qdot à l'étape 3.3.1 si nécessaire.
- Effectuer l'analyse des données et de trouver la taille de pas de la myosine marche.
- Ouvrez le fichier vidéo dans ImageJ 17 et recadrer la vidéo autour d'un point mobile. Recadrage d'une assez grande superficie que l'endroit ne fait jamais moins de 20 pixels du bord, et s'assurer qu'il n'y a pas d'autres endroits de la vidéo. Assurez-vous que cet endroit se déplace sur une trajectoire linéaire.
- Suivre la place dans la vidéo pour générer les coordonnées x et y dans le temps, en pixels, en appliquant l'analyse FIONA (étape 2.5.3) pour chaque image de la vidéo.
- Autre pixels de nanomètres, de la manière décrite dans la section précédente.
- Calculer le déplacement de la position initiale en fonction du temps.
- Exécutez le test t sur le déplacement d'obtenir les étapes de la myosine marche.
REMARQUE: Le programme prévu t-test (step_t_test.zip) est codé en IDL et conconsiste de 14 sous-programmes dans le dossier.- Ouvrez toutes les sous-routines en IDL et compilent toutes deux fois. Ensuite, exécutez mtltyanalysis_ttest.pro et choisir un fichier texte contenant uniquement les données à distance dans une seule colonne. Une sortie fichier Excel sera généré, contenant les données brutes, l'ajustement et la taille de l'étape.
- Supprimer toutes les valeurs zéro de la colonne étape de taille. Tracer la distribution des tailles de pas à l'aide de l'origine ou MATLAB. Monter une gaussienne de l'histogramme.
REMARQUE: Les formats d'étape de zéro valeurs doivent être supprimés car une étape de zéro signifie qu'aucune mesure ne soit prise à partir de la trame précédente. Le montage donne un pic autour de 36 nm (voir la figure 5).
4. épais Préparation de l'échantillon pour FIONA
- Préparer les boîtes quantiques encapsulées dans un sol-gel.
- Mélanger 4,5 ml TMOS, 1 ml ddH 2 O et 100 pi de HCl (120 mM). Soniquer le mélange sur de la glace pendant 30 minutes dans le bain à ultrasons specified dans la liste des matières (fréquence = 40 kHz, chauffage = off). Mélanger la solution toutes les 10 min.
- Diluer 1,5 ul Qdot605 dans 1,5 ml d'HEPES 50 mM (pH 7,2). Solution avec 1,5 ml de TMOS Mélanger l'étape précédente.
- Verser le mélange dans un plat à fond de verre. Sceller le plat de fond de verre avec du Parafilm et conserver à 4 ° C pendant 1 h 5.
- Ajouter 2 ml de BME à 1% dans du PBS à la coupelle d'échantillon et incuber à température ambiante pendant 30 minutes avant l'imagerie.
- Préparer l'échantillon cornée tachée de points quantiques.
REMARQUE: Lapin-yeux étaient des cadeaux du Dr Marina Marjanovic.- Séparer la cornée des yeux et le couper en 3 mm x 3 mm morceaux.
- Diluer une Qdot 605 pi de streptavidine-dans 1 ml de PBS. Incuber le tissu de la cornée avec une solution nM Qdots à 4 ° C pendant 1 heure. Laver le tissu avec du PBS.
- Prenez une lame de verre propre et une lamelle # 1.5. Mettez 4 couches de ruban adhésif double face sur la lame de verre le long de la côté le plus long, une mettre encore 4 couches de ruban adhésif double faces parallèles à la bande précédente et laisser un canal d'environ 1 cm entre les deux. Mettez le tissu de l'étape précédente dans le milieu du chenal, et couvrir avec une lamelle.
- Appuyez légèrement sur les côtés de la lamelle couvre-objet pour le faire adhérer aux bandes. Mouiller le canal avec 50 pi de PBS avant l'imagerie.
- Image des points quantiques dans un sol-gel et de la cornée.
- Pour l'imagerie FIONA dans des échantillons épais, utilisez un objectif 60X immersion dans l'eau avec une distance de travail de 0,27 mm, ou un objectif 60X immersion dans l'eau avec une distance de travail de 0,28 mm.
- Monter l'échantillon sur le microscope. Ajuster la lentille de telle sorte que TIRF qu'il atteigne le mode épifluorescence (par exemple le faisceau laser sort de l'objectif avec un angle contre la lamelle couvre-objet). Insérez une lentille de grossissement supplémentaire (3.3X ou 4.0X).
- Déplacer le plan focal de l'objectif à une position z souhaitée (par exemple,> 200 pm). Enregistrez les images de immobilepoints quantiques dans l'échantillon.
- Effectuer une analyse FIONA comme décrit à la section 2.5 de ce protocole.
Access restricted. Please log in or start a trial to view this content.
Résultats
Une configuration typique de type objectif TIRFM est représenté sur la Figure 3. Tout d'abord, l'échantillon Cy3 ADN immobilisé sur la surface a été imagée. Une image typique est représentée sur la figure 4a. L'image a été prise avec le temps d'exposition de 0,5 s, avec un gain de EM = 50 et la sensibilité du CCD = 12.13 pour la caméra. La fonction à répartition de points (PSF) d'une seule molécule d'ADN-Cy3 est représenté sur la figure ...
Access restricted. Please log in or start a trial to view this content.
Discussion
FIONA est une technique pour localiser la position d'un émetteur fluorescent (fluorophore organique ou points quantiques) avec une précision nanométrique et une résolution temporelle à 1 ms 4 8. Lorsque suffisamment de photons sont collectés, cette technique permet de déterminer la position d'un émetteur fluorescent beaucoup plus précise que la limite de diffraction (~ 200 nm) et donc cette technique ouvre la voie à observer ce qui n'a pas été vu en microscopie optique classique / trad...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs déclarent qu'ils n'ont aucun intérêt financier concurrents.
Remerciements
Ce travail a été soutenu par NIH Subventions 068 625, subventions de la NSF 1063188 et Centre de physique des cellules vivantes 0822613. Des remerciements spéciaux vont à Dr Marina Marjanovic dans Beckman Institute for Advanced Science et de la Technologie pour le don de l'œil du lapin.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Double-sided tape | 3M | ~75 µm thick | |
| EMCCD camera | Andor Technology | DU-897E-CS0-#BV | |
| Ultrasonic cleaner | Branson | 2510 | |
| Fluorescence filter set | Chroma | 49016 | |
| Actin polymerization buffer | Cytoskeleton | BSA02 | |
| Biotin G-actin | Cytoskeleton | AB07 | |
| G-actin | Cytoskeleton | AKL95 | |
| General actin buffer | Cytoskeleton | BSA01 | |
| Laser shutter (with driver) | Electro-Optical Products Corp. | SH-10-MP | |
| IDL | Exelis Visual Information Solutions | ||
| Neutravidin | Fisher Scientific | PI-31000 | |
| Coverslip | Fisherbrand | 22X30-1.5 | 0.16-0.19 mm thick |
| Microscope slide | Gold Seal Microslides | 30103X1 | 0.93-1.05 mm thick |
| Plasma cleaner | Harrick Plasma | PDC-001 | |
| Glass bottom dish | In Vitro Scientific | D35-20-1.5-N | |
| Cy3-DNA oligos | Integrated DNA Technologies | 5'-Cy3/GCCTCGCTGCCGTCGCCA-3'Bio | |
| Fluorescent beads | Invitrogen | T-7280 | |
| Qdot 605-streptavidin | Invitrogen | Q10101MP | |
| Qdot605 | Invitrogen | Q21301MP | |
| Qdot705 | Invitrogen | Q22021MP | |
| Qdot705 Antibody Conjugation Kit | Invitrogen | Q22061MP | |
| MATLAB | MathWorks | ||
| Optical table | Newport Corp | RS4000 Series | |
| 60X Objective | Nikon | Plan Apo VC 60x WI | |
| 100X Objective | Olympus | PlanApo 100X/1.45 Oil ∞/0.17 | |
| 60X Objective | Olympus | UPlanApo 60X/1.20W | |
| Inverted microscope | Olympus | IX71/IX70/IX81 | |
| Origin | OriginLab | ||
| Anti-FLAG antibody | Sigma Aldrich | F7425-.2MG | |
| ATP | Sigma Aldrich | A7699 | |
| BME | Sigma Aldrich | 63689-25ML-F | |
| BSA | Sigma Aldrich | A7906 | |
| BSA-biotin | Sigma Aldrich | A8549-10MG | |
| CK | Sigma Aldrich | C3755 | Creatine Phosphokinase from rabbit muscle |
| CP | Sigma Aldrich | P1937 | Phosphocreatine di(tris) salt |
| DTT | Sigma Aldrich | 43815 | DL-Dithiothreitol |
| EGTA | Sigma Aldrich | E3889 | Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid |
| HCl | Sigma Aldrich | 93363-500G | |
| HEPES | Sigma Aldrich | H0887 | |
| KCl | Sigma Aldrich | P9333 | |
| MgCl2 | Sigma Aldrich | M1028 | |
| NaCl | Sigma Aldrich | S7653 | |
| PCA | Sigma Aldrich | 03930590 | Protocatechuic acid |
| PCD | Sigma Aldrich | P8279 | Protocatechuate-3,4-dioxygenase |
| TMOS | Sigma Aldrich | 341436-25G | Tetramethyl orthosilicate |
| Tris-HCl | Sigma Aldrich | 93363 | |
| Trolox | Sigma Aldrich | 238813 | 6-hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid |
| 1” diameter broadband dielectric mirrors with mounts | Thorlabs | BB1-E02, KM100 | Quantity: 2 |
| ½” diameter posts | Thorlabs | TR4 | Quantity ≥ 6 |
| 10X beam expander | Thorlabs | BE10M-A | |
| 2” diameter f = 300 mm lens with mount | Thorlabs | LA1256-A, LMR2 | TIR lens |
| Fluorescent alignment target | Thorlabs | VRC2SM1 | |
| Laser safety goggles | Thorlabs | LG3 | |
| ND filter(s) | Thorlabs | FW1AND | |
| Optical beam profiler | Thorlabs | BP209-VIS | |
| Post-mounted iris diaphragm | Thorlabs | ID25 | Quantity: 2 |
| Shearing interferometer | Thorlabs | SI100 | |
| XYZ translation stage, ½” travel | Thorlabs | T12XYZ | |
| Laser | World Star Technologies | TECGL-30 | 532 nm, 30 mW |
Références
- Abbe, E. The Relation of Aperture and Power in the Microscope. Journal of the Royal Microscopical Society. 2 (3), 300-309 (1882).
- Abbe, E. The Relation of Aperture and Power in the Microscope (continued). Journal of the Royal Microscopical Society. 2 (4), 460-473 (1882).
- Thompson, R. Precise Nanometer Localization Analysis for Individual Fluorescent Probes. Biophysical Journal. 82 (5), 2775-2783 (2002).
- Yildiz, A., et al. Myosin V Walks Hand-Over-Hand: Single Fluorophore Imaging with 1.5-nm Localization. Science. 300 (5628), 2061-2065 (2003).
- Yildiz, A., Tomishige, M., Vale, R. D., Selvin, P. R. Kinesin Walks Hand-Over-Hand. Science. 303 (5658), 676-678 (2004).
- Yildiz, A., et al. Myosin VI Steps via a Hand-over-Hand Mechanism with Its Lever Arm Undergoing Fluctuations when Attached to Actin. Journal of Biological Chemistry. 279 (36), 37223-37226 (2004).
- Yildiz, A., Selvin, P. R. Fluorescence Imaging with One Nanometer Accuracy: Application to Molecular Motors. Accounts of Chemical Research. 38 (7), 574-582 (2005).
- Toprak, E., Yildiz, A., Hoffman, M. T., Rosenfeld, S. S., Selvin, P. R. Why kinesin is so processive. Proceedings of the National Academy of Sciences. 106 (31), (2009).
- Kural, C., et al. Tracking melanosomes inside a cell to study molecular motors and their interaction. Proceedings of the National Academy of Sciences. 104 (13), 5378-5382 (2007).
- Gordon, M. P., Ha, T., Selvin, P. R. Single-molecule high-resolution imaging with photobleaching. Proceedings of the National Academy of Sciences of the United States of America. 101 (17), 6462-6465 (2004).
- Qu, X., Wu, D., Mets, L., Scherer, N. F. Nanometer-localized multiple single-molecule fluorescence microscopy. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11298-11303 (2004).
- Churchman, L. S., Ökten, Z., Rock, R. S., Dawson, J. F., Spudich, J. A. Single molecule high-resolution colocalization of Cy3 and Cy5 attached to macromolecules measures intramolecular distances through time. Proceedings of the National Academy of Sciences of the United States of America. 102 (5), 1419-1423 (2005).
- Huang, B., Wang, W., Bates, M., Zhuang, X. Three-Dimensional Super-Resolution Imaging by Stochastic Optical Reconstruction Microscopy. Science. 319 (5864), 810-813 (2008).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Meth. 3 (10), 793-796 (2006).
- Bates, M., Huang, B., Dempsey, G. T., Zhuang, X. Multicolor Super-Resolution Imaging with Photo-Switchable Fluorescent Probes. Science. 317 (5845), 1749-1753 (2007).
- Betzig, E., et al. Imaging Intracellular Fluorescent Proteins at Nanometer Resolution. Science. 313 (5793), 1642-1645 (2006).
- Abramoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics international. 11 (7), 36-42 (2004).
- Enderlein, J., Toprak, E., Selvin, P. R. Polarization effect on position accuracy of fluorophore localization. Optics Express. 14 (18), 8111-8120 (2006).
- Cheezum, M. K., Walker, W. F., Guilford, W. H. Quantitative comparison of algorithms for tracking single fluorescent particles. Biophysical Journal. 81 (4), 2378-2388 (2001).
- Rasnik, I., McKinney, S. A., Ha, T. Nonblinking and long-lasting single-molecule fluorescence imaging. Nature Methods. 3 (11), 891-893 (2006).
- Zhuang, X., et al. A Single-Molecule Study of RNA Catalysis and Folding. Science. 288 (5473), 2048-2051 (2000).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An Oxygen Scavenging System for Improvement of Dye Stability in Single-Molecule Fluorescence Experiments. Biophysical Journal. 94 (5), 1826-1835 (2008).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon