Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Estimation topographique de Visual population réceptive champs par IRMf
Dans cet article
Résumé
It is important to obtain unbiased estimates of visual population receptive fields (pRFs) by functional magnetic resonance imaging. We use mild regularization constraints to estimate pRF topography without a-priori assumptions about pRF shape, allowing us to choose specific pRF models post-hoc. This is particularly advantageous in subjects with visual-pathway lesions.
Résumé
Cortex visuel est rétinotopique organisé afin que les populations voisines de cellules correspondent aux pièces voisines du champ visuel. Imagerie par résonance magnétique fonctionnelle nous permet d'estimer voxel population champs réceptifs (PRF), ce est à dire, la partie du champ visuel qui active les cellules au sein de chaque voxel. Avant,, PRF estimation méthodes directes 1 souffrent de certaines limitations: 1) le modèle pRF est choisi a priori et peut ne pas saisir pleinement la forme réelle pRF, et 2) centres de PRF sont sujettes à une mauvaise localisation près de la frontière de l'espace de relance. Voici une nouvelle topographique pRF méthode d'estimation 2 est proposé qui contourne largement ces limites. Un modèle linéaire est utilisé pour prédire le signal du sang en oxygène en fonction du niveau (GRAS) par la convolution de la réponse linéaire du PRF au stimulus visuel avec la fonction de réponse hémodynamique canonique. PRF topographie est représenté comme un vecteur de poids dont les composantes représenter la strongueur de la réponse globale des neurones aux stimuli voxel présenté à différents endroits du champ visuel. Les équations linéaires qui en résultent peuvent être résolus pour le vecteur de poids pRF utilisant la régression ridge 3, ce qui donne la topographie pRF. Un modèle pRF qui est adaptée à la topographie estimée peut alors être choisi post-hoc, améliorant ainsi les estimations des paramètres tels que l'emplacement PRF PRF-centre, l'orientation pRF, taille, etc. Avoir la topographie pRF disponibles permet également la vérification visuelle des estimations des paramètres PRF permettant l'extraction de diverses propriétés PRF sans avoir à faire des hypothèses a priori sur la structure pRF. Cette approche promet d'être particulièrement utile pour étudier l'organisation pRF des patients souffrant de troubles du système visuel.
Introduction
Imagerie par résonance magnétique fonctionnelle (IRMf) mesure non invasive l'organisation fonctionnelle du cortex visuel à l'échelle macroscopique (typiquement de l'ordre de quelques millimètres). Les premières études de rétinotopie IRMf ont utilisé une mesure de cohérence entre l'emplacement de relance et a suscité des réponses audacieuses 4-7. Ces études généralement ne ont pas estimé la population réceptive taille du champ. Plus tard, Dumoulin et Wandell 1 ont proposé une méthode pour surmonter une telle limitation en modélisant explicitement l'emplacement et la taille pRF, en utilisant une fonction linéaire de ce modèle pour prédire la réponse BOLD. Toutefois, une limitation de cette méthode est de pionnier que le modèle pRF paramétrique doit être choisi a priori, et peut mener à des estimations erronées pRF si elle se avère ne pas être approprié.
Pour surmonter les limitations de la méthode PRF-modèle paramétrique, de nouveaux procédés ont été développés récemment. Ces méthodes prédisent directement la réponse BOLD aux stimulus en reconstruisant la topographie pRF. Une méthode 8 proposé par Greene et ses collègues reconstitue la topographie pRF par rétro-projection des réponses audacieuses pour les espaces de relance 1D individuels et la construction de la topographie pRF dans l'espace de relance 2D comme une technique typique de tomographie par ordinateur. D'autre part, le procédé proposé par nous deux estime directement la topographie 2D PRF à l'aide d'une régression linéaire et l'application d'une technique de régularisation. Dans ce procédé, la topographie pRF est représenté comme un ensemble de poids qui est multiplié par le stimulus pour estimer la réponse de la population neuronale d'un voxel donné. Ensuite, l'oxygène dans le sang en fonction du niveau (GRAS) réponse final évoqué par le stimulus est estimée par la convolution de la réponse de la population neuronale et la fonction de réponse hémodynamique canonique. Afin de résoudre le système linéaire sous-contraint, en outre, la régularisation crête de régression est utilisée pour appliquer rareté (voir Figure 1ci-dessous). La technique de régularisation supprime le bruit et des artefacts et permet ainsi notre méthode pour estimer la topographie pRF plus robuste.
Les méthodes topographiques ne forcez pas la forme pRF d'avoir une certaine forme paramétrique, et ne peut donc découvrir la structure réelle pRF. Un modèle paramétrique appropriée peut alors être choisie en fonction de la topographie pRF. Par exemple, la topographie pRF peut être utilisé pour séparer le centre pRF et surround et, le centre modélisation pRF ultérieur peut être plus précis, en minimisant l'influence de suppression surround ainsi que l'influence d'autres artefacts potentiels résultant dans des zones éloignées de la centre pRF. Nous avons récemment effectué une comparaison quantitative entre notre méthode et plusieurs autres méthodes que directement (à savoir avant d'estimer la topographie) ajustement gaussien isotrope 1, anisotrope gaussien, et la différence de gaussiennes isotrope à l'pRF neuf. On a constaté que la topogrméthode basée aphy-performé ces méthodes à l'égard du centre pRF modélisation en réalisant plus variance expliquée de la série BOLD de temps de signal.
L'estimation précise des propriétés PRF dans divers domaines révèle comment ils couvrent le champ visuel et est important pour étudier l'organisation fonctionnelle du cortex visuel particulièrement en ce qui a trait à la perception visuelle. Les propriétés telles que la façon dont la taille pRF changements avec l'excentricité 1,10 et pRF organisation surround central 9 sont bien étudiés dans la littérature humaine. La méthode proposée pour estimer les résultats de topographie PRF dans la modélisation plus précise paramètre pRF et est plus susceptible de révéler des régularités inconnues, pas facilement modélisée a priori dans les modèles paramétriques directs. Cette approche sera particulièrement adapté à l'étude l'organisation pRF chez les patients avec des lésions de la voie visuelle, pour qui la structure pRF est pas nécessairement prévisible a priori. Ci-dessous est décrit comment estimer ee pRF topographie et la façon d'utiliser la topographie pour modéliser le centre pRF.
Protocole
1. Acquisition de données
- Préparer un protocole de stimulation qui est efficace pour provoquer une réponse visuelle rétinotopique fiable comme décrit précédemment dans Dumoulin et Wandell 1 et Lee et al. 2. Cependant, d'autres paradigmes bien établis sont également applicables en fonction de la question expérimental spécifique à traiter.
- Stimuli à barres présents dérive à travers l'écran séquentiellement le long 8 directions de l'espace, dans les étapes de 45 degrés. Assurez-vous que le mouvement est en synchronie avec l'acquisition d'image du scanner (TR ~ 2 sec) pour que la barre se déplace d'une étape une fois un IRMf cadre démarre et reste au nouvel emplacement jusqu'à ce que la trame se termine.
- Pour mesurer un signal de référence correcte, ajouter des époques sans barre stimulation 1.
- Définir un champ de vision (10 à 15 ° de rayon) dans l'angle visuel sur lequel le stimulus est présentée. Mobile présents ou des motifs de damiers vacillantes (taille de checker = 0,94 x 0,94 ° 2, pattetaux de mise à jour rn = 250 ms / motif) dans la barre de susciter des réponses visuelles fortes.
- Entrez les paramètres spécifiques suivants: 8 directions espacées régulièrement du mouvement, bar largeur égale à 1,875 degrés, et les barres se déplacent par la moitié de la largeur de la barre par trame (2 sec). Des détails supplémentaires peuvent être trouvés dans Lee et al. 2.
- Générer un endroit (~ 0,25 °) dans le centre de l'écran sur lequel les yeux du sujet sont obsédés pendant l'expérience. Changez la couleur de la tache aléatoire dans le temps.
- Scannez le cerveau d'un sujet dans un scanner IRM utilisant un balayage d'écho-planaire-imagerie typique (PEV) qui a une durée de 192 cadres (24 cadres dans chaque sens de déplacement). Répéter les scans 4-8 fois pour augmenter le rapport signal-sur-bruit.
- Définissez les paramètres pour la séquence EPI comme suit: TR = 2 sec, TE = 40 ms, taille de la matrice = 64 x 64, 28 tranches, la taille de voxel = 3 x 3 x 3 mm 3, angle de bascule = 90 ° alternativement demander séquences avec une résolution plus fine (e.g., 2 x 2 x 2 mm 3) ou un court-TR (par exemple, 1 à 1,5 sec) ne couvrant que le cortex visuel 2.
- mouvements oculaires de la piste avec un système de eyetracker lors des analyses fonctionnelles pour assurer la fixation est maintenu à moins de 1 à 1,5 ° du point de fixation.
REMARQUE: Ici, un oculomètre-tête coordonnée basée dans un système de lunettes est utilisé, mais d'autres systèmes de eyetracker approprié peut être utilisé à la place. - Demandez aux sujets pour fixer la tache sur le centre de l'écran généré à l'étape 1.3.2. Pour se assurer que les sujets sont fixateur, demandez-leur de signaler les changements de couleur du point de fixation.
- Obtenir scans anatomiques, à 1 x 1 x 1 mm de résolution 3 (par exemple, T1-MPRAGE; TR = 1900 ms, TE = 2,26 ms, 900 ms = TI, angle de bascule = 9 °, 176 partitions).
REMARQUE: Ces analyses anatomiques seront utilisés pour la segmentation ainsi que pour aligner les images fonctionnelles à l'anatomie dans et entre les scans. Pour un meilleur alignement entre la fonctional (EPI) des images et de l'anatomie, obtiennent également une analyse de l'anatomie inplane, avec une résolution identique à la PEV, en utilisant T1 rapide gâtés écho de gradient (SPGR) une séquence.
2. Les données de pré-traitement
NOTE: Avant d'estimer les propriétés PRF, plusieurs étapes données typique IRMf pré-traitement sont nécessaires, telles que la correction de mouvement de la tête et l'alignement des volumes fonctionnels à l'analyse anatomique. Dans cet article, tous les pré-traitement, l'estimation, l'analyse et la présentation des résultats obtenus sont effectuées en utilisant la boîte à outils open source de logiciel basé sur MATLAB VISTA LAB disponible sur le site du logiciel de VISTA. http://white.stanford.edu/newlm/index.php/Main_Page.
- Chargez l'analyse anatomique dans MATLAB et préparer une anatomie de volume à l'aide d'une fonction appelée createVolAnat.
- Segment Matière grise, matière blanche, et le LCR en utilisant la fonction "ItkGray".
- Préparer les données fonctionnelles en convertissant DICOM (c. , format de fichier IRM première pour Siemens) en fichiers nifti (c.-à-format de fichier de l'IRM fonctionnelle standard), et les données de charge dans Vista en utilisant une fonction appelée mrInit.
- Corriger tête mouvement et aligner des images fonctionnelles à l'anatomie chargé dans l'étape 2.1 en utilisant rxAlign basée sur une matrice de transformation affine.
- Scans de mouvement corrigée fonctionnels moyens pour améliorer le rapport signal-sur-bruit en cliquant mrVISTA Analyse TimeSeries moyenne tseries. Exclure des analyses en moyenne au cours de laquelle les mouvements oculaires se écarte de fixation plus de 1 à 1,5 °. Si les signaux de différentes pistes ont différents dc-dérives, analyses fonctionnelles moyens après la suppression des dérives à courant continu.
- Calculer coordonne la correspondance entre les analyses fonctionnelles et matière grise et d'identifier les correspondants voxels matière grise dans les analyses fonctionnelles en sélectionnant les menus suivants: mrVISTA fenêtre ouverte gris trois-fenêtre d'affichage. Affecter des signaux gras dans les voxels de matière grise par interpolation, en choisissant l'une des options unvailable dans mrVISTA.
3. Estimation de pRF Topographie et Parametric Modeling
- Télécharger les fichiers de code via le lien suivant: https://sites.google.com/site/leesangkyun/prf/codes.zip, extraire le fichier compressé et les placer dans un lieu privilégié de l'ordinateur local. Ajoutez le chemin du dossier dans MATLAB.
- Réglez les paramètres de stimulation utilisés dans l'expérience en sélectionnant les menus suivants: Analyse mrVISTA rétinotopique modèle figurant Paramètres. Spécifiez les paramètres suivants tels que des images de relance, la taille de relance, la fonction hémodynamique canonique, le taux du scanner IRMf de cadre.
- Avant l'estimation PRF préparer des jeux de paramètres initiaux (figure 1B).
- Définissez les ensembles de validation croisée dans "tprf_set_params.m" des fichiers de code. timeseries Divisez en au moins deux sous-ensembles (un jeu pour les tests et les jeux restants pour la formation) qui sont assez longues pour que la barre Sweep l'espace de relance entier. Alternativement, sans moyenne scans à l'étape 2.4, de valider les analyses en laissant de côté un balayage pour les tests et en utilisant les analyses restantes pour la formation.
- Définir un ensemble de paramètres grossier (λ à la figure 1; λ = [10 -2 10 -1 1 10 1 10 2]) dans "tprf_set_params.m". Ensuite, définissez une plage fine échelle ([0,1 0,3 0,5 0,7 0,9 1 3 5 7 9]) dans "tprf_set_params.m".
NOTE: Le programme utilise la grossière SET pour sélectionner les λ résultant dans la variance expliquée plus haut. Ensuite, le programme recherche l'espace autour du λ sélectionné en utilisant la gamme de fine échelle, pour affiner la sélection de λ qui donne la variance expliqué plus haut. - Fixer un seuil (0,2) de la variance expliquée pour voxels visuellement sensibles dans "tprf_set_params.m".
NOTE: Ce seuil est utilisé comme référence pour la sélection de voxels visuellement sensibles. Sinon, faire uneUn retour sur investissement pour non-voyants région sensible (par exemple, en traçant une sphère avec un rayon de 1 cm dans une région du cerveau réagissant visuellement non), où le seuil peut être calculée automatiquement. - Définir un ensemble de seuils ([0,3, 0,5, 0,7]) pour définir la région du centre pRF dans la topographie normalisée "tprf_set_params.m" (ce est à dire, [0-1] ou [-1 à 1] avec les époques sans stimulation de bar à l'étape 1.3.1).
NOTE: De l'ensemble des seuils du programme prévu sélectionne le "meilleur" seuil, ce est à dire le seuil qui définit une région centrale pRF pour laquelle le modèle de centre pRF explique le plus grand signal de variance. Vous pouvez également choisir un autre ensemble de valeurs de seuil en fonction des caractéristiques de la topographie.
- Exécuter "tprf_runpRFest.m" calculer la topographie pRF (Figure 1) et se adapter à une gaussienne 2D anisotrope. Après avoir spécifié tous les paramètres décrits dans ce protocole, etl'exécution du code, obtenir les résultats définitifs d'estimation.
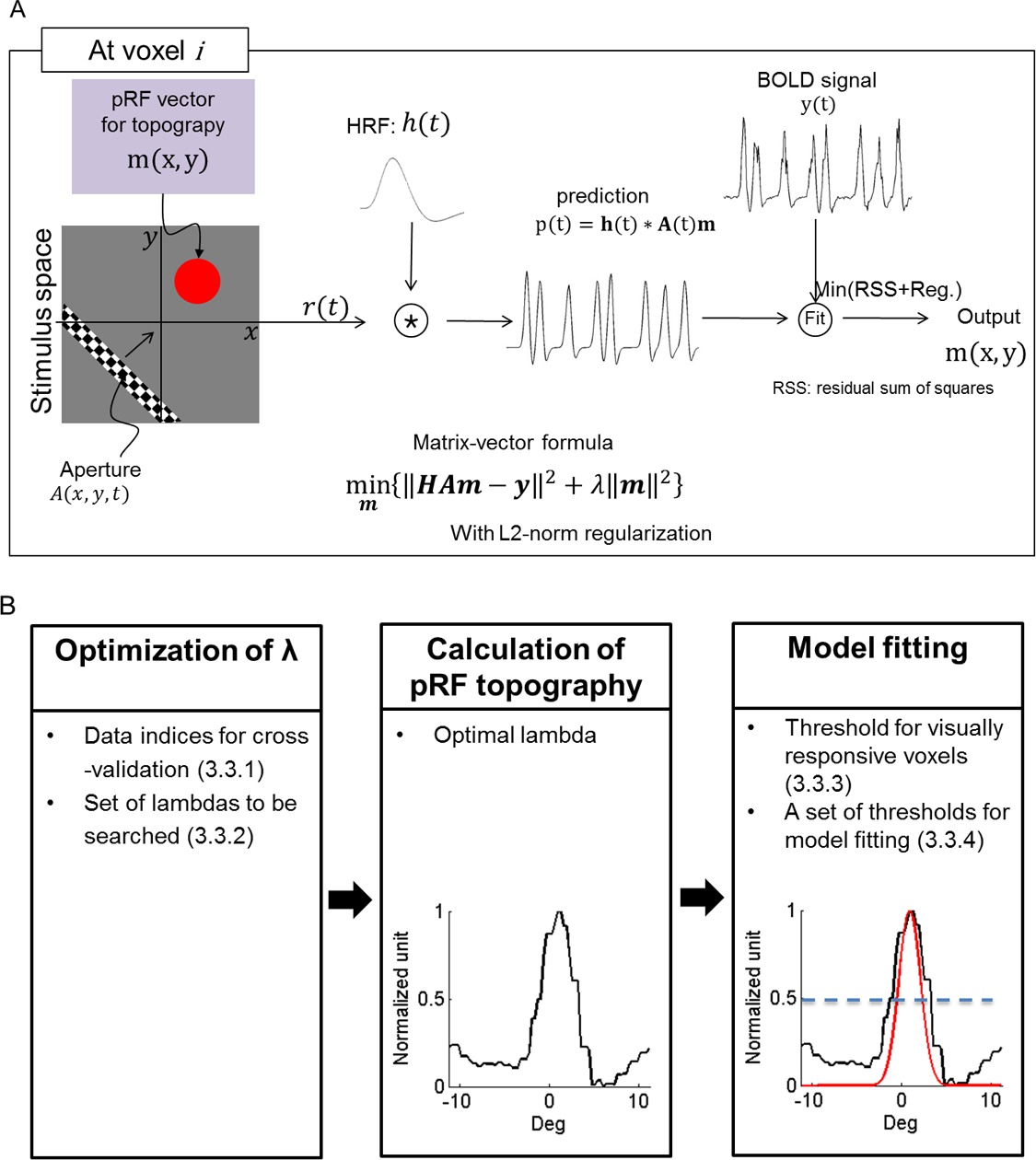
Figure 1: processus d'estimation PRF. (A) Représentation schématique du processus suivi pour pRF topographie estimation h (t):. Fonction de réponse hémodynamique, A (t): relance, m: pRF, Reg:. Norme L2 régularisation (B) Des mesures spécifiques pour pRF topographie estimation et pRF modélisation de centre. L'ensemble des paramètres nécessaires à l'estimation est listé dans chaque étape. Une section unidimensionnelle de la topographie et son modèle sont illustrés. Sous courbes "ajustement du modèle", noires et rouges représentent la topographie et de son modèle de centre pRF avec un seuil de centre de 0,5, respectivement. La ligne pointillée bleue indique un seuil pour la pRFrégion centrale.
Résultats
PRF modélisation précise nécessite la capture formes PRF correctement. Sans connaître la topographie pRF, la sélection de modèles à symétrie circulaire utilisée dans les études antérieures 1,9-11 est un choix raisonnable. Ce est parce que, si l'organisation rétinotopique locale est homogène dans toutes les directions de champ visuel, une réponse de la population locale pourrait être représenté comme un agrégat cumulatif symétrie circulaire des réponses neuronales. Cependant, nos observ...
Discussion
Cet article montre comment estimer la topographie de la population visuels champs récepteurs dans le cortex visuel humain et comment l'utiliser pour sélectionner un modèle paramétrique appropriée pour le champ récepteur. Pour une rétinotopie succès, un protocole de stimulation appropriée et une méthode d'analyse efficaces devraient être choisis, et les paramètres expérimentaux du sujet (de mouvement et de fixation) doivent être optimisés. Bar stimuli mobiles séquentielle dans le champ visuel sont...
Déclarations de divulgation
The authors declare that they have no competing financial interests.
Remerciements
We thank the VISTA software group (Brian Wandell and associates, at Stanford).
S. S. was supported by McNair 2280403105,NEI R01-EY109272, and NEI R01-EY024019 and as HHMI Early Carrer Award. A. P. and G. K. was supported by the Max-Planck Society, G. K. was supported by the PLASTICISE project of the 7th Framework Programme of the European Commission, Contract no. HEATH-F2-2009-223524.
matériels
| Name | Company | Catalog Number | Comments |
| MRI scanner | Siemens/Philips/GE | ||
| MATLAB | The Mathworks, Inc. | http://www.mathworks.com | |
| VISTA software | VISTA software group | http://white.stanford.edu/newlm/index.php/Software | |
| PsychoToolbox | PsychoToolbox | http://psychtoolbox.org | |
| Eye Tracker (VisuaStimDigital) | Resonance Technology Inc | http://mrivideo.com/ |
Références
- Dumoulin, S. O., Wandell, B. A. Population receptive field estimates in human visual cortex. Neuroimage. 39, 647-660 (2008).
- Lee, S., Papanikolaou, A., Logothetis, N. K., Smirnakis, S. M., Keliris, G. A. A new method for estimating population receptive field topography in visual cortex. Neuroimage. 81, 144-157 (2013).
- Hastie, T., Tibshirani, R., Friedman, J. H. . The elements of statistical learning : data mining, inference, and prediction. , (2009).
- Sereno, M. I., et al. Borders of multiple visual areas in humans revealed by functional magnetic resonance imaging. Science. 268, 889-893 (1995).
- Engel, S. A., Glover, G. H., Wandell, B. A. Retinotopic organization in human visual cortex and the spatial precision of functional MRI. Cereb Cortex. 7, 181-192 (1997).
- Engel, S. A., et al. fMRI of human visual cortex. Nature. 369, 525 (1994).
- DeYoe, E. A., et al. Mapping striate and extrastriate visual areas in human cerebral cortex. Proc Natl Acad Sci U S A. 93, 2382-2386 (1996).
- Greene, C. A., Dumoulin, S. O., Harvey, B. M., Ress, D. Measurement of population receptive fields in human early visual cortex using back-projection tomography. J Vis. , (2014).
- Zuiderbaan, W., Harvey, B. M., Dumoulin, S. O. Modeling center-surround configurations in population receptive fields using fMRI. J Vis. , (2012).
- Harvey, B. M., Dumoulin, S. O. The relationship between cortical magnification factor and population receptive field size in human visual cortex: constancies in cortical architecture. J Neurosci. 31, 13604-13612 (2011).
- Haak, K. V., Cornelissen, F. W., Morland, A. B. Population receptive field dynamics in human visual cortex. PLoS One. 7, e37686 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon