Method Article
Une technique Temps différentiel coloration Couplé avec Full Gill bilatérale dénervation pour étudier ionocytes à Fish
Dans cet article
Résumé
This manuscript describes a protocol to track the re-distribution of branchial ionocytes and their innervation using a time differential staining technique coupled with full bilateral gill denervation.
Résumé
Ionocytes branchiaux (CI) sont les unités fonctionnelles pour la régulation ionique dans les poissons. Chez les adultes, ils se trouvent sur la filamenteux et épithélium lamellaire de la branchie où ils ions de transport tels que Na +, Cl - et Ca 2+ via une variété de canaux ioniques, les pompes et les échangeurs. La branchie téléostéens est extrinsèque innervé par le visage (VI), glossopharyngien (IX) et vague (X) nerfs. Les nerfs IX et X sont aussi la source extrinsèque de branchiale innervation IC. Ici, deux techniques utilisées pour étudier l'innervation, la prolifération et la distribution de circuits intégrés sont décrites: une technique de coloration différentielle de temps et une technique bilatérale pleine branchies de dénervation. En bref, les poissons rouges sont exposés à un colorant spécifique mitochondrie essentiel (par exemple, MitoTracker Rouge) qui marque (fluorescence rouge) Les circuits intégrés pré-existant. Les poissons ont été soit pu récupérer pendant 3-5 jours ou immédiatement subi une dénervation branchies bilatérale complète. Après 3-5 jours de récupération, le gmaux sont récoltées et fixées pour l'immunohistochimie. Le tissu est ensuite colorées avec un anticorps primaire α-5 (cibles Na + / K + ATPase contenant des cellules) en conjonction avec un anticorps secondaire qui marque tous les (nouveaux et pré-existante) CI vert. En utilisant l'imagerie confocale, on a démontré que CI préexistants semblent jaune (marqué avec un colorant à la fois α-5 et spécifique à la mitochondrie viable) et de nouveaux circuits intégrés sont vertes (marquée avec α-5 uniquement). Les deux techniques utilisées en tandem peuvent être appliquées pour étudier l'innervation, la prolifération et la distribution de circuits intégrés sur le filament des branchies lorsque les poissons sont exposés aux défis environnementaux.
Introduction
CI sont l'unité fonctionnelle pour la régulation ionique dans les poissons et se trouvent sur les surfaces épithéliales des filaments des branchies et des lamelles 4,6-8,10. Bien que divers sous-types ont été décrits qui possèdent des caractéristiques uniques, la plupart des circuits intégrés sont caractérisées par une forte densité de mitochondries (donc ils sont également connus en tant que cellules mitochondrie riche) et / ou une abondance de l'enzyme Na + / K + ATPase (NKA). Typiquement, ces CI maison une variété d'autres pompes, canaux ioniques et des échangeurs impliqués dans la régulation d'ions (par exemple, Na + / H + échangeur, Na + / Cl - co-transporteur, H + pompe) 2,10,11. La redistribution et la prolifération de circuits intégrés comme un mécanisme compensatoire est centrale pour le maintien de l'homéostasie ionique particulièrement en période de stress ionique (par exemple, l'exposition à l'eau d'ions pauvres) 4,8,9.
Cette étude décrit un temps de coloration différentielle TechniQue 1 à identifier ionocytes nouvellement proliféré (CI) dans les branchies des poissons. Cette technique est couplée à une dénervation bilatérale complète des arcs branchiaux. Goldfish (Carassius auratus), les espèces utilisées dans ces études, est bien adapté pour étudier la prolifération des cellules épithéliales maillants parce qu'ils ont une remarquable capacité à remodeler structurellement leurs branchies 2. Gill remodelage se réfère à la croissance ou la rétraction d'une masse cellulaire interlamellaire (ILCM) lorsque le poisson (normalement maintenu à 15 - 30 ° C) sont acclimatés à l'eau froide (<15 ° C) ou l'hypoxie, 3 respectivement. Des études antérieures utilisant le temps technique de coloration différentielle sur les poissons rouges ont mis l'accent sur la redistribution, innervation et la prolifération de circuits intégrés sur les branchies dans le contexte de branchies remodelage 4,5. Katoh et Kaneko 1 développé cette nouvelle technique pour étudier la transformation et le remplacement de circuits intégrés branchiaux dans killifish (Fundulus heteroclitus) transferred l'eau de mer (SW) à l'eau douce (FW). Dans cette étude, l'accent est mis sur la prolifération et l'innervation de circuits intégrés dans le poisson rouge acclimatés à 25 ° C.
En utilisant la technique de coloration à l'écart de temps, il a été montré que, dans le contexte de branchie remodelage, le poisson rouge maintenir un nombre constant de circuits intégrés au cours de l'exposition hypoxique et la récupération normoxique ultérieur, cependant, le pourcentage de cellules innervés a diminué tout au long de la période de récupération normoxique 5. Il a été proposé il ya plus de 70 ans que les mécanismes d'absorption ioniques dans les poissons sont sous contrôle neural 12. La branchie téléostéens est innervée par les nerfs du visage (VII), glossopharyngien (IX) et vague (X) appelés aussi les «nerfs branchiaux" 13,14. Des études menées par Jonz et Nurse (2003) sur le poisson zèbre (Danio rerio) Gill innervation ont montré que l'origine de l'innervation extrinsèque (du corps cellulaire des fibres nerveuses est extrinsèque à la branchie) ainsi que intrinsèque (corps cellulairefibre nerveuse est intrinsèque à la branchie). Les mêmes auteurs ont également démontré que les circuits intégrés branchiaux sont innervés extrinsèque 7.
Dans cette étude, la technique de coloration différentiel de temps couplé avec la pleine branchies dénervation bilatéral a été utilisé pour étudier la prolifération de circuits intégrés manquent innervation extrinsèque poissons rouges. Gill complet dénervation bilatérale se réfère à sectionner les nerfs crâniens IX et X. Ces deux approches sont possibles chez les poissons rouges parce que leur taille relativement importante (de 30 à 200 g) simplifie les procédures chirurgicales délicates et ionocytes sont facilement identifiés en utilisant des techniques immunohistochimiques standard. Dans la présente étude, les circuits intégrés ont été visualisées en utilisant un colorant vital spécifique mitochondrie (par exemple, MitoTracker Rouge) ou un anticorps primaire contre l'α-sous-unité de la Na + / K + ATPase (α-5; Developmental Studies Hybridoma Bank, Université de l'Iowa, Iowa City IA). Ce protocole fournit une métho simpled de visualiser et analyser la redistribution et la prolifération de circuits intégrés sur les branchies des poissons.
Protocole
Les deux protocoles conformes aux lignes directrices du Conseil canadien de protection des animaux (CCPA) et ont été menées avec l'approbation de l'Université Comité de protection des animaux d'Ottawa (Protocole BL-226).
1. Temps différentiel coloration Technique: mitochondrie riche Dye Bath
- Préparez 1 mM MitoTracker Rouge solution mère en dissolvant 50 pg dans 94,0 ul de diméthylsulfoxyde (DMSO à 100%). Conserver la solution d'achat d'actions dans l'obscurité à -20 ° C lorsqu'il ne est pas en cours d'utilisation. Éviter les cycles de gel / dégel.
- Préparer boîtes sombres (3-6 boîtes) avec un volume maximum de 600 ml. Remplissez les cases avec 400 ml d'eau du système (eau les poissons sont normalement tenue à) et placer une pierre de l'air dans chaque case pour fournir une source d'O 2. Obtenir poissons rouges (30-40 g) et les placer dans les boîtes avec 400 ml d'eau et une pierre à air. Après 30 min, ajouter le colorant mitochondrie riche viable pour donner des concentrations finales de 0,1 pM et 0,01% de DMSO. Baigner les poissons pendant 4 hr.
- Si ce sont des poissons de commande (ce est à dire, pas de dénervation), tourner sur les flux de l'eau pour les boîtes, permettre au colorant de débusquer et de récupérer le poisson pour la période de temps imparti dans le protocole. Les poissons sont généralement récupérés pour 3-5 jours.
- Après la période de récupération passer à la section 3: Temps différentiel coloration Technique: immunohistochimie. Si ces poissons doivent être dénervé passer à la section 2: Bilatérale pleine procédure de dénervation.
2. pleine procédure de dénervation bilatérale
- Obtenir une paire de étudiants ciseaux Vannas de printemps (courbes), une paire de pince-droites de modèle standard, une paire de pince-courbes de modèle standard, deux paires de n ° 5 forceps, une paire de rétracteurs de tissus, boules petite de coton (1 - 2 mm de diamètre), et des cotons-tiges (Q Conseils ou équivalent).
- Préparer le bain d'eau anesthésique. Tout d'abord, dissoudre 10 g de benzocaïne à un volume final de 100 mlde 99% d'éthanol pour préparer une solution de stock. Pour préparer le bain d'eau anesthésie, dissoudre 15 ml de la solution mère de benzocaïne dans 30 L d'eau du système aéré à la température requise. Aérer l'eau en plaçant un rapport air-pierre relié à une pompe à air ou une conduite d'air centrale dans le réservoir d'eau.
- Placer le poisson dans le bain d'eau anesthésique (Figure 1A).
- Une fois a cessé de respirer, placer le poisson sur une table d'opération et intuber comme le montre la figure 1B. Pour ce faire, insérer un tube dans sa cavité buccale pour irriguer les branchies avec une solution anesthésique aéré. L'irrigation des branchies se assure que le poisson est alimenté avec une quantité suffisante d'anesthésique et O 2 au cours de la procédure de dénervation. Placez le poisson afin que la tête est légèrement incliné vers le bas. Cela permet un meilleur accès à la zone située derrière le quatrième arc branchial.
- Soulevez doucement l'opercule avec la pince de modèle standard droiteset placer les écarteurs de tissus entre l'opercule et l'intérieur de la tête. Ouvrez avec précaution les écarteurs de tissus de garder l'opercule loin de la tête et de garder les branchies exposées.
- Assurez-vous que la solution anesthésique irrigue les branchies pendant cette procédure. Reposer l'enrouleur gère à côté de la tête qui donne accès à tous les quatre arcs branchiaux.
- Placez les courbes pince modèle standard entre le quatrième arc branchial et l'arrière de la tête et doucement les ouvrir pour créer une tension dans le ligament fixer le quatrième arc branchial à la tête. Avec une paire de forceps No. 5 créer une petite ouverture (2 à 3 mm) en perçant l'épithélium reliant l'extrémité dorsale des arcs branchiaux à la cavité operculaire. Faites attention de ne pas aller trop profondément car il ya le risque d'endommager un vaisseau sanguin majeur.
- Avec une petite boule de coton tenue au numéro 5 pince lentement et soigneusement élargir l'incision pour exposer la IX (glossopharyngien) et X (nerf vague) nerfs. Gratuit lenerfs de tout le tissu conjonctif à l'aide du n ° 5 forceps, en prenant également soin de ne pas endommager les vaisseaux sanguins.
NOTE: Le IX et X branchiale nerfs du poisson rouge profond repos derrière le quatrième arc branchial et sont à proximité de grands vaisseaux sanguins alimentant les arcs branchiaux. - Une fois que les nerfs ont été identifiés utiliser les ciseaux courbes de printemps pour couper soigneusement les nerfs tout en maintenant l'incision ouverte avec les courbes pince de forme standard. Après sectionnement des nerfs, retirer délicatement la pince courbes. Il ne est pas nécessaire de fermer l'incision avec des sutures, car l'épithélium est très mince et l'incision ferme habituellement sur son propre sein de 24 à 48 h. Retirer écarteur de tissus.
- Répétez la même procédure de l'autre côté de la tête.
- Mettez l'irrigation des branchies du anesthésie à l'eau aérée frais pour récupérer le poisson de l'anesthésie. Une fois les mouvements operculaires ont repris déplacer le poisson dans des cuves expérimentales de récupérer pendant au moins 24 h.
- Effectuer une procédure de «simulacre» sur un ensemble distinct de poissons. La procédure de «simulacre» implique percer l'épithélium derrière le quatrième arc branchial sans sectionner les nerfs.
3. Temps différentiel coloration Technique: immunohistochimie
- Tout d'abord, préparer paraformaldéhyde 4% (PFA) dans 1x tampon phosphate salin (PBS; 4 g PFA dans 96 ml de PBS). PFA ne se dissout pas facilement dans du PBS à température ambiante. Chauffer la solution dans un bain d'eau pour dissoudre PFA. Effectuez cette dans une hotte. Une fois PFA est en solution laisser refroidir avant de l'utiliser. Conserver à 4 ° C pendant jusqu'à deux semaines.
- Avant euthanasier les poissons et extraire le tissu des branchies, placez 3-4 ml de PFA 4% dans un flacon de scintillation pour un total de 8 flacons de scintillation (1 flacon par Gill arc). En outre, prendre un petit bateau et peser le remplir avec 1x PBS. Il sera utilisé pour laver le tissu après qu'il a été excisée. Gardez toutes les solutions sur la glace.
- Après l'exposition de colorant mitochondrie riche viableexpérience a fini, euthanasier les poissons rouges en le plaçant dans un bain d'eau avec une overdose de la benzocaïne.
- Utilisez une pince contondants pour soulever l'opercule sur un côté de la tête et ciseaux courbes à couper chaque extrémité du panier branchiale des branchies. Prenez soigneusement les branchies par les rakers utilisant le forceps émoussé et les sortir de la cavité operculaire. Laver immédiatement les branchies dans le froid de la glace 1x PBS pour éliminer l'excès benzocaïne et de sang.
- Placez les branchies excisées dans des flacons séparés (un flacon pour chaque arc branchies) remplis de 4% PFA et fixer O / N à 4 ° C.
- Après fixation, laver l'excès de PFA dans du PBS 1X et placer le tissu dans un tube à puce 2 ml remplie de 1,5 ml de 1% de Triton-X sur un agitateur pendant 6 heures à température ambiante ou O / N à 4 ° C. Cette étape perméabilise les tissus. Si l'ensemble des branchies est trop gros pour la placer dans un tube de 2 ml puis couper le tissu en sections assez petit pour tenir le tube en prenant soin de ne pas endommager les filaments.
- Préparer les dilutions d'anticorps primaires par kmxing 4 pi de la solution de réserve de chaque anticorps primaire (total de 8 pi) dans 992 pi de PBS 1x. Assurez-vous que la NKA (marque les cellules NKA-riches) et Zn-12 (étiquettes neurones) anticorps primaires ont été soulevées dans le même hôte. Ceci est important si les chercheurs décident d'identifier les sous-types spécifiques IC en même temps pendant lequel ils auront à utiliser des anticorps primaires et secondaires soulevées dans une espèce différente d'accueil.
- Retirer la solution de Triton-X et sans lavage du tissu ajouter une dilution 1: 250 (dilué dans 1 x PBS) d'un anticorps monoclonal NKA (α-5) pour détecter des cellules NKA-riche et un anticorps neuronale spécifique poisson zèbre (Zn-12) pour détecter des fibres nerveuses (anticorps primaires) et incuber sur un agitateur pendant 6 heures à température ambiante ou O / N à 4 ° C.
- Laver l'anticorps primaire 3 fois pendant 3 min chacun utilisant 1x PBS. Pour ce faire, retirez la solution d'anticorps primaire du tube par aspiration hors aide d'une pipette.
- Préparer l'anticorps secondaire à une1: 200 dilution en mélangeant 5 pi d'actions anticorps secondaire dans 995 pi de PBS 1x. Appliquer un anticorps secondaire (Alexa Fluor 488) et incuber pendant 6 heures à température ambiante ou O / N à 4 ° C sur un agitateur.
REMARQUE: MitoTracker Rouge est excité à une longueur d'onde ~ 594 nm et une fluorescence rouge. Un anticorps secondaire qui est excité à une ~ 488 nm de longueur d'onde et émet une fluorescence verte doit être utilisé pour marquer NKA et Zn-12 anticorps primaires. - Retirer l'anticorps secondaire en excès par lavage du tissu 3 fois pendant 5 minutes chacune (comme décrit à l'étape 3.7).
4. Imaging
- Après les lavages, monter le tissu sur une lame concave pour monter ensemble l'imagerie confocale de cellules et des fibres nerveuses. Pour monter le tissu, placer d'abord dans une goutte (200 ul) de 1 x PBS sur une lame de microscope plat. Cela garantit que le tissu ne se dessèchent pas.
- Séparer les hémibranchies maillants avec les micro-ciseaux courbes. Placez une goutte de PBS 1x et une goutte de milieu de montage dans une diapositive concave.
- Placez les hémibranchies séparés dans la diapositive concave avec le bord d'attaque du filament vers le haut et couvrir avec une lamelle. Tamponnez les bords de la lamelle avec du vernis à ongles afin de prévenir la lamelle de se déplacer et de déplacer le tissu. Laisser le tissu à se déposer au fond de la glissière concave de 10 à 15 minutes avant l'imagerie.
- Pour chaque arc Gill, sélectionnez six filaments maillants au hasard pour l'imagerie, la production de six images par arc branchial. Utilisez la microscopie confocale classique à l'image du tissu en prenant 1-3 um tranches optiques.
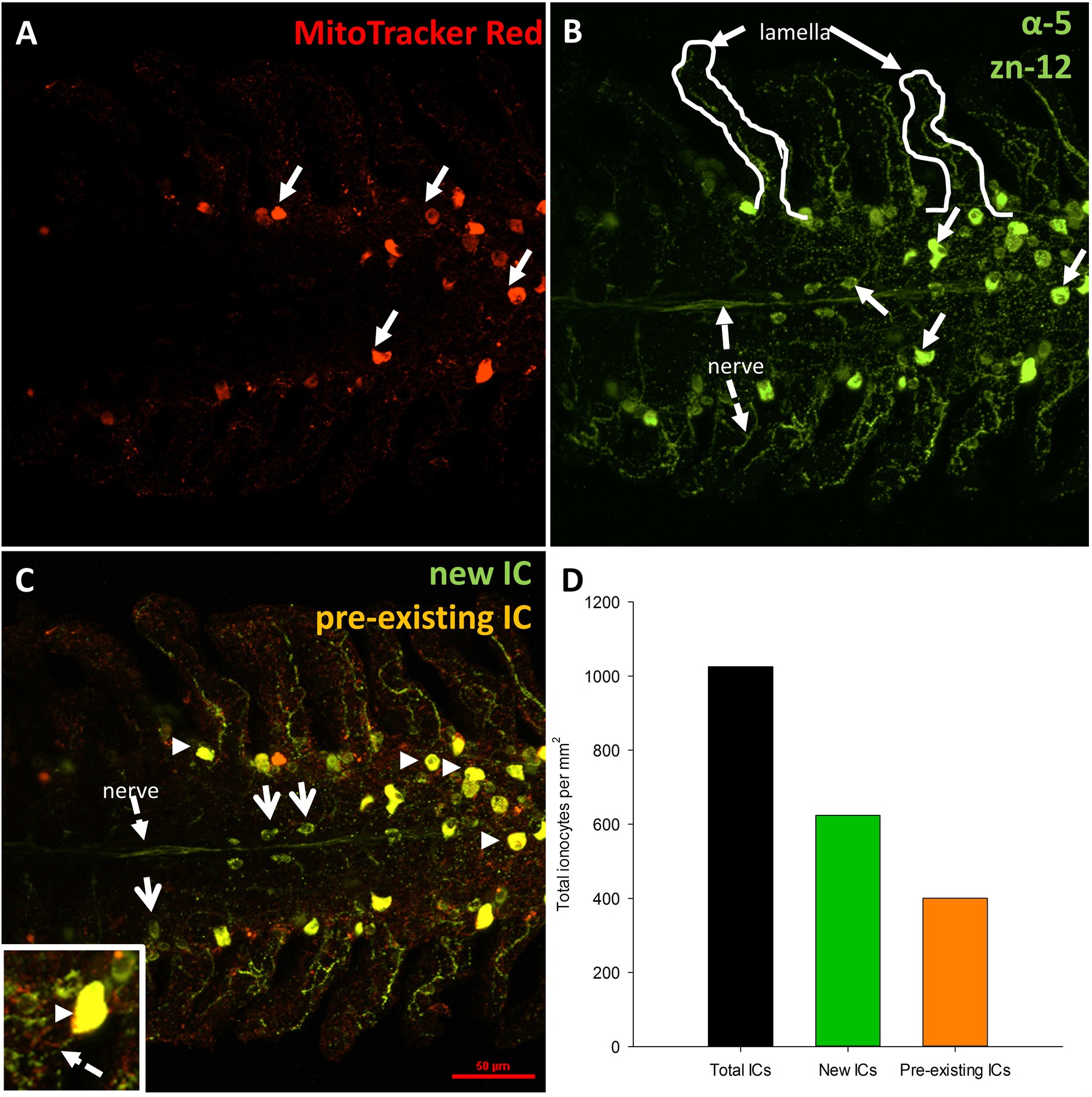
NOTE: Toutes les cellules pré-existants sera étiqueté avec MitoTracker Rouge et positif pour NKA apparaîtra jaune seulement. Les cellules qui apparaissent en rouge seulement sont des circuits intégrés pré-existante qui ne contiennent pas NKA. Toute cellule nouvellement proliféré ne sera positif pour NKA et apparaîtra vert uniquement. Les fibres nerveuses apparaissent également vert.
5. Image Analysis pour Ionocyte Quantification
- Pour each branchies filament qui a été imagé, quantifier les circuits intégrés et innervation associé en faisant défiler les sections de la pile de Z et compter le nombre de lamelles et filamenteux CI présente et si oui ou non ils sont nouvellement différenciés, pré-existant, et / ou innervée .
- Quantifier les circuits par fil ou par zone (mm 2) du filament. Pour ce faire, en utilisant les outils de dessin associés au logiciel utilisé pour acquérir les images pour décrire les lamelles du filament englobant la zone du filament dans laquelle les circuits intégrés ont été quantifiés. La plupart des logiciels d'imagerie confocale ont la possibilité de calculer la superficie d'une région décrite sur l'image. Utilisez l'option dans le logiciel d'imagerie qui vous permet de le faire pour acquérir la région.
- Diviser les CI comptés par la surface calculée par le logiciel pour obtenir une mesure de circuits intégrés par unité de surface (par exemple, par mm 2).
Résultats
La figure 1 illustre la table d'opération mis en place (figure 1A), le placement du poisson pendant la chirurgie (figure 1B) et les trois étapes les plus importantes pour le moment technique de coloration différentielle (Figure 1C). Dans l'étape 1, le poisson est conservé pendant 30 min dans un bain d'eau bien aérée à 25 ° C dans l'obscurité. Au cours de la période de 30 min, le chercheur peut préparer le colorant aliquote de mitochondrie riche en DMSO, qui est ajouté à l'eau au cours de l'étape 2 (figure 1C). La période d'incubation à l'étape 2 permet l'absorption du colorant mitochondrie riche de l'eau dans les cellules de mitochondrie riche (c.-CI). Le poisson peut alors soit subir la procédure complète bilatérale de dénervation ou d'un simulacre de procédure dans laquelle le poisson est anesthésié et l'opercule manipulé mais les nerfs restent intacts. Le mis en place à l'étape 3 représente une chambre de récupération fourni avec de l'eau courante pendant un poisson qui a either subi dénervation bilatérale complète ou une procédure de «simulacre».
Après la période de récupération, le poisson a été euthanasiés et les branchies ont été excisés et fixés pour l'immunohistochimie. La distribution globale et l'innervation de circuits intégrés sur le filament des branchies d'un poisson qui avait subi une procédure de «simulacre» est représenté dans la figure 2. Les circuits intégrés sont présents sur l'épithélium filamenteux ainsi que à la base des régions interlamellaires. Figure 2A de spectacles CI pré-existants marqués avec mitochondrie riche colorant (ce est à dire, ces circuits existaient avant les procédures dénervation / faux ont été effectuées). Figure 2B montre des fibres nerveuses innervant les circuits pré-existants et nouvellement formées (identifié par NKA immunoréactivité) de la filamenteux et épithélium lamellaire. Enfin, la fusion des deux images (figure 2C) révèle clairement les circuits pré-existants (affiche jaune) et les nouveaux circuits intégrés (apparaît en vert).La figure 2D est un graphique représentant la quantification de l'IC pour le filament représentée sur la figure 2A-C. Sur ce filament spécifique, il semble y avoir un plus grand nombre de circuits intégrés nouvellement proliféré par mm 2 de circuits pré-existante (N = 1). Pour supprimer la source d'innervation branchiale extrinsèque, les nerfs crâniens IX et X (innervation extrinsèque) ont été rompus. La figure 3A montre la région dorsale de la cavité operculaire après que les filaments maillants et les épithéliums couvrant les nerfs ont été retirés pour exposer le IX et X nerfs crâniens (indiquées en chiffres romains) qui se étendent à partir de deux grands troncs nerveux à innervent les quatre arcs (figure 3A); les arcs branchiaux sont numérotés de 1 à 4. La figure 3B-E illustrer dénervation sélective du premier arc branchial. Le premier arc branchial est innervée par les deux nerfs crâniens IX et X (figure 3B) qui peuvent être éliminés sans toucher l'innervation au reste of les arcs branchiaux (figure 3C-E). Les résultats complets de dénervation bilatéraux dans la perte progressive de l'innervation extrinsèque aux filaments maillants (figures 4A-C). poissons témoins présentent un faisceau nerveux évident qui se étend sur la longueur du filament (figure 4A). Dénervation bilatérale pleine entraîné une certaine perte de l'innervation extrinsèque après deux jours de récupération (Figure 4B). En outre disparition de l'innervation extrinsèque a été notée au bout de 5 jours de récupération de dénervation (figure 4C). Tout en restant innervation à ICS après 5 jours de récupération sans doute a été dérivé de nerfs avec les organismes cellulaires dans le filament des branchies (innervation intrinsèque; Figure 4C).

Figure 1. expérimental mis en place pour la procédure de dénervation et la séquence des étapes utilisées dans letemps technique de coloration différentielle. (A) table d'opération mis en place pour la procédure de dénervation montrant les réservoirs d'anesthésie et de récupération. (B) Exemple de la mise en place d'une anesthésié, poissons intubé. (C) étapes clés utilisés dans la technique de coloration différentiel de temps. Dans l'étape 1, le poisson est placé dans un environnement contrôlé, le bain d'eau aérée statique de la température pendant 30 min. Le colorant mitochondrie riche est ajouté à l'étape 2 à une concentration finale de 0,1 uM et on laisse le poisson de se baigner dans la solution pendant au moins 4 heures. Le débit d'eau est redémarré à l'étape 3 à quel point le poisson subit soit une dénervation bilatérale complète de la branchie ou d'une intervention chirurgicale fictive. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
 />
/>
Figure 2. Des micrographies lumière représentant le temps technique de coloration différentielle dans un poisson rouge (acclimatés à 25 ° C) deux jours après dénervation bilatéral intégral. (A) La répartition des ionocytes pré-existante (CI; flèches). Sur un seul filament des branchies est révélé par le colorant coloration de mitochondrie riche (B) La distribution de circuits intégrés (nouveaux et préexistants) et branchiaux nerfs (flèches pointillées) qui est révélé par une coloration avec des α-5 et Zn-12 d'anticorps, respectivement. Les flèches indiquent CI (C) Le chevauchement de (A) et (B) distingue CI préexistantes. (Apparaîtra jaune; indiquées par des flèches) de circuits intégrés nouvellement proliféré (apparaît en vert; indiquées par des flèches). Pièce d'insert en (C) est un agrandissement d'une ionocyte préexistante innervé. (D) du graphe représentatif de quantification IC pour le filament représenté sur les panneaux (AC). N bar = 1. Echelle dans le panneau (C) est de 50 um et se applique à tous les panneaux./ftp_upload/52548/52548fig2highres.jpg "target =" _ blank "> Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
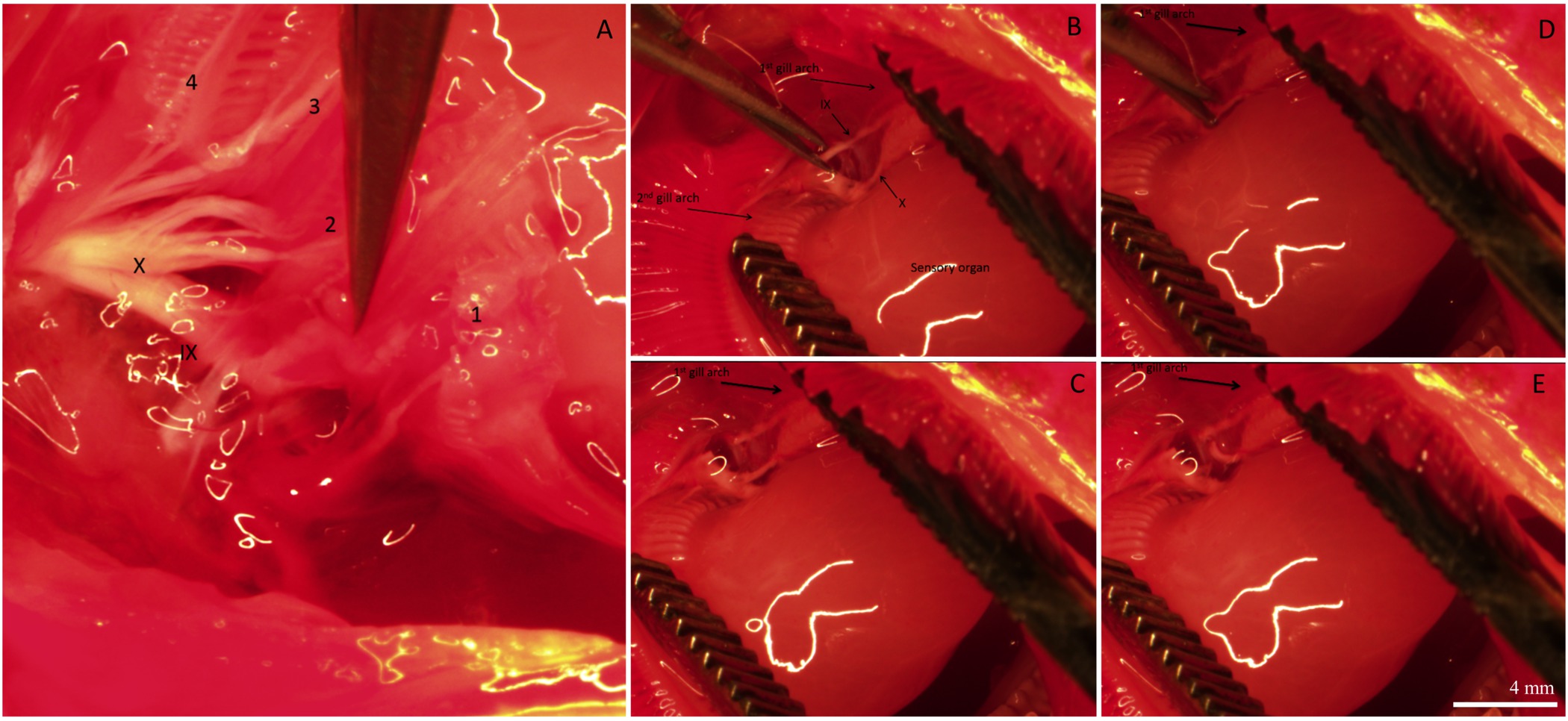
Figure 3. Des images représentatives illustrant différentes étapes de l'innervation des branchies. Vue (A) dorsale de la cavité buccale montrant les nerfs crâniens IX et X innervant tous les quatre branchies arches. Arches Gill sont numérotés 1-4. Les filaments des branchies et le tissu qui recouvre les nerfs ont été enlevés afin de mieux visualiser l'innervation. (B) le 1 er et 2 arches e maillants sont séparés de révéler l'organe sensoriel et les branches des nerfs crâniens IX et X innervant le 1 er Gill Arch. (CE) Séquence d'images montrant la dénervation sélective du 1 er branchies arc en coupant les branches des nerfs crâniens IX et X. Pour un nouveau schémaprésentation des branchies innervation des poissons téléostéens, reportez-vous à la figure 1 dans Milsom et al 26 Les lignes blanches dans les images sont réflexion de l'eau des lumières de microscope. ils ne définissent pas de structure morphologique. La barre d'échelle dans le panneau (E) est de 4 mm et se applique à tous les panneaux. Se il vous plaît cliquer ici pour voir une version plus grande de cette figure.
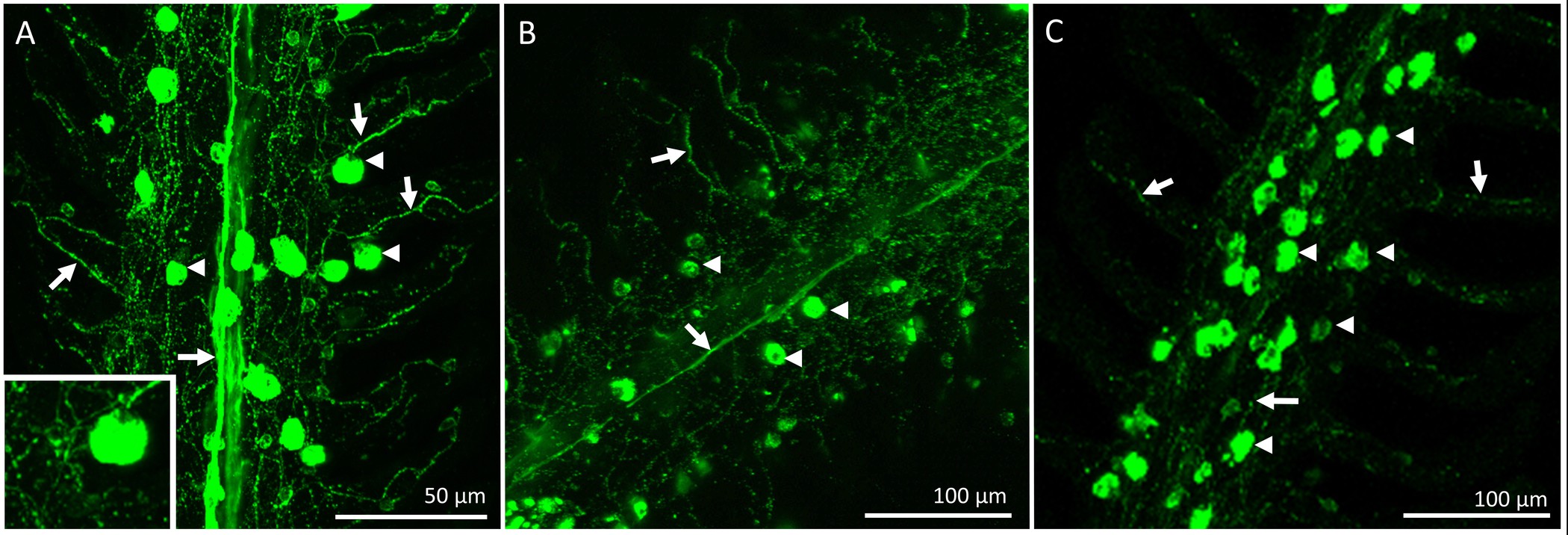
Figure 4. microscope optique représentant la distribution et l'innervation des ionocytes sur un filament unique du 1 er arc branchial d'un poisson rouge acclimatés à 25 ° C ionocytes (indiqué par des flèches) ont été colorées avec l'anticorps et les nerfs α-5 (indiqué bflèches y) ont été colorées avec l'anticorps zn-12. (A) Gill filament d'un poisson de contrôle montrant un faisceau nerveux central provenant vraisemblablement des nerfs IX et X (innervation extrinsèque) ayant une vaste lamellaire ramification. Certains des ionocytes indiquées sont également innervés (insert). (B) Un filament des branchies deux jours après dénervation bilatérale complète. Il y avait une réduction du nerf faisceau central tandis que l'innervation lamellaire est apparu en grande partie intact. (C) Un filament des branchies cinq jours après dénervation bilatérale complète démontrant que innervation extrinsèque était largement absent. L'analyse qualitative suggère que dénervation bilatérale complète entraîne une dégradation de l'innervation extrinsèque maillant tout en maintenant les nerfs avec des corps cellulaires dans le filament des branchies (innervation intrinsèque) la création d'un réseau de nerfs à travers le filament et en lamelles. Se il vous plaîtcliquez ici pour voir une version plus grande de cette figure.
Discussion
La technique de coloration différentiel de temps peut être un outil utile pour comprendre la régulation dynamique de l'absorption d'ions et d'examiner la redistribution temporelle de circuits intégrés dans l'épithélium des branchies. Bien qu'une procédure simple, il existe un certain nombre de points essentiels qui sont essentiels pour le succès de la technique de coloration à l'écart de temps. Le poisson rouge doit être exposé à la teinture de mitochondrie riche pour le temps imparti dans le protocole. Expositions plus courtes seront entraîner une mauvaise absorption du colorant par les cellules de mitochondrie riche (c.-à-ionocytes). Lors de la fixation, le tissu des branchies doit être excisée rapidement et maintenu dans l'obscurité pour éviter photo blanchiment. Le tissu doit être traité pour l'imagerie dans les 2 semaines de fixation. Pendant le nerf procédure de sectionnement bilatérale se assurer que le poisson est bien anesthésié; les nerfs et les vaisseaux sanguins sont clairement identifiés; et le poisson reprendra sa fonction operculaire complète avant d'être déplacé vers un réservoir de récupération.
"> L'environnement FW présente poisson avec le double défi d'équilibrer les pertes d'ions passifs et le gain de l'eau osmotique 14. L'équilibrage des pertes d'ions passifs se fait par l'absorption active de sel à travers les circuits intégrés qui sont localisés à l'filamenteux et épithélium lamellaire où ils peuvent établir un contact direct avec l'environnement extérieur 2,4,8,9,16. Cependant, l'emplacement des circuits intégrés sur les branchies ne est pas statique. Au cours des trois dernières décennies un certain nombre d'études ont montré que plusieurs espèces de poissons FW, face avec un défi ionique et / ou de la température, de redistribuer CI branchiaux du filament ou de la base de la lamelle vers les régions plus distales de la lamelle 1,2,4,5,17-21. Cette redistribution peut augmenter l'épaisseur des lamelles qui peut compromettre le transfert de gaz (O 2, CO 2) dans l'épithélium de branchie 22. Les chercheurs ont utilisé la technique de coloration différentiel de temps décrit dans ce manuscrit pour suivre la relocalisation et emergence de nouveaux circuits intégrés sur l'épithélium des branchies sous ces différentes conditions expérimentales (figure 1C) 1,4,5.Les branchies, et sans doute les circuits intégrés de branchies, sont innervés par les nerfs crâniens IX et X 7,23-25. Ces nerfs transportent à la fois efférente et afférences vers et depuis le maillant, respectivement. Ils sont situés à la face dorsale de la cavité buccale derrière la 4 e arc branchial. L'accessibilité des nerfs et la facilité avec laquelle la procédure de dénervation bilatérale peut être effectué est spécifique à l'espèce. Chez la truite, par exemple, l'anatomie pointue et aplatie de la tête permet aux nerfs de se coucher dans un seul plan derrière la 4 e arc branchial sous une mince couche de tissu. Cela rend les nerfs visible et facilement accessible au chercheur pour effectuer la procédure de dénervation. En revanche, les poissons rouges ont un museau plus court et une tête plus ronde. Les nerfs crâniens IX et X de poissons rouges sont plus profondes dans le SI dorsalede de la cavité après la 4 e arc branchial occupant des plans différents. Cette orientation limite la facilité d'accès aux nerfs et nécessite une approche plus prudente pour identifier et séparer les nerfs appropriées. Le but de la procédure de dénervation est de supprimer afférentes et efférentes entrée sensorielle et de la branchie respectivement. Dénervation des arcs branchiaux peut également être couplé avec des expériences de flux ionique utilisant des radio-isotopes (par exemple, 22 Na). Ces techniques peuvent être utilisées en tandem pour étudier la contribution des influx nerveux sur le mouvement des ions à travers l'épithélium de branchie. Une autre limitation à la procédure de dénervation est l'incapacité à faire la distinction entre les neurones sensoriels et moteurs, ainsi lorsque sectionner le faisceau nerveux, il est possible que les deux types d'innervation sont retirés. Séparation des neurones moteurs peut affecter le mouvement des opercules des branchies et des poissons. Ainsi, lorsque la réalisation d'expériences de dénervation maillants il est important de surveiller également la ventilation après lapoisson a récupéré de la procédure pour se assurer que la circulation des branchies suffisante pour le gaz et l'échange d'ions.
Les protocoles décrits dans cette utilisation manuscrits animaux adultes tenus en 12h12 cycle de lumière: sombre et nourris avec des granulés alimentaires commerciaux. Ces procédés peuvent être modifiés de plusieurs façons. Tout d'abord, la période de récupération après une exposition de colorant mitochondrie riche peut être ajustée aux exigences de protocole du chercheur (par exemple, 1, 3, 5, ou 14 jours). La plus longue période de récupération après l'exposition de colorant mitochondrie riche en laboratoire a été 14 jours 4,5. Il n'y avait pas de diminution significative de l'intensité de la fluorescence du colorant mitochondrie riche après 14 jours de récupération. Deuxièmement, l'utilisation de l'anticorps primaire α-5 est limité à l'identification de cellules NKA-riche et ne distingue pas entre les différents sous-types de circuits intégrés de branchies. Heureusement, chez les poissons rouges il a été établi que la majorité des circuits intégrés sont deux mitochondrriche en ions (étiquette avec MitoTracker) et NKA riche (étiquette avec α-5) des cellules qui peuvent ne pas être le cas dans toutes les espèces de poissons 4,27. Les expériences futures peuvent se concentrer sur la suite de la redistribution temporelle de sous-types de circuits intégrés spécifiques en utilisant des anticorps dirigés spécifiquement contre une variété de canaux, pompes et les échangeurs (par exemple, NHE, H + pompe). Des études antérieures ont constaté que la majorité des ionocytes colorées avec un colorant exposition mitochondrie riche NKA immunoréactivité 4. Innervation du CI peut être détectée en utilisant un anticorps primaire contre l'antigène spécifique de neurones dérivés de poisson zèbre (Zn-12). Dans cette étude, α-5 et Zn-12 anticorps primaires ont été détectées en utilisant le même anticorps secondaire (Alexa Fluor 488) pour les deux. Cette limitation est due à la fois des anticorps primaires élevés dans une souris hôte et est surmonté par le fait que les cellules riches en NKA et les neurones peuvent être distingués morphologiquement même si elles émettent une fluorescence de la même couleur. Coloration séquentielleavec différents anticorps secondaires (par exemple, première α-5 avec Alexa Fluor 488 puis Zn-12 avec Alexa Fluor 594) peut également être utilisé pour éliminer le problème d'avoir deux marqueurs fluorescents de la même couleur. Enfin, le protocole bilatéral pleine nerf de sectionnement peut être modifié pour cibler les nerfs à arches maillants spécifiques. Par exemple, le sectionnement des nerfs sélective peut être effectuée sur le premier arc branchial en séparant doucement les premier et deuxième arcs branchiaux pour exposer les nerfs menant au premier arc branchial à la fin dorsale du panier branchies (Figure 2B-E). La technique de différence de temps peut également être appliquée pour étudier la distribution des ionocytes dans le poisson poisson zèbre larves mesure qu'ils se développent et les transitions de transport d'ions de la peau pour les branchies.
Déclarations de divulgation
The authors declare that they have no competing financial interests.
Remerciements
We would like to thank William Fletcher for animal care at the University of Ottawa. The authors would also like to thank Dr. William Milsom for teaching VT the full bilateral denervation technique at the University of British Columbia. A travel grant for this research was provided by the Faculty of Graduate and Postgraduate Studies at the University of Ottawa. This research is also supported by NSERC PGS-D scholarship to VT and Discovery Grants Program to SFP.
matériels
| Name | Company | Catalog Number | Comments |
| MitoTracker Red | Life Technologies | M-7512 | |
| Dimethyl sulfoxide | Sigma Alrdich | D2650 | |
| α-5 primary antibody | Develompental Hybridoma Bank | a5 | |
| zn12 primary antibody | Develompental Hybridoma Bank | zn12 | |
| Alexa Fluor 488 (anti mouse) | Life Technologies | A-11001 | |
| Benzocaine | Sigma Alrdich | E1501 | 4-aminobenzoic acid ethyl ester, ethyl 4-aminobenzoate |
| Vannas spring scissors | Fine Science Tools | 15000-10 | |
| Standard pattern forceps | Fine Science Tools | 11000-12 | straight |
| Standard pattern forceps | Fine Science Tools | 11001-12 | curved |
| Dumont No. 5 forceps | Fine Science Tools | 11252-30 | |
| Tissue retractor | Fine Science Tools | 17009-07 | |
| Paraformaldehyde | Sigma Alrdich | P6148 | |
| Triton X | Sigma Alrdich | X100 | |
| Vectashield with DAPI | Vector Laboratories | H-1200 |
Références
- Katoh, F., Kaneko, T. Short-term transformation and long-term replacement of branchial chloride cells in killifish transferred from seawater to freshwater, revealed by morphofunctional observations and a newly established 'time-differential double fluorescent staining' technique. J. Exp. Biol. 206 (22), 4113-4123 (2003).
- Perry, S. F. Relationships between branchial chloride cells and gas transfer in freshwater fish. Comp. Biochem. Physiol. A. Mol. Integr. Physiol. 119 (1), 9-16 (1998).
- Sollid, J., Weber, R. E., Nilsson, G. E. Temperature alters the respiratory surface area of crucian carp Carassius carassius and goldfish Carassius auratus. J. Exp. Biol. 208 (6), 1109-1116 (2005).
- Mitrovic, D., Perry, S. F. The effects of thermally induced gill remodeling on ionocyte distribution and branchial chloride fluxes in goldfish (Carassius auratus). J. Exp. Biol. 212 (6), 843-852 (2009).
- Tzaneva, V., Vadeboncoeur, C., Ting, J., Perry, S. F. Effects of hypoxia-induced gill remodelling on the innervation and distribution of ionocytes in the gill of goldfish, Carassius auratus. J. Comp. Neurol. 522 (1), 118-130 (2014).
- Greco, A. M., Fenwick, J. C., Perry, S. F. The effects of soft-water acclimation on gill structure in the rainbow trout Oncorhynchus mykiss. Cell Tissue Res. 285 (1), 75-82 (1996).
- Jonz, M. G., Nurse, C. A. Epithelial mitochondria-rich cells and associated innervation in adult and developing zebrafish. J. Comp. Neurol. 497 (5), 817-832 (2006).
- Laurent, P., Hebibi, N. Gill morphometry and fish osmoregulation. Can. J. Zool. 67 (12), 3055-3063 (1989).
- Perry, S. F., Laurent, P. Adaptational responses of rainbow trout to lowered external NaCL concentration: contribution of the branchial chloride cell. J. Exp. Biol. 147, 147-168 (1989).
- Evans, D. H., Piermarini, P. M., Choe, K. P. The multifunctional fish gill: dominant site of gas exchange, osmoregulation, acid-base regulation, and excretion of nitrogenous waste. Physiol. Rev. 85 (1), 97-177 (2005).
- Hwang, P. P., Lee, T. H., Lin, L. Y. Ion regulation in fish gills: recent progress in the cellular and molecular mechanisms. Am. J. Physiol. Regul. Integr. Comp. Physiol. 301 (1), R28-R47 (2011).
- Krogh, A. The Active Uptake of Ions into Cells and Organisms. Proc. Natl. Acad. Sci. U. S. A. 25 (6), 275-277 (1939).
- Nilsson, G. E., Randall, D. J., Hoar, W. S. Innervation and pharmacology of the gills. Fish Physiology. , 185-272 (1984).
- Sundin, L., Nilsson, S. Branchial innervation. J. Exp. Zool. 293 (3), 232-248 (2002).
- Dymowska, A. K., Hwang, P. P., Goss, G. G. Structure and function of ionocytes in the freshwater fish gill). Respir. Physiol. Neurobiol. 184 (3), 282-292 (2012).
- Witters, H., Berckmans, P., Vangenechten, C. Immunolocalization of Na+/K+-ATPase in the gill epithelium of rainbow trout, Oncorhynchus mykiss. Cell Tissue Res. 283 (3), 461-468 (1996).
- Bindon, S., Fenwick, J. C., Perry, S. F. Branchial chloride cell proliferation in the rainbow trout, Onchorhynchus mykiss: implications for gas transfer. Can. J. Zool. 72 (8), 1395-1402 (1994).
- Bradshaw, J. C., Kumai, Y., Perry, S. F. The effects of gill remodeling on transepithelial sodium fluxes and the distribution of presumptive sodium-transporting ionocytes in goldfish (Carassius auratus). J. Comp. Physiol. B. 182 (3), 351-366 (2012).
- Chou, M. Y., et al. Effects of hypothermia on gene expression in zebrafish gills: upregulation in differentiation and function of ionocytes as compensatory responses. J. Exp. Biol. 211 (19), 3077-3084 (2008).
- Kaneko, T., Katoh, F. Functional morphology of chloride cells in killifish Fundulus heteroclitus, a euryhaline teleost with seawater preference. Fisheries Science. 70 (5), 723-733 (2004).
- Ouattara, N., et al. Changes in gill ionocyte morphology and function following transfer from fresh to hypersaline waters in the tilapia Sarotherodon melanotheron. Aquaculture. 290 (1-2), 155-164 (2009).
- Bindon, S., Gilmour, K., Fenwick, J., Perry, S. The effects of branchial chloride cell proliferation on respiratory function in the rainbow trout, Oncorhynchusmykiss. J. Exp. Biol. 197 (1), 47-63 (1994).
- Dunel-Erb, S., Bailly, Y., Laurent, P. Pattern of gill innervation in two teleosts, the perch and the trout. Can. J. Zool. 71, 18-25 (1993).
- Jonz, M. G., Nurse, C. A. New developments on gill innervation: insights from a model vertebrate. J. Exp. Biol. 211 (15), 2371-2378 (2008).
- Jonz, M. G., Zaccone, G. Nervous control of the gills. Acta Histochem. 111 (3), 207-216 (2009).
- Milsom, W. K., Reid, S. G., Rantin, F. T., Sundin, L. Extrabranchial chemoreceptors involved in respiratory reflexes in the neotropical fish, Colossoma macropomum (the tambaqui). J. Exp. Biol. 205 (12), 1765-1774 (2002).
- Hwang, P., Lee, T. New insights into fish ion regulation and mitochondrion-rich cells. Comp Biochem Physiol A Mol Integr Physiol. 148 (3), 479-497 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon