Method Article
Mise en place d'un segmentaire fémoral Critical-size Defect modèle chez la souris Stabilisé par Plate ostéosynthèse
Dans cet article
Résumé
Although mouse models are invaluable tools for bone tissue engineering, models of long bone defects are sparse. This need motivated development of the present protocol which uses a locking plate with four screws and a dedicated jig to perform and stabilize a reproducible, femoral, critical-size defect with low morbidity.
Résumé
The use of tissue-engineered bone constructs is an appealing strategy to overcome drawbacks of autografts for the treatment of massive bone defects. As a model organism, the mouse has already been widely used in bone-related research. Large diaphyseal bone defect models in mice, however, are sparse and often use bone fixation which fills the bone marrow cavity and does not provide optimal mechanical stability. The objectives of the current study were to develop a critical-size, segmental, femoral defect in nude mice. A 3.5-mm mid-diaphyseal femoral ostectomy (approximately 25% of the femur length) was performed using a dedicated jig, and was stabilized with an anterior located locking plate and 4 locking screws. The bone defect was subsequently either left empty or filled with a bone substitute (syngenic bone graft or coralline scaffold). Bone healing was monitored noninvasively using radiography and in vivo micro-computed-tomography and was subsequently assessed by ex vivo micro-computed-tomography and undecalcified histology after animal sacrifice, 10 weeks postoperatively. The recovery of all mice was excellent, a full-weight-bearing was observed within one day following the surgical procedure. Furthermore, stable bone fixation and consistent fixation of the implanted materials were achieved in all animals tested throughout the study. When the bone defects were left empty, non-union was consistently obtained. In contrast, when the bone defects were filled with syngenic bone grafts, bone union was always observed. When the bone defects were filled with coralline scaffolds, newly-formed bone was observed in the interface between bone resection edges and the scaffold, as well as within a short distance within the scaffold.
The present model describes a reproducible critical-size femoral defect stabilized by plate osteosynthesis with low morbidity in mice. The new load-bearing segmental bone defect model could be useful for studying the underlying mechanisms in bone regeneration pertinent to orthopaedic applications.
Introduction
Massive défauts osseux diaphysaires sont un grand défi pour le chirurgien orthopédiste. remplacement d'os avec greffe osseuse autologue, actuellement considéré comme le traitement de l'étalon-or, est en quantité limitée et est associée à une morbidité liées à la récolte. Pour toutes ces raisons, les constructions osseuses de l'ingénierie tissulaire combinant des cellules souches mésenchymateuses de moelle osseuse avec échafauds ostéoconducteur ont été explorés comme une alternative pour les autogreffes dans la chirurgie orthopédique.
À ce jour, la plupart des études ont été réalisées dans des modèles animaux cliniquement pertinents , tels que les chiens, les porcs et les moutons 1-3, mais l' évaluation préliminaire de ces constructions dans orthotopique, segmentaire, critique de taille os défauts dans les modèles de petits animaux (comme souris) pourrait avoir plusieurs avantages: (i) de faibles charges, (ii) un grand nombre d'animaux peuvent être utilisés; (Iii) contrairement aux grands modèles animaux, l'homogénéité des souches de souris limite les variations individuelles de la résorption d'un échafaudagee formation de l'os et; (Iv) le plus important, la disponibilité d'anticorps spécifiques et les animaux de gènes ciblés permettre l'évaluation des processus biologiques impliqués dans la cicatrisation osseuse. Last but not least, l'utilisation de souches immunodéficientes de souris permet également des études en utilisant soit des greffes ou des cellules d'origine humaine sans réponses immunitaires indésirables chez les souris.
Malgré les avantages mentionnés ci-dessus, les modèles de défauts osseux diaphysaires massives chez la souris sont rares. La plupart de ces modèles utilisent fixation d'os d'une broche intramédullaire qui remplit la cavité de la moelle osseuse (limitant ainsi le volume du matériau à tester) et empêche également la reproductibilité en ne fournissant pas la stabilité en rotation et axial 2,4-7.
Les objectifs de l'étude sont (i) mimant une situation de non-union osseuse clinique, pour décrire un, critique de taille reproductible, segmentaire, modèle de défaut fémorale chez la souris, qui est stabilisée par précis et reproductible blocage plaque osteosynthesis qui fournit un environnement biomécanique très stable 8-10; (Ii) pour illustrer le présent modèle avec deux substituts osseux potentiels et de décrire les analyses formation d'os qui pourraient être utilisés.
Protocole
Déclaration d' éthique: Les souris utilisées dans la présente étude ont été traités conformément aux lignes directrices publiées par le Comité européen pour "soin et l' utilisation des animaux de laboratoire" (directive 2010/63 / UE et la Convention européenne STE 123). Le protocole expérimental a été approuvé par le comité d'éthique de la Faculté de médecine Lariboisière Saint-Louis (LCEE LV / 2010-01-04).
1. Les animaux
- Utilisez des souris athymiques (10 semaines). Utilisez un nombre minimal de 6 souris avec défaut gauche vide comme groupe témoin négatif.
2. échafauds Préparation
- Syngéniques Graft Préparation
- Utilisez isogreffe osseuse pour combler le défaut de fournir un groupe de contrôle avec un nombre minimum de 6 animaux.
- Obtenir os isogreffes par la récolte excisées os fémoral de souris appartenant soit à des «défauts laissés vides ou" défauts remplis de corail échafaudage "groupes (eest évite l'utilisation de l' animal supplémentaire pour recueillir isogreffe osseuse) 11.
- Rincer l'os réséqué avec Phosphate Buffered Saline (PBS) et le garder stérile en utilisant humide compresse de gaze.
- Coral Échafaudages Préparation
- Utilisez échafaudage qui sont faits de corail naturel: Acropora sp. cubes exosquelette corail, 3 x 3 x 3 mm en tant que substitut osseux potentiel avec un minimum de 6 animaux.
- Tailler à la main chaque cube de corail à la forme de cylindre (3,5 hauteur; 2 mm de diamètre).
- Stériliser chaque échafaudage par autoclavage (121 ° C pendant 20 min), le laver avec du PBS stérile, et immergé dans un milieu de culture complet (α-MEM) pendant 24 heures avant l'implantation chez la souris.
3. Procédures anesthésiques et analgésie
- Fournir une analgésie préventive, 15 minutes avant l'anesthésie, par injection sous-cutanée de la buprénorphine (0,1 mg / kg de poids corporel de l'animal).
- Appliquer une pommade chez l'animalles yeux pour prévenir la sécheresse toutes les 30 minutes, tandis que les animaux sont sous anesthésie.
- Placez la souris sur un coussin chauffant pour prévenir l'hypothermie.
- Anesthésie et analgésie pendant la procédure chirurgicale
- Injecter par voie intrapéritonéale d'une solution contenant de la xylazine (8 mg / kg) et de kétamine (100 mg / kg).
- Fournir de l' oxygène par l' intermédiaire d' écoulement par (50 ml / min).
- Confirmer la profondeur adéquate de l' anesthésie par la présence d' une bonne relaxation musculaire et l' absence de réponse de l' animal à un stimulus nocif (par exemple., Ferme pincée d'orteil).
- Injecter par voie sous- cutanée une dose unique de l'enrofloxacine (0,05 mg / kg) en tant que prophylaxie microbiennes.
- Analgésie post-opératoire
- Fournir une analgésie postopératoire par injection sous-cutanée de la buprénorphine (0,1 mg / kg) toutes les 12 h pendant 3 jours consécutifs.
- Anesthésie au cours des procédures d' imagerie diagnostique
- Placez les souris dans un anesthetizing-box, puis induire et maintenir une anesthésie à l'aide d'environ 4% et 2% d'isoflurane dans de l'oxygène, respectivement.
- Confirmer la profondeur adéquate de l'anesthésie par une bonne relaxation musculaire animal et le manque de mouvement.
- Conditions de récupération
- Gardez les souris sur coussin chauffant jusqu'à guérison
- Ne pas laisser un animal sans surveillance jusqu'à ce qu'il ait repris connaissance suffisante pour maintenir décubitus sternale après la chirurgie.
- Ne retournez pas un animal qui a subi une intervention chirurgicale à la compagnie d'autres animaux jusqu'à guérison complète.
- Conditions post-opératoires
- Hôte les souris séparément pendant les 3 premiers jours Hôte les souris par 4 dans des cages après jour 3.
- Fournir de l' eau et de la nourriture adaptée ad libitum. Permettre aux souris de poids-ours, sans aucune restriction d'activité pendant la période post-opératoire.
4. Intervention chirurgicale:Fémoral segmentaire Defect Modèle 11,12
- Après l'anesthésie, placez chaque souris en décubitus ventral avec le membre postérieur gauche en extension.
- Frotter la branche pour la chirurgie aseptique en utilisant 10% de povidone iode pendant 5 min, puis placez un champ stérile sous la branche pour créer une surface stérile (un drap transparent stérile est utilisé afin d'être en mesure de surveiller les mouvements respiratoires pendant la procédure). On prend soin de maintenir la stérilité du champ opératoire pendant l'opération.
- Faire 15 - incision cutanée longitudinale de 17 mm sur la face antérolatérale du fémur, l'extension de l'articulation de la hanche à l'articulation fémoro-tibiale.
- Inciser le fascia lata, diviser le muscle vastus lateralis et muscle biceps fémoral pour exposer toute la longueur de la diaphyse fémorale. Il faut être prudent pour préserver le nerf sciatique caudale et la capsule articulaire distale (figure 1).
- Pour améliorer fémorale diaphyse exposûr, recoupent le muscle fessier et biceps fémoral de la 3 ème trochanter.
- Effectuer une dissection circulaire du fémur au milieu de la diaphyse.
- Appliquer une plaque de titane micro-blocage 6 trous (10 mm de long, 1,5 mm de large, poids: 30 mg) sur le côté fémoral antérieur.
NOTE: Les trous de la plaque, qui sont en forme de cône en retrait avec une partie cylindrique, accueillir titane auto-taraudage vis de blocage (2 mm de long, diamètre extérieur de 0,47 mm, poids: 5 mg, avec inférieure de la vis à tête filetée pour permettre le verrouillage au sein le trou de la plaque), qui sont reliés à une tige qui dévisse en position verrouillée. - Percer le trou le plus proximal de la plaque à l' aide d' un foret de 0,3 mm et soit la puissance du moteur dédié ou la puissance du moteur non dédié fonctionnant à 2500 tours par minute à environ 500 mW 12).
- Insérez la première vis à l' aide d' un tournevis dédié, puis le verrouiller (Figure 2).
NOTE: Depuis l'alignement des til plaque est déterminée par application de la première vis, il est important de positionner la plaque parallèle au fémur lors de l'insertion de la vis. - Percer le trou le plus distal de la plaque de la même façon, insérer et bloquer la vis (Figure 3).
- Insérez, mais ne pas de verrou, les deux autres vis extérieures.
- Placez le fil de l'0,22 mm Gigli a vu de près autour de l'os dans une orientation médio-latérale, puis l' insérer dans les fentes du gabarit (Figure 4).
- Insérer le gabarit dédié sur la tige des deux vis et l' appliquer au- dessus de la plaque (figure 5).
- Effectuer une ostéotomie fémorale de 3,5 mm de long mi-diaphysaire en utilisant la scie de Gigli sous irrigation (en utilisant une solution saline isotonique stérile) pour éviter la nécrose thermique. Avez-assistant du chirurgien prendre le gabarit. Avoir le chirurgien applique une tension constante et régulière. Veillez à ne pas emmêler le fil de scie et d'utiliser les moyens des deux tiers du fil. Évitez exmouvement de processus afin d'obtenir une coupe osseuse droite (figure 6).
- Après l'ostéotomie, retirez la scie de Gigli. Pour éviter d'endommager les tissus mous, couper la scie de fil près de l'os d'un côté.
- Retirez le gabarit et verrouiller les deux dernières vis (figure 7).
- Soit laisser le défaut segmentaire vide ou chirurgicalement le remplir en mettant des matériaux à tester à l'intérieur du défaut.
- Abondamment rincer le champ opératoire avec une solution saline isotonique stérile.
- Placez le muscle vastus lateralis librement sur la plaque. Fermez le fascia et les avions sous-cutané en utilisant un motif de suture continue simple et 5.0 glycomère 631 suture; fermer la peau avec un motif de suture interrompue simple à l'aide 4.0 glycomère 631 suture. Alternativement, il est également possible de fermer la peau à l'aide de la colle de peau.
5. Les évaluations in vivo de régénération osseuse
- Avec les souris sous anesthésie, effectuer radiographiqueévaluations de manière longitudinale en utilisant les deux rayons X classiques (26 kV, 10 sec; 2X grossissement; résolution spatiale de 20 lignes / mm) et haute résolution micro-tomographie par ordinateur (μCT).
- Pour l' analyse μCT, d' acquérir des images à une résolution de 36 um (50 kV et 478 mA, à 40 msec de temps d'exposition, en utilisant un filtre de 0,5 mm d'aluminium, l' étape de rotation de 0,7 ° et la rotation tomographique de 180 °). Analyser les images à l'aide du logiciel résident.
6. Ex évaluations in vivo de régénération osseuse
- Dix semaines après la chirurgie, induire une anesthésie à l'isoflurane dans de l'oxygène, puis sacrifiez la souris par injection intrapéritonéale d'une dose excessive d'un barbiturique (1 ml de pentobarbital).
- Exciser les os fémoral, retirer superposant tissu musculaire, et fixer les échantillons d'os dans 4% de paraformaldehyde (pH 7,4) pendant quatre jours.
- Retirer la plaque et les vis de chaque échantillon d'os excisés après paraformaldehyde FIXAtion.
- Analyse ex vivo u CT
- Placez chaque os excisés et fixés dans des tubes en polyéthylène remplis de 75% d' alcool et analyser à l'aide ex vivo μCT.
- Acquérir des images à 80 kV et 100 pA (temps d'exposition de 1,000 msec, d' aluminium 0,5 filtre et 4 um de taille de pixel appareil photo (2400 x 4000 avec une taille de voxel de 7 um), quatre images moyennes pour chaque incrément de rotation de 0,9 °.
- Reconstruire des images à trois dimensions (taille de voxel moyenne de 13 pm) en utilisant une rétroprojection filtrée Hamming avec le logiciel résidant.
- Pour l'analyse quantitative de la formation osseuse, utiliser un logiciel résident pour obtenir le volume des tissus minéralisés (seuil inférieur gris de 45 indices de niveaux de gris et gris seuil supérieur de 240 indices en niveaux de gris) dans une région déterminée et cohérente d'intérêt correspondant au défaut.
- Effectuer des analyses de la même manière pour chaque souris avec le même region d'intérêt.
- Utilisez le test d'une manière analyse (intervalle de confiance - à 95% et le niveau significatif à p <0,05) pour comparer le taux de syndicalisation des os et le volume des tissus minéralisés dans la région d'intérêt entre les groupes.
- L' analyse histologique
- Intégrer chaque excisée et fixé os fémoral en résine de méthacrylate de méthyle et le traiter pour l'histologie décalcifié.
- Couper chaque échantillon d'os de la longueur en section épaisse (200 um) en utilisant une scie circulaire de diamant refroidi à l'eau.
- Broyer chaque section de l'échantillon d'os jusqu'à une épaisseur de 100 um, polir, et tacher à l'aide STEVENEL taches de picrofuchsin bleu et van Gieson.
NOTE: Après coloration, les cellules apparaissent en bleu, l'os en rose, et le corail en brun en microscopie optique.
Résultats
Les interventions chirurgicales mentionnées ci-dessus ont duré entre 45 et 60 min. Ostectomy et ostéosynthèse étaient faciles à réaliser avec l'aide de l'assistant d'un chirurgien, mais sans utiliser le système grossissant. Pas de complications peropératoires ont eu lieu. Dans une étude préliminaire sur 18 souris 11, radiographies post - opératoires ont fourni des preuves que la longueur du défaut osseux (3,43 ± 0,12 mm) et le positionnement de la plaque (distance entre la cavité articulaire étouffer et la partie distale de la plaque = 2,65 ± 0,56 mm) étaient reproductibles.
Le taux de mortalité liée à l'anesthésie était d'environ 5%.
La récupération fonctionnelle du membre opéré a été excellent dans tous les animaux et de poids-roulement complète a été observée dans un jour après la chirurgie (animée Figure 1). Le poids de l'ostéosynthèse (plaque et des vis) utilisé dans la present étude était d'environ 0,1% du poids corporel de la souris. Aucune complication postopératoire (par exemple, infection de la plaie, échec implant, l' os migration de greffe, etc.) se sont produites. Pas automutilation ou de blessures causés par compagnons de cage ont eu lieu.
Lorsque les défauts osseux chirurgicalement induites ont été laissées vides, aucune formation osseuse significative n'a été observée avec l'os cohérente non-union. Par contre, lorsque les défauts ont été remplis avec soit une isogreffe ou un échafaudage de corail, os nouvellement formé étendant à partir de l'extrémité proximale et distale des bords de l'os a été observée. En outre, alors que la formation osseuse a permis le rétablissement de la continuité de l' os dans la plupart des défauts traités avec isogreffes (figure 8), il a été observé que l' intérieur de l'échafaudage de corail dans les défauts remplis avec ce matériau. En fait, aucun osseuse n'a été observée à une distance supérieure à 1 mm des bords osseux. Absence de cartilage dans toutes les analyses histologiques résultats fournis preuve de lala stabilité de l'ostéosynthèse obtenue (figure 9, figure 10).
Radiographies et microCT analyses ont fourni des preuves que l'union des os ne se produit pas chez un animal du groupe de défauts gauche vide, 10 semaines après l'implantation. Le volume de tissu minéralisé évaluée par des analyses de microCT était de 0,8 ± 0,3 mm 3 et est représentatif de l'os nouvellement formé. Dans les groupes d'échafaudage isogreffe et de corail, l'union des os a été obtenu en 4 et 4 animaux respectivement. Le volume de tissu minéralisé évaluée par des analyses de microCT était de 4,4 ± 0,9 mm et 3 8,9 ± 0,7 mm 3. Dans ces groupes, cependant, parce que le isogreffe et l'échafaud de corail contenaient des minéraux, une nouvelle formation osseuse ne pouvait pas être vraiment distingué du matériau implanté restant (isogreffe ou échafaudage corail). Tant le taux d'union de bon et le volume de tissu minéralisé obtenu à partir du groupe isogreffe etdans le groupe de squelette de corail étaient significativement (p <0,001) plus élevées que celles obtenues dans le groupe de défauts gauche vide.
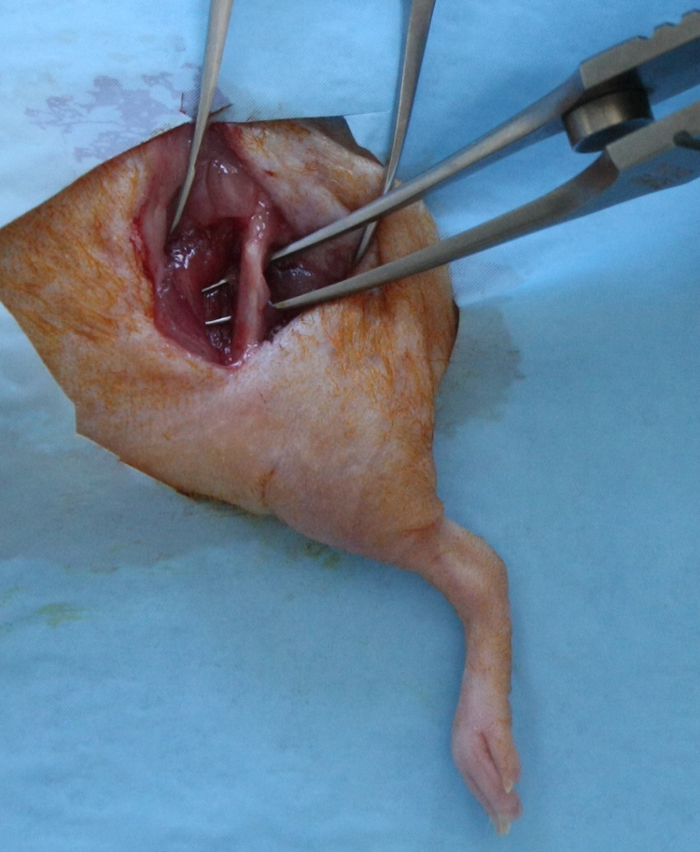
Figure 1:. Exposition chirurgicale pour la création de l'fémoral segmentaire Defect A 15 - 17 mm incision cutanée longitudinale, allant de l'articulation de la hanche à l'articulation fémoro - tibiale, a été faite sur la face antérolatérale du fémur. Le fascia lata est incisé; le muscle vastus lateralis et muscle biceps fémoral ont été divisés pour exposer toute la longueur de la diaphyse fémorale. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
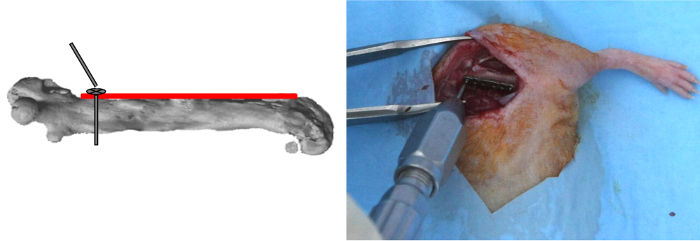
Figure 2: PlatePositionnement et proximal vis Placement. La plaque a été appliquée sur le côté fémoral antérieur. Le trou le plus proximal de la plaque a été foré; la première vis a été insérée et, puis, verrouillé. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
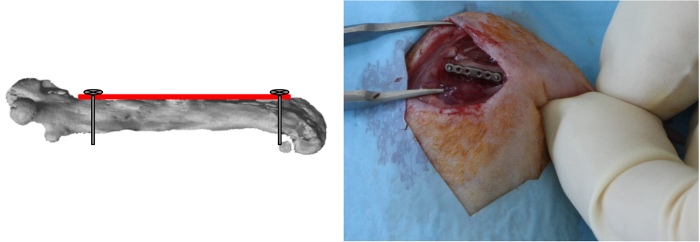
Figure 3:. Distal vis Placement Le trou le plus distal de la plaque a été foré et la vis a été insérée et verrouillée. (Reproduit avec la permission de Tissue Eng Partie C, 2013, 19 (4), 271-280) S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
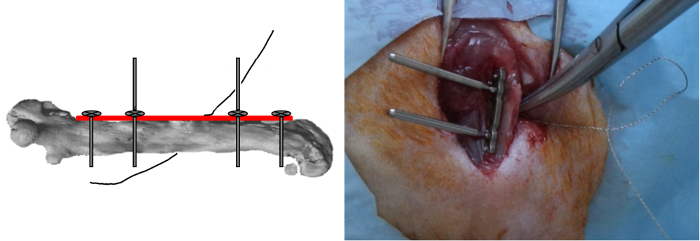
Figure 4: Gigli Saw positionnement. Les deux autres vis extérieures ont été insérées mais non verrouillées et le fil des 0,22 mm scies Gigli était liée étroitement autour de l'os dans une orientation médio-latérale. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
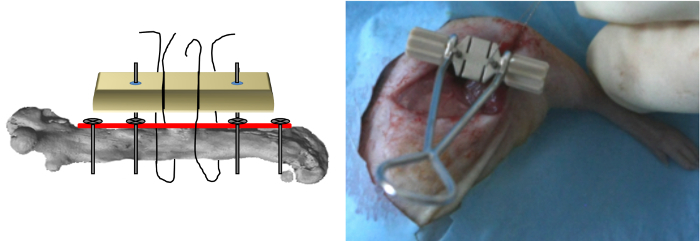
Figure 5: Jig Positionnement Le gabarit a été inséré sur la tige des deux dernières vis et appliquée dessus de la plaque et le fil de la scie a ensuite été inséré dans les fentes du gabarit.. (Reproduit avec la permission de Tissue Eng Partie C, 2013, 19 (4), 271-280) S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 6:. Ostectomy Ostectomy a été effectuée et la scie Gigli a été retirée. (Reproduit avec la permission de Tissue Eng Partie C, 2013, 19 (4), 271-280) S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
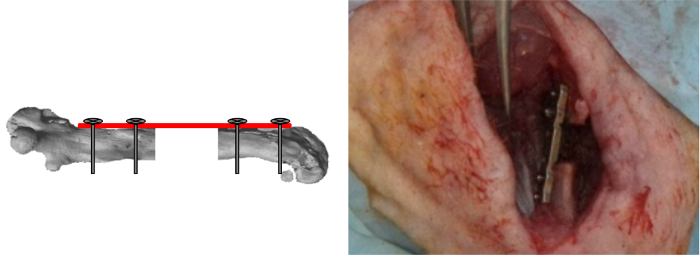
Figure 7:. Vis de verrouillage intérieures Le gabarit a été retiré et les deux dernières vis verrouillée. Les défauts segmentaires étaient alors soit vide ou rempli gauche avec les matériaux testés. (Reproduit avec la permission de Tissue Eng Partie C, 2013, 19 (4), 271-280) S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
t = "Figure 8" src = "/ files / ftp_upload / 52940 / 52940fig8.jpg" />
Figure 8: Représentant postopératoires Radiographies et sagittale μCT reconstruction de l'os fémoral de souris de l' os fémoral avec le défaut respectif soit gauche vide (AE), ou rempli de greffe massive osseuse syngénique (FJ), ou rempli d'énormes échafaudages de corail Acropora (KO. ); immédiatement après la chirurgie (A, F, K), 4 semaines après la chirurgie (B, G, L), 6 semaines après l' intervention chirurgicale (C, H, M) et 10 semaines après l' intervention chirurgicale (D, E, I, J, N , O) (plaque longueur = 10 mm). (Reproduit avec la permission de Tissue Eng Partie C, 2013, 19 (4), 271-280) S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
fichiers / ftp_upload / 52940 / 52940fig9.jpg "/>
. Figure 9: Représentant Radiographie, μCT Reconstruction et histologie d'un Defect Rempli avec le Coral Échafaudages Testé dans la présente étude Un grand montant de l' os nouvellement formé a été observé en entre les bords osseux environnants et l'échafaud de corail; en revanche, petit os était présent à l'intérieur de l'échafaud. Taches: Stevenel bleu et von Gieson picrofuchsin. Dans ces conditions, les os, les cellules, et de corail colorés en rouge, bleu et brun, respectivement. Barre d'échelle = 500 um. ACS = Acropora d'échafaudage corail; BN = os. (Reproduit avec la permission de Tissue Eng Partie C, 2013, 19 (4), 271-280) S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
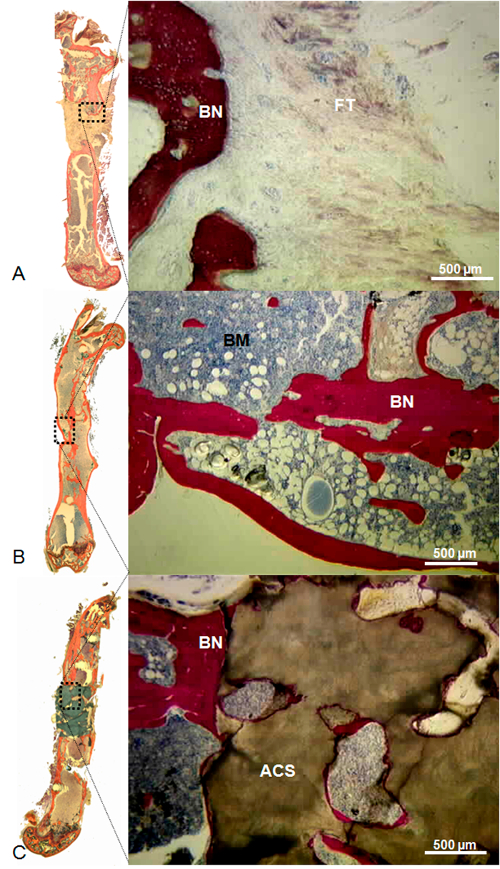
Figure 10: repré repré- histologie d'un Defect Gauche Empty (A), Rempli de Massive syngéniques de greffe osseuse (B), et Rempli Coral Échafaudages (C). Dans le défaut reste vide, l' arrondi de l'osseuse bords avec le remplissage du canal médullaire et de tissu fibreux abondant profond dans le défaut ont été observées. Dans le défaut rempli de greffe osseuse syngénique massif, la continuité osseuse a été observée entre le greffon osseux et les bords environnants; la moelle osseuse était présent dans toute la cavité originale. Dans le défaut rempli de corail échafaud, l'os nouvellement formé a été observée entre les bords osseux environnants et l'échafaud de corail, mais petit os était présent à l'intérieur de l'échafaud. Taches: Stevenel bleu et von Gieson picrofuchsin. Dans ces conditions, les os, les cellules, et de corail colorés en rouge, bleu et brun, respectivement. Barre d'échelle = 500 mm. ACS, échafaudage corail; BN, os; BM, la moelle osseuse; FT, le tissu fibreux. (Reproduit avec la permission de Tissue Eng Partie C, 2013, 19 (4), 271-280)oad / 52940 / 52940fig10large.jpg "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Animés / vidéo Figure 1: vidéo représentatif de la démarche d'une souris à un post - opératoire de la journée. Poids plein roulement a été observée. S'il vous plaît cliquer ici pour voir cette vidéo.
Discussion
Implantation ectopique de matériaux et dispositif chez des souris orthopédiques liées est généralement effectuée pour évaluer l'os formant des capacités des diverses échafauds 13,14. Des différences importantes existent cependant entre les modèles ectopiques et orthotopique, y compris les facteurs de signalisation ostéogénique indigènes et les interactions paracrines avec les cellules osseuses formant hôtes.
La présente étude établit un reproductible grand segmentaire murin, critique taille défaut fémoral (3,5 mm, environ 20-25% de la longueur du fémur). Compte tenu de la taille d'un tel défaut et la stabilité fournie par la plaque ostéosynthèse résultante, ce modèle imite l'os atrophique non-union cliniquement rencontré.
La période post-opératoire choisi dans la présente étude, est en ligne avec les souris modèles non syndiqués décrits précédemment, montrant un manque de guérison adéquate après 8 à 12 semaines 4,9,15,16.
Plus important encore, reproduet stable ostéosynthèse cible, ainsi que la stabilité des substituts osseux implantés ont été obtenus sans morbidité et une mortalité de 1,2 à l'utilisation à la fois la plaque de verrouillage et un dispositif de serrage pour effectuer l'ostéotomie. Ce résultat contraste également les résultats rapportés lorsque l'un fixateur externe ou d' un clou intramédullaire ont été utilisés 4,5,17-24. Pour les fixateurs externes inconvénients potentiels comprennent: la variabilité de la rigidité, les infections des voies broches, desserrant des broches, des potentiels de blessures dues aux broches et le poids des matériaux (4 à 20% du poids du corps de la souris). Pour le clou intramédullaire inconvénients potentiels incluent: le remplissage de la cavité médullaire avec l'ongle et des lésions iatrogènes des surfaces articulaires.
D' autres segments de souris, la taille critique des défauts fémorale stabilisée par une plaque d' ostéosynthèse ont été décrits par défaut osseux créé par une bavure et allant de 1,5 à 2 mm de long 16,25. In the modèle actuel, l'utilisation d'un gabarit et un fil de scie a permis une précision de 3,5 mm de long ostectomie sans muscles importants traumatismes.
Cependant, pour réussir dans l'accomplissement de la procédure il faut prendre en considération plusieurs points clés: Ne pas utiliser petite souris (souris Nude soit avec un poids de moins de 25 g ou de l'âge de moins de 8 semaines), sinon la plaque devrait être trop long. Lorsque vous approchez de l'os fémoral, prendre soin de préserver à la fois le nerf sciatique caudale et la capsule articulaire distale. Appliquer la plaque sur le côté antérieur de l'os fémoral et depuis l'alignement de la plaque est déterminée par application de cette première vis, prendre soin de positionner la plaque parallèle au fémur lors de l'insertion de cette première vis.
Avant de faire le ostectomie, prendre soin d'effectuer une dissection circulaire du fémur au milieu de la diaphyse pour éviter un traumatisme musculaire. Lors de l'exécution de la ostectomie, l'assistant du chirurgien doit tenir fermement le guide et le surgeon doit être prudent (i) de ne pas emmêler le fil de scie, (ii) d'utiliser les moyens des deux tiers du fil tout en appliquant une tension constante et régulière, et (iii) afin d'éviter un mouvement excessif pour obtenir une coupe osseuse droite.
la cicatrisation osseuse est possible dans le présent modèle pourvu d'une greffe osseuse est utilisée. En outre, ce modèle permet d'autres études sur les mécanismes impliqués dans les stratégies de remplacement des os lorsque soit des greffes d'origine humaine ou des cellules sont utilisées dans un grand, segmentaire, défaut osseux bien standardisé.
En outre, conformément aux tendances actuelles exigeant le raffinement et la réduction de l' utilisation des animaux dans la recherche liée à l' orthopédie, ce modèle peut être utilisé en conjonction avec des techniques d'imagerie in vivo telles que la bioluminescence. Ces techniques non invasives permettent de suivre à la fois la survie des cellules implantées et la guérison des tissus sans exiger le sacrifice d'animaux 26.
Les principales limites du modèle actuel sont à la foisles conditions portantes et le volume du défaut osseux créé, car ils ne miment pas complètement celles rencontrées cliniquement chez les humains. Autres limites du modèle sont (i) la radio-opacité de la plaque qui peut nécessiter l' enlèvement de la plaque avant ex vivo μCT analyse et peut compliquer l' interprétation des résultats longitudinaux d'examen radiographique et, (ii) l'incapacité de moduler la rigidité de plaque peut être un paramètre clé mécanique dans la formation osseuse 27-30.
Il faut garder à l'esprit également, lors de l'utilisation soit isogreffe osseuse ou d'autres échafauds contenant un composant minéral (en particulier le carbonate de calcium), que certains biais sont introduits dans le processus de segmentation de l'analyse micro-CT, parce que la densité osseuse nouvellement formée en partie recouverte par soit la densité de isogreffe ou de la densité de l'échafaudage. Pour cette raison, le volume osseux obtenir par l'analyse micro-CT refléter principalement le volume des tissus minéralisés (os nouvellement formé, plussubstitut osseux) 11,26,31.
Déclarations de divulgation
Les auteurs déclarent qu'ils ont aucun intérêt financier concurrents.
Remerciements
Les auteurs tiennent à remercier Rena Bizios pour ses précieux commentaires sur le manuscrit.
matériels
| Name | Company | Catalog Number | Comments |
| α-MEM , Minimum Essential Medium Eagle | Sigma-Aldrich, France | M4526 | 500 ml |
| Acropora sp. coral exoskeleton cubes, Biocoral® | Biocoral®, Inoteb, France | 3 x 3 x 3 mm cubes, autoclaving (121 °C for 20 min) sterilization | |
| Buprenorphine, Buprecare® | Axience, Pantin, France | 0.3 mg/ml | |
| Xylazine, Rompun® 2% | Bayer HealthCare, Puteaux, France | 20 mg/ml | |
| Ketamine, Ketamine 500® | Virbac, Carros, France | 50 mg/ml | |
| Isoflurane, Forène® | Abbott, Arcueil, France | ||
| Enrofloxacine, Baytril® 5% | Bayer HealthCare, Puteaux, France | 50 mg/ml | |
| Pentobarbital, Dolethal® | Vétoquinol, Lure, France | 182.2 mg/ml | |
| Anesthetizing box | Ugo Basile, Gemonio, Italy | 7900/10 | |
| Plastic transparent sterile drape, BusterOpCover 30 x 45 cm | Buster, Coveto, Montagu, France | 613867 | |
| 10% povidone iodine, Vétédine® Solution | Vétoquinol, Lure, France | 100 mg/ml | |
| Titanium micro- locking plate, MouseFix Plate XL | RISystem AG, Davos, Switzerland, http://www.risystem.com/ | RIS.401.120 | 6 holes, 10 mm long and 1.5 mm wide, autoclaving (121 °C for 20 min) sterilization or cold sterilzation (ethylene oxide) |
| 0.3 mm drill bit, Drill Bit 0.30 mm | RISystem AG, Davos, Switzerland, http://www.risystem.com/ | RIS.592.200 | autoclaving (121 °C for 20 min) sterilization or cold sterilzation (ethylene oxide) |
| Engine power | RISystem AG, Davos, Switzerland, http://www.risystem.com/ | AccuPen | Cold sterilzation (ethylene oxide) |
| Screw driver, Handrill | RISystem AG, Davos, Switzerland, http://www.risystem.com/ | RIS.390.130 | autoclaving (121 °C for 20 min) sterilization or cold sterilzation (ethylene oxide) |
| Self-tapping locking screws, MouseFix Screw 2 mm | RISystem AG, Davos, Switzerland, http://www.risystem.com/ | RIS.401.100 | 2 mm long, 0.47 mm outer diameter and 0.34 mm core diameter, autoclaving (121 °C for 20 min) sterilization or cold sterilzation (ethylene oxide) |
| Jig, MouseFix XL Drill and Saw Guide | RISystem AG, Davos, Switzerland, http://www.risystem.com/ | RIS.301.103 | 3.5 mm between the slots, autoclaving (121 °C for 20 min) sterilization or cold sterilzation (ethylene oxide) |
| 0.22-mm Gigli saws (0.22 mm Saws) | RISystem AG, Davos, Switzerland | ||
| 5.0 glycomer 631, Biosyn | Covidien, Vétoquinol, Lure, France | Tapper-cut needle | |
| 4.0 glycomer 631, Biosyn | Covidien, Vétoquinol, Lure, France | Tapper-cut needle | |
| X-ray, MX20 | Faxitron X-ray Corp, Edimex, Le Plessis Grammorie | ||
| In vivo high-resolution microcomputed tomography, Skyscan 1176 | Skyscan, Aartselaar, Belgium | ||
| Ex vivo high-resolution microcomputed tomography, Skyscan 1172 | Skyscan, Aartselaar, Belgium | ||
| Resident software: Nrecon (v1.6.9) / Ctan (v.1.14.4) | Skyscan, Aartselaar, Belgium |
Références
- Auer, J. A., et al. Refining animal models in fracture research: seeking consensus in optimising both animal welfare and scientific validity for appropriate biomedical use. BMC Musculoskelet Disord. 8 (72), (2007).
- Histing, T., et al. Small animal bone healing models: standards, tips, and pitfalls results of a consensus meeting. Bone. 49 (4), 591-599 (2011).
- Horner, E. A., et al. Long bone defect models for tissue engineering applications: criteria for choice. Tissue Eng. Part B Rev. 16 (2), 263-271 (2010).
- Srouji, S., et al. A model for tissue engineering applications: femoral critical size defect in immunodeficient mice. Tissue Eng. Part C Methods. 17 (5), 597-606 (2011).
- Thompson, Z., Miclau, T., Hu, D., Helms, J. A. A model for intramembranous ossification during fracture healing. J Orthop Res. 20 (5), 1091-1098 (2002).
- Harris, J. S., Bemenderfer, T. B., Wessel, A. R., Kacena, M. A. A review of mouse critical size defect models in weight bearing bones. Bone. 55 (1), 241-247 (2013).
- Garcia, P., et al. The LockingMouseNail--a new implant for standardized stable osteosynthesis in mice. J. Surg. Res. 169 (2), 220-226 (2011).
- Garcia, P., Histing, T., Holstein, J. H., Pohlemann, T., Menger, M. D. Femoral non-union models in the mouse. Injury. 41 (10), 1093-1094 (2010).
- Garcia, P., et al. Development of a reliable non-union model in mice. J. Surg. Res. 147 (1), 84-91 (2008).
- Viateau, V., Logeart-Avramoglou, D., Guillemin, G., Petite, H., Conn, P. M. Animal Models for bone tisue enginering purposes. Sourcebook of models for biomedical research. , 725-738 (2008).
- Manassero, M., et al. A novel murine femoral segmental critical-sized defect model stabilized by plate osteosynthesis for bone tissue engineering purposes. Tissue Eng. Part C Methods. 19 (4), 271-280 (2013).
- Matthys, R., Perren, S. M. Internal fixator for use in the mouse. Injury. 40 Suppl 4, S103-S109 (2009).
- Becquart, P., et al. Ischemia is the prime but not the only cause of human multipotent stromal cell death in tissue-engineered constructs in vivo. Tissue Eng. Part A. 18 (19-20), 2084-2094 (2012).
- Deschepper, M., et al. Proangiogenic and prosurvival functions of glucose in human mesenchymal stem cells upon transplantation. Stem Cells. 31 (3), 526-535 (2013).
- Oetgen, M. E., Merrell, G. A., Troiano, N. W., Horowitz, M. C., Kacena, M. A. Development of a femoral non-union model in the mouse. Injury. 39 (10), 1119-1126 (2008).
- Liu, K., et al. A murine femoral segmental defect model for bone tissue engineering using a novel rigid internal fixation system. J Surg Res. 183 (2), 493-502 (2013).
- Zwingenberger, S., et al. Establishment of a femoral critical-size bone defect model in immunodeficient mice. J Surg Res. 181 (1), e7-e14 (2013).
- Cheung, K. M., et al. An externally fixed femoral fracture model for mice. J. Orthop Res. 21 (4), 685-690 (2003).
- Claes, L., et al. Hyperhomocysteinemia is associated with impaired fracture healing in mice. Calcif. Tissue Int. 85 (1), 17-21 (2009).
- Drosse, I., et al. Validation of a femoral critical size defect model for orthotopic evaluation of bone healing: a biomechanical, veterinary and trauma surgical perspective. Tissue Eng. Part C Methods. 14 (1), 79-88 (2008).
- Holstein, J. H., et al. Advances in the establishment of defined mouse models for the study of fracture healing and bone regeneration. J. Orthop. Trauma. 23 (5 Suppl), S31-S38 (2009).
- Johnson, K. D., August, A., Sciadini, M. F., Smith, C. Evaluation of ground cortical autograft as a bone graft material in a new canine bilateral segmental long bone defect model. J. Orthop. Trauma. 10 (1), 28-36 (1996).
- Meinig, R. P., Buesing, C. M., Helm, J., Gogolewski, S. Regeneration of diaphyseal bone defects using resorbable poly(L/DL-lactide) and poly(D-lactide) membranes in the Yucatan pig model. J. Orthop. Trauma. 11 (8), 551-558 (1997).
- Wu, J. J., Shyr, H. S., Chao, E. Y., Kelly, P. J. Comparison of osteotomy healing under external fixation devices with different stiffness characteristics. J. Bone Joint Surg. Am. 66 (8), 1258-1264 (1984).
- Xing, J., et al. Establishment of a bilateral femoral large segmental bone defect mouse model potentially applicable to basic research in bone tissue engineering. J. Surg. Res. 192 (2), 454-463 (2014).
- Manassero, M., et al. Comparison of Survival and Osteogenic Ability of Human Mesenchymal Stem Cells in Orthotopic and Ectopic Sites in Mice. Tissue Eng. Part A. 22 (5-6), 534-544 (2016).
- Bos, R. R., et al. Degradation of and tissue reaction to biodegradable poly(L-lactide) for use as internal fixation of fractures: a study in rats. Biomaterials. 12 (1), 32-36 (1991).
- Oest, M. E., Dupont, K. M., Kong, H. J., Mooney, D. J., Guldberg, R. E. Quantitative assessment of scaffold and growth factor-mediated repair of critically sized bone defects. J.Orthop. Res. 25 (7), 941-950 (2007).
- Pihlajamaki, H., Bostman, O., Tynninen, O., Laitinen, O. Long-term tissue response to bioabsorbable poly-L-lactide and metallic screws: an experimental study. Bone. 39 (4), 932-937 (2006).
- Rai, B., et al. Combination of platelet-rich plasma with polycaprolactone-tricalcium phosphate scaffolds for segmental bone defect repair. J. Biomed. Mater Res. A. 81 (4), 888-899 (2007).
- Komlev, V. S., et al. Kinetics of in vivo bone deposition by bone marrow stromal cells into porous calcium phosphate scaffolds: an X-ray computed microtomography study. Tissue Eng. 12 (12), 3449-3458 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon