Method Article
Создание Сегментные бедренных критического размера дефекта модели у мышей стабилизированный пластинкой остеосинтеза
В этой статье
Резюме
Although mouse models are invaluable tools for bone tissue engineering, models of long bone defects are sparse. This need motivated development of the present protocol which uses a locking plate with four screws and a dedicated jig to perform and stabilize a reproducible, femoral, critical-size defect with low morbidity.
Аннотация
The use of tissue-engineered bone constructs is an appealing strategy to overcome drawbacks of autografts for the treatment of massive bone defects. As a model organism, the mouse has already been widely used in bone-related research. Large diaphyseal bone defect models in mice, however, are sparse and often use bone fixation which fills the bone marrow cavity and does not provide optimal mechanical stability. The objectives of the current study were to develop a critical-size, segmental, femoral defect in nude mice. A 3.5-mm mid-diaphyseal femoral ostectomy (approximately 25% of the femur length) was performed using a dedicated jig, and was stabilized with an anterior located locking plate and 4 locking screws. The bone defect was subsequently either left empty or filled with a bone substitute (syngenic bone graft or coralline scaffold). Bone healing was monitored noninvasively using radiography and in vivo micro-computed-tomography and was subsequently assessed by ex vivo micro-computed-tomography and undecalcified histology after animal sacrifice, 10 weeks postoperatively. The recovery of all mice was excellent, a full-weight-bearing was observed within one day following the surgical procedure. Furthermore, stable bone fixation and consistent fixation of the implanted materials were achieved in all animals tested throughout the study. When the bone defects were left empty, non-union was consistently obtained. In contrast, when the bone defects were filled with syngenic bone grafts, bone union was always observed. When the bone defects were filled with coralline scaffolds, newly-formed bone was observed in the interface between bone resection edges and the scaffold, as well as within a short distance within the scaffold.
The present model describes a reproducible critical-size femoral defect stabilized by plate osteosynthesis with low morbidity in mice. The new load-bearing segmental bone defect model could be useful for studying the underlying mechanisms in bone regeneration pertinent to orthopaedic applications.
Введение
Массивные диафизарные костные дефекты являются большой проблемой для хирурга-ортопеда. замене кости с аутогенной костного трансплантата, в настоящее время рассматривается как золотой стандарт лечения, в ограниченном количестве и связано с уборочной, связанных с заболеваемостью. По этим причинам, тканевой инженерии кости конструкции, сочетающие костного мозга мезенхимальных стволовых клеток с остеокондуктивном матриксе были исследованы в качестве альтернативы для аутотрансплантатов в ортопедической хирургии.
На сегодняшний день, большинство исследований были проведены в клинически соответствующих моделях животных , таких как собаки, свиньи и овцы 1-3, но предварительная оценка этих конструкций в ортотопических, сегментарный, критического размера костных дефектов в моделях небольших животных (например , мышей) может иметь несколько преимуществ: (I) низкие затраты, (II) большое количество животных можно управлять; (III), в отличие от крупных животных моделях, гомогенность линий мышей ограничивает индивидуальные вариации в каркасного резорбции Aформирование й кости и; (IV) самое главное, наличие специфических антител и ген-направленных животных позволяют оценку биологического процесса, участвующих в лечении костей. И последнее, но не в последнюю очередь, использование иммунодефицитных штаммов мышей позволяет также исследования с использованием либо трансплантатов или клетки человеческого происхождения без неблагоприятных иммунных реакций у мышей.
Несмотря на вышеупомянутые преимущества, массивные диафизарные модели дефекта кости у мышей немногочисленны. Большинство таких моделей используют фиксацию костной ткани с интрамедуллярной штифтом, заполняющей полость костного мозга (ограничивая тем самым объем материала, подлежащего испытанию) , а также препятствует воспроизводимости, не обеспечивая вращения и осевую устойчивость 2,4-7.
Целями данного исследования являются: (I) изображая клинический костный несоюзных ситуацию, чтобы описать воспроизводимый, критический величину, сегментарный, бедренную модель дефектов у мышей, которая стабилизируется точной и воспроизводимой замок пластины osteosynthтеза , что обеспечивает высокую стабильность биомеханической среды 8-10; (II), для иллюстрации настоящего модель с двумя потенциальными заменителями костной ткани и для описания формирования кости анализов, которые могут быть использованы.
протокол
Этика Заявление: Мыши , используемые в настоящем исследовании , были обработаны в соответствии с руководящими принципами , опубликованных Европейским комитетом по «уходу и использованию лабораторных животных" (Директива 2010/63 / ЕС и Европейской конвенции ETS 123). Экспериментальный протокол был одобрен Комитетом по этике факультета медицины Lariboisière Сен-Луи (КДЭОС LV / 2010-01-04) путем.
1. Животные
- Используйте бестимусных мышей (10 недель). Используйте минимальное количество 6 мышей с дефектом остается пустым, как отрицательной контрольной группы.
2. Каркасы Подготовка
- Сингенных Привитые Подготовка
- Используйте кости изотрансплантат для заполнения дефекта, чтобы обеспечить контрольную группу с минимальным количеством 6 животных.
- ПОЛУЧИТЬ кости изотрансплантаты по заготовке вырезают бедренной кости от мыши, принадлежащей либо "дефекты пусты или" дефекты заполнены коралла эшафот "групп (мэто не требует использования дополнительного животного , чтобы собрать кости изотрансплантат) 11.
- Промойте резецировали кости фосфатным буферным раствором (PBS) и держать его стерильным используя влажную марлевую компресс.
- Коралловые Эшафот Подготовка
- Используйте леску, которые сделаны из натурального коралла: Акропора Sp. коралловые экзоскелет кубики, 3 х 3 х 3 мм в качестве потенциального заменителя костной ткани с минимумом 6 животных.
- Вырезают вручную каждый кубик коралла к форме цилиндра (3,5 высота, диаметр 2 мм).
- Стерилизация каждый помост автоклавированием (121 ° С в течение 20 мин), промойте его стерильным PBS, и погружают ее в полной культуральной среде (α-MEM), в течение 24 ч до имплантации у мышей.
3. Анестетики Процедуры и обезболивание
- Обеспечить профилактическое обезболивание, 15 минут до начала анестезии, путем подкожной инъекции бупренорфин (0,1 мг / кг массы тела животного).
- Нанесите мазь в животномглаза, чтобы предотвратить сухость каждые 30 мин, пока животные находятся под анестезией.
- Поместите мышей на разогреве площадку, чтобы предотвратить переохлаждение.
- Анестезия и обезболивание во время хирургической процедуры
- Вводят внутрибрюшинно раствор, содержащий ксилазина (8 мг / кг) и кетамина (100 мг / кг).
- Доставка кислорода через поток-по (50 мл / мин).
- Подтверждение адекватной глубины анестезии наличием хорошей мышечной релаксации и отсутствие реакции животного на болевые раздражители (например., Фирма схождение пинч).
- Вводят подкожно разовая доза энрофлоксацину (0,05 мг / кг) в качестве микробных профилактики.
- Послеоперационный Обезболивание
- Обеспечить послеоперационное обезболивание путем подкожной инъекции бупренорфин (0,1 мг / кг) через каждые 12 ч в течение 3 дней подряд.
- Анестезия во время процедур диагностической визуализации
- Поместите мышей в anesthetizinг-поле, а затем вызвать и поддерживать анестезии с использованием приблизительно 4% и 2% изофлуран в кислороде, соответственно.
- Подтверждение адекватной глубины анестезии путем хорошей релаксации мышц животных и отсутствие движения.
- условия восстановления
- Держите мышей на утепление площадку до полного выздоровления
- Не оставляйте животное без присмотра, пока он не пришел в сознание достаточное для поддержания грудины лежачее после операции.
- Не возвращать животное, которое перенес операцию на компании других животных, пока полностью не выздоровел.
- Послеоперационные условия
- Хост мышей отдельно в течение первых 3-х дней хост мышей на 4 в клетках после того, как 3-й день.
- Обеспечить воду и приспособленный еды вволю. Разрешить мышей к весу медведицы, без каких-либо ограничений деятельности в течение всего послеоперационного периода.
4. Хирургическая процедура:Бедренных Сегментные Дефект Модель 11,12
- После анестезии, поместите каждую мышь в вентральной лежачее с левой задней конечности в расширении.
- Scrub конечности для асептической хирургии с использованием 10% повидон-йод в течение 5 мин, а затем поместить стерильный драпировка под конечность, чтобы создать стерильную поверхность (стерильный прозрачный драпировка используется для того, чтобы иметь возможность следить за дыхательное движение во время процедуры). Принимают меры для поддержания стерильности операционного поля во время процедуры.
- Сделайте 15 а - 17-мм продольный разрез кожи над переднебоковой бедренной кости, простирающийся от тазобедренного сустава до коленного сустава.
- Надрезать широкую фасцию, разделить латеральной широкой мышцы и двуглавой мышцы бедра мышцы , чтобы выставить на всю длину бедренной кости диафиза. Следует соблюдать осторожность , чтобы сохранить седалищного нерва каудально и суставной капсулы дистально (рисунок 1).
- Для усиления бедренной кости диафиза экспКонечно, секут ягодичной мышцы и двуглавой мышцы бедра от 3 - го вертела.
- Выполните круговое рассечение бедренной кости в середине диафиза.
- Нанесите 6-отверстие титана микро-фиксирующую пластину (длиной 10 мм; шириной 1,5 мм, вес: 30 мг) на передней стороне бедра.
Примечание: Отверстия пластины, которые конически утопленные с цилиндрической частью, вмещать титана самонарезающие крепежные винты (длиной 2 мм, 0,47 мм наружный диаметр, вес: 5 мг, с нижней поверхности головки винта с резьбой, чтобы включить блокировку в отверстие пластины), которые соединены со штоком, который закручивается выключен, когда заблокирован. - Дрель наиболее проксимального отверстие пластины с использованием 0,3 мм сверло и либо специальную мощность двигателя или непрофильными мощность двигателя , работающего при 2500 оборотах в минуту при температуре приблизительно 500 мВт 12).
- Вставьте первый винт , используя специальную отвертку , а затем зафиксировать его (рисунок 2).
Примечание: Так как выравнивание тон пластинкой определяется применением этого первого винта, важно расположить пластину параллельно бедренной кости при вставке винта. - Дрель наиболее дистальной отверстие пластины аналогичным образом, вставить и зафиксировать винт (рисунок 3).
- Вставить, но не делали никакого замка, два других наружных винта.
- Поместите провод 0,22 мм Джильи увидел близко вокруг кости в медио-латеральной ориентации , а затем вставьте его в пазы зажимного приспособления (рисунок 4).
- Вставьте специальный зажим на стволе двух последних винтов и применить его над пластиной (рисунок 5).
- Выполните 3,5-мм длиной в середине-диафизарной бедренную ostectomy с использованием Джильи увидел при орошении (используя стерильный изотонический солевой раствор) для предотвращения термического некроза. У помощника хирурга взять кондуктор. У хирурга применяют постоянную устойчивую напряженность. Будьте осторожны, чтобы не зацепить провод пилы и использовать средние две трети проволоки. Избегайте ехДвижение цесс, чтобы получить прямой разрез кости (рисунок 6).
- После ostectomy, удалите Джильи увидел. Во избежание повреждения мягких тканей, разрезать пильной проволоки близко к кости на одной стороне.
- Снимите приспособление и зафиксировать два последних винта (рисунок 7).
- Либо оставьте дефект сегментарный пустым или хирургическим путем заполнить его, помещая материалы, которые будут проверены внутри дефекта.
- Обильно промыть операционное поле стерильной изотонический солевой раствор.
- Поместите латеральной широкой мышцы свободно над тарелкой. Закройте фасции и подкожной плоскости, используя простой непрерывный рисунок шва и 5,0 glycomer 631 шовный; закрыть кожу с простым прерывистым рисунком шовного с использованием 4.0 glycomer 631 шовного материала. В качестве альтернативы, также возможно, чтобы закрыть кожу с помощью клея с кожей.
5. В Vivo оценках регенерации кости
- С мышей под анестезией, выполняют рентгенографическиеоценки в продольном способом, используя как обычные рентгеновские лучи (26 кВ, 10 сек; 2X увеличение; 20 линий / мм пространственное разрешение) и высокого разрешения микро-компьютерная томография (μCT).
- Для анализа μCT, получать изображения с разрешением 36 мкм (50 кВ и 478 мА, при 40 мс время экспозиции, используя алюминиевый фильтр 0,5 мм, поворот шаг 0,7 º и томографическое вращения 180 º). Анализ изображений с помощью программного обеспечения резидента.
6. Ex Vivo Оценки регенерации кости
- Через десять недель после операции, индукция анестезии с использованием изофлуран в кислороде, а затем принести в жертву мышей путем внутрибрюшинной инъекции передозировки барбитуратов (1 мл фенобарбитала).
- Акцизный бедренной кости, удалить накладывания мышечной ткани, и зафиксировать образцы кости в 4% параформальдегида (рН 7,4) в течение четырех дней.
- Снимите пластину и винты из каждого вырезанных кости образца после параформальдегида Fixaции.
- Ex Vivo ц CT Анализ
- Поместите каждую вырезанную и неподвижную кость в полиэтиленовых трубок , заполненных 75% спиртом и анализируют его с помощью Экс естественных μCT.
- Получение изображений при 80 кВ и 100 мкА (время экспозиции 1000 мс, алюминий 0,5 фильтра и размером 4 мкм камера пиксела (2400 х 4000 с размером воксела 7 мкм), средние четыре кадра для каждого поворота приращения 0,9 º.
- Реконструировать 3-мерные изображения (средний размер воксела 13 мкм) с использованием Хэмминга фильтрованное обратного проецирования с программным обеспечением резидента.
- Для количественного анализа формирования костной ткани, используют резидентный программное обеспечение для получения объема минерализованной ткани (нижний порог серого 45 показателей в оттенках серого и серого верхнего порога 240 градаций серого) показателей в определенной и последовательной области, представляющей интерес, соответствующего дефекта.
- Провести анализ таким же образом, для каждой мыши с той же региона интереса.
- Используйте тест одностороннего анализа (доверительный интервал - на 95% и значительный уровень при р <0,05), чтобы сравнить скорость союзное кости и объем минерализованной ткани в области интересов между группами.
- Гистологический анализ
- Вставить каждый вырезают и фиксировали бедренную кость в метилметакрилата смолы и обработать его для undecalcified гистологии.
- Разрежьте каждый костный образец продольно в толстые секции (200 мкм) с использованием круговую охлаждаемую водой алмазную пилу.
- Измельчите каждый участок кости образца до толщины 100 мкм, отполировать и окрашивает ее с помощью Stevenel синий и ван Гизону picrofuchsin пятна.
Примечание: После окрашивания клетки появляются в синем, кости в розовый и кораллов в коричневый под световым микроскопом.
Результаты
Вышеперечисленные хирургические процедуры продолжались с 45 до 60 мин. Ostectomy и остеосинтез было легко выполнить с помощью помощника хирурга, но без использования какой-либо системы увеличительного. Нет интраоперационных осложнений не наблюдалось. В предварительном исследовании по 18 мышей 11, послеоперационные рентгенограммы при условии доказательства того, что длина костного дефекта (3,43 ± 0,12 мм) и позиционирующая пластина (расстояние между задушить полости сустава и дистальной части пластины = 2,65 ± 0,56 мм) воспроизводились.
Уровень смертности связанных с анестезией составляла около 5%.
Функциональное восстановление оперированной конечности был отличный во всех животных и полном весовую наблюдалось в течение суток после операции (анимированный рисунок 1). Вес остеосинтеза (пластины и винты), используемых в рнегодуют исследование было около 0,1% от веса тела мыши. Нет послеоперационных осложнений (например, раневой инфекции, имплантант недостаточность, костного трансплантата миграции и т.д.) не произошло. Ни один саморана или травмы, вызванные cagemates не произошло.
Когда хирургически индуцированные дефекты кости были оставлены пустыми, не значительное образование кости не наблюдалось с последовательным костном несращения. В отличие от этого, когда дефекты были заполнены либо с изотрансплантат или коралловым помост, новообразованный кости проходит от проксимального и дистального краев кости наблюдалось. Кроме того, образование в то время как кости допускается воссоздание непрерывности кости в большинстве дефектов , обработанных изотрансплантаты (рисунок 8), это наблюдалось только внутри коралловых эшафот в дефектов , заполненных этим материалом. На самом деле, не наблюдалось кости на расстоянии более 1 мм от костистых краев. Отсутствие хряща во всех гистологических анализов результаты представили доказательстваСтабильность достигнутого остеосинтеза (рис 9, рисунок 10).
Рентгенограммы и microCT анализы представили доказательства, что костный союз не встречается ни в одном животном группы дефектов слева пусто, через 10 недель после имплантации. Объем минерализованной ткани оценивается с помощью анализов microCT составляла 0,8 ± 0,3 мм 3 и был представитель вновь образованной кости. В изотрансплантат и коралловых групп строительных лесов, костный союз был получен в 4-х и 4-х животных соответственно. Объем минерализованной ткани оценивали с помощью анализа microCT составила 4,4 ± 0,9 мм 3 и 8,9 ± 0,7 мм 3. В этих группах, однако, поскольку как изотрансплантат и коралловые эшафот содержали минералы, формирование новой костной ткани не может быть действительно отличается от остального имплантированного материала (изотрансплантат или коралла строительных лесов). И скорость подноса союза и объем минерализованной ткани, полученный из группы изотрансплантат иот коралловых эшафот группы были значительно (р <0,001) выше, чем полученные из группы дефектов слева пусто.
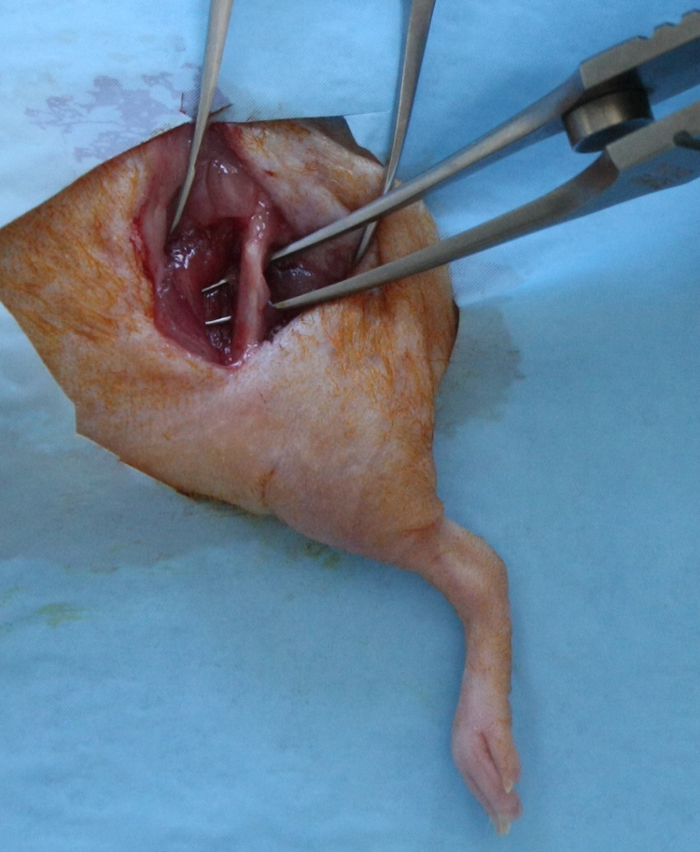
Рисунок 1:. Хирургическая экспозиции для создания бедренного Сегментные радиационных дефектов в 15 - 17-мм разрез продольной кожи, простирающаяся от тазобедренного сустава до коленного сустава, был сделан по переднебоковой бедренной кости. Фасции Лата рассекали; латеральной широкой мышцы и двуглавой мышцы бедра мышцы были разделены , чтобы выставить на всю длину бедренной кости диафиза. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
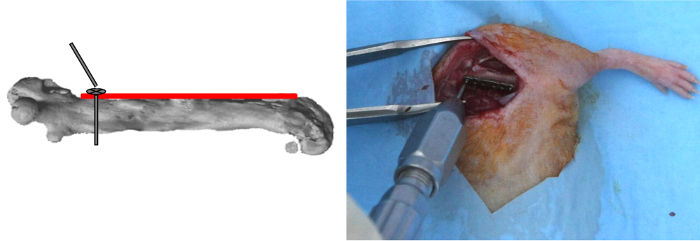
Рисунок 2: ТарелкаПозиционирование и проксимального винта размещения. Пластина наносили на передней стороне бедренной кости. Наиболее проксимальный отверстие пластины была пробурена; первый винт был вставлен и, затем, заблокирован. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
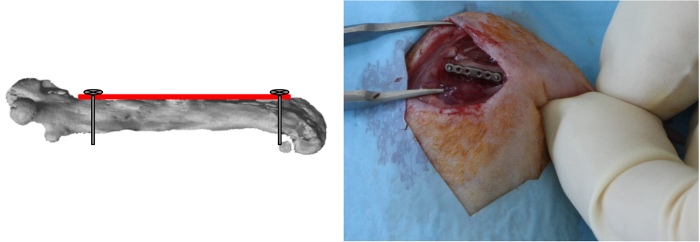
Рисунок 3:. Дистальных винтов Размещение наиболее дистальной отверстие пластины была пробурена и винт был вставлен и зафиксирован. (Печатается с разрешения Tissue Eng Часть C, 2013, 19 (4), 271-280) Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
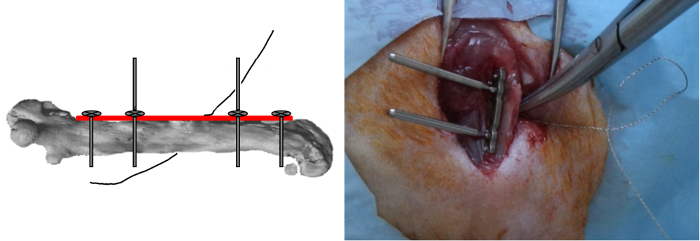
Рисунок 4: Gigli пила позиционирования. Две другие внешние винты были вставлены , но не заперта , а провод 0,22 мм Джильи пилы была тесно связана вокруг кости в медио-латеральной ориентации. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
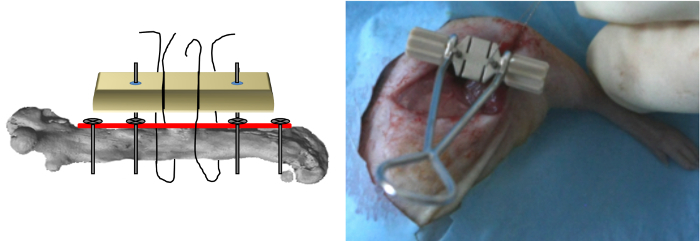
Рисунок 5: Jig Позиционирование Кондуктор был вставлен на шток двух последних винтов и прикладной над пластиной и провод пилы затем был вставлен в пазы зажимного приспособления.. (Печатается с разрешения Tissue Eng Часть C, 2013, 19 (4), 271-280) Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рис . 6: Ostectomy Ostectomy проводили и Джильи пилы был снят. (Печатается с разрешения Tissue Eng Часть C, 2013, 19 (4), 271-280) Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
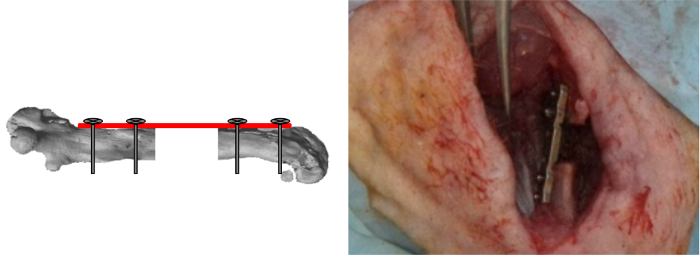
Рисунок 7:. Внутренние винты Запирание Кондуктор был удален и два последних винта заблокированы. Дефекты сегментные были затем либо пусты или заполнены материалами тестируемых. (Печатается с разрешения Tissue Eng Часть C, 2013, 19 (4), 271-280) Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
т = "Рисунок 8" SRC = "/ файлы / ftp_upload / 52940 / 52940fig8.jpg" />
Рисунок 8: Представитель Послеоперационный рентгенограммы и Саггитальная μCT Реконструкция бедренной кости мышей бедренной кости с соответствующим дефектом либо оставлено пустым (AE), или заполнены с массивными сингенный костного трансплантата (FJ) или заполнены массивные коралловые каркасы Acropora (KO. ); сразу же после операции (A, F, К), через 4 недели после операции (B, G, L), через 6 недель после операции (С, Н, М), и через 10 недель после операции (D, E, I, J, N , O) (пластина длина = 10 мм). (Печатается с разрешения Tissue Eng Часть C, 2013, 19 (4), 271-280) Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Файлы / ftp_upload / 52940 / 52940fig9.jpg "/>
. Рисунок 9: Представитель Рентгенограмма, μCT Реконструкция и гистологии Дефект наполнится Coral строительные леса Испытано в настоящем исследовании Большое количество новообразованной кости наблюдалось в промежутке между окружающими костными краями и коралловым эшафоте; В отличие от этого, маленькая кость присутствует внутри эшафот. Пятна: Stevenel Синий и фон Гизону picrofuchsin. В этих условиях, кости, клетки, и кораллами окрашивается в красный цвет, синий и коричневый, соответственно. Шкала бар = 500 мкм. ACS = Акропора коралла подмости; BN = кости. (Печатается с разрешения Tissue Eng Часть C, 2013, 19 (4), 271-280) Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
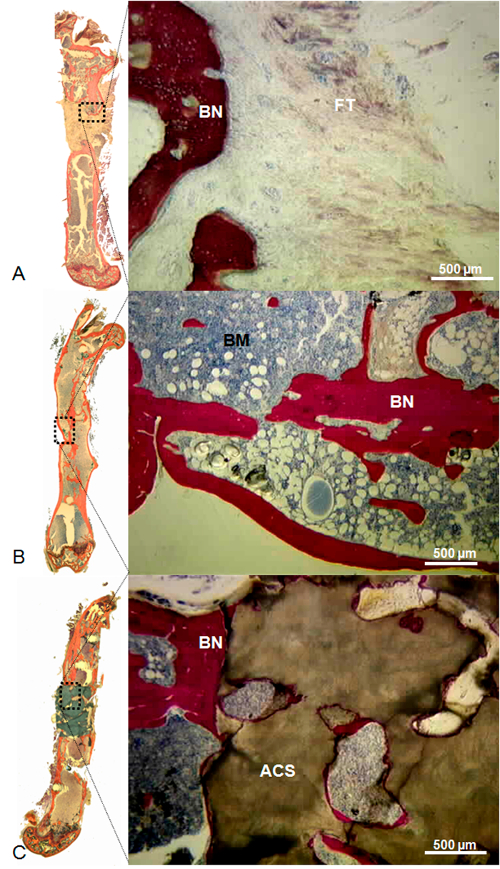
Рисунок 10: предста ставитель Гистология Дефект остается пустым (A), наполненная Массивная сингенных костным трансплантатом (B), и заполняли с коралловым строительные леса (С). В дефект остается пустым, округление костлявых края с медуллярной пломбирования каналов и обильным фиброзной ткани глубокой в дефект наблюдались. В дефект, наполненную массивной сингенных костного трансплантата, наблюдалась преемственность кости между трансплантатом и окружающими костными краями; костный мозг присутствовал на протяжении исходной полости. В дефект, заполненный коралловым эшафот, наблюдалась новообразованная кость между окружающими костными краями и коралловым эшафот, но мало костей присутствовала внутри эшафот. Пятна: Stevenel Синий и фон Гизону picrofuchsin. В этих условиях, кости, клетки, и кораллами окрашивается в красный цвет, синий и коричневый, соответственно. Шкала бар = 500 мм. ACS, коралловые подмости; BN, кости; БМ, костный мозг; FT, фиброзная ткань. (Печатается с разрешения Tissue Eng Часть C, 2013, 19 (4), 271-280)OAD / 52940 / 52940fig10large.jpg "целевых =" _blank "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.

Анимированные / видео Рисунок 1: представитель видео походкой мыши один день в послеоперационном периоде. Полная масса наблюдалась подшипника. Пожалуйста , нажмите здесь , чтобы просмотреть это видео.
Обсуждение
Внематочная имплантации ортопедических связанных материалов и устройств на мышах обычно проводится для оценки кости , образующую потенциала различных каркасах 13,14. Важные различия, однако существуют между внематочной и ортотопической модели, в том числе родных факторов остеогенной сигнализации и паракринной взаимодействия с принимающими кости клеток, образующих.
Настоящее исследование устанавливает воспроизводимый мышиный большой сегментарный, критический размер бедренной кости дефект (3,5 мм, примерно 20-25% от длины бедренной кости). Учитывая размер такого дефекта и стабильности, обеспечиваемой в результате пластины остеосинтеза, эта модель имитирует клинически попавшееся атрофический кости несоюзных.
Послеоперационный период времени выбран в настоящем исследовании, в соответствии с описанными ранее не союзные модели мышей, демонстрируя отсутствие адекватного исцеления после 8 до 12 недель 4,9,15,16.
Самое главное, что reproduCible и стабильный остеосинтез, а также стабильность имплантированных заменителей костной ткани , были получены без значительной заболеваемости и смертности 1,2 с использованием как крепежного элемента и зажимного приспособления для выполнения ostectomy. Этот результат контрастирует также результаты сообщили , когда либо внешний фиксатор или остеосинтеза были использованы 4,5,17-24. Для внешних фиксаторов потенциальных К недостаткам можно отнести: изменчивость в жесткости, инфекции штырьки путей, ослабив штифтов, потенциалы травм из-за булавок и веса материалов (от 4 до 20% от массы тела мыши). Для остеосинтеза потенциальные недостатки включают в себя: заполнение костномозговой полости с ногтем и ятрогенного повреждения суставных поверхностей.
Другие мышиные сегментные, критического размера бедренные дефекты , стабилизированные пластины остеосинтеза были описаны с дефектом кости , созданного заусенца и в пределах от 1,5 до длины 16,25 2 мм. В гое настоящая модель, использование джиг и пильного проволоки позволило точную 3,5 мм длиной ostectomy без существенных мышц травмы.
Однако, чтобы добиться успеха в выполнении процедуры следует взять на себя внимание несколько ключевых моментов: Не используйте маленький мышей (голых мышей, либо с весом до 25 г или в возрасте до 8 недель) в противном случае пластина должна быть слишком длинным. При приближении к бедренной кости, заботиться о сохранении как седалищного нерва каудально и суставной капсулы дистально. Нанесите пластину на передней стороне бедренной кости, и так как выравнивание пластины определяется применением этого первого винта, позаботиться, чтобы расположить пластину параллельно бедренной кости при вставке этот первый винт.
Перед тем как сделать ostectomy, позаботиться, чтобы выполнять круговое рассечение бедренной кости в середине диафиза, чтобы избежать мышечной травмы. При выполнении ostectomy, помощник хирурга должен твердо держать направляющую и СурGeon должен быть осторожным (я), чтобы не зацепить пильной проволоки, (б) использовать средние две трети проволоки при применении постоянного устойчивую напряженность, и (III), чтобы избежать избыточного движения, чтобы получить прямой разрез кости.
Кость исцеление возможно в данной модели при условии, используется костный трансплантат. Кроме того, эта модель позволяет дальнейшие исследования механизмов, участвующих в стратегии замены кости, когда либо человеческого происхождения-трансплантаты или клетки используются в хорошо стандартизированной, большой, сегментарной, костный дефект.
Кроме того, в соответствии с современными тенденциями , требующих уточнения и сокращение использования животных в ортопедии , связанных с исследованиями, эта модель может быть использована в сочетании с методами визуализации в естественных условиях , таких как биолюминесценции. Такие неинвазивные методы позволяют мониторинг как имплантированный выживаемость клеток и заживление тканей , не требуя жертвоприношения животных 26.
Основные ограничения данной модели являются какУсловия несущие и объем костного дефекта, созданного, потому что они не полностью имитируют те, которые встречаются клинически в организме человека. Другие ограничения модели (я) радио-помутнение пластины , которая может потребовать удаления пластины перед тем экс естественных условиях μCT анализа и может осложнить интерпретацию продольных рентгенографических результатов обследования и, (б) невозможность модулировать пластины жесткости , которая может быть ключевым параметром механического в формировании костной ткани 27-30.
Следует иметь в виду также, при использовании либо кости изотрансплантат или другие каркасы, содержащие минеральные компоненты (в частности, карбонат кальция), что некоторые смещения введены в процессе сегментации анализа микро-КТ, потому что новообразованный плотность костной ткани частично перекрывается либо плотность изотрансплантат или плотность строительных лесов. По этой причине объем кости получить путем анализа микро-КТ в основном отражают объем минерализованные ткани (новообразованной кости плюсзаменитель костной ткани) 11,26,31.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Авторы выражают благодарность Rena Bizios за ее ценные замечания по рукописи.
Материалы
| Name | Company | Catalog Number | Comments |
| α-MEM , Minimum Essential Medium Eagle | Sigma-Aldrich, France | M4526 | 500 ml |
| Acropora sp. coral exoskeleton cubes, Biocoral® | Biocoral®, Inoteb, France | 3 x 3 x 3 mm cubes, autoclaving (121 °C for 20 min) sterilization | |
| Buprenorphine, Buprecare® | Axience, Pantin, France | 0.3 mg/ml | |
| Xylazine, Rompun® 2% | Bayer HealthCare, Puteaux, France | 20 mg/ml | |
| Ketamine, Ketamine 500® | Virbac, Carros, France | 50 mg/ml | |
| Isoflurane, Forène® | Abbott, Arcueil, France | ||
| Enrofloxacine, Baytril® 5% | Bayer HealthCare, Puteaux, France | 50 mg/ml | |
| Pentobarbital, Dolethal® | Vétoquinol, Lure, France | 182.2 mg/ml | |
| Anesthetizing box | Ugo Basile, Gemonio, Italy | 7900/10 | |
| Plastic transparent sterile drape, BusterOpCover 30 x 45 cm | Buster, Coveto, Montagu, France | 613867 | |
| 10% povidone iodine, Vétédine® Solution | Vétoquinol, Lure, France | 100 mg/ml | |
| Titanium micro- locking plate, MouseFix Plate XL | RISystem AG, Davos, Switzerland, http://www.risystem.com/ | RIS.401.120 | 6 holes, 10 mm long and 1.5 mm wide, autoclaving (121 °C for 20 min) sterilization or cold sterilzation (ethylene oxide) |
| 0.3 mm drill bit, Drill Bit 0.30 mm | RISystem AG, Davos, Switzerland, http://www.risystem.com/ | RIS.592.200 | autoclaving (121 °C for 20 min) sterilization or cold sterilzation (ethylene oxide) |
| Engine power | RISystem AG, Davos, Switzerland, http://www.risystem.com/ | AccuPen | Cold sterilzation (ethylene oxide) |
| Screw driver, Handrill | RISystem AG, Davos, Switzerland, http://www.risystem.com/ | RIS.390.130 | autoclaving (121 °C for 20 min) sterilization or cold sterilzation (ethylene oxide) |
| Self-tapping locking screws, MouseFix Screw 2 mm | RISystem AG, Davos, Switzerland, http://www.risystem.com/ | RIS.401.100 | 2 mm long, 0.47 mm outer diameter and 0.34 mm core diameter, autoclaving (121 °C for 20 min) sterilization or cold sterilzation (ethylene oxide) |
| Jig, MouseFix XL Drill and Saw Guide | RISystem AG, Davos, Switzerland, http://www.risystem.com/ | RIS.301.103 | 3.5 mm between the slots, autoclaving (121 °C for 20 min) sterilization or cold sterilzation (ethylene oxide) |
| 0.22-mm Gigli saws (0.22 mm Saws) | RISystem AG, Davos, Switzerland | ||
| 5.0 glycomer 631, Biosyn | Covidien, Vétoquinol, Lure, France | Tapper-cut needle | |
| 4.0 glycomer 631, Biosyn | Covidien, Vétoquinol, Lure, France | Tapper-cut needle | |
| X-ray, MX20 | Faxitron X-ray Corp, Edimex, Le Plessis Grammorie | ||
| In vivo high-resolution microcomputed tomography, Skyscan 1176 | Skyscan, Aartselaar, Belgium | ||
| Ex vivo high-resolution microcomputed tomography, Skyscan 1172 | Skyscan, Aartselaar, Belgium | ||
| Resident software: Nrecon (v1.6.9) / Ctan (v.1.14.4) | Skyscan, Aartselaar, Belgium |
Ссылки
- Auer, J. A., et al. Refining animal models in fracture research: seeking consensus in optimising both animal welfare and scientific validity for appropriate biomedical use. BMC Musculoskelet Disord. 8 (72), (2007).
- Histing, T., et al. Small animal bone healing models: standards, tips, and pitfalls results of a consensus meeting. Bone. 49 (4), 591-599 (2011).
- Horner, E. A., et al. Long bone defect models for tissue engineering applications: criteria for choice. Tissue Eng. Part B Rev. 16 (2), 263-271 (2010).
- Srouji, S., et al. A model for tissue engineering applications: femoral critical size defect in immunodeficient mice. Tissue Eng. Part C Methods. 17 (5), 597-606 (2011).
- Thompson, Z., Miclau, T., Hu, D., Helms, J. A. A model for intramembranous ossification during fracture healing. J Orthop Res. 20 (5), 1091-1098 (2002).
- Harris, J. S., Bemenderfer, T. B., Wessel, A. R., Kacena, M. A. A review of mouse critical size defect models in weight bearing bones. Bone. 55 (1), 241-247 (2013).
- Garcia, P., et al. The LockingMouseNail--a new implant for standardized stable osteosynthesis in mice. J. Surg. Res. 169 (2), 220-226 (2011).
- Garcia, P., Histing, T., Holstein, J. H., Pohlemann, T., Menger, M. D. Femoral non-union models in the mouse. Injury. 41 (10), 1093-1094 (2010).
- Garcia, P., et al. Development of a reliable non-union model in mice. J. Surg. Res. 147 (1), 84-91 (2008).
- Viateau, V., Logeart-Avramoglou, D., Guillemin, G., Petite, H., Conn, P. M. Animal Models for bone tisue enginering purposes. Sourcebook of models for biomedical research. , 725-738 (2008).
- Manassero, M., et al. A novel murine femoral segmental critical-sized defect model stabilized by plate osteosynthesis for bone tissue engineering purposes. Tissue Eng. Part C Methods. 19 (4), 271-280 (2013).
- Matthys, R., Perren, S. M. Internal fixator for use in the mouse. Injury. 40 Suppl 4, S103-S109 (2009).
- Becquart, P., et al. Ischemia is the prime but not the only cause of human multipotent stromal cell death in tissue-engineered constructs in vivo. Tissue Eng. Part A. 18 (19-20), 2084-2094 (2012).
- Deschepper, M., et al. Proangiogenic and prosurvival functions of glucose in human mesenchymal stem cells upon transplantation. Stem Cells. 31 (3), 526-535 (2013).
- Oetgen, M. E., Merrell, G. A., Troiano, N. W., Horowitz, M. C., Kacena, M. A. Development of a femoral non-union model in the mouse. Injury. 39 (10), 1119-1126 (2008).
- Liu, K., et al. A murine femoral segmental defect model for bone tissue engineering using a novel rigid internal fixation system. J Surg Res. 183 (2), 493-502 (2013).
- Zwingenberger, S., et al. Establishment of a femoral critical-size bone defect model in immunodeficient mice. J Surg Res. 181 (1), e7-e14 (2013).
- Cheung, K. M., et al. An externally fixed femoral fracture model for mice. J. Orthop Res. 21 (4), 685-690 (2003).
- Claes, L., et al. Hyperhomocysteinemia is associated with impaired fracture healing in mice. Calcif. Tissue Int. 85 (1), 17-21 (2009).
- Drosse, I., et al. Validation of a femoral critical size defect model for orthotopic evaluation of bone healing: a biomechanical, veterinary and trauma surgical perspective. Tissue Eng. Part C Methods. 14 (1), 79-88 (2008).
- Holstein, J. H., et al. Advances in the establishment of defined mouse models for the study of fracture healing and bone regeneration. J. Orthop. Trauma. 23 (5 Suppl), S31-S38 (2009).
- Johnson, K. D., August, A., Sciadini, M. F., Smith, C. Evaluation of ground cortical autograft as a bone graft material in a new canine bilateral segmental long bone defect model. J. Orthop. Trauma. 10 (1), 28-36 (1996).
- Meinig, R. P., Buesing, C. M., Helm, J., Gogolewski, S. Regeneration of diaphyseal bone defects using resorbable poly(L/DL-lactide) and poly(D-lactide) membranes in the Yucatan pig model. J. Orthop. Trauma. 11 (8), 551-558 (1997).
- Wu, J. J., Shyr, H. S., Chao, E. Y., Kelly, P. J. Comparison of osteotomy healing under external fixation devices with different stiffness characteristics. J. Bone Joint Surg. Am. 66 (8), 1258-1264 (1984).
- Xing, J., et al. Establishment of a bilateral femoral large segmental bone defect mouse model potentially applicable to basic research in bone tissue engineering. J. Surg. Res. 192 (2), 454-463 (2014).
- Manassero, M., et al. Comparison of Survival and Osteogenic Ability of Human Mesenchymal Stem Cells in Orthotopic and Ectopic Sites in Mice. Tissue Eng. Part A. 22 (5-6), 534-544 (2016).
- Bos, R. R., et al. Degradation of and tissue reaction to biodegradable poly(L-lactide) for use as internal fixation of fractures: a study in rats. Biomaterials. 12 (1), 32-36 (1991).
- Oest, M. E., Dupont, K. M., Kong, H. J., Mooney, D. J., Guldberg, R. E. Quantitative assessment of scaffold and growth factor-mediated repair of critically sized bone defects. J.Orthop. Res. 25 (7), 941-950 (2007).
- Pihlajamaki, H., Bostman, O., Tynninen, O., Laitinen, O. Long-term tissue response to bioabsorbable poly-L-lactide and metallic screws: an experimental study. Bone. 39 (4), 932-937 (2006).
- Rai, B., et al. Combination of platelet-rich plasma with polycaprolactone-tricalcium phosphate scaffolds for segmental bone defect repair. J. Biomed. Mater Res. A. 81 (4), 888-899 (2007).
- Komlev, V. S., et al. Kinetics of in vivo bone deposition by bone marrow stromal cells into porous calcium phosphate scaffolds: an X-ray computed microtomography study. Tissue Eng. 12 (12), 3449-3458 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены