Method Article
Istituzione di un segmentale femorale critico-size difetto del modello in topi stabilizzati da osteosintesi Piastra
In questo articolo
Riepilogo
Although mouse models are invaluable tools for bone tissue engineering, models of long bone defects are sparse. This need motivated development of the present protocol which uses a locking plate with four screws and a dedicated jig to perform and stabilize a reproducible, femoral, critical-size defect with low morbidity.
Abstract
The use of tissue-engineered bone constructs is an appealing strategy to overcome drawbacks of autografts for the treatment of massive bone defects. As a model organism, the mouse has already been widely used in bone-related research. Large diaphyseal bone defect models in mice, however, are sparse and often use bone fixation which fills the bone marrow cavity and does not provide optimal mechanical stability. The objectives of the current study were to develop a critical-size, segmental, femoral defect in nude mice. A 3.5-mm mid-diaphyseal femoral ostectomy (approximately 25% of the femur length) was performed using a dedicated jig, and was stabilized with an anterior located locking plate and 4 locking screws. The bone defect was subsequently either left empty or filled with a bone substitute (syngenic bone graft or coralline scaffold). Bone healing was monitored noninvasively using radiography and in vivo micro-computed-tomography and was subsequently assessed by ex vivo micro-computed-tomography and undecalcified histology after animal sacrifice, 10 weeks postoperatively. The recovery of all mice was excellent, a full-weight-bearing was observed within one day following the surgical procedure. Furthermore, stable bone fixation and consistent fixation of the implanted materials were achieved in all animals tested throughout the study. When the bone defects were left empty, non-union was consistently obtained. In contrast, when the bone defects were filled with syngenic bone grafts, bone union was always observed. When the bone defects were filled with coralline scaffolds, newly-formed bone was observed in the interface between bone resection edges and the scaffold, as well as within a short distance within the scaffold.
The present model describes a reproducible critical-size femoral defect stabilized by plate osteosynthesis with low morbidity in mice. The new load-bearing segmental bone defect model could be useful for studying the underlying mechanisms in bone regeneration pertinent to orthopaedic applications.
Introduzione
Massive difetti ossei diafisarie sono una grande sfida per il chirurgo ortopedico. la sostituzione ossea con innesto osseo autologo, attualmente considerato come il trattamento gold-standard, è in quantità limitata ed è associata a morbidità raccolta legate. Per queste ragioni, costrutti osso tissutale, che conciliano cellule staminali mesenchimali del midollo osseo con ponteggi osteoconduttive sono stati esplorati come alternativa per autotrapianti in chirurgia ortopedica.
Fino ad oggi, la maggior parte degli studi sono stati condotti in modelli animali clinicamente rilevanti, quali cani, maiali e pecore 1-3, ma la valutazione preliminare di questi costrutti in ortotopico, segmentale, difetti ossei critico-size in modelli animali di piccola (come topi) potrebbe avere diversi vantaggi: (i) le spese basse, (ii) un gran numero di animali possono essere azionati; (Iii) in contrasto con grandi modelli animali, omogeneità dei ceppi di topi limita variazioni individuali scaffold riassorbimento unND formazione ossea e; (Iv) soprattutto, la disponibilità di anticorpi specifici e animali gene targeting consentono la valutazione del processo biologico coinvolto nella guarigione ossea. Ultimo ma non meno importante, l'uso di ceppi di topi immunodeficienti consente anche studi usando sia innesti o cellule di origine umana senza risposte immunitarie avverse nei topi.
Nonostante i vantaggi di cui sopra, enormi modelli difetto osseo diafisarie nei topi sono scarsi. La maggior parte di tali modelli utilizzano fissaggio osseo con un perno intramidollare che riempie la cavità del midollo osseo (limitando così il volume di materiale da testare) e ostacola anche la riproducibilità non fornendo rotazione ed assiale stabilità 2,4-7.
Gli obiettivi di questo studio sono: (i) simulando una situazione di non-union ossa clinica, per descrivere un riproducibili, critica-size, segmentale, modello di difetto femorale in topi, che è stabilizzata da accurate e riproducibili osteosynth bloccaggio a lamelleESIS che fornisce un ambiente biomeccanico altamente stabile 8-10; (Ii) illustrare il modello presente con due potenziali sostituti ossei e descrivere analisi formazione ossea che potrebbe essere utilizzato.
Protocollo
Etica Dichiarazione: I topi utilizzati nel presente studio sono stati trattati in conformità con le linee guida pubblicate dal Comitato europeo per la "cura e l'uso di animali da laboratorio" (Direttiva 2010/63 / UE e la Convenzione europea ETS 123). Il protocollo sperimentale è stato approvato dal Comitato Etico della Facoltà di Medicina Lariboisière Saint-Louis (CEEA LV / 2010-01-04).
1. Gli animali
- Utilizzare topi atimici (10 settimane). Utilizzare un numero minimo di 6 topi con difetti lasciati vuoti come gruppo di controllo negativo.
2. Preparazione Ponteggi
- Singenici Graft Preparazione
- Utilizzare isograft osso per riempire il difetto di fornire gruppo di controllo con un numero minimo di 6 animali.
- Ottenere isografts osso di raccolta escisse osso femorale da topo appartenenti a una "difetti lasciati vuoti o" difetti pieni di corallo impalcatura "gruppi (THè evita l'uso di animali in più per raccogliere isograft osso) 11.
- Lavare l'osso resecato con tampone fosfato (PBS) e mantenerlo sterile umida impacco di garza.
- Coral Ponteggio Preparazione
- Utilizzare impalcatura che sono fatti di corallo naturale: Acropora sp. cubi esoscheletro corallo, 3 x 3 x 3 mm, come potenziale sostituto osseo con un minimo di 6 animali.
- Intagli a mano ogni cubo corallo alla forma del cilindro (3,5 altezza; diametro di 2 mm).
- Sterilizzare ogni scaffold in autoclave (121 ° C per 20 min), lavare con PBS sterile, e immerso in mezzo di coltura completo (α-MEM) per 24 ore prima dell'impianto in topi.
3. procedure di anestesia e l'analgesia
- Fornire analgesia preventiva, 15 min prima dell'anestesia, per iniezione sottocutanea di buprenorfina (0,1 mg / kg di peso corporeo dell'animale).
- Applicare una pomata nell'animaleocchi per prevenire la secchezza ogni 30 minuti mentre gli animali sono sotto anestesia.
- Mettere i topi su un blocco di riscaldamento per evitare l'ipotermia.
- Anestesia e Analgesia durante la procedura chirurgica
- Iniettare intraperitoneale una soluzione contenente xilazina (8 mg / kg) e ketamina (100 mg / kg).
- Fornire ossigeno mediante flusso-by (50 ml / min).
- Conferma adeguata profondità dell'anestesia dalla presenza di buon rilassamento muscolare e mancanza di risposta animale ad uno stimolo nocivo (ad es., Società punta pinch).
- Iniettare per via sottocutanea di una singola dose dell'enrofloxacina (0,05 mg / kg) come profilassi microbici.
- Analgesia post-operatoria
- Fornire postoperatoria mediante iniezione sottocutanea di buprenorfina (0,1 mg / kg) ogni 12 ore per 3 giorni consecutivi.
- Anestesia durante le procedure diagnostiche per immagini
- Mettere i topi in un anesthetizing-box, e quindi indurre e mantenere l'anestesia con circa il 4% e il 2% isoflurano in ossigeno, rispettivamente.
- Conferma un'adeguata profondità dell'anestesia dalla buona rilassamento muscolare animale e la mancanza di movimento.
- Condizioni di recupero
- Mantenere i topi sul pad riscaldamento fino al completo recupero
- Non lasciare un animale incustodito fino a quando non ha ripreso conoscenza sufficiente a mantenere decubito sternale dopo l'intervento chirurgico.
- Non restituire un animale che ha subito un intervento chirurgico per la compagnia di altri animali fino alla completa guarigione.
- Condizioni post-operatorie
- Ospitare i topi separatamente durante i primi 3 giorni ospiterà i topi da 4 nelle gabbie dopo giorno 3.
- Fornire acqua e adattato libitum cibo annuncio. Lasciare i topi di peso-orso, senza alcuna restrizione di attività per tutto il periodo post-operatorio.
4. Procedura chirurgica:Femorale segmentale Defect Modello 11,12
- Dopo l'anestesia, inserire ogni mouse in decubito ventrale con l'arto posteriore sinistra in estensione.
- Scrub l'arto per la chirurgia asettica utilizzando 10% di povidone iodio per 5 minuti e poi posizionare una garza sterile sotto l'arto per creare una superficie sterile (un telo trasparente sterile è utilizzato per essere in grado di monitorare il movimento respiratorio durante la procedura). Si ha cura di mantenere la sterilità del campo operatorio durante la procedura.
- Fare un 15 - 17 mm incisione cutanea longitudinale sulla faccia antero-laterale del femore, che si estende dal anca al giunto ginocchio.
- Incidere la fascia lata, dividere il muscolo vasto laterale e muscolo bicipite femorale per esporre l'intera lunghezza della diafisi femorale. Si deve usare cautela per preservare il nervo sciatico caudalmente e la capsula articolare distale (Figura 1).
- Per migliorare femorale expo diafisicerto, transetto il muscolo gluteo e bicipite femorale dal 3 trocantere.
- Effettuare una dissezione circolare del femore al centro della diafisi.
- Applicare una titanio piastra di micro-bloccaggio a 6 buche (10 mm di lunghezza; 1,5 mm di larghezza, peso: 30 mg) sul lato femorale anteriore.
NOTA: I fori della piastra, che sono conicamente incassati con una porzione cilindrica, ospitare titanio autofilettanti viti di bloccaggio (lungo 2 mm, diametro esterno 0,47 millimetri, peso: 5 mg, con superficie inferiore della vite a testa filettata per consentire il bloccaggio entro il foro della placca) che sono collegati ad uno stelo, che torce quando bloccato. - Eseguire il foro più prossimale della piastra con una punta 0,3 mm e sia la potenza del motore dedicato o potenza motrice non dedicata funzionare a 2,500 rpm a circa 500 mW 12).
- Inserire la prima vite con un cacciavite dedicato e quindi bloccarla (Figura 2).
NOTA: Dato che l'allineamento di tegli piastra è calcolato applicando questa prima vite, è importante posizionare la piastra parallela al femore durante l'inserimento della vite. - Eseguire il foro più distale della piastra in modo simile, inserire e bloccare la vite (Figura 3).
- Inserire, ma non fare blocco, le altre due viti esterne.
- Posizionare il filo di 0,22 millimetri Gigli vide strettamente attorno all'osso in un orientamento medio-laterale e quindi inserire nelle asole della dima (Figura 4).
- Inserire la dima dedicato sul gambo delle ultime due viti e applicarlo sopra la piastra (Figura 5).
- Eseguire un ostectomia femorale lunga 3,5 mm metà diafisario utilizzando il Gigli ha visto sotto irrigazione (mediante soluzione isotonica salina sterile) per evitare necrosi termica. Hanno l'assistente del chirurgo prendere la maschera. Avere il chirurgo applica una tensione costante costante. Fare attenzione a non groviglio il filo sega e di utilizzare al centro due terzi del filo. Evitare exmovimento processo per ottenere un taglio dritto osso (Figura 6).
- Dopo la ostectomia, rimuovere la Gigli ha visto. Per evitare danni dei tessuti molli, tagliare la sega a filo vicino al osso da un lato.
- Rimuovere la dima e bloccare le ultime due viti (Figura 7).
- O lasciare il difetto segmentale vuoto o chirurgicamente riempirlo mettendo materiali da testare all'interno del difetto.
- Abbondantemente risciacquare il campo chirurgico con soluzione isotonica salina sterile.
- Posizionare il muscolo vasto laterale liberamente sopra la piastra. Chiudere la fascia e piani sottocutanei utilizzando un semplice modello di sutura continua e 5,0 glycomer 631 sutura; chiudere la pelle con un semplice modello di sutura interrotta usando 4.0 glycomer 631 sutura. In alternativa, è anche possibile chiudere la pelle con colla di pelle.
5. In Vivo valutazioni di rigenerazione ossea
- Con i topi sotto anestesia, eseguire radiograficovalutazioni in maniera longitudinale, utilizzando sia i raggi X convenzionali (26 kV, 10 sec; 2X ingrandimento; 20 linee / mm risoluzione spaziale) e ad alta risoluzione di micro-tomografia computerizzata (μCT).
- Per l'analisi μCT, acquisire immagini con una risoluzione di 36 micron (50 kV e 478 mA, a 40 msec tempo di esposizione, utilizzando una di filtro 0,5 millimetri di alluminio, fase di rotazione di 0,7 °, e la rotazione tomografica di 180 °). Analizzare le immagini utilizzando il software residente.
6. Le valutazioni ex vivo di rigenerazione ossea
- Dieci settimane dopo l'intervento, indurre l'anestesia con isoflurano in ossigeno, e quindi sacrificare i topi mediante iniezione intraperitoneale di una dose eccessiva di barbiturici (1 ml di pentobarbital).
- Asportare le ossa femorali, rimuovere la sovrapposizione tessuto muscolare, e fissare i campioni di ossa in paraformaldeide al 4% (pH 7,4) per quattro giorni.
- Rimuovere la placca e le viti da ogni campione di osso asportati dopo paraformaldeide FIXAzione.
- Ex Vivo μ Analisi CT
- Mettere ogni osso asportato e fissati in tubi di polietilene riempito con il 75% di alcol e analizzarli utilizzando ex vivo μCT.
- Acquisire le immagini a 80 kV e 100 mA (tempo di esposizione di 1.000 msec, alluminio 0,5 filtro e 4 micron dimensione del pixel fotocamera (2.400 x 4.000 con una dimensione voxel di 7 micron), media quattro fotogrammi per ogni incremento di rotazione di 0,9 °.
- Ricostruire le immagini in 3 dimensioni (dimensione media voxel di 13 micron) con un back-proiezione Hamming-filtrata con il software residente.
- Per l'analisi quantitativa della formazione ossea, utilizzare software residente per ottenere il volume di tessuto mineralizzato (soglia inferiore grigia 45 indici scala di grigi e la soglia grigio superiore 240 indici scala di grigi) in una regione determinata e coerente di interesse corrispondente al difetto.
- Eseguire analisi nello stesso modo per ogni mouse con la stessa regione di interesse.
- Utilizzare il test unidirezionale analisi (intervallo di confidenza - al 95% e il livello significativo con p <0,05) per confrontare il tasso unione ossea e il volume di tessuto mineralizzato nella regione di interesse tra i gruppi.
- analisi istologica
- Incorpora ogni asportato e fissato osso femorale in resina di metacrilato di metile e di processo per l'istologia undecalcified.
- Tagliare ciascun campione osso longitudinalmente in sezione di spessore (200 micron) con un raffreddamento ad acqua sega circolare diamantata.
- Macinare ogni sezione campione osseo fino a uno spessore di 100 micron, lucidare e macchiare utilizzando Stevenel macchie blu e van Gieson picrofuchsin.
NOTA: Dopo la colorazione, le cellule appaiono in blu, osso in rosa, e corallo in marrone al microscopio ottico.
Risultati
Le suddette procedure chirurgiche durate dal 45 a 60 min. Ostectomia e osteosintesi erano facili da eseguire con l'aiuto di assistente di un chirurgo ma senza usare alcun sistema di ingrandimento. Non si sono verificate complicanze intraoperatorie. In uno studio preliminare su 18 topi 11, radiografie postoperatorie fornito prove che la lunghezza difetto osseo (3,43 ± 0,12 millimetri) e il posizionamento piastra (distanza tra la cavità articolare soffocare e la parte distale della piastra = 2,65 ± 0,56 millimetri) erano riproducibili.
Il tasso di mortalità correlata all'anestesia era di circa il 5%.
Il recupero funzionale dell'arto operato era eccellente in tutti gli animali e pieno portante è stata osservata entro un giorno dopo l'intervento chirurgico (Animated Figura 1). Il peso del osteosintesi (placca e viti) utilizzato nella pstudio resent era circa 0,1% del peso corporeo mouse. Non ci sono complicanze postoperatorie (ad esempio, infezione della ferita, fallimento dell'impianto, migrazione innesto osseo, ecc) si sono verificati. No autolesionismo o lesioni causate da cagemates si è verificato.
Quando i difetti ossei chirurgicamente indotte sono stati lasciati vuoti, senza significativa formazione ossea è stata osservata con l'osso coerente non-union. Al contrario, quando i difetti sono stati riempiti sia con un isograft o uno scaffold di corallo, osso neoformato estende dal bordo prossimale e distale dell'osso è stato osservato. Inoltre, considerando che la formazione ossea permesso ripristino della continuità ossea in molte difetti trattati con isografts (figura 8), è stato osservato solo all'interno del ponteggio corallo difetti riempiti con questo materiale. Infatti, nessun osso è stata osservata una distanza superiore a 1 mm dai bordi ossei. Assenza di cartilagine in tutta istologico analizza i risultati forniti prova dellastabilità del osteosintesi raggiunto (Figura 9, Figura 10).
Le radiografie e microCT analisi fornite prove del fatto che l'unione delle ossa non si è verificato in tutti gli animali del gruppo di difetto di-sinistra-vuoto, 10 settimane dopo l'impianto. Il volume di tessuto mineralizzato valutati da analisi microCT era 0,8 ± 0,3 mm 3 ed è stato rappresentante del-tessuto osseo formatosi di recente. Nei gruppi impalcatura isograft e corallo, l'unione delle ossa è stato ottenuto in 4 e 4 animali, rispettivamente. Il volume di tessuto mineralizzato valutati da analisi microCT era 4.4 ± 0.9 mm 3 e 8.9 ± 0.7 mm 3. In questi gruppi, tuttavia, perché sia la isograft e il patibolo coralli contenevano minerali, formazione di nuovo osso non poteva essere veramente distinto dal materiale impiantato restante (isograft o impalcatura di corallo). Sia il tasso di unione bon e il volume del tessuto mineralizzato ottenuto dal gruppo isograft edal gruppo scaffold corallo erano significativamente (p <0,001) superiori a quelli ottenuti dal gruppo difetto-sinistra-vuoto.
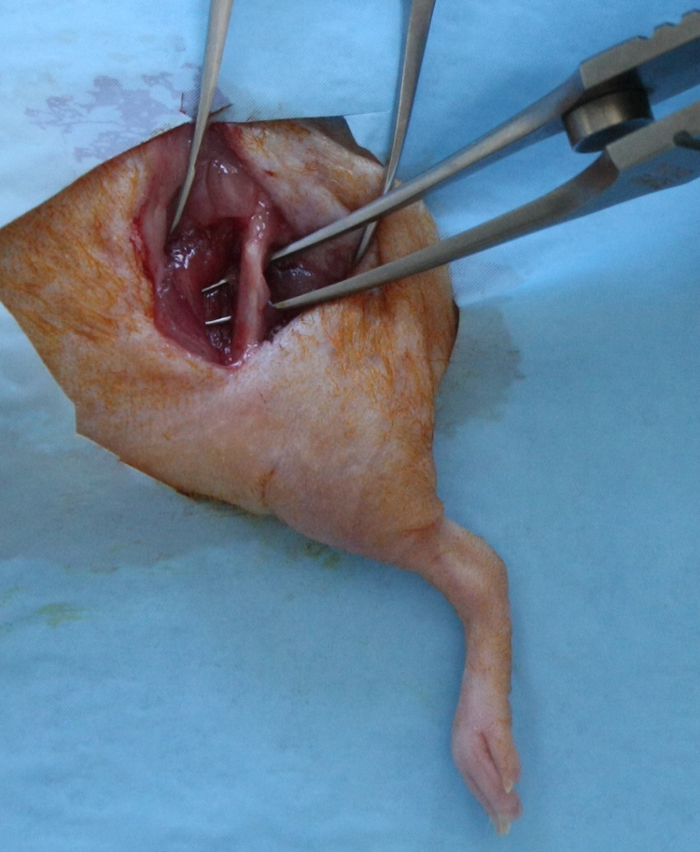
Figura 1:. L'esposizione chirurgica per la creazione della femorale segmentale Defect A 15 - 17 mm incisione cutanea longitudinale, che si estende dal anca al giunto ginocchio, è stata fatta sulla faccia antero-laterale del femore. La fascia lata è stato inciso; il muscolo vasto laterale e muscolo bicipite femorale sono stati divisi per esporre l'intera lunghezza della diafisi femorale. Clicca qui per vedere una versione più grande di questa figura.
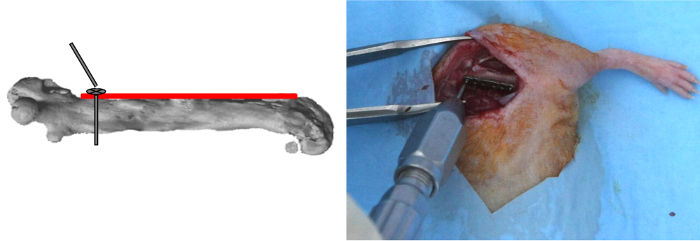
Figura 2: PiastraPosizionamento e prossimale vite Placement. La targa è stata applicata sul lato femorale anteriore. Il foro più prossimale della placca è stato perforato; la prima vite è stato inserito e, quindi, chiusa a chiave. Clicca qui per vedere una versione più grande di questa figura.
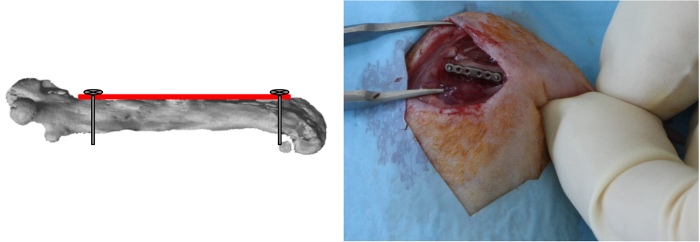
Figura 3:. Distal Screw Placement Il foro più distale della placca è stato perforato e la vite è stato inserito e bloccato. (Ristampato con il permesso di tessuto Eng parte C 2013, 19 (4), 271-280) Clicca qui per vedere una versione più grande di questa figura.
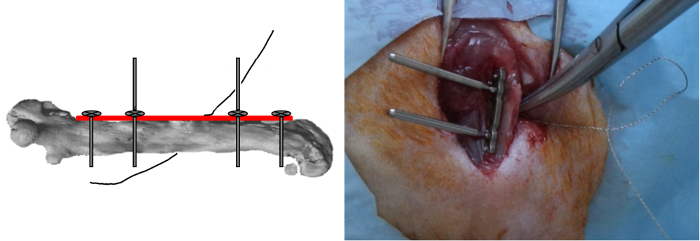
Figura 4: Gigli Sega di posizionamento. Gli altri due viti esterne sono state inserite ma non bloccate e il filo dei 0,22 mm seghe Gigli era legata stretta intorno all'osso in un orientamento medio-laterale. Si prega di cliccare qui per vedere una versione più grande di questa figura.
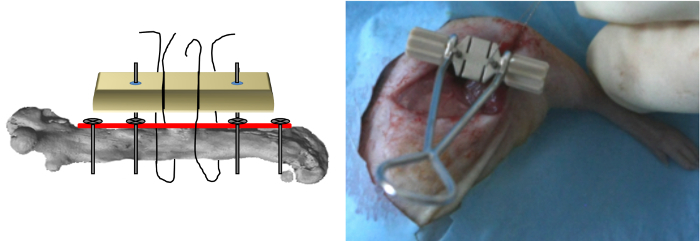
Figura 5: La maschera di posizionamento La maschera è stato inserito sullo stelo degli ultimi due viti e applicato sopra la piastra e il filo della lama è stata quindi inserita nelle scanalature della dima.. (Ristampato con il permesso di tessuto Eng parte C 2013, 19 (4), 271-280) Clicca qui per vedere una versione più grande di questa figura.

Figura 6:. Osteotomia ostectomia è stata eseguita e la sega Gigli è stata ritirata. (Ristampato con il permesso di tessuto Eng parte C 2013, 19 (4), 271-280) Clicca qui per vedere una versione più grande di questa figura.
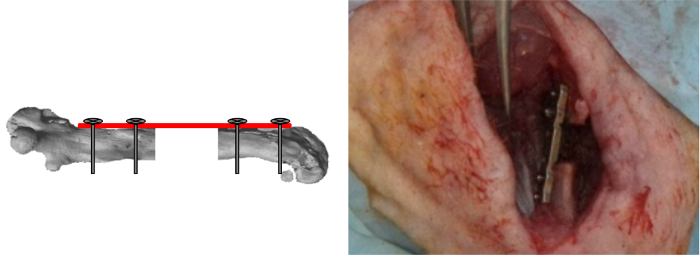
Figura 7:. Viti interne Chiusura La maschera è stata rimossa e le ultime due viti bloccato. I difetti segmentale erano poi o lasciati vuoti o riempiti con i materiali testati. (Ristampato con il permesso di tessuto Eng parte C 2013, 19 (4), 271-280) Clicca qui per vedere una versione più grande di questa figura.
t = "Figura 8" src = "/ files / ftp_upload / 52940 / 52940fig8.jpg" />
Figura 8: Rappresentante postoperatoria radiografie e sagittale μCT ricostruzione dell'osso femorale di topi osso femorale con il rispettivo difetto sia lasciato vuoto (AE), o pieni di enorme osso singenici trapianto (FJ), o pieni di enormi ponteggi corallo Acropora (KO. ); immediatamente dopo l'intervento (A, F, K), 4 settimane dopo l'intervento (B, G, L), 6 settimane dopo l'intervento (C, H, M), e 10 settimane dopo l'intervento (D, E, I, J, N , O) (lamiere di lunghezza = 10 mm). (Ristampato con il permesso di tessuto Eng parte C 2013, 19 (4), 271-280) Clicca qui per vedere una versione più grande di questa figura.
file / ftp_upload / 52940 / 52940fig9.jpg "/>
. Figura 9: Rappresentante Radiografia, μCT Ricostruzione e Istologia di un difetto Riempito con il corallo Patibolo Testato nel presente studio Una grande quantità di osso neoformato è stata osservata in-tra le circostanti bordi ossee e l'impalcatura del corallo; in contrasto, piccolo osso era presente all'interno del ponteggio. Macchie: Stevenel blu e von Gieson picrofuchsin. In queste condizioni, l'osso, le cellule, e corallo macchiate di rosso, blu e marrone, rispettivamente. Barra di scala = 500 micron. ACS = Acropora patibolo corallo; BN = osso. (Ristampato con il permesso di tessuto Eng parte C 2013, 19 (4), 271-280) Clicca qui per vedere una versione più grande di questa figura.
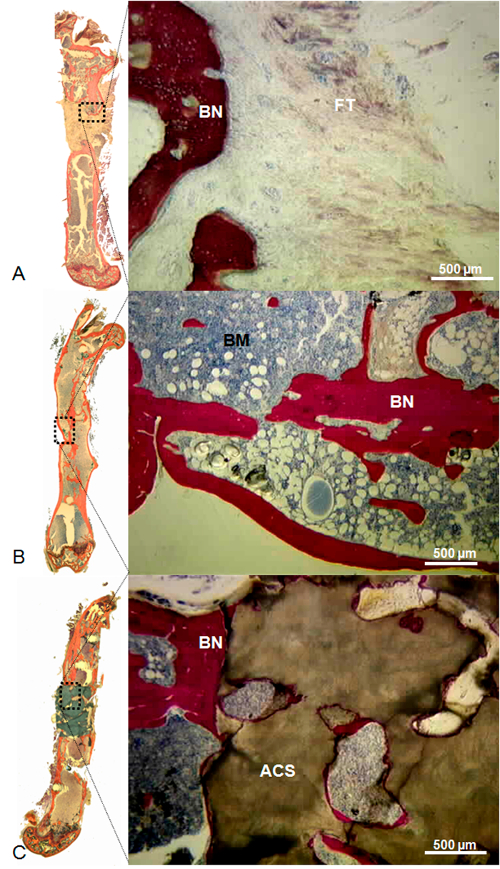
Figura 10: rappre presentante Istologia di un difetto lasciato vuoto (A), pieno di Massive singenici innesto osseo (B), e riempito di corallo Scaffold (C). In difetto lasciato vuoto, l'arrotondamento del ossea bordi con ripieno canale midollare e abbondante tessuto fibroso profondo in difetto sono stati osservati. In difetto riempito con enorme innesto osseo singenici, è stata osservata una continuità ossea tra il trapianto e le circostanti bordi ossei; midollo osseo era presente in tutta la cavità originaria. In difetto pieno di impalcatura corallo, è stata osservata osso neoformato tra le circostanti bordi ossee e il patibolo corallo, ma poco osso era presente all'interno del patibolo. Macchie: Stevenel blu e von Gieson picrofuchsin. In queste condizioni, l'osso, le cellule, e corallo macchiate di rosso, blu e marrone, rispettivamente. Barra di scala = 500 mm. ACS, impalcatura di corallo; BN, osso; BM, del midollo osseo; FT, tessuto fibroso. (Ristampato con il permesso dal tessuto Eng parte C 2013, 19 (4), 271-280)OAD / 52940 / 52940fig10large.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.

Animato / video Figura 1: il video rappresentante l'andatura di un mouse a un post-operatorio giorno. Peso è stata osservata cuscinetto. Cliccate qui per vedere il video.
Discussione
Impiantazione ectopica di materiali e dispositivi in topi ortopedici specifici è comunemente eseguita per valutare l'osso formando funzioni di vari ponteggi 13,14. tuttavia esistono importanti differenze tra i modelli ectopiche e ortotopico, compresi i fattori di segnalazione osteogenic nativi e le interazioni con le cellule paracrini che formano l'osso ospite.
Il presente studio stabilisce un riproducibile grande segmentale murino, critico-size difetti femorale (3,5 mm, circa il 20-25% della lunghezza del femore). Considerando le dimensioni di tale difetto e la stabilità fornita dalla osteosintesi piatto risultante, questo modello imita l'osso atrofica non-union clinicamente incontrato.
Il periodo di tempo post-operatorio scelto nel presente studio, è in linea con i topi modelli non sindacali precedentemente descritti, mostrando una mancanza di un'adeguata guarigione dopo 8 a 12 settimane 4,9,15,16.
Ancora più importante, reproducible e stabile osteosintesi, nonché stabilità dei sostituti ossei impiantati sono stati ottenuti senza morbilità e mortalità 1,2 con l'uso di entrambe piastra di bloccaggio e una maschera per eseguire l'osteotomia. Questo risultato contrasta anche i risultati riportati in cui sia un fissatore esterno o un chiodo endomidollare sono stati utilizzati 4,5,17-24. Per i fissatori esterni potenziali svantaggi includono: variabilità in rigidità, infezioni delle vie perni, allentando i perni, potenziali lesioni dovute ai perni e il peso dei materiali (da 4 a 20% del peso corporeo del mouse). Per il chiodo endomidollare potenziali svantaggi includono: riempimento della cavità midollare con il chiodo e danni iatrogeni delle superfici articolari.
Altri murino segmentale, critica size difetti femorali stabilizzate mediante piastra osteosintesi sono state descritte con difetto osseo creato da una fresa e da 1,5 a 2 mm di lunghezza 16,25. in the presente modello, l'uso di una maschera e un filo sega permesso una precisa osteotomia 3,5 millimetri a lungo senza muscoli significativi traumi.
Tuttavia, per riuscire a eseguire la procedura si dovrebbe prendere in considerazione alcuni punti chiave: non utilizzare piccolo topo (topi nudi o con un peso di meno di 25 grammi o di età inferiore a 8 settimane) altrimenti il piatto dovrebbe essere troppo lungo. Quando si avvicina l'osso femorale, fare attenzione a preservare sia il nervo sciatico caudalmente e la capsula articolare distale. Applicare la piastra sul lato anteriore dell'osso femorale e poiché l'allineamento della piastra è calcolato applicando questa prima vite, avere cura di posizionare la piastra parallela al femore durante l'inserimento questa prima vite.
Prima di effettuare il ostectomia, aver cura di effettuare una dissezione circolare del femore al centro della diafisi per evitare traumi muscolari. Quando si esegue l'osteotomia, l'assistente del chirurgo deve tenere saldamente la guida e il surgeon deve essere attento (i) non aggrovigliare il filo sega, (ii) utilizzare mezzo due terzi del filo durante l'applicazione di una tensione costante costante, e (iii) per evitare il movimento in eccesso per ottenere un taglio dritto osso.
guarigione ossea è possibile nella presente modello fornito un innesto osseo viene utilizzato. Inoltre, questo modello consente ulteriori studi dei meccanismi coinvolti nelle strategie di sostituzione delle ossa quando sia innesti o cellule umane di origine vengono utilizzati in un ben standardizzata grande, segmentale, difetti, osso.
Inoltre, in linea alle tendenze attuali che richiedono la raffinatezza e la riduzione di utilizzo di animali nella ricerca ortopedia legati, questo modello può essere utilizzato in combinazione con in vivo tecniche di imaging come la bioluminescenza. Tali tecniche non invasive permettono di monitorare sia la sopravvivenza delle cellule impiantate e la guarigione dei tessuti senza richiedere il sacrificio di animali 26.
Le principali limitazioni del presente modello sono sia lacondizioni portanti e il volume del difetto osseo creato perché non imitano completamente quelli incontrati clinicamente nell'uomo. Le limitazioni del modello sono (i) la radio-opacità del piatto che può richiedere la rimozione della piastra prima ex vivo μCT analisi e possono complicare l'interpretazione dei longitudinali risultati degli esami radiografici e, (ii) l'impossibilità di modulare piastra rigidezza può essere un parametro chiave meccanica nella formazione dell'osso 27-30.
Si deve tenere a mente anche, quando si utilizza isograft osso o altre impalcature che contengono una componente minerale (in particolare carbonato di calcio), che alcuni pregiudizi vengono introdotti nel processo di segmentazione delle analisi micro-CT, perché la densità ossea di nuova costituzione in parte sovrapposto con sia la densità isograft o densità patibolo. Per questo motivo il volume osseo ottenere dall'analisi micro-CT sono relativi principalmente il volume del tessuto mineralizzato (osso neoformato piùsostituto osseo) 11,26,31.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti.
Riconoscimenti
Gli autori desiderano ringraziare Rena Bizios per i suoi preziosi commenti sul manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| α-MEM , Minimum Essential Medium Eagle | Sigma-Aldrich, France | M4526 | 500 ml |
| Acropora sp. coral exoskeleton cubes, Biocoral® | Biocoral®, Inoteb, France | 3 x 3 x 3 mm cubes, autoclaving (121 °C for 20 min) sterilization | |
| Buprenorphine, Buprecare® | Axience, Pantin, France | 0.3 mg/ml | |
| Xylazine, Rompun® 2% | Bayer HealthCare, Puteaux, France | 20 mg/ml | |
| Ketamine, Ketamine 500® | Virbac, Carros, France | 50 mg/ml | |
| Isoflurane, Forène® | Abbott, Arcueil, France | ||
| Enrofloxacine, Baytril® 5% | Bayer HealthCare, Puteaux, France | 50 mg/ml | |
| Pentobarbital, Dolethal® | Vétoquinol, Lure, France | 182.2 mg/ml | |
| Anesthetizing box | Ugo Basile, Gemonio, Italy | 7900/10 | |
| Plastic transparent sterile drape, BusterOpCover 30 x 45 cm | Buster, Coveto, Montagu, France | 613867 | |
| 10% povidone iodine, Vétédine® Solution | Vétoquinol, Lure, France | 100 mg/ml | |
| Titanium micro- locking plate, MouseFix Plate XL | RISystem AG, Davos, Switzerland, http://www.risystem.com/ | RIS.401.120 | 6 holes, 10 mm long and 1.5 mm wide, autoclaving (121 °C for 20 min) sterilization or cold sterilzation (ethylene oxide) |
| 0.3 mm drill bit, Drill Bit 0.30 mm | RISystem AG, Davos, Switzerland, http://www.risystem.com/ | RIS.592.200 | autoclaving (121 °C for 20 min) sterilization or cold sterilzation (ethylene oxide) |
| Engine power | RISystem AG, Davos, Switzerland, http://www.risystem.com/ | AccuPen | Cold sterilzation (ethylene oxide) |
| Screw driver, Handrill | RISystem AG, Davos, Switzerland, http://www.risystem.com/ | RIS.390.130 | autoclaving (121 °C for 20 min) sterilization or cold sterilzation (ethylene oxide) |
| Self-tapping locking screws, MouseFix Screw 2 mm | RISystem AG, Davos, Switzerland, http://www.risystem.com/ | RIS.401.100 | 2 mm long, 0.47 mm outer diameter and 0.34 mm core diameter, autoclaving (121 °C for 20 min) sterilization or cold sterilzation (ethylene oxide) |
| Jig, MouseFix XL Drill and Saw Guide | RISystem AG, Davos, Switzerland, http://www.risystem.com/ | RIS.301.103 | 3.5 mm between the slots, autoclaving (121 °C for 20 min) sterilization or cold sterilzation (ethylene oxide) |
| 0.22-mm Gigli saws (0.22 mm Saws) | RISystem AG, Davos, Switzerland | ||
| 5.0 glycomer 631, Biosyn | Covidien, Vétoquinol, Lure, France | Tapper-cut needle | |
| 4.0 glycomer 631, Biosyn | Covidien, Vétoquinol, Lure, France | Tapper-cut needle | |
| X-ray, MX20 | Faxitron X-ray Corp, Edimex, Le Plessis Grammorie | ||
| In vivo high-resolution microcomputed tomography, Skyscan 1176 | Skyscan, Aartselaar, Belgium | ||
| Ex vivo high-resolution microcomputed tomography, Skyscan 1172 | Skyscan, Aartselaar, Belgium | ||
| Resident software: Nrecon (v1.6.9) / Ctan (v.1.14.4) | Skyscan, Aartselaar, Belgium |
Riferimenti
- Auer, J. A., et al. Refining animal models in fracture research: seeking consensus in optimising both animal welfare and scientific validity for appropriate biomedical use. BMC Musculoskelet Disord. 8 (72), (2007).
- Histing, T., et al. Small animal bone healing models: standards, tips, and pitfalls results of a consensus meeting. Bone. 49 (4), 591-599 (2011).
- Horner, E. A., et al. Long bone defect models for tissue engineering applications: criteria for choice. Tissue Eng. Part B Rev. 16 (2), 263-271 (2010).
- Srouji, S., et al. A model for tissue engineering applications: femoral critical size defect in immunodeficient mice. Tissue Eng. Part C Methods. 17 (5), 597-606 (2011).
- Thompson, Z., Miclau, T., Hu, D., Helms, J. A. A model for intramembranous ossification during fracture healing. J Orthop Res. 20 (5), 1091-1098 (2002).
- Harris, J. S., Bemenderfer, T. B., Wessel, A. R., Kacena, M. A. A review of mouse critical size defect models in weight bearing bones. Bone. 55 (1), 241-247 (2013).
- Garcia, P., et al. The LockingMouseNail--a new implant for standardized stable osteosynthesis in mice. J. Surg. Res. 169 (2), 220-226 (2011).
- Garcia, P., Histing, T., Holstein, J. H., Pohlemann, T., Menger, M. D. Femoral non-union models in the mouse. Injury. 41 (10), 1093-1094 (2010).
- Garcia, P., et al. Development of a reliable non-union model in mice. J. Surg. Res. 147 (1), 84-91 (2008).
- Viateau, V., Logeart-Avramoglou, D., Guillemin, G., Petite, H., Conn, P. M. Animal Models for bone tisue enginering purposes. Sourcebook of models for biomedical research. , 725-738 (2008).
- Manassero, M., et al. A novel murine femoral segmental critical-sized defect model stabilized by plate osteosynthesis for bone tissue engineering purposes. Tissue Eng. Part C Methods. 19 (4), 271-280 (2013).
- Matthys, R., Perren, S. M. Internal fixator for use in the mouse. Injury. 40 Suppl 4, S103-S109 (2009).
- Becquart, P., et al. Ischemia is the prime but not the only cause of human multipotent stromal cell death in tissue-engineered constructs in vivo. Tissue Eng. Part A. 18 (19-20), 2084-2094 (2012).
- Deschepper, M., et al. Proangiogenic and prosurvival functions of glucose in human mesenchymal stem cells upon transplantation. Stem Cells. 31 (3), 526-535 (2013).
- Oetgen, M. E., Merrell, G. A., Troiano, N. W., Horowitz, M. C., Kacena, M. A. Development of a femoral non-union model in the mouse. Injury. 39 (10), 1119-1126 (2008).
- Liu, K., et al. A murine femoral segmental defect model for bone tissue engineering using a novel rigid internal fixation system. J Surg Res. 183 (2), 493-502 (2013).
- Zwingenberger, S., et al. Establishment of a femoral critical-size bone defect model in immunodeficient mice. J Surg Res. 181 (1), e7-e14 (2013).
- Cheung, K. M., et al. An externally fixed femoral fracture model for mice. J. Orthop Res. 21 (4), 685-690 (2003).
- Claes, L., et al. Hyperhomocysteinemia is associated with impaired fracture healing in mice. Calcif. Tissue Int. 85 (1), 17-21 (2009).
- Drosse, I., et al. Validation of a femoral critical size defect model for orthotopic evaluation of bone healing: a biomechanical, veterinary and trauma surgical perspective. Tissue Eng. Part C Methods. 14 (1), 79-88 (2008).
- Holstein, J. H., et al. Advances in the establishment of defined mouse models for the study of fracture healing and bone regeneration. J. Orthop. Trauma. 23 (5 Suppl), S31-S38 (2009).
- Johnson, K. D., August, A., Sciadini, M. F., Smith, C. Evaluation of ground cortical autograft as a bone graft material in a new canine bilateral segmental long bone defect model. J. Orthop. Trauma. 10 (1), 28-36 (1996).
- Meinig, R. P., Buesing, C. M., Helm, J., Gogolewski, S. Regeneration of diaphyseal bone defects using resorbable poly(L/DL-lactide) and poly(D-lactide) membranes in the Yucatan pig model. J. Orthop. Trauma. 11 (8), 551-558 (1997).
- Wu, J. J., Shyr, H. S., Chao, E. Y., Kelly, P. J. Comparison of osteotomy healing under external fixation devices with different stiffness characteristics. J. Bone Joint Surg. Am. 66 (8), 1258-1264 (1984).
- Xing, J., et al. Establishment of a bilateral femoral large segmental bone defect mouse model potentially applicable to basic research in bone tissue engineering. J. Surg. Res. 192 (2), 454-463 (2014).
- Manassero, M., et al. Comparison of Survival and Osteogenic Ability of Human Mesenchymal Stem Cells in Orthotopic and Ectopic Sites in Mice. Tissue Eng. Part A. 22 (5-6), 534-544 (2016).
- Bos, R. R., et al. Degradation of and tissue reaction to biodegradable poly(L-lactide) for use as internal fixation of fractures: a study in rats. Biomaterials. 12 (1), 32-36 (1991).
- Oest, M. E., Dupont, K. M., Kong, H. J., Mooney, D. J., Guldberg, R. E. Quantitative assessment of scaffold and growth factor-mediated repair of critically sized bone defects. J.Orthop. Res. 25 (7), 941-950 (2007).
- Pihlajamaki, H., Bostman, O., Tynninen, O., Laitinen, O. Long-term tissue response to bioabsorbable poly-L-lactide and metallic screws: an experimental study. Bone. 39 (4), 932-937 (2006).
- Rai, B., et al. Combination of platelet-rich plasma with polycaprolactone-tricalcium phosphate scaffolds for segmental bone defect repair. J. Biomed. Mater Res. A. 81 (4), 888-899 (2007).
- Komlev, V. S., et al. Kinetics of in vivo bone deposition by bone marrow stromal cells into porous calcium phosphate scaffolds: an X-ray computed microtomography study. Tissue Eng. 12 (12), 3449-3458 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon