Method Article
encapsulation cytochrome
Dans cet article
Résumé
Cette procédure décrit comment encapsuler cytochrome c (cyt. C) en silice (SiO 2) sol-gels, processus ces gels pour former bioaerogels, et utiliser ces bioaerogels de reconnaître rapidement l' oxyde nitrique (NO) par une réaction en phase gazeuse. Ce type de protocole peut aider dans le développement futur de biocapteurs ou d'autres dispositifs bioanalytiques.
Résumé
Des applications telles que les capteurs, les batteries et les piles à combustible ont été améliorées grâce à l'utilisation d'aérogels très poreux lorsque des composés fonctionnels sont encapsulés dans les aérogels. Cependant, peu de rapports sur l'encapsulation des protéines dans les sol-gels qui sont traités pour former des aérogels existent. Un procédé d'encapsulation de cytochrome c (cyt. C) dans la silice (SiO 2) sol-gels qui sont traitées dans des conditions surcritiques pour former bioaerogels avec une activité en phase gazeuse pour l' oxyde nitrique (NO) est présenté. Cyt. C est ajoutée à un mélange de sol de silice sous la concentration en protéine et le tampon contrôlée des conditions de force. Le mélange de sol est ensuite gélifiée et le liquide remplissant les pores du gel est remplacé par une série d'échange de solvant avec du dioxyde de carbone liquide. Le dioxyde de carbone est amené à son point critique et évacué hors de former des aérogels secs avec cyt. C encapsulé à l' intérieur. Ces bioaerogels sont caractérisés par la spectroscopie UV-visible d'uned dichroïsme circulaire et peut être utilisé pour détecter la présence d'oxyde nitrique en phase gazeuse. Le succès de ce procédé dépend de la régulation de la concentration cyt. C et la concentration du tampon et ne nécessite pas d' autres composants tels que des nanoparticules métalliques. Il peut être possible d'encapsuler d'autres protéines en utilisant une approche similaire rendant cette procédure importante pour l'avenir le potentiel de développement de l'appareil bioanalytique.
Introduction
Cytochrome c (cyt. C) est une protéine de transfert d' électrons clé impliquée dans les réactions de la respiration cellulaire de l'organisme. Il a été montré être impliqué dans l' apoptose, une forme contrôlée de mort cellulaire, et il est capable de détecter de telles petites molécules toxiques comme l' oxyde nitrique et le monoxyde de carbone 1-3. l'oxyde nitrique (NO) joue un rôle dans divers processus physiologiques qui se produisent dans les systèmes nerveux, cardiovasculaire et immunitaire. Bien que cyt. C nécessite généralement un environnement aqueux tamponné à des valeurs de pH neutre à demeurer structurellement intact et actif, la recherche a montré que cyt. C peut conserver sa structure et sa fonction dans des matériaux solides appelés aérogels sous certaines conditions 4-9.
Aérogels sont des matériaux très poreux souvent formés par la synthèse d'oxydes métalliques de sol-gel (Bien que les aérogels d'oxydes métalliques sont très fréquentes, le carbone et d'autres types d'aérogels ont été synthétisés. Un exemple est InP aerogels) 10 et le séchage de ces sol-gels, de telle sorte que la matrice solide poreuse est laissée inchangée 11-14. Tous les pores aérogels solides donnent lieu à la surface disponible rendant beaucoup aérogels extrêmement utiles pour toutes les applications dans lesquelles les réactions de surface sont importantes. Quand le produit chimique ou la fonctionnalité biochimique est assemblé au sein de la nanoarchitecture aérogel, il a été montré que la porosité physique et une meilleure surface des aérogels aident à améliorer les capteurs, ainsi que des électrodes pour batteries, piles à combustible, et des applications supercondensateur 11,15-23 . Pour sécher les aérogels d'une manière qui laisse la matrice solide poreuse inchangée, il est typique pour éliminer le solvant restant dans les pores après la synthèse sol-gel, par extraction par solvant supercritique. Tout effondrement des pores qui peuvent être causés par les forces de tension de surface comme une évaporation du solvant du gel sont minimisés parce que dans le séchage supercritique, une interface liquide-vapeur jamais formes.
Il existe de nombreux rapports de protéines hème tels que cyt. c étant encapsulé dans sol-gels qui ont été conservés par voie humide ou qui ont été séchées ambiently 24-30. Les rapports des biomolécules encapsulant dans des sol-gels qui sont ensuite séchées dans des conditions surcritiques pour former aérogels sont rares en raison du traitement nécessaire qui peut être préjudiciable à la structure de nombreuses protéines. Dans le cas de cyt. C, certaines conditions permettent de conserver la capacité de cyt. C pour détecter et répondre à l' oxyde nitrique en phase gazeuse dans les aérogels. Une fois stabilisé à l'aérogel, la structure de l'aérogel poreux de haute qualité facilite la réaction entre cyt. C et 4,8,9 de l' oxyde nitrique. Cyt. C peut être encapsulé dans aérogels d'abord l' associer en couches multiples autour d' or ou d' argent des nanoparticules en solution 4-8. Ces superstructures à couches multiples servent à protéger la protéine dans la matrice d'aérogel. Dans le plus récent approach que nous avons mis au point, lorsque la concentration en protéine et le tampon de force sont contrôlés en même temps que d' autres conditions de synthèse, cyt. c conserve l' intégrité dans les aérogels même sans nanoparticule métallique 9 association initiale.
La synthèse commence comme de nombreuses synthèses d'aérogel commencent par mélange des précurseurs de silice sol-gel pour une période de temps définie. Il est après un certain temps que cyt. C est ajouté comme une solution tamponnée dans le mélange de mélange. Il se produit alors une gélification pour former une structure solide de silice poreuse dont les pores sont remplis d'eau, le méthanol, les réactifs restants et les sous-produits. Ce liquide qui remplit les pores peut être rincé avec divers solvants à travers une série d'échanges de solvants, les derniers échanges avec le dioxyde de carbone liquide ayant lieu dans un appareil de séchage au point critique conservés à basse température. Amener les gels au-dessus de la température critique (31,1 ° C) du dioxyde de carbone facilite la formation en tant quefluide upercritical intérieur de l'appareil sous pression qui peut être évacué pour former des aérogels secs, très poreux. La température relativement basse requise pour le dioxyde de carbone pour former un fluide supercritique est avantageux par rapport à d'autres solvants, car elle conserve la protéine en dessous d'une température à laquelle il peut subir une dénaturation.
Notre approche sans nanoparticule métallique à encapsuler cyt. C dans aérogels est avantageuse car elle est une procédure simple qui peut conduire à l'élaboration d'un protocole plus généralement applicable pour l' encapsulation d' autres protéines ainsi. De nombreuses protéines ne peuvent pas interagir avec les nanoparticules métalliques de la même manière que cyt. C ne et la synthèse de nanoparticules métalliques ou de l' achat ajoute du temps et des dépenses supplémentaires à la procédure. Les quelques rapports sur l'encapsulation des protéines dans les aérogels rendent le développement de cette procédure une étape importante pour trouver une procédure plus générale pour encapsuler d'autres protéines dans les aérogels qui peuvent aider in potentiels futurs dispositifs bioanalytiques.
La section de protocole de ce manuscrit décrit comment synthétiser silice sol-gels, encapsuler cyt. C dans ces sol-gels, sécher ces sol-gels composites pour former des aérogels, caractérisent ces bioaerogels en utilisant la spectroscopie de dichroïsme UV-visible et circulaire et détecter la présence de l'oxyde nitrique en phase gazeuse avec ces bioaerogels. Cyt. C a été encapsulé avec succès dans des aérogels , lorsqu'il est dissous d' abord dans 4,4 à 70 mM de solutions aqueuses de tampon phosphate. Cependant, la structure des protéines optimisées aérogels a été constaté lors de l' encapsulation au résultat de 40 mM de phosphate de solutions tamponnées cyt. C produire chargé aérogel cyt. Les concentrations de C dans la plage de 5 à 15 um 9. Par conséquent, le protocole donné ci - dessous consiste à synthétiser aérogels en utilisant des solutions de phosphate 40 mM en tampon de cyt. C résultant en un cyt chargé. Concentration en C dans les aérogels de 15 uM.
Protocole
Des lunettes de sécurité ou des lunettes, blouse de laboratoire et des gants de laboratoire doivent être portés en tout temps pendant la procédure. Ne jamais faire fonctionner l'appareil de séchage au point critique, sans lunettes de sécurité ou des lunettes. Toutes les solutions contenant le tétraméthoxysilane, le méthanol, l'éthanol, l'acétone et l'ammoniac doivent être traités dans une hotte.
1. Assurez - Buffer et Cyt. C Solutions
- Faire ~ 750 ml de pH 7, un tampon phosphate de potassium 40 mM, tout d'abord préparer 500 ml de 0,04 M de phosphate de potassium monobasique en pesant 2,72 g de phosphate de potassium monobasique et de dissoudre dans de l'eau en utilisant un ballon de 500 ml volumétrique.
- Préparer 500 ml de 0,04 M de phosphate de potassium dibasique en pesant 3,48 g de phosphate de potassium dibasique et de se dissoudre dans l'eau en utilisant un ballon de 500 ml volumétrique.
- Verser la solution de sel dibasique dans un grand bécher avec un barreau d'agitation et de commencer à agiter la solution sur une plaque d'agitation.
- Ajouter lentement portions du sel monosodique solution de la solution de sel dibasique tout en surveillant le pH avec une électrode de pH mètre et jusqu'à ce que le pH est de 7,00. Environ 250 à 300 ml de la solution de sel monosodique seront utilisés.
- Peser environ 0,023 g de cyt. C et placer dans scintillation en verre du flacon. Ajouter 2000 pi de tampon de phosphate de potassium préparé à l' aide d' une micropipette puis agiter doucement la solution pour mélanger jusqu'à ce que tout le solide, cyt rouge. C est dissous dans la solution et aucune matière particulaire reste.
- Prendre 20 pl de la cyt solution préparée. C et ajouter à un 1 cm longueur de trajet en plastique cuvette. Ajouter 3 ml de tampon préparé.
- Prendre UV-vis du spectre 300-700 nm en utilisant un tampon dans la cellule de référence. Utiliser la cyt. C absorbance (A) à 409 nm, le coefficient d'extinction 31 (ε) de 106 100 M -1 cm -1, la longueur du trajet de la cuvette (l), et la loi de Beer-Lambert pour déterminer la concentration (c) de la solution (A = εlc).
- Retour calculer la concentration de la solution préparée d'origine. 2 ml d'une préparation cyt. Solution C est généralement comprise entre 0,7 à 0,9 mm dans la concentration.
- Diluer la solution préparée cyt. Original C à 800 pl de 0,105 mM par pipetage de 117 ul de 0,72 mM préparé CYT. Solution de c dans un flacon à scintillation. Ajoutez ensuite le reste des 800 pi (683 pi dans ce cas) de tampon préparé. Agiter pour mélanger. Les volumes exacts peuvent varier en fonction de la concentration exacte de la cyt préparé d' origine. Solution de c comme le volume de cyt. C à pipeter est calculée comme étant (800 pi * 0,105 mM) / (cyt d' origine. Concentration c en mM).
- Stocker cyt préparé et dilué d' origine. Solutions de c à 2-8 ° C dans un réfrigérateur jusqu'à utilisation pour un maximum de deux semaines.
2. Synthétiser silice (SiO 2) Sol
- Etiquette jetable 50 ml polypropylène bécher 'Beaker A '. Placer bécher sur le plateau d'une balance analytique et utiliser une pipette Pasteur en verre pour ajouter 1,88 g tétraméthoxysilane dans le bécher. Zéro de la balance, puis la pipette 2,88 g de méthanol dans 'Beaker A'.
- Cover 'Beaker A' avec Parafilm.
- Etiquette jetable 50 ml polypropylène bécher 'Beaker B'. Ajouter une barre d'agitation magnétique et la place sur le plateau d'une balance analytique. Utiliser une pipette de verre pour ajouter 0,75 g d'eau et 3,00 g de méthanol.
- Cover 'Beaker B' avec Parafilm.
- Commencez agiter le contenu de 'Beaker B' sur une plaque d'agitation dans une hotte, puis utiliser une seringue pour insérer 5 pi de solution d'hydroxyde d'ammonium 28,0 à 30,0% de par le Parafilm couvrir dans le mélange en remuant.
- Dès que l'étape 2.5 est terminée, ajouter le contenu de 'Beaker A' à 'Beaker B'. Agiter le mélange pendant 20 min tout couvert de Parafilm.
3. Préparer Gel Moisissures
Remarque: Il y aest le temps de préparer des moules de gel pendant le mélange de sol de silice est en remuant à l'étape 2.6.
- Acquérir 8-9 flacons en polypropylène de scintillation (16 mm x 57 mm, taille de volume de 6,5 ml, avec des fonds en tranches off) et les capots correspondants. Mettez une pellicule de plastique sur l'extrémité du bouchon du flacon pour créer une surface plane pour le gel pour former sur et placez le bouchon au-dessus en veillant à ce que la pellicule plastique reste intacte à l'intérieur du bouchon.
- Aligner les flacons avec bouchon-end sur le dessus de banc et a ouvert le fond vers le haut.
4. Préparer Cyt. C -silica Sol-gels
- A l'issue d'un sol de mélange (étape 2.6), ajouter 3 ml de mélange de sol à un usage unique de 50 ml bêcher en polypropylene propre.
- Utiliser une pipette Pasteur en verre à baisser lentement 500 pi des 0,105 mM diluée cyt. De solution de c (faite à l' étape 1.9) au mélange de sol de 3 ml au cours de ~ 1 min. Assurez - vous de mélanger doucement le mélange tout en ajoutant le cyt. C pour éviter la formation d' un grandtouffes rouges. En supposant que les volumes sont additifs, en diluant 500 pi de la solution de c 0,105 mM cyt. À 3500 ul, maintenant la concentration dans le sol est cyt. C, en théorie, 15 uM.
- Pipet 0,5 ml de la résultante cyt. Sol c de silice dans chaque moule préparé. pipeter également 0,5 ml de sol restant «brut» de silice dans un ou deux moules à utiliser comme échantillons témoins au cours du procédé de séchage supercritique.
- Couvrir les ouvertures des moules avec Parafilm face vers le haut et le mettre au réfrigérateur (~ 2-8 ° C) pendant la nuit ou pendant au moins 12 heures pour produire sol-gels.
- Prenez les moules hors du réfrigérateur. Retirez le Parafilm du haut d'un moule contenant un cyt c sol-gel. également supprimer le bouchon et la pellicule plastique du fond.
- Après avoir ajouté un peu d'éthanol à partir d'une bouteille de lavage dans le moule, utilisez la fin de disque circulaire d'un piston de la seringue pour pousser soigneusement le gel du moule et dans un récipient propre 20 ml à scintillation en verre flacon suiteaining environ 5 ml d'éthanol.
- Répéter cette procédure d'extraction de gel (étapes 4.5 et 4.6) , jusqu'à ce que la totalité de la cyt. C gels sont introduits dans le flacon et tous les gels de silice sont ajoutés dans une fiole séparée. Si plus d'une concentration de gel de c cyt. A été fait, assurez - vous de stocker comme gels ensemble dans des flacons séparés. Remplissez ensuite les flacons vers le haut avec de l'éthanol, le capuchon et entreposer entre 2-8 ° C.
- Toutes les quatre heures durant la journée, retirez les gels du réfrigérateur, décantent l'éthanol au large des gels et remplacer avec de l'éthanol frais.
- Pendant trois jours supplémentaires, submerger les gels de sol humide dans de l'acétone, la décantation et l'ajout d'acétone fraîche trois fois par jour.
5. supercritique Cyt sec. C -silica Sol-gels
- Refroidir un appareil de séchage au point critique (voir la figure 1) à 10 ° C en réglant la température d'un circulateur fixé à 8 ° C.
- Une fois que l'appareil a reached 10 ° C, effectuer un test de fuite sur l'appareil de remplissage d'un bateau de transfert avec de l'acétone et en le scellant à l'intérieur de l'appareil.
- Ouvrir la valve de remplissage de l'appareil et ajouter du dioxyde de carbone jusqu'à ce que l'appareil est à moitié plein.
- Fermez le robinet de remplissage et d'écouter attentivement pour siffler les portes et les vannes où les joints toriques ou des joints peuvent se détériorer.
- Remplacez les joints toriques ou joints si une fuite est détectée.
- Après avoir terminé le test de fuite, ouvrir la vanne de purge pour libérer l'acétone et de dioxyde de carbone dans l'évacuation d'une hotte aspirante. Retirez ensuite le bateau de transfert de l'appareil.
- Après avoir vérifié que l'appareil est exempt de fuites, versez délicatement les gels humides des flacons de scintillation, ainsi que la plupart de l'acétone, en trois longues sections du bateau de transfert (paniers d'échantillons ou de couvertures de gaze ne sont pas nécessaires). Délicatement pousser et déplacer les gels dans le bateau avec une pince pour assurer que tous les gels sont complètement submergés in acétone. Ajouter de l'acétone, si nécessaire avant de sceller le bateau à l'intérieur de l'appareil.
- Ouvrir la valve de remplissage de l'appareil pour ajouter du dioxyde de carbone, puis ouvrir la vanne de purge pour libérer l'acétone pendant cinq minutes dès que l'acétone, le mélange avec le dioxyde de carbone est observée à couler au fond de l'appareil à travers la fenêtre de l'appareil. Cette infiltration de l'acétone au fond se produit avant que l'appareil est complètement rempli de dioxyde de carbone, de sorte que la valve de remplissage doit rester ouvert dans la mesure nécessaire lors de la vidange de sorte que l'appareil continue à remplir, même tandis que le drain est ouvert.
- Fermez le robinet de vidange. Gardez la valve de remplissage fendu légèrement.
- Cinq minutes plus tard, ouvrir la vanne de vidange pendant cinq minutes encore et régler la vanne de remplissage pour être suffisamment ouvert pour que l'appareil reste plein pendant tout le temps de vidange. Fermez le robinet de vidange, maintenir le robinet de remplissage entrouverte, puis répétez cette étape de vidange une fois de plus de cinqminutes plus tard.
- Après ces trois premières étapes de drainage, ouvrir le drain pendant 5 minutes à une heure environ toutes les 40 min pendant la durée d'au moins six heures pour assurer le remplacement total d'acétone par du dioxyde de carbone liquide dans les gels. Toujours régler la vanne de remplissage pour être suffisamment ouvert lors de chaque vidange de sorte que le niveau de liquide dans l'appareil ne descend jamais au-dessous de la partie supérieure de l'embarcation lors de la vidange.
- Une fois les étapes de drainage sont terminés, fermez le robinet de remplissage et de vidange du dioxyde de carbone liquide, de sorte que le niveau reste visible juste au-dessus des dents sur le bateau en regardant à travers la fenêtre de l'appareil.
- Régler la température de l'appareil de thermostat fixé à 40 ° C pour faire en sorte que le dioxyde de carbone liquide monte au- dessus de sa température critique et à la pression (Tc = 31 ° C; c P = 7,4 MPa).
- Au bout d'environ 15 minutes, on observe la transition de l'état liquide à un fluide supercritique à travers la fenêtre de l'appareil en tant que liquide meniscnous au-dessus des dents du bateau disparaît. Attendre au moins 15 minutes de temps d'équilibration, puis ouvrez la soupape d'aération d'une petite quantité pour commencer à libérer le fluide supercritique.
- Au cours d'environ 45 min, continuer à ouvrir de manière incrémentielle la soupape d'aération plus large et plus large de sorte qu'un sifflement stable, mais très faible de liquide de libération peut être entendu et la jauge de pression est observée à diminuer lentement à zéro.
- Après la pression de l'appareil est passé à zéro, ouvrir la porte de l'appareil, retirer le bateau, et d'utiliser des pinces pour placer les aérogels nouvellement séchées dans des flacons de scintillation en verre propre.
6. Caractériser Cyt. C -silica aérogels avec UV-visible et dichroïsme circulaire (CD) Spectroscopie
- Préparer une plate-forme de carton pour maintenir les monolithes d'aérogel dans la trajectoire du faisceau du spectrophotomètre ou un CD spectromètre UV-visible.
- Découpez un morceau de carton léger de 2,5 cm x 2,5 cm (tel que le carton d'une boîte de labotissu ratoire), plier en deux, couper à mi-hauteur sur le pli, puis plier les deux volets, créé par la coupe, le dos.
- Découpez un 5 cm x 5 cm morceau de carton léger, avec un 1,5 cm x 1,5 cm trou carré au milieu. Ensuite, utilisez du ruban électrique noir pour diminuer la taille de la cale à 0,5 cm x 0,5 cm.
- Collez les rabats du carton plié et la coupe contre le 5 cm x 5 cm morceau de carton de sorte qu'une petite surface courbée est créée pour un monolithe de aérogel pour siéger directement en face du trou de 0,5 cm x 0,5 cm (voir la figure 2) . Ensuite, la bande du dos de carton pour le spectrophotomètre UV-visible de sorte que le trou est en ligne avec la trajectoire du faisceau.
- Mesurer l'épaisseur des gels, qui seront utilisés pour les longueurs de trajet, avec un micromètre.
- Placer un gel sur la plate-forme de carton et de mesurer un spectre 300-800 nm avec de l'air dans le compartiment du spectrophotomètre UV-visible référence.
- Monter un polynôme, A = a λ n, dans la région de longueur d' onde (λ) , où l'absorbance (A) est principalement due à la diffusion de fond, ~ 700-800 nm. Le coefficient est généralement apte à un nombre compris entre 1 x 10 ~ 8 et 1 x 10 6 et le coefficient n vaut habituellement apte à un nombre compris entre 2 et 3 ~.
- Calculer la dispersion à d' autres longueurs d' onde, en utilisant les coefficients a et n, obtenu à partir de l'ajustement.
- Soustraire cette absorbance calculée scatter de fond du spectre brut pour obtenir un spectre de dispersion corrigée.
- Monter la dispersion soustrait du spectre avec une courbe de Gauss dans la région de 370 à 490 nm en utilisant un logiciel approprié (GRAMMES / AI 8.0) pour déterminer la hauteur du pic, centre de pointe, et la largeur de pic du pic Soret de l'aérogel.
- Appliquer la loi de Beer-Lambert , en utilisant l'épaisseur mesurée du gel pour une longueur de trajet (L), le coefficient d'extinction 31 (ε) de 106 100 M -1 cm -1 , et la hauteur du pic de Soret (A) pour calculer la concentration (c) de la cyt. c dans l'aérogel (A = εlc).
- Comparez le cyt calculé. Concentration de c à la concentration théoriquement dans le gel (15 uM) pour déterminer la viabilité de cyt. C au sein de l'aérogel. Viabilités pour cent typiques sont proches de 100%, mais il convient de noter que ces viabilités sont que des estimations , car le calcul est basé sur le coefficient d'extinction de cyt. C en solution 31 qui est présumée être légèrement différente de celle du coefficient d'extinction de cyt. c dans les aérogels qui ne sont pas connus.
- azote Exécuter dans l'instrument de CD au moins 5 minutes avant de tourner la lampe.
- La bande du support en carton vers le spectromètre de CD de sorte que le trou est en ligne avec la trajectoire du faisceau.
- Mesurer une longueur d'onde du spectre blanc continu avec rien dans le support en carton 350-500 nm à 100 nm / min, en prenant une moyenne de trois balayages.
- Placer un gel (épaisseur mesurée précédemment à l'étape 6.2) sur la plate-forme de carton et de mesurer un spectre 350-500 nm à 100 nm / min, en prenant une moyenne de trois balayages.
- Répéter les mesures UV-visible et CD pour tous les monolithes d'aérogel d'intérêt.
7. Détecter la présence de l'oxyde nitrique (NO) gaz avec Cyt. C -silica aérogels
ATTENTION: Travailler avec NO est dangereux et tous les gaz NO doit être manipulé dans une hotte ou évacué dans une hotte. Une exposition soutenue à NO est toxique pour les tissus comme hautement toxiques de dioxyde d'azote et / ou peroxyde d'azote formera lorsque NO entre en contact avec l'air. Chaleur et corrosives fumées sont également produites lorsque NO entre en contact avec l'eau.
- Placer une 8 L d'oxyde nitrique cylindre (10% d'oxyde nitrique, 90% d'azote) dans une hotte bien ventilée et régler la pression à 4 bars.
- Relier un tube à la fois le cylindre d'oxyde nitrique et à une bouteille d'azote (pression de consigne à 6 psi) et relier les extrémités du tube à un clapet en T (voir figure 3a).
- Choisissez un monolithe d'aérogel pour l'expérience et de mesurer l'épaisseur (ou la longueur du trajet) avec un micromètre.
- Placez l'aérogel (~ 3 mm d'épaisseur) dans une cuvette jetable avec capuchon en plastique et de mettre la cuvette dans le spectrophotomètre. Couper l'aérogel légèrement si nécessaire pour tenir dans la cuvette.
- Insérer deux aiguilles de seringue dans le capuchon en plastique de la cuvette, l' une reliée à la sortie de la vanne en T et une relié à un tube pour servir de gaz d' échappement dans la hotte (voir la figure 3b). Utiliser Parafilm pour sceller les aiguilles sur le tube et le capuchon de la cuvette.
- Placer une cuvette jetable vide dans la cellule de référence.
- Ajuster la position de la cuvette d'aérogel pour faire en sorte que l'aérogel se situe dans la trajectoire du faisceau avant de commencer l'expérience.
- Prendre un premier spectre 800-300 nm.
- Surveiller la différence entre l'absorbance à 414 nm et l'absorbance à 408 nm, tout en tournant la vanne en T pour basculer entre l'azote et le mélange oxyde nitrique / azote à des intervalles de temps fixés en veillant à ce que, à aucun moment le débit d'azote ou d'un mélange d'oxyde nitrique / azote si élevé que le débit l'aérogel se déplace dans la cuvette.
- Prendre un spectre final de 800 à 300 nm, une fois que les cycles d'exposition sont terminés.
- Répétez la procédure avec trois à quatre monolithes pour obtenir une réponse moyenne de détection.
Résultats
Les résultats de la procédure décrite dans aérogels contenant cyt viable. C. Comme il est précisé à la fin de l'introduction, cyt. C peut être encapsulé dans des solutions aqueuses de tampon allant de 4,4 à 70 mM de phosphate. Des exemples de cyt. Aérogels réalisés à partir de solutions contenant des concentrations de tampon différentes -silica c (c -SiO 2 cyt.) Sont représentés sur la figure 4. Tous les gels sont relativement translucides, avec des gels fabriqués à partir de 70 mM de tampon la plus opaque.
Une comparaison de la spectroscopie des cyt. C dans des conditions différentes est montré dans la figure 5. Un spectre typique (Figure 5c) montre le grand pic Soret autour de 408 nm pour cyt. C -SiO 2 aérogels et est très similaire au spectre de cyt . c en solution (figure 5a). En outre, un spectre de cyt.c encapsulée dans des aérogels avec des nanoparticules métalliques est également représentée (figure 5b) et de la cyt. c spectre -SiO 2 aérogel est semblable à ce spectre aussi bien. Lorsque la cyt. C -SiO 2 aérogel est exposé à l' oxyde nitrique, un déplacement typique du pic de Soret est observée (figure 5d).
Les spectres UV-vis pour les gels fabriqués à partir cyt. Les solutions C dans des concentrations de tampon différentes sont représentées sur la figure 6. Tous ces gels présentent caractéristique spectroscopique UV-visible caractéristiques indiquant que cyt. C se trouve pas dans un état dénaturé dans les gels. Toutefois, la diminution de translucidité des gels fabriqués à partir des résultats de tampon 70 mM dans un rapport signal sur bruit plus faible pour ces spectres.
Les spectres de CD de cyt. C -SiO 2 aérogels sont similaires aux spectres de cyt. C encapsulée dans des aérogels avec des nanoparticules métalliques, tandis que les deux types de spectres d'aérogel diffèrent d'un spectre de cyt. c dans une solution tamponnée (figure 7).
La figure 8 montre une réponse de surveillance de l' oxyde nitrique typique pour cyt. C -SiO 2 aérogels et les aérogels correspondants qui contiennent également des nanoparticules métalliques en plus de cyt. C. La différence entre l'absorbance à 414 nm et 408 nm, qui est à voir augmenter puis diminuer lorsque les gels sont exposés à de l'oxyde nitrique et d'azote, respectivement, successivement.
Si le dioxyde de carbone supercritique ne soit pas libéré à une vitesse suffisamment lente, la viabilité de la cyt. C dans les aérogels formés sera compromise. Ceci est révélé en comparant les spectres UV-visible obtenu après la formation de gels en libérant le dioxyde de carbone à l'autretaux (figure 9).

Figure 1: un appareil critique de séchage au point L'appareil de séchage au point critique montré de la (A) avant et (B) en arrière avec la porte du bateau de transfert et appareil montré à côté de l'arrière de l'appareil..

Figure 2: plate - forme de carton La plate - forme de carton assemblé pour maintenir un aérogel dans le chemin du faisceau d'un instrument..

Figure 3: Monoxyde de détection mis en place L'oxyde nitrique de détection mis en place est représenté , y compris (A) , la hotte fermée 10% d' oxyde nitrique.90% du cylindre de l' azote, les tubes et vanne en T, et (B) de la cuvette avec des aiguilles insérées.

Figure 4:.. Cyt Sample c -SiO 2 aérogels aérogels encapsulant 15 uM cyt c 4,4 mM, 40 mM et du tampon phosphate de potassium 70 mM sont indiqués par rapport à un sou de gauche à droite.. Ces aérogels sont d'environ 0,2-0,5 cm de haut. Reproduit avec la permission 9.

Figure 5:. Cyt c spectroscopie -SiO 2 aérogel spectres visible de 15 uM cytochrome c en (a) un sol de phosphate tampon 50 mM.ution; (B) Au (5 nm) ~ cyt c -SiO 2 aérogel. (C) cyt c -SiO 2 aérogel (exposé à l' air). (D) cyt. C -SiO 2 aérogel (exposés à l' oxyde nitrique pour 3,5 min). Ces spectres représentatives de chaque type de gel sont décalées pour plus de clarté, et la ligne en pointillés indique la position du pic de Soret cyt. C dans le tampon. Bien que chaque spectre est de 15 uM cyt. C, les épaisseurs de gel (ou hauteurs) ne sont 0,2-0,5 cm par rapport à la 1 cm cuvette de solution résultant en une absorption de solution supérieure. Reproduit avec la permission 9.
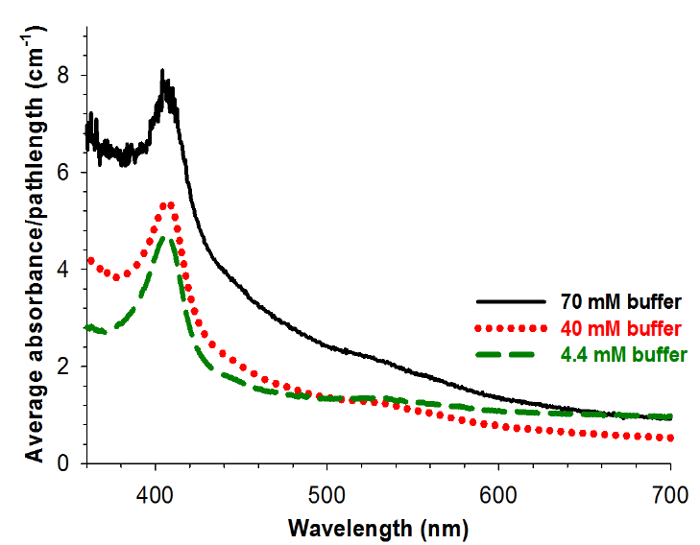
Figure 6: Spectroscopie aérogel en tant que concentration du tampon encapsulé est modifiée moyennée absorption spectrale UV-visible d'aérogels , divisé par la longueur du trajet du gel pour les gels d' encapsulage 15 _.6; M cyt c dans 70 mM (noir) (moyenne des 4 spectres), 40 mM (rouge, pointillé) (moyenne de 8 spectres), et 4,4 mM (vert, en pointillés) (moyenne de 9 spectres) de tampon phosphate de potassium. . Reproduit avec la permission 9.

Figure 7:... Aérogel spectroscopie de dichroïsme circulaire Les spectres de dichroïsme circulaire de cyt c dans une solution de tampon phosphate de sodium (solide), deux spectres représentatifs de cyt c -SiO 2 aérogels ( en pointillés) et deux spectres représentatifs de Au (5 nm) ~ cyt. c SiO- 2 aérogels (pointillés). Reproduit avec la permission 9.
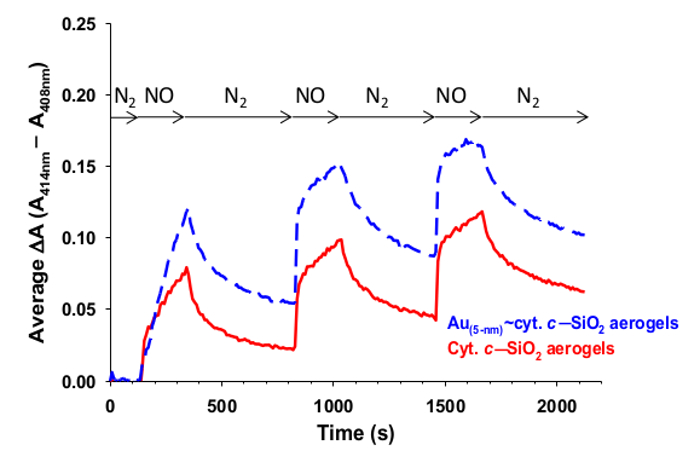
Figure 8: détection d'oxyde nitrique avec cyt c -SiO 2. . sub> aérogels Surveillance du changement (AA = A 414 nm - A 408 nm). l'intensité Soret de cyt c (rouge solide) et Au ~ cyt c (pointillé bleu) encapsulé dans SiO 2 composites nanoarchitectures d'aérogel que le flux de gaz. est basculée entre l'azote (où Soret pic maximal est à ~ 408 nm) et de l'oxyde nitrique (où Soret pic maximal est à ~ 414 nm). Chaque courbe est une moyenne de 3-4 essais, avec deux de la cyt c -SiO 2 essais contrôlés à AA = A 414 nm -. A 407 nm depuis le pic maximal initial Soret était à 407 nm pour ces essais. Reproduit avec la permission 9.

Figure 9:. Effet de la durée de libération de fluide supercritique Averaged absorbance spectrale UV-visible divisé par la longueur du trajet de gel pour cyt c -SiO 2 aérogels enca.psulating 10 uM cyt. c dans 50 mM de tampon phosphate dans laquelle les aérogels surcritiques séchées ont été faites soit par la libération de dioxyde de carbone supercritique pendant 45 min (massif, noir (moyenne de 9 spectres)) ou 7 min ( en pointillé rouge (moyenne de 4 Les spectres)). Reproduit avec la permission 9.
Discussion
Comme décrit, cette procédure a toujours produit cyt viable. C encapsulé dans aérogels. La concentration du cyt. C dans les aérogels peut varier de 5 à 15 uM et la concentration du tampon de la solution c cyt. Initiale encapsulée dans les aérogels peut faire varier de 4,4 à 70 mM de phosphate , sans effets néfastes graves sur la protéine de viabilité. Cependant, le centre de pointe et la largeur maximale de la cyt caractéristique. C Soret pic dans les aérogels sont les plus proches de ce qu'ils sont pour cyt. C en solution lorsque cyt. C est encapsulé dans des aérogels de solutions de tampon 40 mM 9.
La synthèse de la cyt. C -SiO 2 aérogels est affectée par l'âge de certains des réactifs de départ. Le méthanol, le tétraméthoxysilane, et une solution d'hydroxyde d'ammonium sont hygroscopiques et doivent être remplacés tous les un à deux mois. L'eau accrue qui se accumule dansces réactifs au cours du temps affecte les caractéristiques structurelles de gel et le temps de transition sol-à-gel.
Lors de séchage supercritique, le bateau de transfert du point critique appareil de séchage peut contenir jusqu'à dix-huit 0,5 cm d'épaisseur, 1 gels cm de diamètre. Comme il est indiqué dans la section de protocole, un remplissage spécifique et de la procédure de vidange doivent être suivies pour transférer le dioxyde de carbone dans les sols gels. Il est important de noter que, au début du protocole de vidange, le mélange de drainage de gaz carbonique et d'acétone circule à une vitesse élevée pour que le tube de vidange rigide congèle avec de l'humidité de condensation à la glace à l'extérieur. Le mélange vidangeant contient un peu d'eau puisque l'acétone est pas anhydre et cette eau peut parfois geler dans une mesure que le tuyau de vidange obstrue réellement. Il est nécessaire de surveiller ces sabots et à écouter pour un arrêt de l'écoulement. La vanne de vidange doit être fermé pendant quelques minutes afin que le sabot va fondre si un sabot est détecté. Dansle pire des cas, si le robinet de vidange est pas fermé, un sabot peut causer tant de pression pour construire ce que le tube de drainage apparaît avec force hors de l'appareil. Après les quelques premières périodes de vidange, la majorité de l'acétone aura été rincé hors de l'appareil, et la présence de morceaux de glace humide diminue de manière spectaculaire. La décharge va progressivement ressembler à de la glace sèche comme protocole de vidange se poursuit avec toute preuve résiduelle de la présence de l'acétone (comme parfum) devenir indétectable à la fin du processus de vidange.
Après que le dioxyde de carbone dans l'appareil a fait la transition de l'état liquide à fluide supercritique et le processus d' évacuation a commencé, il est nécessaire de libérer le fluide à une vitesse lente pendant au moins 45 min , comme indiqué dans le mode opératoire 9. Un taux de libération plus élevé peut diminuer la viabilité de cyt. C (comme le montre la figure 9) dans les aérogels et les aérogels se peut effectivement briser comme the fluide se précipite pour échapper aux gels. En général, même lorsque les aérogels restent intacts après l'ouverture de la porte de l'appareil, il est important de les manipuler avec soin et doucement comme ils sont fragiles et peuvent se casser facilement.
Les gels de silice de commande qui se déversent le long de la cyt. C -SiO 2 gels sont utilisés après séchage supercritique afin de déterminer si le transfert de dioxyde de carbone dans les gels a été réussie. Parfois , le cyt. C -SiO 2 gels peuvent sembler trouble et il est important de déterminer si cela est dû à un transfert incomplet solvant ou si elle peut avoir à faire avec la concentration de la cyt. C ou un tampon encapsulé dans les gels. Si les gels de silice sans cyt. C semblent avoir, un aspect translucide homogène tout au long, ce qui peut être considéré comme une preuve que le transfert de solvant a eu lieu complètement même si le cyt. C -SiO 2 gels ont une certaine nébulosité à eux. Nébulosité dans les gels de silicesans cyt. c après séchage indique que peu d' acétone est resté à l' intérieur des gels au cours de la ventilation.
Comme indiqué dans la section de protocole, les mesures de sécurité importantes doivent être prises lorsque l'on travaille avec de l'oxyde nitrique (NO). Pour détecter NO en utilisant les aérogels, il est nécessaire de sceller la cuvette très bien et d'épuiser le gaz circulant sur les aérogels dans une hotte. Sinon, l'ensemble spectrophotomètre peut être déplacé dans une hotte avec le NO bouteille de gaz comme une précaution supplémentaire pour limiter l'exposition au gaz NO. Au contact de l'air NO immédiatement produire le dioxyde d'azote, peroxyde d'azote hautement toxique, ou les deux. NO peut également réagir avec l'eau pour produire de la chaleur et corrosives fumées. Par conséquent, l'exposition prolongée au NO peut entraîner une toxicité directe des tissus.
Lorsque vous utilisez le cyt. C -SiO 2 aérogels pour détecter la présence d'oxyde nitrique, la bande Soret sera initialement à ~ 408 nm et se déplaceraà ~ 414 nm en présence d'oxyde nitrique. Après le passage de retour à l'azote, la bande Soret devrait revenir de nouveau à être centré à ~ 408 nm. Il peut également être possible d'utiliser la cyt. C -SiO 2 aérogels pour détecter la présence d'autres ligands tels que le monoxyde de carbone 27.
Différentes procédures publiées comprennent une étape supplémentaire consistant à combiner or ou d' argent avec des nanoparticules cyt. C dans la solution avant le mélange avec le sol et le séchage surcritique pour former des aérogels 4-8. La comparaison de la spectroscopie UV-visible de cyt. C encapsulée dans des aérogels avec des nanoparticules métalliques à celle de la cyt. C encapsulée dans des aérogels sans nanoparticules métalliques montre que ces deux types de techniques d'encapsulation produisent cyt. C de la viabilité similaire dans les aérogels (Figure 5) . Cependant, le cyt. C encapsulé avec des nanoparticules métalliques est légèrement plus stable que cyt. C encapsulerd sans nanoparticules métalliques dans les aérogels 9. Les spectres CD des deux types de cyt. C aérogels sont également similaires, même si les deux diffèrent du spectre de la cyt. C dans un tampon qui indique un certain déroulement de cyt. C dans les aérogels (figure 7). Les rapports précédents sur cyt. C encapsulées dans des aérogels suggèrent que la spectroscopie par dichroïsme circulaire est le plus susceptible d' évaluer la couche la plus externe de la protéine dépliée lors du contact avec le gel de silice, à l' intérieur soit en métal cyt plusieurs couches de nanoparticules nucléé. Structures C ou des structures plus ou moins organisés qui forment en l' absence de nanoparticules métalliques sont présents dans aérogels 4,9. La majorité de la cyt. C à l'intérieur de chaque structure de type auto-organisé à l' intérieur des aérogels reste pliée , telle que mesurée par la spectroscopie UV-visible cependant. L'avantage du protocole décrit des nanoparticules présentes sans que l'achat coûteux ou la synthèse de temps en métalles nanoparticules ne sont pas nécessaires. Les protéines ont pas souvent été encapsulés avec succès dans les aérogels, et ainsi cette procédure est importante en ce qu'elle peut conduire à l'élaboration d'une méthode plus générale pour encapsuler d'autres protéines dans les aérogels avec importance potentielle pour les futurs dispositifs bioanalytiques.
Déclarations de divulgation
Les auteurs déclarent qu'ils ont aucun intérêt financier concurrents.
Remerciements
Soutien pour ce travail et / ou de la publication a été fourni par l'Institut des sciences du Collège de l'Université Fairfield des Arts et des Sciences, Faculté de subventions de recherche de l'Université Fairfield, un Prix scientifique Cottrell College de la Société de recherche en sciences Advancement, Collège de l'Université Fairfield des Arts et des Sciences et Chimie et Biochimie Département de l'Université Fairfield. Nous tenons à remercier Jean Marie Wallace pour un aperçu beaucoup plus utiles et des conseils en ce qui concerne ce domaine de recherche générale. De plus, nous adressons un merci tout spécial à tous passés, actuels et futurs chercheurs de premier cycle du Research Lab Harper-Leatherman.
matériels
| Name | Company | Catalog Number | Comments |
| Potassium phosphate, monobasic | Fisher Scientific | P285-500 | Certified ACS (also possible to use sodium phosphate monobasic) |
| Potassium phosphate dibasic anhydrous | Fisher Scientific | P288-500 | Certified ACS (also possible to use sodium phosphate dibasic) |
| Water | Millipore Direct-Q | 18 MΩ cm | |
| pH meter and electrode | Denver Instrument | UB-10 | |
| Cytochrome c from equine heart | Sigma Aldrich | C7752-100MG | ≥95% based on Mol. Wt. 12,384, used as received and stored at -20 °C |
| Glass scintillation vials | Wheaton | 03-341-25J | 20 ml, O.D. x height (with cap): 28 mm x 61 mm |
| Disposable cuvette | Fisher Scientific | 14-955-126 | methacrylate, 10 mm x 10 mm x 45 mm |
| Ultraviolet Visible Spectrophotometer | Shimadzu | UV-1800 | Uses UVProbe v 2.33 software |
| Circular dichroism spectrometer (or spectropolarimeter) | JASCO | J-810 | |
| Isotemp Laboratory Refrigerator | Fisher Scientific | ||
| Polypropylene disposable beakers | Fisher Scientific | 01-291-10 | 50 ml |
| Tetramethylorthosilicate (also known as tetramethoxysilane, TMOS) | Sigma Aldrich | 218472-500G | 98% purity |
| Methanol | Fisher Scientific | A457-4 | GC Resolv grade |
| Ammonium hydroxide solution | Sigma Aldrich | 221228-25ML-A | ACS reagent, 28.0%-30.0% |
| General purpose polypropylene scintillation vials | Sigma Aldrich | Z376825-1PAK | 16 mm x 57 mm, volume size 6.5 ml, slice off bottom with sharp knife or razor |
| generic plastic wrap | various | ||
| Parafilm M laboratory wrapping film | Fisher Scientific | S37440 | |
| Plastic syringe plunger | various | use syringe plunger from 3 ml syringe | |
| Ethyl alcohol | Acros | 61509-0040 | Absolute, 200 proof, 99.5% A.C.S. reagent |
| Acetone | Fisher Scientific | A949-4 | HPLC grade |
| Critical point drying apparatus | Quorum Technologies | E3000 Series | |
| Circulator | Fisher Scientific | Isotemp 3016 | |
| Carbon dioxide cylinder | Tech Air | siphon tube | |
| Micrometer | Central Tool Company | ||
| GRAMS/AI 8.0 software | Thermo Electron Corporation | ||
| Nitrogen cylinder | Tech Air | Another inert gas could be substituted | |
| 10% nitric oxide/90% nitrogen cylinder | Airgas | ||
| Tygon tubing | various | ||
| T-switch valve | various | ||
| syringe needles | various |
Références
- Pettigrew, G. W., Moore, G. R. Cytochromes c. Biological Aspects. , SpringerVerlag. Berlin. (1987).
- Moore, G. R., Pettigrew, G. W. Cytochromes c. Evolutionary, Structural, and Physicochemical Aspects. , SpringerVerlag. Berlin. (1990).
- Scott, R. A., Mauk, A. G. Cytochrome c: A Multidisciplinary Approach. , University Science Books. Sausalito, CA. (1996).
- Wallace, J. M., Rice, J. K., Pietron, J. J., Stroud, R. M., Long, J. W., Rolison, D. R. Silica nanoarchitectures incorporating self-organized protein superstructures with gas-phase bioactivity. Nano Lett. 3 (10), 1463-1467 (2003).
- Wallace, J. M., Dening, B. M., Eden, K. B., Stroud, R. M., Long, J. W., Rolison, D. R. Silver-colloid-nucleated cytochrome c. superstructures encapsulated in silica nanoarchitectures. Langmuir. 20 (21), 9276-9281 (2004).
- Wallace, J. M., Stroud, R. M., Pietron, J. J., Long, J. W., Rolison, D. R. The effect of particle size and protein content on nanoparticle-gold-nucleated cytochrome c. superstructures encapsulated in silica nanoarchitectures. J.Non-Cryst. Solids. 350, 31-38 (2004).
- US Patent. , 7,238,729 U.S. Patent 6,824,776 (2004) (2007).
- Harper-Leatherman, A. S., Wallace, J. M., Rolison, D. R. Cytochrome c. stabilization and immobilization in aerogels. Enzyme Stabilization and Immobilization: Methods and Protocols. Minteer, S. D. 679, Springer. New York, NY. 193-205 (2011).
- Harper-Leatherman, A. S., et al. Simplified procedure for encapsulating cytochrome c. in silica aerogel nanoarchitectures while retaining gas-phase bioactivity. Langmuir. 28 (41), 14756-14765 (2012).
- Hitihami-Mudiyanselage, A., Senevirathne, K., Brock, S. L. Assembly of phosphide nanocrystals into porous networks: Formation of InP gels and aerogels. ACS Nano. 7 (2), 1163-1170 (2013).
- Fricke, J. Aerogels. , Springer-Verlag. Berlin. (1986).
- Hüsing, N., Schubert, U. Aerogels-airy materials: chemistry, structure, and properties. Angew. Chem. Int. Edit. 37 (1-2), 22-45 (1998).
- Aerogels Handbook. Aegerter, A. M., Leventis, N., Koebel, M. M. , Springer. New York, NY. (2011).
- Kazuyoshi, K. Recent progress in aerogel science and technology. Adv. Porous Mater. 1 (2), 147-163 (2013).
- Leventis, N., Elder, I. A., Anderson, M. L., Rolison, D. R., Merzbacher, C. I. Durable modification of silica aerogel monoliths with fluorescent 2,7-diazapyrenium moieties. Sensing oxygen near the speed of open-air diffusion. Chem. Mater. 11 (10), 2837-2845 (1999).
- Plata, D. L., et al. Aerogel-platform optical sensors for oxygen gas. J. Non-Cryst. Solids. 350, 326-335 (2004).
- Rolison, D. R., Pietron, J. J., Long, J. W. Controlling the sensitivity, specificity, and time signature of sensors through architectural design on the nanoscale. ECS Trans. 19 (6), 171-179 (2009).
- Carroll, M. K., Anderson, A. M. Aerogels as platforms for chemical sensors. Aerogels Handbook. Aegerter, A. M., Leventis, N., Koebel, M. M. , Springer. New York, NY. 637-650 (2011).
- Rolison, D. R. Catalytic nanoarchitectures-The importance of nothing and the unimportance of periodicity. Science. 299 (5613), 1698-1701 (2003).
- Pietron, J. J., Stroud, R. M., Rolison, D. R. Using three dimensions in catalytic mesoporous nanoarchitectures. Nano Lett. 2 (5), 545-549 (2002).
- Anderson, M. L., Morris, C. A., Stroud, R. M., Merzbacher, C. I., Rolison, D. R. Colloidal gold aerogels: Preparation, properties, and characterization. Langmuir. 15 (3), 674-681 (1999).
- Anderson, M. L., Stroud, R. M., Rolison, D. R. Enhancing the activity of fuel-cell reactions by designing three-dimensional nanostructured architectures: Catalyst-modified carbon-silica composite aerogels. Nano Lett. 3 (9), 1321(2003).
- Chervin, C. N., et al. Defective by design: vanadium-substituted iron oxide nanoarchitectures as cation-insertion hosts for electrochemical charge storage. J. Mater. Chem. A. 3 (22), 12059-12068 (2015).
- Ellerby, L. M., et al. Encapsulation of proteins in transparent porous silicate-glasses prepared by the sol-gel method. Science. 255 (5048), 1113-1115 (1992).
- Massari, A. M., Finkelstein, I. J., Fayer, M. D. Dynamics of proteins encapsulated in silica sol-gel glasses studied with IR vibrational echo spectroscopy. J. Am. Chem. Soc. 128 (12), 3990-3997 (2006).
- Ray, A., Feng, M., Tachikawa, H. Direct electrochemistry and Raman spectroscopy of sol-gel-encapsulated myoglobin. Langmuir. 21 (16), 7456-7460 (2005).
- Blyth, D. J., Aylott, J. W., Richardson, D. J., Russell, D. A. Sol-gel encapsulation of metalloproteins for the development of optical biosensors for nitrogen-monoxide and carbon-monoxide. Analyst. 120 (11), 2725-2730 (1995).
- Lan, E. H., Dave, B. C., Fukuto, J. M., Dunn, B., Zink, J. I., Valentine, J. S. Synthesis of sol-gel encapsulated heme proteins with chemical sensing properties. J. Mater. Chem. 9 (1), 45-53 (1999).
- Miller, J. M., Dunn, B., Valentine, J. S., Zink, J. I. Synthesis conditions for encapsulating cytochrome c. and catalase in SiO2 sol-gel materials. J. Non-Cryst. Solids. 202 (3), 279-289 (1996).
- Ronda, L., Bruno, S., Faggiano, S., Bettati, S., Mozzarelli, A. Oxygen binding to heme proteins in solution, encapsulated in silica gels, and in the crystalline state. Methods in Enzymology. Poole, R. K. 437, Elsevier Academic Press. San Diego, CA. 311-328 (2008).
- Margoliash, E., Frohwirt, N. Spectrum of Horse-Heart Cytochrome c. Biochem. J. 71 (3), 570-572 (1959).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon