Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Préparation d'un Hexahelicene corannulène-fonctionnalisé par du cuivre (I) catalysées Acétylène-azoture cycloaddition de parts non planaire polycycliques
Dans cet article
Résumé
Ici, nous présentons un protocole pour synthétiser un composé organique complexe constitué de trois unités polycycliques non planes, assemblé facilement avec des rendements raisonnables.
Résumé
The main purpose of this video is to show 6 reaction steps of a convergent synthesis and prepare a complex molecule containing up to three nonplanar polyaromatic units, which are two corannulene moieties and a racemic hexahelicene linking them. The compound described in this work is a good host for fullerenes. Several common organic reactions, such as free-radical reactions, C-C coupling or click chemistry, are employed demonstrating the versatility of functionalization that this compound can accept. All of these reactions work for planar aromatic molecules. With subtle modifications, it is possible to achieve similar results for nonplanar polyaromatic compounds.
Introduction
En raison de leur géométrie particulière, corannulène et hélicènes sont des molécules qui peuvent adopter une structure loin de planéité et de donner lieu à des propriétés intéressantes. 1-15 Au cours des dernières années, la recherche de récepteurs moléculaires pour les nanotubes de carbone et les fullerènes est une zone très active 16-19 en raison, principalement, à leurs applications potentielles comme matériaux pour les cellules solaires organiques, des transistors, des capteurs et autres dispositifs. 20-28 l'excellente complémentarité de forme entre corannulène et un fullerène ont attiré l'attention de plusieurs chercheurs dans le but de concevoir récepteurs moléculaires capables d'établir une association supramoléculaire par les forces de dispersion. 29-39
La chimie des composés aromatiques polycycliques non planes mentionnés ci - dessus est similaire à celle décrite pour les molécules totalement planes, mais il est parfois difficile de trouver des conditions appropriées pour atteindre des sélectivités et des rendements souhaités. 40 Dans ce travail , nous présentons la synthèse d'une molécule (7) comportant trois unités polycycliques en quelques étapes avec de bons rendements en appliquant des techniques simples et typiques , dans tous les laboratoires de recherche. La molécule est d' une grande importance , car il peut adopter une conformation en forme de pince pour établir de bonnes interactions avec C 60 37 en solution; et il peut ouvrir une ligne de recherche comme un récepteur potentiel plus élevé fullerènes chiraux grâce à l'éditeur de liens de hélicène, qui est une molécule chirale en raison de l'existence d'un axe stéréogénique. 41-45 Cependant, seulement hélicène racémique sera utilisé dans ce travail.
A ce stade, la seule limite à la synthèse de ces récepteurs est la préparation de hélicènes et corannulenes, étant donné qu'ils ne sont pas disponibles dans le commerce. Mais, selon les nouvelles méthodes publiés ailleurs 46-48 ils peuvent être obtenus en quantités appropriées dans un court laps de temps raisonnable.
Protocole
1. Fonctionnalisation 2,15-Dimethylhexahelicene
- Dibromation de 2,15-dimethylhexahelicene
- Peser 0,356 g (1,0 mmol) de 2,15-dimethylhexahelicene, 0,374 g (2,1 mmoles) fraîchement recristallisé N - bromosuccinimide (NBS) et 24 mg (0,07 mmol) de peroxyde de benzoyle (BPO) (70% en poids à 30% de l'eau comme agent stabilisant). Placez toutes les matières solides dans un flacon de 100 ml de Schlenk avec un barreau d'agitation magnétique. Mettez sous atmosphère d'azote par trois cycles d'évacuation de gaz suivie par le remplissage avec un gaz inerte dans la ligne Schlenk.
- Ajouter 21 ml de tétrachlorure de carbone (CCl 4). Dégazer la solution par la même évacuation / processus de remplissage (étape 1.1.1) avec une agitation vigoureuse et soigneusement afin d'éviter une perte massive de solvant.
- On chauffe à reflux (77 ° C) le mélange avec un bain d'huile, pendant 4 heures. Vérifiez la réaction par résonance magnétique 1 H-nucléaire (RMN). Doublets entre 3,7 ppm et 4,0 ppm shoULD apparaissent. Ils indiquent la présence de CH diastéréotopiques 2 - groupes (Figure 1).
- Une fois terminé, refroidir le mélange à la température ambiante et éliminer le solvant sous vide. Mettre en place un piège rempli d'azote liquide pour éviter la contamination de la pompe.
- Reprendre le brut dans 30 ml de dichlorométhane (DCM), transférer dans un ballon à fond rond et mélanger avec 4 g de gel de silice (typiquement ajouter 5 fois le poids brut). Le mélange est concentré dans un évaporateur rotatif.
- Pendant ce temps, remplir une colonne (longueur d' environ 20 cm et une épaisseur de 4,5 cm) avec un gel de SiO 2 préalablement mélangés avec l'hexane / acétate d' éthyle (95: 5) comme phase mobile. Ajouter le mélange au sommet de la colonne, puis ajouter une couche de sable (2 cm).
- Versez délicatement dans la nouvelle phase mobile et effectuer la chromatographie en recueillant des fractions dans des tubes à essai (typiquement 20 ml par tube et 4 ml près de l'élution du produit attendu). Vérifiez fractions par chromatographie sur couche mince(CCM) avec la même phase mobile (hexane / acétate d'éthyle 95: 5) et de l'image sous lumière UV. Le produit attendu (4b) doit éluer à un facteur de rétention (Rf) de 0,35 sous forme d'huile jaune après avoir combiné toutes les fractions souhaitée et l' élimination du solvant à l'évaporateur rotatif. 334 mg doivent être obtenus (rendement 65%).
NOTE: Toutes les techniques de Schlenk, l'utilisation d'un bain d'huile pour le chauffage et la colonne des paramètres de chromatographie seront largement utilisés dans la plupart des protocoles, donc à partir de maintenant, ils ne seront pas couverts en détail et à seulement quelques commentaires, si nécessaire, volonté être donné.
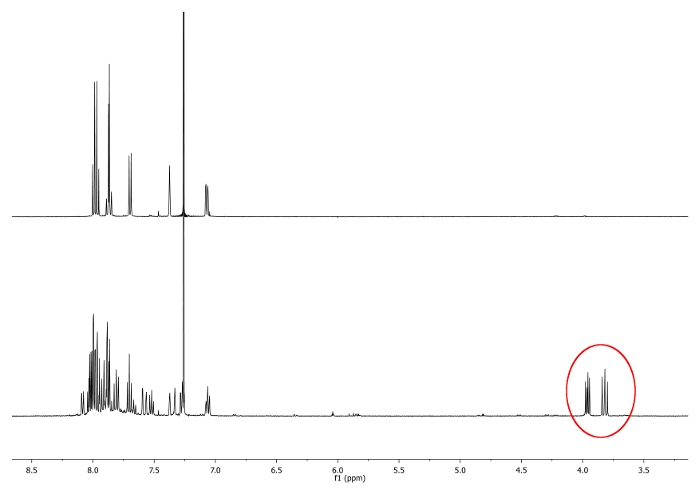
Les spectres ' H-RMN de la figure 1 1 (500 MHz, CDCl 3) de 2,15. -dimethylhelicene ( en haut) et une aliquote prise après 2 h Nouveaux signaux, correspondant à -CH 2 -.., sont représentés dans un cercle rouge (en bas) S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
- Synthèse de 2,15-bis (azidométhyl) hexahelicene
- Peser 0,103 g (0,2 mmol) de 2,15-bis (bromométhyl) hexahelicene et 0,390 g (6 mmoles) d'azoture de sodium. Placez les deux solides dans un ballon de Schlenk de 50 ml équipé d'un barreau magnétique et placé sous atmosphère d'azote.
- Mélanger 8,6 ml de tétrahydrofuranne (THF) avec 5,2 ml d'eau (H 2 O) et verser le mélange de solvants dans le ballon de Schlenk. Dégazer la solution.
- On chauffe à reflux (65 ° C) pendant 3 h. Vérifiez la réaction par 1 H-RMN. -CH 2 - signaux doivent passer à 3,75 ppm (Figure 2).
- Ensuite, cool descendre le mélange à la température ambiante et éliminer le THF sous vide. On dilue avec 50 ml de H 2 O.
- Transférer le mélange dans une ampoule à décanter et on extrait trois fois avec 40 ml de DCM. Combinez toutes les phases organiques et laver avec de pur H 2 O (50 ml).
- On purifie le produit brut par Chromatographie sur colonne de gel de silice en utilisant un mélange hexane / acétate d'éthyle (85:15) comme phase mobile pour donner une huile jaune à Rf = 0,38 correspondant à 2,15-bis (azomethyl) hexahelicene (5b). 70 mg doivent être obtenus (rendement 80%).
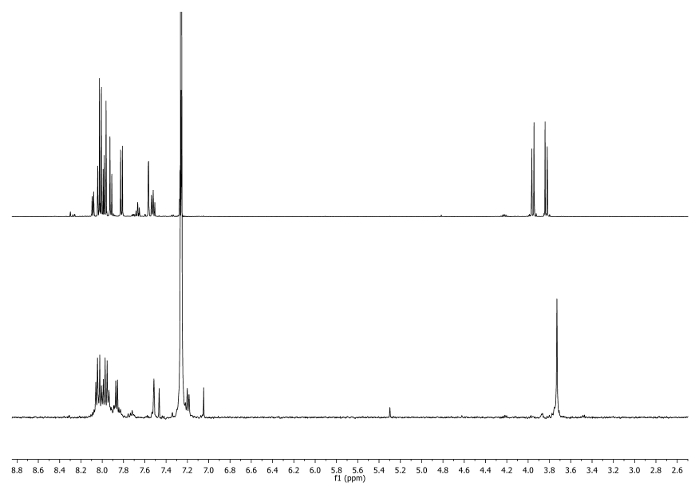
Figure 2: 1 H-spectres RMN (500 MHz, CDCI3) de 4 b ( en haut) et une aliquote prise après 3 heures( en bas). Notez les changements dans la région aliphatique. S'il vous plaît , cliquez ici pour voir une version plus grande de cette figure.
2. Fonctionnalisation de corannulène
- Monobromation de corannulène
- Peser 0,125 g (0,5 mmol) de corannulène, 89 mg (0,5 mmol) de NBS fraîchement recristallisée et 17 mg d'or (III), le chlorure d'hydrate.
- Placez tous les composés dans un flacon de 10 ml spécialement conçus pour les réactions à micro-ondes équipé d'un barreau magnétique puis mis dans une atmosphère d'azote à l'aide d'un ballon à fond rond à 2 cols.
- Ajouter 7 ml de 1,2-dichloroéthane (DCE) et dégazer la solution.
- Soniquer le mélange pendant 2 minutes pour disperser les particules de sel d'or.
- Chaleur à l'intérieur du réacteur à micro-ondes à 100 ° C pendant 2 heures.
- Une fois terminé, transférer le brut à un ballon à fond rond et éliminer le solvant par rotarévaporation y.
- On purifie le produit brut par Chromatographie sur une colonne de gel de SiO 2 en utilisant de l' hexane comme phase mobile.
REMARQUE: Bromocorannulene (4a) est obtenu sous la forme d' un solide jaune à Rf = 0,38. 99 mg doivent être obtenus (rendement 60%). Corannulène qui n'a pas réagi (3a) peut être récupéré et stocké pour des utilisations ultérieures. Il apparaît à Rf = 0,29.
- Le couplage de Sonogashira et des Bomocorannulene éthynyltriméthylsilane
- Peser 49 mg (0,15 mmol) de bromocorannulene, 11 mg (0,015 mmol) de [PdCl 2 (dppf)] 49,50 (dppf étant le 1,1-'bis (diphenylphsphino phosphino ) ferrocene, 3 mg (0,015 mmole) de CuI. 51
- Placez toutes les matières solides dans un ballon de Schlenk de 50 ml avec un barreau magnétique et placé sous atmosphère d'azote.
- Ajouter 5,0 ml de triéthylamine (NEt 3) et dégazer le mélange.
- Enfin, ajouter 104 ul (0,75 mmol) de éthynyltriméthylsilane.
- Soniquer le mélange pendant 2 mindisperser des particules de sel métallique.
- On chauffe à 85 ° C pendant 24 heures avec une sonication périodique pour empêcher le dépôt de sels métalliques.
NOTE: La couleur du mélange vire au noir bientôt, indiquant la présence de palladium (0). - Refroidir à la température ambiante et on évapore sous vide NEt 3.
- Redissoudre dans 20 ml de DCM et on purifie par Chromatographie sur une colonne de gel de silice en éluant avec de l' hexane pour donner un solide jaune à Rf = 0,28 correspondant à 5a. 41 mg doivent être obtenus (rendement 78%).
NOTE: Si le brut est filtré à travers un tampon de Celite dans le DCM, un échantillon pur raisonnable pourrait être obtenu, mais les dérivés de phosphine ne sont pas supprimés totalement.
- Préparation de Ethynylcorannulene TMS Déprotection
- Peser 35 mg (0,10 mmol) de 5a et 7,3 mg (0,125 mmol) de fluorure de potassium anhydre.
- Placez toutes les matières solides dans un ballon de Schlenk de 50 ml muni d'un barreau magnétique d'unD mis sous atmosphère d'azote.
- Mélanger 4 ml de THF et 4 ml de methanol (MeOH) et verser le mélange dans le ballon de Schlenk. Dégazer complètement.
- Laisser réagir à la température ambiante, Gardez le ballon loin de la lumière en le recouvrant d'un film opaque. Vérifiez la réaction par 1 H-RMN en regardant 3,48 ppm. Un signal correspondant à -CCH doit apparaître (figure 3).
NOTE: Bien que ce composé porte un alcyne terminal qui est réactif et se décompose facilement, nous avons trouvé aucun problème pendant le travail jusqu'à décrit ci-dessous. Elle a été réalisée sous la lumière naturelle. - Une fois terminé, éliminer le THF sous vide et diluer avec 10 ml d'eau, le transfert de tout à une ampoule à décanter.
- Extraire avec du DCM (3 x 15 ml), mélanger toutes les phases organiques dans un ballon à fond rond et de se concentrer dans un évaporateur rotatif à la température ambiante pour obtenir enfin un solide jaune correspondant au 6a. 27 mg doivent être obtenus (rendement quantitatif).
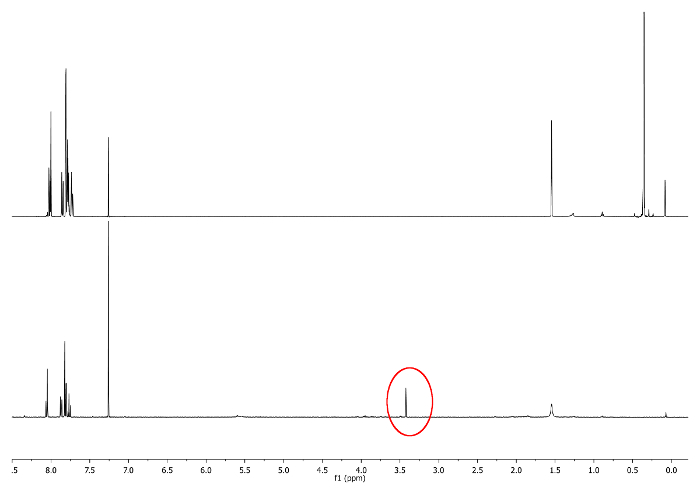
Figure 3:.. 1 spectres H-RMN (500 MHz, CDCI3) 5 un (haut) et 6 bis (bas) singlet -CCH est représenté dans un cercle rouge S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
3. Assemblage final par Click Chemistry
- Peser 15,3 mg (0,035 mmol) de 5b, 20,0 mg (0,073 mmol) de 6a, 1,4 mg (0,007 mmol) de sel de sodium de l' acide ascorbique, 1,7 mg (0,007 mmol) de CuSO 4 · 5H 2 O.
- Placez toutes les matières solides dans un flacon de 50 ml de Schlenk muni d'ambar agnétiques et mis sous atmosphère d'azote.
- Mélanger 3 ml de H 2 O et 12 ml de THF et versez le mélange dans le ballon de Schlenk. Dégazer soigneusement la solution.
- On chauffe à 65 ° C pendant 3 jours avec un condenseur relié à la partie supérieure du flacon et vérifier périodiquement la réaction pour contrôler la température, l'agitation et le volume du solvant. Vérifiez la réaction par 1 H-RMN. Le signal à 3,48 ppm devrait disparaître et être déplacé à 7,27 ppm indiquant la consommation de éthynyle corannulène et l'existence de l'unité triazole (Figure 4).
- Une fois terminé, éliminer le THF sous vide et on dilue avec 20 ml d'eau, transférer le mélange dans une ampoule à décanter.
- Extrait avec du DCM (3 x 20 ml), de combiner les phases organiques dans un ballon à fond rond et on concentre dans un évaporateur rotatif.
- On purifie le produit brut par Chromatographie sur colonne en éluant avec du SiO 2 d' hexane acétate de gel / acétate d' éthyle (1: 1) pour donner un solide jaune pâle à Rf = 0,59correspondant à 7. 27 mg doivent être obtenus (rendement 75%).
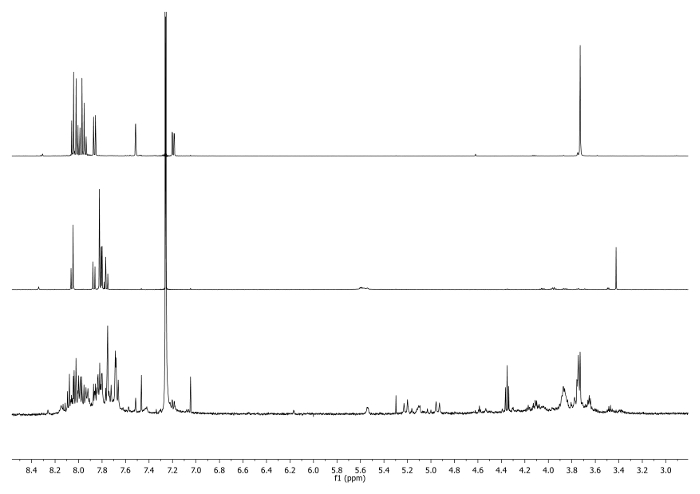
Figure 4: 1 H-spectres RMN (500 MHz, CDCI3) 5 b ( en haut), 6 bis (milieu) et une aliquote prise après 2 jours ( en bas) Notez la disparition du signal de -CCH dans le brut.. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
Résultats
Corannulène (3 a) et 2,15-dimethylhexahelicene (3 b) pourraient être préparés suivant les méthodes actuelles 46-48 de façon simple , avec de très bons rendements (Figure 5). Les deux partagent une molécule commune, le 2,7-diméthylnaphtalène, en tant que matériau de départ, ce qui donne lieu à une divergence de synthèse convergente de la molécule finale.
Discussion
Composé final 7 a été préparé après 6 étapes à partir de précurseurs aromatiques polycycliques non planes 3a et 3b avec modérée à de très bons rendements à chaque réaction. La principale limitation observée dans cette voie était la bromation des deux composés polycycliques non planaires. Cependant, dans le cas du composé 4 bis, une quantité importante de corannulène libre peut être récupéré pour...
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
This work was funded by the Spanish Ministerio de Economìa y Competitividad (CTQ 2013-41067-P). H.B. acknowledge with thanks a MEC-FPI grant.
matériels
| Name | Company | Catalog Number | Comments |
| 2,15-Dimethylhexahelicene | N/A | N/A | Prepared according to reference 5b,c in the main text. |
| Corannulene | N/A | N/A | Prepared according to reference 5a in the main text. |
| N-Bromosuccinimide (NBS) | Sigma Aldrich | B8.125-5 | ReagentPlus®, 99%. Recrystallized from hot water. |
| Benzoyl peroxide (BPO) | Sigma Aldrich | B-2030 | ~70% (titration). 30% water as stabilizer. |
| Sodium azide | Sigma Aldrich | S2002 | ReagentPlus®, ≥99.5%. |
| Gold (III) chloride Hydrate | Sigma Aldrich | 50778 | puriss. p.a., ACS reagent, ≥49% Au basis. |
| Ethynyltrimethylsilane | Sigma Aldrich | 218170 | 98%. |
| [PdCl2(dppf)] | N/A | N/A | Prepared according to reference 6 in the main text. |
| CuI | N/A | N/A | Prepared according to reference 7 in the main text. |
| KF | Sigma Aldrich | 307599 | 99%, spray-dried. |
| (+)-Sodium L-ascorbate | Fluka | 11140 | BioXtra, ≥99.0% (NT). |
| Copper(II) Sulphate 5-hydrate | Panreac | 131270 | for analysis. |
| Carbon tetrachloride (CCl4) | Fluka | 87030 | for IR spectroscopy, ≥99.9%. |
| Dichloromethane (DCM) | Fisher Scientific | D/1852/25 | Analytical reagent grade. Distilled prior to use. |
| Hexane | Fisher Scientific | H/0355/25 | Analytical reagent grade. Distilled prior to use. |
| Ethyl acetate | Scharlau | AC0145025S | Reagent grade. Distilled prior to use. |
| Tetrahydrofuran (THF) | Fisher Scientific | T/0701/25 | Analytical reagent grade. Distilled prior to use. |
| 1,2-Dichloroethane (DCE) | Sigma Aldrich | D6,156-3 | ReagentPlus®, 99%. |
| Methanol (MeOH) | VWR | 20847.36 | AnalaR NORMAPUR. |
| Triethyl amine (NEt3) | Sigma Aldrich | T0886 | ≥99%. |
| Silica gel | Acros | 360050010 | Particle size 40-60mm. |
| Sand - low iron | Fisher Scientific | S/0360/63 | General purpose grade. |
| TLC Silica gel 60 F254 | Merck | 1.05554.0001 | |
| Monowave 300 (Microwave reactor) | Anton Para | ||
| Sonicator | Grupo Selecta | 3000513 | 6 Litres. |
Références
- Scott, L. T., Hashemi, M. M., Bratcher, M. S. Corannulene bowl-to-bowl inversion is rapid at room temperature. J. Am. Chem. Soc. 114 (5), 1920-1921 (1992).
- Sygula, A., et al. Bowl stacking in curved polynuclear aromatic hydrocarbons: crystal and molecular structure of cyclopentacorannulene. J. Chem. Soc., Chem. Commun. (22), 2571-2572 (1994).
- Nuckolls, C., et al. Circular Dichroism and UV−Visible Absorption Spectra of the Langmuir−Blodgett Films of an Aggregating Helicene. J. Am. Chem. Soc. 120 (34), 8656-8660 (1998).
- Beljonne, D., et al. Electro-optic response of chiral helicenes in isotropic media. J. Chem. Phys. 108 (4), 1301-1304 (1998).
- Treboux, G., Lapstun, P., Wu, Z., Silverbrook, K. Electronic conductance of helicenes. Chem. Phys. Lett. 301 (5-6), 493-497 (1999).
- Katz, T. J. Syntheses of Functionalized and Aggregating Helical Conjugated Molecules. Angew. Chem., Int. Ed. 39 (11), 1921-1923 (2000).
- Furche, F., et al. Circular Dichroism of Helicenes Investigated by Time-Dependent Density Functional Theory. J. Am. Chem. Soc. 122 (8), 1717-1724 (2000).
- Urbano, A. Recent Developments in the Synthesis of Helicene-Like Molecules. Angew. Chem., Int. Ed. 42 (34), 3986-3989 (2003).
- Botek, E., Champane, B., Turki, M., André, J. M. Theoretical study of the second-order nonlinear optical properties of [N]helicenes and [N]phenylenes. J. Chem. Phys. 120 (4), 2042-2048 (2004).
- Lovas, F. J., et al. Interstellar Chemistry: A Strategy for Detecting Polycyclic Aromatic Hydrocarbons in Space. J. Am. Chem. Soc. 127 (12), 4345-4349 (2005).
- Wigglesworth, T. J., Sud, D., Norsten, T. B., Lekhi, V. S., Branda, N. R. Chiral Discrimination in Photochromic Helicenes. J. Am. Chem. Soc. 127 (20), 7272-7273 (2005).
- Wu, Y. -. T., Siegel, J. S. Aromatic Molecular-Bowl Hydrocarbons: Synthetic Derivatives, Their Structures, and Physical Properties. Chem. Rev. 106 (12), 4843-4867 (2006).
- Tsefrikas, V. M., Scott, L. T. Geodesic Polyarenes by Flash Vacuum Pyrolysis. Chem. Rev. 106 (12), 4868-4884 (2006).
- Wu, Y. -. T., Hayama, T., Baldrige, K. K., Linden, A., Siegel, J. S. Synthesis of Fluoranthenes and Indenocorannulenes: Elucidation of Chiral Stereoisomers on the Basis of Static Molecular Bowls. J. Am. Chem. Soc. 128 (21), 6870-6884 (2006).
- Wu, Y. -. T., Siegel, J. S. Synthesis, structures, and physical properties of aromatic molecular-bowl hydrocarbons. Top. Curr. Chem. 349, 63-120 (2014).
- Pérez, E. M., Martìn, N. Curves ahead: molecular receptors for fullerenes based on concave-convex complementarity. Chem. Soc. Rev. 37 (8), 1512-1519 (2008).
- Tashiro, K., Aida, T. Metalloporphyrin hosts for supramolecular chemistry of fullerenes. Chem. Soc. Rev. 36 (2), 189-197 (2007).
- Kawase, T. Ball- Bowl- and Belt-Shaped Conjugated Systems and Their Complexing Abilities: Exploration of the Concave−Convex π−π Interaction. Chem. Rev. 106 (12), 5250-5273 (2006).
- Martin, N., Pérez, E. M. Molecular tweezers for fullerenes. Pure Appl. Chem. 82 (3), 523-533 (2010).
- Hoppe, H., Sariciftci, N. S. Morphology of polymer/fullerene bulk heterojunction solar cells. J. Mater. Chem. 16 (1), 45-61 (2006).
- Kim, S. N., Rusling, J. F., Papadimitrakopoulos, F. Carbon Nanotubes for Electronic and Electrochemical Detection of Biomolecules. Adv. Mater. 19 (20), 3214-3228 (2007).
- Dennler, G., Scharber, M. C., Brabec, C. J. Polymer-Fullerene Bulk-Heterojunction Solar Cells. Adv. Mater. 21 (13), 1323-1338 (2009).
- Helgesen, M., Søndergaard, R., Krebs, F. C. Advanced materials and processes for polymer solar cell devices. J. Mater. Chem. 20 (1), 36-60 (2010).
- Brabec, C. J., et al. Polymer-Fullerene Bulk-Heterojunction Solar Cells. Adv. Mater. 22 (34), 3839-3856 (2010).
- Delgado, J. L., Bouit, P. -. A., Filippone, S., Herranz, M. A., Martìn, N. Organic photovoltaics: a chemical approach. Chem. Commun. 46 (27), 4853-4865 (2010).
- Schnorr, J. M., Swager, T. M. Emerging Applications of Carbon Nanotubes. Chem. Mater. 23 (3), 646-657 (2011).
- Wang, C., Takei, K., Takahashi, T., Javey, A. Carbon nanotube electronics - moving forward. Chem. Soc. Rev. 42 (7), 2592-2609 (2013).
- Park, S., Vosguerichian, M., Bao, Z. A review of fabrication and applications of carbon nanotube film-based flexible electronics. Nanoscale. 5, 1727-1752 (2013).
- Mizyed, S., et al. Embracing C60 with Multiarmed Geodesic Partners. J. Am. Chem. Soc. 123 (51), 12770-12774 (2001).
- Sygula, A., Sygula, R., Ellern, A., Rabideau, P. W. Novel Twin Corannulene: Synthesis and Crystal Structure Determination of a Dicorannulenobarrelene Dicarboxylate. Org. Lett. 5 (15), 2595-2597 (2003).
- Georghiou, P. E., Tran, A. H., Mizyed, S., Bancu, M., Scott, L. T. Concave Polyarenes with Sulfide-Linked Flaps and Tentacles: New Electron-Rich Hosts for Fullerenes. J. Org. Chem. 70 (16), 6158-6163 (2005).
- Sygula, A., Fronczek, F. R., Sygula, R., Rabideau, P. W., Olmstead, M. M. A Double Concave Hydrocarbon Buckycatcher. J. Am. Chem. Soc. 129 (13), 3842-3843 (2007).
- Yanney, M., Sygula, A. Tridental molecular clip with corannulene pincers: is three better than two?. Tetrahedron Lett. 54 (21), 2604-2607 (2013).
- Stuparu, M. C. Rationally Designed Polymer Hosts of Fullerene. Angew. Chem., Int. Ed. 52 (30), 7786-7790 (2013).
- Le, V. H., Yanney, M., McGuire, M., Sygula, A., Lewis, E. A. Thermodynamics of Host-Guest Interactions between Fullerenes and a Buckycatcher. J. Phys. Chem. B. 118 (41), 11956-11964 (2014).
- Álvarez, C. M. Enhanced association for C70 over C60 with a metal complex with corannulene derivate ligands. Dalton Trans. 43 (42), 15693-15696 (2014).
- Álvarez, C. M. Assembling Nonplanar Polyaromatic Units by Click Chemistry. Study of Multicorannulene Systems as Host for Fullerenes. Org. Lett. 17 (11), 2578-2581 (2015).
- Yanney, M., Fronczek, F. R., Sygula, A. A 2:1 Receptor/C60 Complex as a Nanosized Universal Joint. Angew. Chem. Int. Ed. 54 (38), 11153-11156 (2015).
- Kuragama, P. L. A., Fronczek, F. R., Sygula, A. Bis-corannulene Receptors for Fullerenes Based on Klärner's Tethers: Reaching the Affinity Limits. Org. Lett. 17 (21), (2015).
- George, S. R. D., Frith, T. D. H., Thomas, D. S., Harper, J. B. Putting corannulene in its place. Reactivity studies comparing corannulene with other aromatic hydrocarbons. Org. Biomol. Chem. 13 (34), 9035-9041 (2015).
- Shen, Y., Chen, C. -. F. Helicenes: Synthesis and Applications. Chem. Rev. 112 (3), 1463-1535 (2012).
- Crassous, J., Saleh, N., Shen, C. Helicene-based transition metal complexes: synthesis, properties and applications. Chem. Sci. 5 (10), 3680-3694 (2014).
- Nakamura, K., Furumi, S., Takeuchi, M., Shibuya, T., Tanaka, K. Enantioselective Synthesis and Enhanced Circularly Polarized Luminescence of S-Shaped Double Azahelicenes. J. Am. Chem. Soc. 136 (15), 5555-5558 (2014).
- Schweinfurth, D., Zalibera, M., Kathan, M., Shen, C., Mazzolini, M., Trapp, N., Crassous, J., Gescheidt, G., Diederich, F. Helicene Quinones: Redox-Triggered Chiroptical Switching and Chiral Recognition of the Semiquinone Radical Anion Lithium Salt by Electron Nuclear Double Resonance Spectroscopy. J. Am. Chem. Soc. 136 (37), 13045-13052 (2014).
- Šámal, M., Chercheja, S., Rybáček, J., Vacek Chocholoušová, J., Vacek, J., Bednárová, L., Šaman, D., Stará, I. G., Starý, I. An Ultimate Stereocontrol in Asymmetric Synthesis of Optically Pure Fully Aromatic Helicenes. J. Am. Chem. Soc. 137 (26), 8469-8474 (2015).
- Siegel, J. S., Butterfield, A. M., Gilomen, B. Kilogram scale production of corannulene. Organic Process Research & Development. 16 (4), 664-676 (2012).
- Mallory, F. B., Mallory, C. W. Photocyclization of stilbenes and related molecules. Organic Reactions. , (1984).
- Sato, M., et al. Convenient synthesis and reduction properties of [7] circulene. J. Chem. Soc., Perkin Trans. 2. (9), 1909-1914 (1998).
- Anderson, G. K., Lin, M. Bis(Benzonitrile)dichloro complexes of palladium and platinum. Inorg Synth. 28, 60-63 (1990).
- Nataro, C., Fosbenner, S. M. Synthesis and Characterization of Transition-Metal Complexes Containing 1,1'-Bis(diphenylphosphino)ferrocene. J. Chem. Ed. 86 (12), 1412-1415 (2009).
- Kauffman, G. B., Pinnell, R. P. Copper (I) Iodide. Inorg. Synth. 6, 3-6 (1960).
- Sonogashira, K. J. Development of Pd-Cu catalyzed cross-coupling of terminal acetylenes with sp2-carbon halides. Organomet. Chem. 653 (1-2), 46-49 (2002).
- Chinchilla, R., Nájera, C. Recent advances in Sonogashira reactions. Chem. Soc. Rev. 40 (10), 5084-5121 (2011).
- Kolb, H. C., Finn, M. G., Sharpless, K. B. Click Chemistry: Diverse Chemical Function from a Few Good Reactions. Angew. Chem. Int. Ed. 40 (11), 2004-2021 (2001).
- Spiteri, C., Moses, J. E. Copper-Catalyzed Azide-Alkyne Cycloaddition: Regioselective Synthesis of 1,4,5-Trisubstituted 1,2,3-Triazoles. Angew. Chem. Int. Ed. 49 (1), 31-33 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon