Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Herstellung eines Corannulene-funktionalisierten Hexahelicen von Kupfer (I) -katalysierte Alkin-Azid-Cyclo von Nichtplanare Polyaromatische Einheiten
In diesem Artikel
Zusammenfassung
Hier präsentieren wir ein Protokoll einer komplexen organischen Verbindung zu synthetisieren, die aus drei nichtplanaren polyaromatischen Einheiten zusammengebaut leicht mit vernünftigen Ausbeuten.
Zusammenfassung
The main purpose of this video is to show 6 reaction steps of a convergent synthesis and prepare a complex molecule containing up to three nonplanar polyaromatic units, which are two corannulene moieties and a racemic hexahelicene linking them. The compound described in this work is a good host for fullerenes. Several common organic reactions, such as free-radical reactions, C-C coupling or click chemistry, are employed demonstrating the versatility of functionalization that this compound can accept. All of these reactions work for planar aromatic molecules. With subtle modifications, it is possible to achieve similar results for nonplanar polyaromatic compounds.
Einleitung
Aufgrund ihrer speziellen Geometrie, Corannulen und Helicene sind Moleküle , die eine Struktur weit von der Planarität und führen zu interessanten Eigenschaften. 1-15 In den letzten Jahren übernehmen kann, ist die Suche nach molekularen Rezeptoren für Kohlenstoff - Nanoröhrchen und Fullerene ein sehr aktives Gebiet 16-19 durch, vor allem, um ihre potenziellen Anwendungen als Materialien für organische Solarzellen, Transistoren, Sensoren und andere Geräte. 20-28 die hervorragende Ergänzung in der Form zwischen Corannulen und einem Fulleren haben die Aufmerksamkeit von mehreren Forschern mit dem Ziel der Gestaltung angezogen molekularen Rezeptoren der Lage , supramolekulare Assoziation durch Dispersionskräfte zu etablieren. 29-39
Die Chemie der oben erwähnten nicht - planaren polyaromatischen Verbindungen ist ähnlich zu derjenigen für völlig planare Moleküle beschrieben, aber es ist manchmal schwierig , geeignete Bedingungen zu finden , um die gewünschten Selektivitäten und Ausbeuten erreicht werden . 40 In dieser Arbeit präsentieren wir die Synthese eines Moleküls (7) in wenigen Schritten mit guten Ausbeuten in jedem Forschungslabor gefunden durch die Anwendung einfach und typische Techniken drei polyaromatischen Einheiten. Das Molekül ist von großer Bedeutung , weil es eine zangenartige Konformation annehmen können gute Wechselwirkungen mit C 60 37 in Lösung herzustellen; und es kann ein Forschungslinie als potentieller Rezeptor für höhere Fullerene chiral dank der Helicen Linker öffnen, die ein chirales Molekül aufgrund der Existenz eines stereogenen Achse. 41-45 jedoch nur racemische Helicen wird in dieser Arbeit verwendet werden.
An diesem Punkt ist die einzige Einschränkung dieser Rezeptoren zu synthetisieren, ist die Herstellung von Helicene und corannulenes, da sie nicht im Handel erhältlich sind. Aber, nach neuen Methoden veröffentlicht anderswo 46-48 sie können in geeigneten Mengen in einem vernünftigen kurzen Zeitraum erhalten werden.
Protokoll
1. Funktionalisierung 2,15-Dimethylhexahelicene
- Bromierung von 2,15-dimethylhexahelicene
- Wiegen 0,356 g (1,0 mmol) 2,15-dimethylhexahelicene, 0,374 g (2,1 mmol) frisch umkristallisiert N - Bromsuccinimid (NBS) und 24 mg (0.07 mmol) Benzoylperoxid (BPO) (70% wt mit 30% Wasser als Stabilisator). Platzieren alle Feststoffe in einem 100 ml Schlenk-Kolben mit einem magnetischen Rührstab. Setzen Sie unter Stickstoffatmosphäre durch drei Zyklen der Gasevakuierung anschließend mit Inertgas in der Schlenk Linie Nachfüllen.
- Hinzufügen 21 ml Kohlenstofftetrachlorid (CCl 4). Entgasen der Lösung durch die gleiche Evakuierung / Nachfüllen (Schritt 1.1.1) unter kräftigem Rühren und sorgfältig, um massiven Verlust an Lösungsmittel zu verhindern.
- Wärme unter Rückfluss (77 ° C) wurde das Gemisch mit einem Ölbad für 4 Stunden. Überprüfen Sie die Reaktion von 1 H-Kernspinresonanz (NMR). Dubletten zwischen 3,7 ppm und 4,0 ppm should erscheinen. Sie weisen auf das Vorhandensein von diastereotopen -CH 2 - Gruppen (Abbildung 1).
- Sobald Sie fertig sind, die Mischung wird auf Raumtemperatur und das Lösungsmittel im Vakuum entfernen. Stellen Sie eine Falle mit flüssigem Stickstoff gefüllt Pumpe Verunreinigungen zu vermeiden.
- Abgeblasen, und der rohe in 30 ml Dichlormethan (DCM), übertragen auf einen Rundkolben und mischen (fügen typischerweise 5-fach das Rohgewicht) mit 4 g Kieselgel. Das Gemisch wird konzentriert in einem Rotationsverdampfer.
- In der Zwischenzeit füllt eine Säule (Länge etwa 20 cm und einer Dicke von 4,5 cm) mit SiO 2 -Gel gemischt vorher mit Hexan / Ethylacetat (95: 5) als mobile Phase. Fügen Sie die Mischung an die Spitze der Kolonne und fügen Sie dann eine Schicht aus Sand (2 cm).
- Füllen Sie vorsichtig in die neue mobile Phase und führen Sie die Chromatographie von Fraktionen in den Reagenzgläsern (typischerweise 20 ml pro Röhrchen und 4 ml in der Nähe des erwarteten Produkts Elution) zu sammeln. Überprüfen Fraktionen durch Dünnschichtchromatographie(TLC) mit der gleichen mobilen Phase (Hexan / Ethylacetat 95: 5) und Bild unter UV-Licht. Das erwartete Produkt (4b) sollte mit einer Retentionsfaktor (Rf) von 0,35 als ein gelbes Öl zu eluieren nach dem Kombinieren aller Fraktionen gesucht und das Lösungsmittel im Rotationsverdampfer entfernt wird. 334 mg sollte (Ausbeute 65%) erhalten werden.
HINWEIS: Alle Schlenk-Techniken, die Verwendung von einem Ölbad zum Heizen und säulenchromatographisch Einstellungen weit in den meisten der Protokolle verwendet werden, so von nun an, werden sie nicht im Detail behandelt werden, und nur wenige Kommentare, wenn nötig, wird gegeben werden.
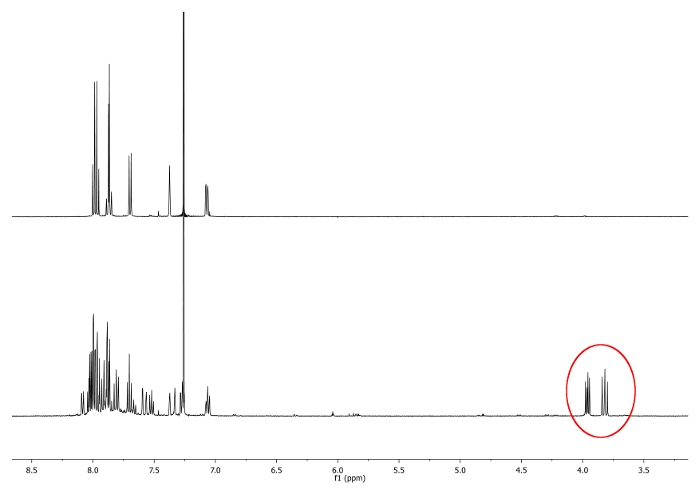
. 1 1 H-NMR - Spektren (500 MHz, CDCl 3) von 2,15 -dimethylhelicene (oben) und ein nach 2 Stunden genommen aliquoten neue Signale, entsprechend -CH 2 -.., sind in einem roten Kreis (unten) dargestellt Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
- Synthese von 2,15-Bis (azidomethyl) Hexahelicen
- Wiegen 0,103 g (0,2 mmol) 2,15-Bis (brommethyl) Hexahelicen und 0,390 g (6 mmol) Natriumazid. Legen Sie beide Feststoffe in einem 50 ml-Schlenk-Kolben mit Magnetstab ausgestattet und unter Stickstoffatmosphäre gestellt.
- Mischen Sie 8,6 ml Tetrahydrofuran (THF) mit 5,2 ml Wasser (H 2 O) und gießen Sie die Mischung von Lösungsmitteln in den Schlenk - Kolben. Entgasen der Lösung.
- Wärme unter Rückfluss (65 ° C) für 3 Stunden. Überprüfen Sie die Reaktion von 1 H-NMR. CH 2 - Signale sollten auf 3,75 ppm verschieben (Abbildung 2).
- Danach cool hinunter die Mischung auf Raumtemperatur und Entfernen THF unter Vakuum. Verdünnt mit 50 ml H 2 O.
- Das Gemisch wird in einen Scheidetrichter und extrahiert dreimal mit 40 ml DCM. Kombinieren Sie alle organischen Phasen und wasche mit reinem H 2 O (50 ml).
- Man reinige das Rohprodukt durch Säulenchromatographie an Kieselgel mit Hexan / Ethylacetat (85:15) als mobile Phase ein gelbes Öl bei Rf = 0,38 , entsprechend 2,15-bis (azomethyl) Hexahelicen (5b) zu ergeben. 70 mg sollte (Ausbeute 80%) erhalten werden.
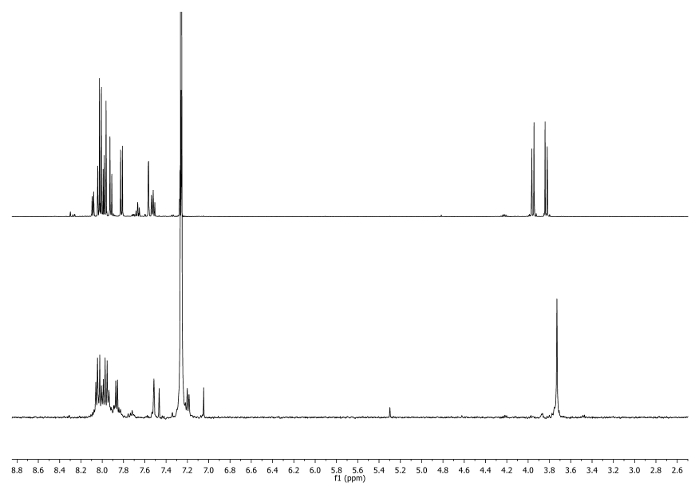
Abbildung 2: 1 H-NMR - Spektren (500 MHz, CDCl 3) 4 b (oben) und ein Aliquot entnommen nach 3 h(unten). Beachten Sie die Änderungen in der aliphatischen Region. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
2. Funktionalisierung von Corannulene
- Monobromierung von Corannulene
- Wiegen 0,125 g (0,5 mmol) Corannulen, 89 mg (0,5 mmol) frisch umkristallisiert NBS und 17 mg Gold (III) -chlorid-Hydrat.
- Legen Sie alle Verbindungen in einen 10-ml-Fläschchen speziell für Mikrowellenreaktionen ausgestattet mit einem Magnetstab und dann in einer Stickstoffatmosphäre mit Hilfe eines 2-Hals-Rundkolben.
- In 7 ml 1,2-Dichlorethan (DCE) und Entgasen der Lösung.
- Beschallen die Mischung 2 min Goldsalzpartikel zu dispergieren.
- Wärme im Inneren des Mikrowellenreaktor bei 100 ° C für 2 Stunden.
- Wenn Sie fertig sind, übertragen die rohe in einen Rundkolben und entfernen Lösungsmittel durch rotary Verdampfung.
- Man reinige das Rohprodukt durch Säulenchromatographie auf SiO 2 -Gel Hexan als mobile Phase verwendet wird .
HINWEIS: Bromocorannulene (4a) als gelber Feststoff bei Rf = 0,38 erhalten. 99 mg sollte (Ausbeute 60%) erhalten werden. Nicht umgesetztes Corannulen (3a) für weitere Verwendungen rückgewonnen und gespeichert werden. Es scheint bei Rf = 0,29.
- Sonogashira - Kupplung von Bomocorannulene und Ethinyltrimethylsilan
- Wiegen 49 mg (0,15 mmol) bromocorannulene, 11 mg (0,015 mmol) [PdCl 2 (dppf)] , 49,50 (dppf wobei 1,1-'bis (diphenylphsphino) ferrocen, 3 mg (0,015 mmol) CuI. 51
- Legen Sie alle Feststoffe in einem 50 ml-Schlenk-Kolben zusammen mit einem Magnetstab und unter Stickstoffatmosphäre gestellt.
- 5,0 ml Triethylamin (NEt 3) und entgast die Mischung.
- Schließlich fügen 104 ul (0,75 mmol) Ethinyltrimethylsilan.
- Beschallen das Gemisch 2 min aufzerstreuen Metallsalzpartikel.
- Hitze bei 85 ° C für 24 Stunden mit periodischen Beschallung Ablagerung von Metallsalzen zu verhindern.
HINWEIS: Die Mischung Farbe bald schwarz wurde, was die Anwesenheit von Palladium (0). - Kühle auf Raumtemperatur und NEt 3 im Vakuum verdampfen.
- Wieder in Lösung in 20 ml DCM und durch Säulenchromatographie über Kieselgel reinigt unter Elution mit Hexan einen gelben Feststoff zu geben Rf = 0,28 bis 5a entspricht. 41 mg sollte (Ausbeute 78%) erhalten werden.
HINWEIS: Wenn das rohe durch ein Celitekissen in DCM gefiltert wird, eine vernünftige reine Probe erhalten werden könnten, jedoch Phosphinderivate nicht vollständig entfernt.
- Herstellung von Ethynylcorannulene durch TMS Das Entschützen
- Wiegen 35 mg (0,10 mmol) 5a und 7,3 mg (0,125 mmol) wasserfreiem Kaliumfluorid.
- Legen Sie alle Feststoffe in einem 50 ml-Schlenk-Kolben, der mit einem Magnetstab ein ausgestattetd unter Stickstoffatmosphäre gesetzt.
- Mischen Sie 4 ml THF und 4 ml Methanol (MeOH) und gießen Sie die Mischung in den Kolben Schlenk. gründlich Degas.
- Bei Raumtemperatur reagieren, Halten von Licht auf den Kolben entfernt, indem sie es mit einer opaken Folie abdecken. Überprüfen Sie die Reaktion von 1 H-NMR durch bei 3,48 ppm suchen. Ein Signal an -CCH müssen entsprechende (Abbildung 3) entstehen.
HINWEIS: Obwohl diese Verbindung mit einer terminalen Alkin trägt, die reaktiv ist und zersetzt sich leicht, fanden wir keine Probleme bei der Aufarbeitung weiter unten beschrieben. Es wurde unter natürlichem Licht durchgeführt. - Sobald Sie fertig sind, entfernen Sie THF unter Vakuum und verdünnt mit 10 ml Wasser, alles in einen Trenntrichter übertragen.
- Extrahieren mit DCM (3 x 15 ml), vereinige alle organischen Phasen in einem Rundkolben und engt im Rotationsverdampfer bei Raumtemperatur bis endlich ein gelber Feststoff 6a entspricht. 27 mg sollte erhalten (quantitative Ausbeute) werden.
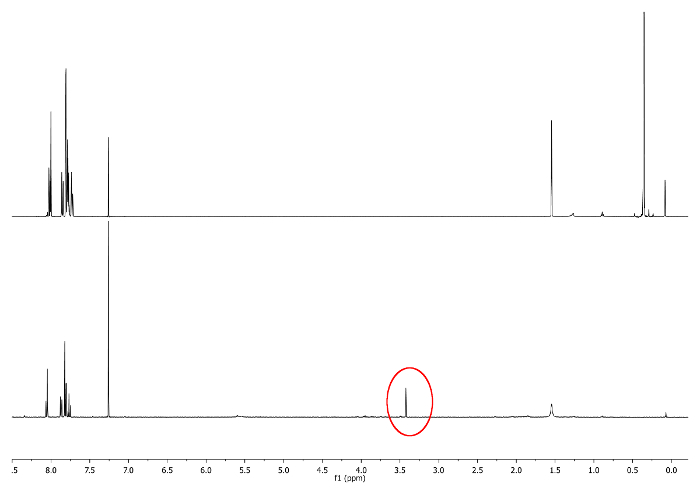
Abbildung 3:.. 1 H-NMR - Spektren (500 MHz, CDCl 3) von 5 a (oben) und 6 a (unten) -CCH Singulett ist in einem roten Kreis dargestellt Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
3. Endmontage von Click-Chemie
- Wiegen 15,3 mg (0,035 mmol) 5b, 20,0 mg (0,073 mmol) 6a, 1,4 mg (0,007 mmol) von Ascorbinsäure - Natriumsalz, 1,7 mg (0,007 mmol) CuSO 4 · 5H 2 O.
- Platzieren alle Feststoffe in einem 50 ml Schlenk-Kolben mit am ausgestattetagnetic bar und unter Stickstoffatmosphäre gestellt.
- Mischen Sie 3 ml H 2 O und 12 ml THF und gießen Sie die Mischung in den Kolben Schlenk. gründlich Entgasen der Lösung.
- Hitze bei 65 ° C für 3 Tage mit einem Kondensator zu dem oberen Ende des Kolbens verbunden ist, und prüfen periodisch die Reaktionstemperatur zu steuern, Rühren und Lösungsmittelvolumen. Überprüfen Sie die Reaktion von 1 H-NMR. Das Signal bei 3,48 ppm sollte verschwinden und 7,27 ppm verschoben werden angibt , den Verbrauch von Ethinyl Corannulen und die Existenz des Triazol - Einheit (Abbildung 4).
- Nach Beendigung entfernen THF unter Vakuum und verdünnte mit 20 ml Wasser, die Mischung in einen Scheidetrichter übertragen.
- Extrahieren mit DCM (3 x 20 ml), vereinige alle organischen Phasen in einem Rundkolben und konzentriert im Rotationsverdampfer.
- Man reinige das Rohprodukt durch Säulenchromatographie an SiO 2 unter Elution mit Hexan / Ethylacetat (1: 1) hellgelben Feststoff zu geben Rf = 0,59entsprechend 7. 27 mg sollte (Ausbeute 75%) erhalten werden.
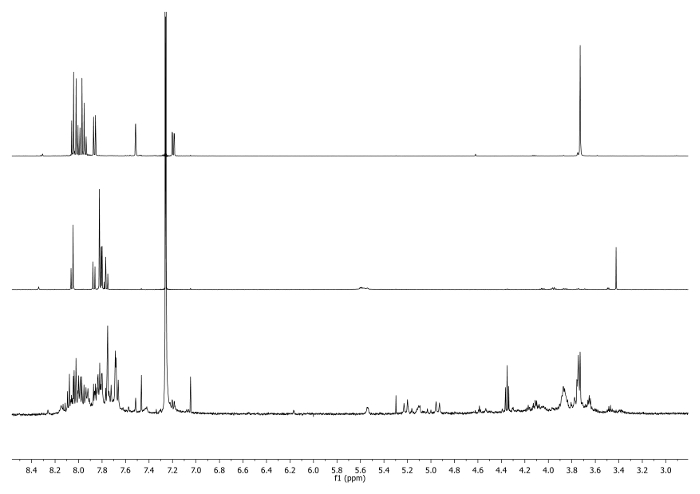
Figur 4: 1 H-NMR - Spektren (500 MHz, CDCl 3) von 5 b (oben), 6 a (Mitte) und ein Aliquot genommen nach 2 Tagen (unten) Hinweis das Verschwinden -CCH Signal in dem rohen.. Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
Ergebnisse
Corannulene (3 a) und 2,15-dimethylhexahelicene (3 b) hergestellt werden konnten folgende aktuelle Methoden 46-48 auf einfache Art und Weise mit sehr guten Ausbeuten (Abbildung 5). Sowohl ein gemeinsames Molekül teilen, 2,7-Dimethylnaphthalin, als Ausgangsmaterial, Anstieg geben zu einer divergenten konvergente Synthese des fertigen Moleküls.
Diskussion
Endgültige Verbindung 7 wurde bei jeder Reaktion nach 6 Stufen von nichtplanaren polyaromatischen Vorstufen 3 a und 3 b mit mäßigen bis sehr guten Ausbeuten hergestellt. Die wichtigste Einschränkung in dieser Strecke zu beobachten war die Bromierungsreaktion der beiden nicht-planaren polyaromatischen Verbindungen. Im Fall der Verbindung 4 jedoch ein, kann eine erhebliche Menge an freiem Corannulen f...
Offenlegungen
The authors have nothing to disclose.
Danksagungen
This work was funded by the Spanish Ministerio de Economìa y Competitividad (CTQ 2013-41067-P). H.B. acknowledge with thanks a MEC-FPI grant.
Materialien
| Name | Company | Catalog Number | Comments |
| 2,15-Dimethylhexahelicene | N/A | N/A | Prepared according to reference 5b,c in the main text. |
| Corannulene | N/A | N/A | Prepared according to reference 5a in the main text. |
| N-Bromosuccinimide (NBS) | Sigma Aldrich | B8.125-5 | ReagentPlus®, 99%. Recrystallized from hot water. |
| Benzoyl peroxide (BPO) | Sigma Aldrich | B-2030 | ~70% (titration). 30% water as stabilizer. |
| Sodium azide | Sigma Aldrich | S2002 | ReagentPlus®, ≥99.5%. |
| Gold (III) chloride Hydrate | Sigma Aldrich | 50778 | puriss. p.a., ACS reagent, ≥49% Au basis. |
| Ethynyltrimethylsilane | Sigma Aldrich | 218170 | 98%. |
| [PdCl2(dppf)] | N/A | N/A | Prepared according to reference 6 in the main text. |
| CuI | N/A | N/A | Prepared according to reference 7 in the main text. |
| KF | Sigma Aldrich | 307599 | 99%, spray-dried. |
| (+)-Sodium L-ascorbate | Fluka | 11140 | BioXtra, ≥99.0% (NT). |
| Copper(II) Sulphate 5-hydrate | Panreac | 131270 | for analysis. |
| Carbon tetrachloride (CCl4) | Fluka | 87030 | for IR spectroscopy, ≥99.9%. |
| Dichloromethane (DCM) | Fisher Scientific | D/1852/25 | Analytical reagent grade. Distilled prior to use. |
| Hexane | Fisher Scientific | H/0355/25 | Analytical reagent grade. Distilled prior to use. |
| Ethyl acetate | Scharlau | AC0145025S | Reagent grade. Distilled prior to use. |
| Tetrahydrofuran (THF) | Fisher Scientific | T/0701/25 | Analytical reagent grade. Distilled prior to use. |
| 1,2-Dichloroethane (DCE) | Sigma Aldrich | D6,156-3 | ReagentPlus®, 99%. |
| Methanol (MeOH) | VWR | 20847.36 | AnalaR NORMAPUR. |
| Triethyl amine (NEt3) | Sigma Aldrich | T0886 | ≥99%. |
| Silica gel | Acros | 360050010 | Particle size 40-60mm. |
| Sand - low iron | Fisher Scientific | S/0360/63 | General purpose grade. |
| TLC Silica gel 60 F254 | Merck | 1.05554.0001 | |
| Monowave 300 (Microwave reactor) | Anton Para | ||
| Sonicator | Grupo Selecta | 3000513 | 6 Litres. |
Referenzen
- Scott, L. T., Hashemi, M. M., Bratcher, M. S. Corannulene bowl-to-bowl inversion is rapid at room temperature. J. Am. Chem. Soc. 114 (5), 1920-1921 (1992).
- Sygula, A., et al. Bowl stacking in curved polynuclear aromatic hydrocarbons: crystal and molecular structure of cyclopentacorannulene. J. Chem. Soc., Chem. Commun. (22), 2571-2572 (1994).
- Nuckolls, C., et al. Circular Dichroism and UV−Visible Absorption Spectra of the Langmuir−Blodgett Films of an Aggregating Helicene. J. Am. Chem. Soc. 120 (34), 8656-8660 (1998).
- Beljonne, D., et al. Electro-optic response of chiral helicenes in isotropic media. J. Chem. Phys. 108 (4), 1301-1304 (1998).
- Treboux, G., Lapstun, P., Wu, Z., Silverbrook, K. Electronic conductance of helicenes. Chem. Phys. Lett. 301 (5-6), 493-497 (1999).
- Katz, T. J. Syntheses of Functionalized and Aggregating Helical Conjugated Molecules. Angew. Chem., Int. Ed. 39 (11), 1921-1923 (2000).
- Furche, F., et al. Circular Dichroism of Helicenes Investigated by Time-Dependent Density Functional Theory. J. Am. Chem. Soc. 122 (8), 1717-1724 (2000).
- Urbano, A. Recent Developments in the Synthesis of Helicene-Like Molecules. Angew. Chem., Int. Ed. 42 (34), 3986-3989 (2003).
- Botek, E., Champane, B., Turki, M., André, J. M. Theoretical study of the second-order nonlinear optical properties of [N]helicenes and [N]phenylenes. J. Chem. Phys. 120 (4), 2042-2048 (2004).
- Lovas, F. J., et al. Interstellar Chemistry: A Strategy for Detecting Polycyclic Aromatic Hydrocarbons in Space. J. Am. Chem. Soc. 127 (12), 4345-4349 (2005).
- Wigglesworth, T. J., Sud, D., Norsten, T. B., Lekhi, V. S., Branda, N. R. Chiral Discrimination in Photochromic Helicenes. J. Am. Chem. Soc. 127 (20), 7272-7273 (2005).
- Wu, Y. -. T., Siegel, J. S. Aromatic Molecular-Bowl Hydrocarbons: Synthetic Derivatives, Their Structures, and Physical Properties. Chem. Rev. 106 (12), 4843-4867 (2006).
- Tsefrikas, V. M., Scott, L. T. Geodesic Polyarenes by Flash Vacuum Pyrolysis. Chem. Rev. 106 (12), 4868-4884 (2006).
- Wu, Y. -. T., Hayama, T., Baldrige, K. K., Linden, A., Siegel, J. S. Synthesis of Fluoranthenes and Indenocorannulenes: Elucidation of Chiral Stereoisomers on the Basis of Static Molecular Bowls. J. Am. Chem. Soc. 128 (21), 6870-6884 (2006).
- Wu, Y. -. T., Siegel, J. S. Synthesis, structures, and physical properties of aromatic molecular-bowl hydrocarbons. Top. Curr. Chem. 349, 63-120 (2014).
- Pérez, E. M., Martìn, N. Curves ahead: molecular receptors for fullerenes based on concave-convex complementarity. Chem. Soc. Rev. 37 (8), 1512-1519 (2008).
- Tashiro, K., Aida, T. Metalloporphyrin hosts for supramolecular chemistry of fullerenes. Chem. Soc. Rev. 36 (2), 189-197 (2007).
- Kawase, T. Ball- Bowl- and Belt-Shaped Conjugated Systems and Their Complexing Abilities: Exploration of the Concave−Convex π−π Interaction. Chem. Rev. 106 (12), 5250-5273 (2006).
- Martin, N., Pérez, E. M. Molecular tweezers for fullerenes. Pure Appl. Chem. 82 (3), 523-533 (2010).
- Hoppe, H., Sariciftci, N. S. Morphology of polymer/fullerene bulk heterojunction solar cells. J. Mater. Chem. 16 (1), 45-61 (2006).
- Kim, S. N., Rusling, J. F., Papadimitrakopoulos, F. Carbon Nanotubes for Electronic and Electrochemical Detection of Biomolecules. Adv. Mater. 19 (20), 3214-3228 (2007).
- Dennler, G., Scharber, M. C., Brabec, C. J. Polymer-Fullerene Bulk-Heterojunction Solar Cells. Adv. Mater. 21 (13), 1323-1338 (2009).
- Helgesen, M., Søndergaard, R., Krebs, F. C. Advanced materials and processes for polymer solar cell devices. J. Mater. Chem. 20 (1), 36-60 (2010).
- Brabec, C. J., et al. Polymer-Fullerene Bulk-Heterojunction Solar Cells. Adv. Mater. 22 (34), 3839-3856 (2010).
- Delgado, J. L., Bouit, P. -. A., Filippone, S., Herranz, M. A., Martìn, N. Organic photovoltaics: a chemical approach. Chem. Commun. 46 (27), 4853-4865 (2010).
- Schnorr, J. M., Swager, T. M. Emerging Applications of Carbon Nanotubes. Chem. Mater. 23 (3), 646-657 (2011).
- Wang, C., Takei, K., Takahashi, T., Javey, A. Carbon nanotube electronics - moving forward. Chem. Soc. Rev. 42 (7), 2592-2609 (2013).
- Park, S., Vosguerichian, M., Bao, Z. A review of fabrication and applications of carbon nanotube film-based flexible electronics. Nanoscale. 5, 1727-1752 (2013).
- Mizyed, S., et al. Embracing C60 with Multiarmed Geodesic Partners. J. Am. Chem. Soc. 123 (51), 12770-12774 (2001).
- Sygula, A., Sygula, R., Ellern, A., Rabideau, P. W. Novel Twin Corannulene: Synthesis and Crystal Structure Determination of a Dicorannulenobarrelene Dicarboxylate. Org. Lett. 5 (15), 2595-2597 (2003).
- Georghiou, P. E., Tran, A. H., Mizyed, S., Bancu, M., Scott, L. T. Concave Polyarenes with Sulfide-Linked Flaps and Tentacles: New Electron-Rich Hosts for Fullerenes. J. Org. Chem. 70 (16), 6158-6163 (2005).
- Sygula, A., Fronczek, F. R., Sygula, R., Rabideau, P. W., Olmstead, M. M. A Double Concave Hydrocarbon Buckycatcher. J. Am. Chem. Soc. 129 (13), 3842-3843 (2007).
- Yanney, M., Sygula, A. Tridental molecular clip with corannulene pincers: is three better than two?. Tetrahedron Lett. 54 (21), 2604-2607 (2013).
- Stuparu, M. C. Rationally Designed Polymer Hosts of Fullerene. Angew. Chem., Int. Ed. 52 (30), 7786-7790 (2013).
- Le, V. H., Yanney, M., McGuire, M., Sygula, A., Lewis, E. A. Thermodynamics of Host-Guest Interactions between Fullerenes and a Buckycatcher. J. Phys. Chem. B. 118 (41), 11956-11964 (2014).
- Álvarez, C. M. Enhanced association for C70 over C60 with a metal complex with corannulene derivate ligands. Dalton Trans. 43 (42), 15693-15696 (2014).
- Álvarez, C. M. Assembling Nonplanar Polyaromatic Units by Click Chemistry. Study of Multicorannulene Systems as Host for Fullerenes. Org. Lett. 17 (11), 2578-2581 (2015).
- Yanney, M., Fronczek, F. R., Sygula, A. A 2:1 Receptor/C60 Complex as a Nanosized Universal Joint. Angew. Chem. Int. Ed. 54 (38), 11153-11156 (2015).
- Kuragama, P. L. A., Fronczek, F. R., Sygula, A. Bis-corannulene Receptors for Fullerenes Based on Klärner's Tethers: Reaching the Affinity Limits. Org. Lett. 17 (21), (2015).
- George, S. R. D., Frith, T. D. H., Thomas, D. S., Harper, J. B. Putting corannulene in its place. Reactivity studies comparing corannulene with other aromatic hydrocarbons. Org. Biomol. Chem. 13 (34), 9035-9041 (2015).
- Shen, Y., Chen, C. -. F. Helicenes: Synthesis and Applications. Chem. Rev. 112 (3), 1463-1535 (2012).
- Crassous, J., Saleh, N., Shen, C. Helicene-based transition metal complexes: synthesis, properties and applications. Chem. Sci. 5 (10), 3680-3694 (2014).
- Nakamura, K., Furumi, S., Takeuchi, M., Shibuya, T., Tanaka, K. Enantioselective Synthesis and Enhanced Circularly Polarized Luminescence of S-Shaped Double Azahelicenes. J. Am. Chem. Soc. 136 (15), 5555-5558 (2014).
- Schweinfurth, D., Zalibera, M., Kathan, M., Shen, C., Mazzolini, M., Trapp, N., Crassous, J., Gescheidt, G., Diederich, F. Helicene Quinones: Redox-Triggered Chiroptical Switching and Chiral Recognition of the Semiquinone Radical Anion Lithium Salt by Electron Nuclear Double Resonance Spectroscopy. J. Am. Chem. Soc. 136 (37), 13045-13052 (2014).
- Šámal, M., Chercheja, S., Rybáček, J., Vacek Chocholoušová, J., Vacek, J., Bednárová, L., Šaman, D., Stará, I. G., Starý, I. An Ultimate Stereocontrol in Asymmetric Synthesis of Optically Pure Fully Aromatic Helicenes. J. Am. Chem. Soc. 137 (26), 8469-8474 (2015).
- Siegel, J. S., Butterfield, A. M., Gilomen, B. Kilogram scale production of corannulene. Organic Process Research & Development. 16 (4), 664-676 (2012).
- Mallory, F. B., Mallory, C. W. Photocyclization of stilbenes and related molecules. Organic Reactions. , (1984).
- Sato, M., et al. Convenient synthesis and reduction properties of [7] circulene. J. Chem. Soc., Perkin Trans. 2. (9), 1909-1914 (1998).
- Anderson, G. K., Lin, M. Bis(Benzonitrile)dichloro complexes of palladium and platinum. Inorg Synth. 28, 60-63 (1990).
- Nataro, C., Fosbenner, S. M. Synthesis and Characterization of Transition-Metal Complexes Containing 1,1'-Bis(diphenylphosphino)ferrocene. J. Chem. Ed. 86 (12), 1412-1415 (2009).
- Kauffman, G. B., Pinnell, R. P. Copper (I) Iodide. Inorg. Synth. 6, 3-6 (1960).
- Sonogashira, K. J. Development of Pd-Cu catalyzed cross-coupling of terminal acetylenes with sp2-carbon halides. Organomet. Chem. 653 (1-2), 46-49 (2002).
- Chinchilla, R., Nájera, C. Recent advances in Sonogashira reactions. Chem. Soc. Rev. 40 (10), 5084-5121 (2011).
- Kolb, H. C., Finn, M. G., Sharpless, K. B. Click Chemistry: Diverse Chemical Function from a Few Good Reactions. Angew. Chem. Int. Ed. 40 (11), 2004-2021 (2001).
- Spiteri, C., Moses, J. E. Copper-Catalyzed Azide-Alkyne Cycloaddition: Regioselective Synthesis of 1,4,5-Trisubstituted 1,2,3-Triazoles. Angew. Chem. Int. Ed. 49 (1), 31-33 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten