Method Article
Modélisation soustractive rapide des couches de cellules vivantes avec une sonde microfluidique
Dans cet article
Résumé
We present a protocol to perform subtractive patterning of live cell monolayers on a surface. This is achieved by local and selective lysis of adherent cells using a microfluidic probe (MFP). The cell lysate retrieved from local regions can be used for downstream analysis, enabling molecular profiling studies.
Résumé
La sonde microfluidique (MFP) facilite l'exécution de la chimie locale sur des substrats biologiques en limitant les volumes de nanolitre de liquides. En utilisant une mise en oeuvre particulière du MFP, le confinement de flux hydrodynamique hiérarchique (hHFC), plusieurs liquides sont simultanément mis en contact avec un substrat. action chimique locale et mise en forme liquide en utilisant l'hHFC, est exploitée pour créer des motifs de cellules par lyse localement et l'élimination des cellules. En utilisant la capacité du MFP de balayage, les motifs de monocouches de cellules définies par l'utilisateur sont créées. Ce protocole permet, en temps réel rapide et un patron de cellules dans l'espace contrôlé, ce qui peut permettre des études d'interaction cellule-cellule sélective et cellule-matrice.
Introduction
Dans leur environnement naturel, les cellules dans les tissus biologiques perçoivent une gamme d'indices biochimiques et physiques diriger leur croissance, l'organisation et le développement. La compréhension de ces indices nécessite une enquête sélective des interactions cellule-cellule et cellule-matrice. Cela nécessite le développement de méthodes pour des monocouches de cellules de formation de motif. Méthodes pour différents types de cellules géométriquement distinctes dans la culture (patterning) permettent de larges études sur les indices physiques et chimiques en biologie cellulaire. La plupart des approches actuelles pour les couches de cellules de formation de motif 1-4 dépendent du dépôt de protéines d'adhésion cellulaire sur des surfaces ou à l' aide de pochoirs microfabricated pour la croissance sélective sur des substrats. En revanche, ici , nous présentons une méthode pour rapidement monocouches de cellules de modèle in situ, à savoir, des cellules en culture, en éliminant les cellules dans des régions sélectionnées de la monocouche. Les méthodes qui effectuent cette soustractive patterning 5-9 usually exigent des substrats spécialisés, traitement de surface, opération complexe, le contact physique ou l'ablation en utilisant un laser, affectant par inadvertance les cellules vivantes. Nous utilisons ici une sonde microfluidique (MFP) 10,11, un balayage de la technologie microfluidique sans contact qui confine hydrodynamiquement un liquide sur un substrat. Un élément important du MFP est la tête microfabriqué contenant microcanaux (Figure 1). La plate - forme associée est constituée de pompes à seringue pour le contrôle de liquide, destiné à balayer les étapes de contrôle et d' un microscope inversé pour la visualisation et la réaction (Figure 2). Dans sa configuration de base, la tête d'imprimante multifonction comprend deux micro - canaux ayant des ouvertures au niveau du sommet, l' un pour l' injection d' un liquide de traitement et l'autre pour aspirer le liquide de traitement injecté conjointement avec un liquide d'immersion (figure 3A). Pendant le fonctionnement PMF, dont le sommet se trouve à une distance fixe par rapport au substrat. Lorsque le débit d'aspiration (Qa) est sufficiently plus élevé que le débit d'injection (Q i), c. -à- Q a: Q i ≥ 2,5, le liquide de traitement est limitée sur le substrat. Il en résulte un confinement de l'écoulement hydrodynamique (HFC). La région dans laquelle le liquide de traitement est en contact direct avec le substrat est appelé l'empreinte. Pour des conditions de fonctionnement normales, l'écoulement du liquide de traitement au sein du HFC est caractérisée par un faible nombre de Reynolds (Re ≈ 10 -2) et un grand nombre de Péclet (Pe ≈ 10 2). Cela implique des flux liquides en régime laminaire à convection étant le principal mode de transfert de masse d'espèces chimiques. Les modèles numériques et analytiques pour le confinement d'écoulement sont décrits ailleurs 12-14.
Dans cet article, nous utilisons l'approche de confinement simultanément plusieurs liquides de traitement, qui est appelé HFC hiérarchique (hHFC) 14. Pour mettre en œuvre hHFC avec le MFP, deux additional ouvertures sont nécessaires pour fournir une source secondaire d'injection et d'aspiration. Cela nous permet de confiner un liquide à l'intérieur d'un second liquide. Les intérieurs (traitement) liquides avantages d'être protégés contre les débris errants sur le substrat par le (blindage) liquide externe. En outre, hHFC permet un fonctionnement en deux modes: (i) le mode imbriqué, dans lequel le liquide de traitement dans les contacts de HFC interne , la surface (figure 3B), et (ii) le mode pincé, dans lequel le liquide interne perd le contact et seul le liquide externe est en contact avec le substrat (figure 3C). La commutation entre les deux modes permet aux utilisateurs d'effectuer ou d' arrêter le traitement du substrat et est obtenu en contrôlant l'écart en tête-à-surface ou en modifiant le rapport entre les flux d'injection (Q i2 / Q i1). Pour une géométrie donnée de canal, l'empreinte du liquide de traitement sur le substrat peut être contrôlée par la modulation des conditions d'écoulement (Figure 3D). hydr de sodiumoxyde (NaOH) est utilisée en tant que liquide de traitement interne pour lyser les cellules, et le lysat est aspiré en continu à partir de la surface. Du fait que les effets chimiques du liquide de traitement sont localisés à l'empreinte interne du HFC, les cellules adjacentes restent non perturbée, ce qui permet des études spatio-temporelle des interactions cellule-cellule. La fonctionnalité du MFP de balayage permet de créer des géométries définies par l' utilisateur des modes cellulaires (figure 4). En outre, le choix de NaOH en tant que liquide de traitement recevant une analyse d'ADN en aval (figure 7).
Protocole
1. MFP Tête et plate-forme de nettoyage et de préparation
NOTE: Ce protocole utilise orienté verticalement hybride silicium-verre MFP dirige 15,16. Le composant de silicium de la tête contient les micro-canaux, qui sont gravés à une profondeur de 100 um. Le silicium gravé est lié au verre par collage anodique. La conception de canal comprend un motif constitué de six canaux, chacun deux pour l' injection et l' aspiration, et deux pour injecter le liquide d'immersion (figure 1). Les canaux utilisés pour l'injection de liquide d'immersion reconstituer les médias entourant l'échantillon biologique, évitant ainsi les pertes dues à l'aspiration et l'évaporation. Les canaux intérieurs et canaux extérieurs utilisés dans les travaux en cours sont 100 x 100 um et 200 x 100 um, respectivement. fabrication Post et le traitement, les têtes de MFP avec chaînes claires et apex polis sont obtenus.
- Préparation de la station de pompage et de traitement des fluidesappareil
- Utilisez capillaires avec un 1/16 '' (1,59 mm) de diamètre extérieur et 0,02 '' (0,51 mm) de diamètre intérieur pour tous les tuyaux reliés aux seringues. Variez la taille capillaire sur la base de l'application et obtenir les connecteurs et raccords appropriés à l'interface de la tête de MFP avec les seringues. Utiliser de l'eau ultrapure où dilutions sont nécessaires.
- seringues propres (250 - 500 volumes pi) et de seringues poinçons par sonication dans une solution chlorée à 0,5% dans l'eau ultrapure To- avant et après des expériences de cellules vivantes. Rincez-les soigneusement à l'eau. Remplissez-les avec de l'eau en plongeant leurs conseils complètement dans un bain d'eau et d'aspiration à l'aide du piston. Purger le liquide tandis que dans le bain d'eau avec l'axe de la seringue en contact avec le joint d'étanchéité à la sortie de la seringue. Répétez aspirée et purge jusqu'à ce qu'aucune bulle d'air sont visibles dans les colonnes de la seringue.
- Connectez seringues remplies aux pompes à seringue à l'aide de connecteurs luer-lock. Utiliser une soupape de commutation montée sur laLes pompes pour diriger le liquide de la seringue à l' un des deux capillaires conduisant soit à la tête d'imprimante multifonction ou les réservoirs de liquide (figure 6). (Si aucune vanne de commutation est disponible voir la section 1.4.4). Purger les deux capillaires avec de l'eau à partir de la seringue à une vitesse d'environ 10 d'écoulement - 50 ul / min, en fonction de la taille de la seringue jusqu'à environ 10 ul d'eau sont laissés dans les seringues.
- Pré-insérer les capillaires purgés dans un connecteur microfluidique / adaptateur approprié qui interface avec les vias de canal dans la tête (par exemple, le connecteur M1 - voir matériaux).
- MFP préparation de la tête
- Nettoyez la tête MFP par sonication en utilisant un détergent pour le nettoyage de la verrerie standard ou 0,5% l'eau de Javel pour le nettoyage rigoureux, pendant 5 min. Purger les canaux avec de l'eau par immersion de la pointe dans l'eau et l'application de vide pour les vias.
- Inspecter les canaux sous un stéréomicroscope pour les obstructions potentielles (colmatage) et retourbe l'étape précédente si nécessaire.
- Montez la tête propre sur le support de tête et visser le connecteur avec le tube pré-inséré et purgé sur la tête. Visser le support de tête à l'étage Z, qui est utilisé pour le contrôle de la distance d'espacement entre la tête et la monocouche cellulaire.
- Calibrer les étapes de la plate - forme de numérisation MFP
- Effectuer le calibrage extrémité du X, Y et Z-étapes avant de connecter la tête à la plate-forme, selon le protocole du fabricant avec une interface logicielle appropriée. stades étalonnés assurent une précision dans le positionnement de la tête MFP.
- Obtenir un écart loin brut zéro (réduction à zéro) en amenant la tête MFP sur une lame de chambre sans cellules et descendre lentement dans 5 um étapes. Au contact de la sonde avec le substrat, les anneaux de Newton devraient être respectées. Ceci est une estimation brute. Une position précise doit être obtenue après réglage de la coplanéité de la pointe de la sonde jusqu'au substratee.
- Pour assurer la coplanarité de la pointe de la sonde, régler l'inclinaison de la tête à l'aide d'un goniomètre (à l'interface de la tête et la phase de Z). Lorsqu'elles sont formées en sorte que les anneaux de Newton sont symétriques (figure 1). Déplacez le MFP tête 20 um à distance du substrat et de régler l'inclinaison en utilisant le goniomètre. Répétez descente, réduction à zéro et réglage de l'inclinaison jusqu'à ce que les anneaux de Newton sont symétriques au contact. Avec l'inclinaison réglée, réglez la position z qui produit les anneaux de Newton symétriques comme zéro.
NOTE: L'étape Z contrôle la distance tête-substrat, tandis que la platine XY commande le balayage du substrat (figure 2). Une explication détaillée peut être trouvée dans nos travaux antérieurs 14.
- Produits chimiques pour l' élimination locale des couches de cellules
Attention: Si l' équipement approprié, l' utilisation de sécurité (par exemple, des gants en nitrile, lunettes de sécurité) pour les produits chimiques en cours de préparation. Utilisez un hoo de fuméed si nécessaire pour la préparation de solutions. Préparer tous les produits chimiques et les tampons avec de l'eau ultra-pure comme diluant.- Préparer une solution à 50 mM de NaOH en tant que liquide de traitement pour le canal d'injection interne (i2 avec un débit Q I2 sur la figure 1).
- Préparer la solution de tampon d'extraction nécessaire à l'injection externe (i1 avec un débit Q I1 sur la figure 1), composé de 1 mM d' acide éthylènediaminetétraacétique (EDTA), 0,5% de Tween 20, et 10 pM de rhodamine B dans du Tris 50 mM (en hydroxymethyl) de aminométhane à pH 8. Pour la purge, utiliser de l'eau dans les seringues d'aspiration.
- Filtrer toutes les solutions à l'aide d'un filtre à seringue de 0,2 um. Degas toutes les solutions filtrées en utilisant un dessiccateur jusqu'à l'arrêt de l'air dissous bouillonnant à la surface.
- Utilisation de la ligne de drain connectée aux pompes à seringue, purger l'eau reste et aspirer les solutions dégazées dans les seringues d'injection à 40 ul / min jusqu'à ce que les seringues sont pleines (250 ou 500 pi).Cela garantit le remplissage sans bulles des seringues, des connecteurs et des capillaires. Le système de commande de soupape à deux capillaire seringue commutateur permet le remplissage de la seringue milieu de l'expérience. En l'absence d'une telle soupape de commutation, déconnectez les capillaires de la tête et remplir les capillaires et la seringue en aspirant les solutions dégazées avant de les reconnecter à la tête.
- Aspirer le traitement et la protection des liquides à travers les capillaires permet l'utilisation de petits volumes au cours du fonctionnement. Si les produits chimiques peuvent être préparés en grandes quantités, remplir des seringues avec les solutions nécessaires directement. Par exemple, les seringues d'aspiration qui contiennent de l'eau peuvent être remplis en utilisant cette approche.
- Purger les capillaires à la tête de MFP avec les liquides alloués pour chaque canal tel que défini dans 1.4.1 et 1.4.2.
REMARQUE: La solution de tampon d'extraction protège le NaOH dans le confinement interne et le composant de la rhodamine dans le tampon facilite la visualisation du ièmee hHFC pendant le fonctionnement. - Si les cellules sont trop confluentes avec des agrégats de cellules apparaissant à la surface cultivée, de compléter le tampon d'extraction de 10% de la protéinase K. Cette complète l'action de NaOH sur ces agrégats en dissolvant les protéines dénaturées que le lysat pénètre dans les canaux d'aspiration. On évite ainsi le colmatage des canaux pendant son fonctionnement.
- Préparation des monocouches de cellules sur des lames de chambre
Attention: Utiliser une hotte de culture cellulaire pour la culture des cellules et manipuler de l' équipement selon les règles fixées par l'agent de biosécurité du laboratoire. Remarque exigences particulières de lignées cellulaires spécifiques et d'adapter le protocole et l'équipement en conséquence.- Incubateurs de culture Utilisation de cellules (à 5% de CO 2 et à 37 ° C) pour la culture et l' expansion des cellules à modelés. Effectuer l'expansion en utilisant des protocoles de culture cellulaire standard 17,18 dans T flacons. Utiliser les médias en culture selon les exigences de la cellulo spécifiquel ligne (par exemple, le sérum et antibiotiques complétés DMEM pour la culture MCF7 et MDAMB 231).
- En arrivant à la confluence des cellules dans les flacons de culture, trypsiniser et recueillir des cellules et des semences 2 × 10 5 cellules / cm 2 dans chacune des diapositives 2-chambre pour la structuration et de la culture de plus de 48 heures. Utiliser les cellules dans l'une des chambres en tant que contrôle pour la croissance et la viabilité cellulaire.
- En arrivant à la confluence des cellules sur les lames de chambre, incuber les cellules pendant 45 min avec 500 solution de colorant cellule-tracker ul (par exemple, vert - CMFDA ou orange - CMRA) à une concentration de 10 uM préparé dans un milieu sans sérum. Ceci est fait pour la visualisation des cellules au cours de formation de motifs. Laver les cellules marquées avec du PBS en rinçant délicatement chaque chambre à l'aide d'une pipette, et la culture ensuite les cellules dans des milieux de sérum supplémenté pour les expériences de mise en forme.
- Obtenir une image de référence de la surface cellulaire cellule-tracker tachés aux fins de comptage de cellules. Ceci est fait pour s'assurerla confluence de la couche cellulaire. En outre, il sert d'aide pour les expériences de quantification si la récupération des échantillons et l'analyse d'ADN sont objectifs.
NOTE: Dans le cas où la viabilité des cellules est à évaluer au cours de structuration, les cellules peuvent être colorées avec un kit de cytotoxicité Vivant / Mort conformément aux instructions du fabricant.
2. Création du hiérarchique hydrodynamiques flux Confinement (hHFC)
- Déplacer le MFP sur la monocouche cellulaire à une distance d'intervalle de 50 pm à partir de la lame de verre. Cette distance d'espace tout en assurant le contact de la hHFC représente également la surface de la monocouche et la variation d'épaisseur.
- Injecter NaOH à 6 ou 8 pi / min à travers i2. Évaluer les autres débits (c. -à- Q I1, Q A1 et A2 Q) en utilisant les règles de flux de la figure 3.
- Moduler la taille du HFC interne en changeant le rapport de Q I2 / I1 Q en utilisant des seringues d'injection.Par exemple, utiliser un Q I1 entre 1,3 ul / min et 4 pl / min, Q I2 fixé à 8 ul / min, ce qui se traduit par une empreinte de NaOH de 150 - 300 cellules (100 - 200 um2 / cellule) ( La figure 3D).
- Injecter milieu complet des plus externe des ouvertures sur la tête de MFP à un débit de 20 ul / min débit pour tenir compte de l'évaporation des médias et de l'aspiration pendant le fonctionnement du hHFC.
3. monocouches de cellules patterning Utilisation hHFC
Remarque: le motif de balayage détermine les zones de la monocouche cellulaire dans lequel les cellules sont extraites (soustractif de formation de motif), en laissant les cellules restantes à l'étude des questions biologiques spécifiques. Ce modèle peut être des lignes droites ou un tableau de points, par exemple. motifs complexes nécessitent la conception d'une trajectoire de balayage approprié. Par exemple, une trajectoire de balayage en damier fournit une grille de zones de cellules (représenté par exemple sur la figure 4A ), ce qui permettrait d'étudier l'effet de différents stimuli sur les cellules dans les différents carrés tout en étant à proximité. Ces modèles peuvent être créés en utilisant le contrôle des étapes de XY de la plate-forme, où le logiciel de commande permet de script des trajectoires de balayage pour la tête MFP sur la monocouche cellulaire.
- Réglez le logiciel de scène pour balayer la tête de sonde sur la monocouche cellulaire dans les modèles définis par l'utilisateur (en définissant les coordonnées Z X, Y et) à une vitesse de balayage de 10 um / s à une distance d'intervalle de 50 pm.
- Avec le hHFC emboîtée en fonctionnement et en contact avec la monocouche, balayer le MFP avec une trajectoire du motif désiré pour effectuer l'élimination des cellules à motifs.
- Pour une co-culture après le premier enlèvement de type cellulaire, les semences d'une lignée cellulaire différente pour combler les lacunes, en utilisant des méthodes décrites à la section 1.5. Se déplacer entre les modes imbriqués et pincés (en augmentant la distance d'intervalle, par exemple) pour contrôler l'élimination des cellules.
NOTE: La vitesse de balayage peut devoir être INVESTIfermée pour d'autres lignées cellulaires. La vitesse de balayage utilisé dans cet effet de démonstration élimination complète des cellules sur les régions numérisées pour les lignées cellulaires utilisées.
4. Traitement en aval pour l'échantillonnage et l'ADN Amplification
- Préparer la station d'échantillonnage pour l'analyse en aval du lysat. Pour la station d'échantillonnage, utilisez un 3D imprimé 8-bande PCR porte-tube. En variante, choisir un support de tube approprié pour servir de cet adaptateur, qui est susceptible d'être monté dans l'intervalle allant de la tête à l'extérieur du substrat à balayage. Essuyer le porte-tube avec 70% d'éthanol ou d'autres décontaminants de surface en fonction de la stringence souhaitée pour l'application. Utilisez une pince magnétique sur le support de tube pour le fixer sur le support de substrat.
- Après la préparation de la station d'échantillonnage, placez le MFP tête 100 um de la monocouche. Commencer à faire fonctionner le hHFC avec une solution de 50 mM de NaOH en tant que liquide de traitement pour le canal d'injection interne avec des débits de 1, 6, -7 Et -17.5 ul / min pour Q I1, I2 Q, Q A1 et A2 respectivement Q.
- Une fois que le confinement d'écoulement est stabilisé (dans environ 10 secondes), descendre la tête de la sonde à une distance d'intervalle de 50 pm pour effectuer la lyse locale à base de NaOH de la sous-population de cellules choisie avec le hHFC. Une fois que la lyse de la sous-population est terminée (environ 30 secondes par empreinte), diriger la tête vers les tubes dans la station d'échantillonnage. Ejecter le lysat collecté dans les tubes PCR directement (figure 6).
- Pour le traitement en aval du lysat, d'abord neutraliser le pH de la solution en mélangeant le lysat avec du tampon Tris (1: 1). Après neutralisation, la chaleur du lysat à 95 ° C pendant 30 min. Puis charger directement le lysat dans un flux de travail qPCR standard fixé par le fournisseur de l'instrument.
Résultats
Le protocole décrit pour la formation de motifs soustractive rapide des monocouches de cellules est démontrée en utilisant une plate - forme à plusieurs composants de la PMF (figures 1 et 2). Le protocole utilise le confinement de l' écoulement hydrodynamique hiérarchique (hHFC; Figure 3) pour traiter localement et à éliminer les cellules de monocouches de cellules, à l' aide de NaOH en tant que liquide de traitement. La configuration hHFC comprend un HFC interne et un HFC externe. Le NaOH confiné dans la hHFC intérieure introduit une action chimique et de cisaillement sur les cellules en contact. Au sein de cette empreinte, les cellules sont exposées de façon homogène à l'action chimique du NaOH, du fait de la convection induite par le transfert de masse à l'intérieur et avec une diffusion négligeable dans la région à l'extérieur du confinement. Le cisaillement sur les cellules, d'autre part, peut être modifié en faisant varier la vitesse de NaOH d'écoulement. Pour simplifier les paramètres de fonctionnement, nous avons choisi de faire de l'action chimique, le mécanisme dominant de l'élimination des cellules par rapport à la cisaille. Àestimer la force de cisaillement appliquée par le hHFC sur la surface, un modèle éléments finis a été construit en utilisant Comsol Multiphysics 5.0. Des simulations ont été effectuées en utilisant le module CFD pour les flux laminaires. Deux conditions limites d' entrée aux ouvertures d'injection de la géométrie et de deux conditions aux limites de sortie aux ouvertures d'aspiration (figure 5) ont été appliquées pour la gamme de débits et dimensions d'ouverture utilisés dans la démonstration actuelle. Dans le modèle obtenu, les règles de flux dicté le profil de cisaillement, alors que les débits ont défini l'ampleur du cisaillement sur la surface. En pratique, une combinaison des deux détermine si le contact avec la surface hHFC. Compte tenu de ces facteurs à l'esprit, nous avons décidé de trouver une gamme de débits pour un fonctionnement en vue d'obtenir une élimination chimique dominante cellulaire. Pour créer un hHFC, nous utilisons la règle d'écoulement d'une aspiration totale à l'injection ratio de débit de 3,5. Les autres règles d'écoulement utilisées ont été définis de façon à minimiser le colmatage à l'intérieur des canaux d'aspiration,qui peut être provoquée par des protéines dénaturées collant aux surfaces des canaux. En utilisant le modèle mis au point, nous avons trouvé des débits 5 à 10 pl / min traduire à une contrainte de cisaillement entre 1 et 3 N / m 2. Sans l'effet chimique de NaOH, par exemple dans le cas du tampon d'extraction, la contrainte de cisaillement ne serait pas suffisamment élevé pour éliminer les cellules 19. Dans la gamme observée, nous notons que le fonctionnement à des débits plus élevés est plus pratique en raison de perturbations dans la voie d'écoulement à des débits d'aspiration faible (c. -à- Q I2 <4 pi / min) en raison de débris cellulaires dans les canaux.
Compte tenu du profil de cisaillement étudiée et des considérations pratiques, les débits du NaOH (Q I2) de 6 et 8 ul / min sont utilisées pour les expériences de mise en forme et Q I1, Q A1 et Q A2 selon les règles de circulation représentées sur la figure 3. Le rapport des flux d'injection (Q I2 / Q I1) u permets pour moduler davantage la taille de l'empreinte hHFC (figure 3D et figure 4B), avec le principe de base élaborés par Autebert et al. , 14. Utilisation de la capacité de liquide de mise en forme de l'hHFC couplé à haute résolution capacité de la plate - forme de MFP de balayage, nous démontrons des cellules vivantes génération de grille à plusieurs échelles et en outre montrer l'application du protocole donné dans le développement de co-cultures (Figure 4C).
La plate-forme nous permet également d'effectuer la récupération de lysat échantillon pour analyse en aval. Pour montrer la qualité du lysat obtenu, nous avons échantillonné lysé localement des cellules à partir d' un et de cinq empreintes dans deux expériences indépendantes, montrant la variation des quantités d'ADN obtenues à partir du lysat (figure 7). Ici, nous avons amplifié l'ADN contenu dans le lysat en utilisant des amorces ß-actine (avant: GGATGCAGAAGGAGATCACT et inversons: CGATCCACACGGAGTACTTG ) Avec 4 ul du lysat neutralisé dans chaque réaction de PCR.
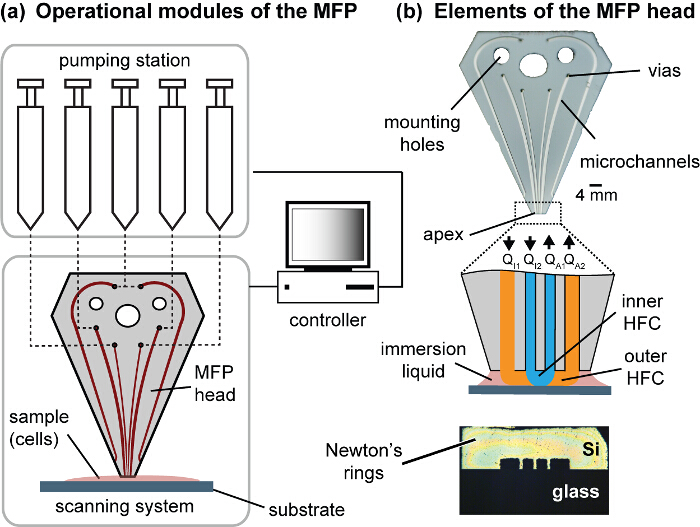
Figure 1. Modules de la plate - forme de MFP et la tête. (A) Les modules opérationnels de la plate - forme comprennent des seringues, les étapes motorisées et un contrôleur motorisé. Le MFP est relié à une platine motorisée Z pour contrôler la distance d'espacement entre la tête et le substrat et le support de substrat est fixé à l'axe X et Y étapes motorisés constituant le système de balayage. (B) La tête MFP a vias fluidiques pour connecter la station de pompage, des trous de montage pour monter la tête sur le Z-scène, et les canaux qui sort de l'apex poli. Le sommet est situé dans le même plan sur le substrat de culture cellulaire. Les anneaux de Newton symétriques peuvent être observées lorsque la pointe et le substrat sont coplanaires et en contact. p_upload / 54447 / 54447fig1large.jpg "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
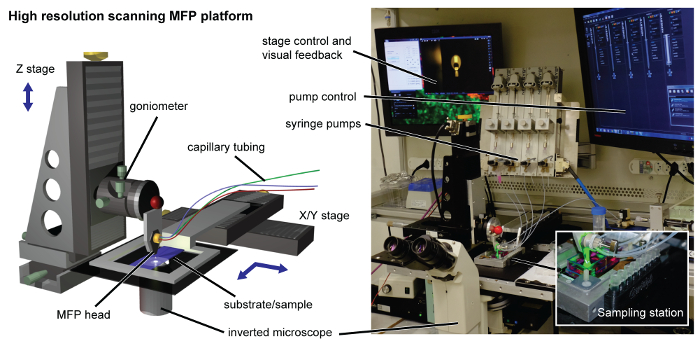
Figure 2. Plate - forme de MFP. La plate - forme de balayage à haute résolution est équipé d'un support de tête usinée interfaçage avec le Z-étape de haute précision motorisé. Le support de substrat est relié à la platine XY à des fins d'analyse. Pour la récupération du lysat pour une analyse en aval, une station d'échantillonnage 3D imprimé est clipsé magnétique sur le côté du porte-substrat (représenté en encadré). Pompes à seringues, un microscope inversé, les contrôleurs et les écrans sont situés autour de la plate - forme. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
3 "src =" / files / ftp_upload / 54447 / 54447fig3.jpg "/>
Figure 3. hiérarchique de confinement d'écoulement hydrodynamique (hHFC) pour le contrôle spatial et temporel de la suppression de la cellule. (A) Représentation schématique d'un seul HFC. (B) Nichée et (C) le mode de fonctionnement pincé hHFC. (D) l' image de l'empreinte de deux rapports de débit d' injection / d'aspiration différents. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
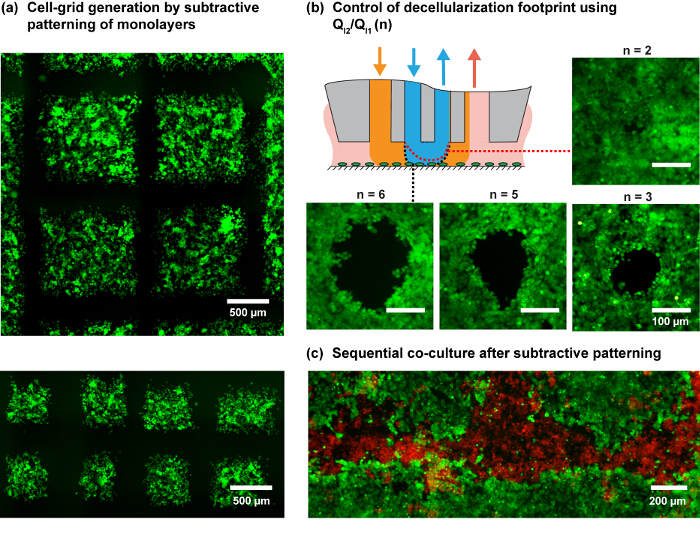
Figure 4. Modèles de monocouches de cellules à l' aide du MFP. (A) de génération Cell-grille par balayage programmée du MFP sur une monocouche de cellules MDA-MB-231. Les cellules ont été colorées avec du vert colorant cellule-tracker. (B) L'empreinte pour les différents rapports d'injection (n) Sur une monocouche de cellules MCF7. Le schéma montre la variation attendue de la forme du HFC intérieure avec un changement de n. (C) Patterned co-culture par motif soustractive de MCF7 monocouche suivie par ensemencement MDA-MB-231 cellules dans les régions soustraites. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
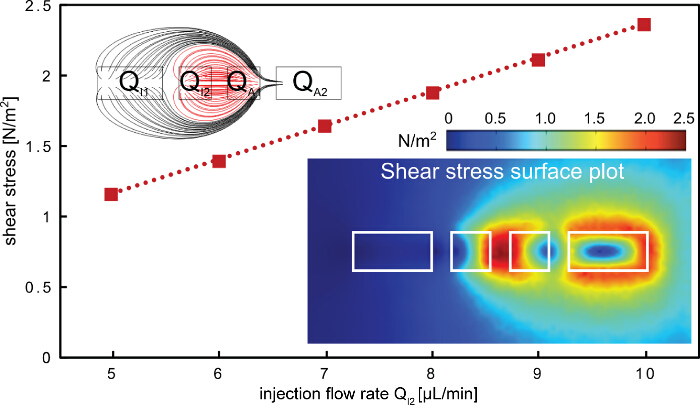
La figure 5. La contrainte de cisaillement sur la surface lors de l' application hHFC. La contrainte de cisaillement sur la surface augmente linéairement avec le débit d'injection intérieure. Le point de cisaillement le plus élevé se trouve entre les deux ouvertures intérieures (fond d'encart à droite), où le liquide de traitement est confinée (lignes de flux rouge, encart supérieur gauche). Les dimensions de l'ouverture utilisée dans le modèle d'éléments finis sont 200, 100, 100 et 200 um pour i1, i2, a1et a2, respectivement. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
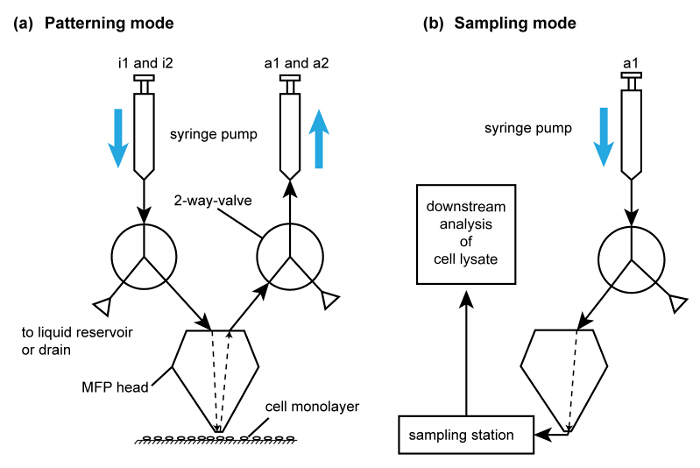
Figure 6. modes de la plate - forme de MFP d'exploitation pour effectuer le prélèvement de cellules et de motifs. (A) Schéma du trajet d'écoulement pour un motif soustractive par lyse cellulaire. Par souci de simplicité, un seul de chacun des chemins d'injection et du débit d'aspiration sont représentés. Les seringues sont remplis à l'aide de la soupape de vidange dans les pompes. i1 et i2 sont utilisés pour l'injection d'un tampon d'extraction et de NaOH, respectivement. (B) Schéma de la voie d'écoulement pour la récupération du lysat. Ce chemin d'écoulement est activé après la collecte de lysat de cellules pour l' analyse à l' aide du chemin d'écoulement (A). S'il vous plaît click ici pour voir une version plus grande de cette figure.
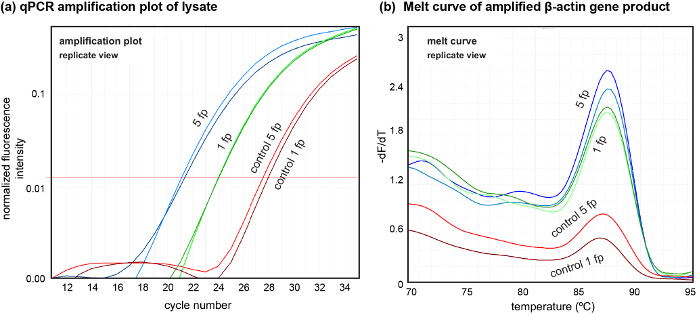
Figure 7. Analyse en aval de l' ADN de lysat cellulaire en utilisant qPCR. Placettes (A) d'amplification de l' ADN dans lysat extrait de 5 empreintes (5 fp) et 1 empreinte (1 fp). Les contrôles ont été extraits après la collecte du lysat dans les deux cas. (B) Faire fondre les courbes d'ADN amplifiés à partir du lysat montre la qualité de l'ADN extrait. qPCR a été réalisée (N = 2, n = 3) pour amplifier le gène de la β-actine. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
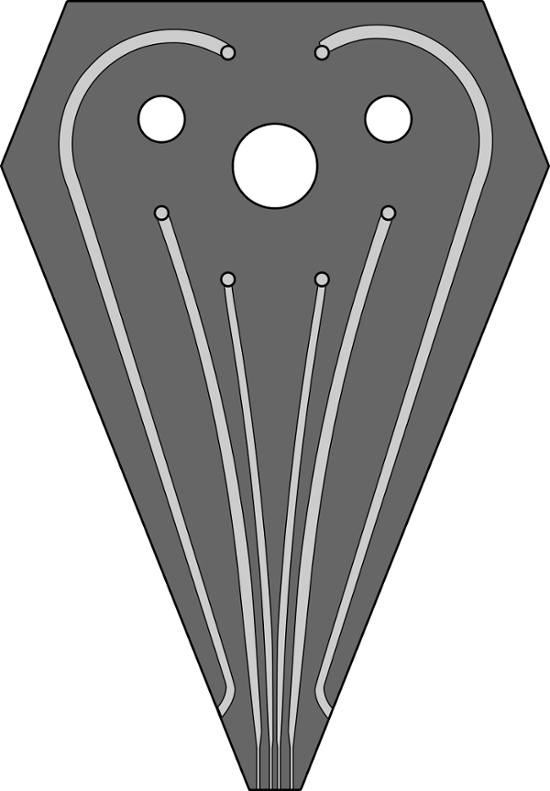
La figure S1. Une image à l' échelle de la conception de canal pour la tête de MFP 6 canauxles canaux utilisés pour des expériences de mise en forme. effectuant la hHFC sont 200, 100, 100, 200 um de large et de 100 um de profondeur. Les deux canaux ultrapériphériques, qui reconstituent liquide d'immersion sont de 500 m de large et 100 um de profondeur. Un fichier GDS pour la même conception a été fournie en tant que complément à cet article. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Nous présentons un protocole polyvalent pour la structuration soustractive des monocouches de cellules qui permet la génération rapide de modèles cellulaires spatialement définis. la lyse sélective des monocouches de cellules est effectuée en utilisant du NaOH en tant que liquide de traitement dans le hHFC. NaOH instantanément dénature les protéines contenues dans la membrane cellulaire. Nous recommandons l'utilisation d'une concentration de 50 mM de NaOH pour assurer le traitement en aval du lysat. Cette concentration peut être augmentée pour plus d'élimination rapide des cellules, le traitement en aval fourni lysat est pas un objectif. Le hHFC veille à ce que les régions avoisinantes non transformées de la monocouche cellulaire restent inchangées et sont disponibles pour l'expansion du motif ou de sondage d'autres propriétés des cellules.
Le taux d'élimination des cellules est fonction à la fois de la chimie et de cisaillement présentées par l'écoulement. Nous avons choisi une plage de fonctionnement des débits d'avoir l'élimination cellulaire dominant de la chimie. vitesses de numérisation de 10 - 20 & #181; m / sec en utilisant un débit d'injection de NaOH 6-8 ul / min sont utilisés pour faciliter la structuration «rapide» soustractive. Le taux rapide de l' enlèvement de la cellule traite des difficultés rencontrées par l' impression de surface de motifs à base approches 20,21. Ces procédés nécessitent un mécanisme pour limiter la croissance des cellules dans les zones spatialement définies, par exemple par dépôt sélectif de protéines d'adhésion cellulaire par impression des micro-contact et l'ensemencement ultérieure des cellules pour obtenir le motif. Elles sont limitées par un faible débit et nécessitent plusieurs étapes pour la génération de modèle ainsi qu'un nouveau gabarit / timbre pour chaque motif. Le procédé décrit ne nécessite pas une croissance sélective de cellules dans des zones définies, et surmonte plusieurs limites en effectuant patterning soustractive, contrairement à l'impression, tout en ne nécessitant aucun traitement supplémentaire du substrat de culture cellulaire.
Avec le protocole décrit dans le présent document, le débit des monocouches de cellules de motifest augmentée, tout en obtenant une rétroaction visuelle immédiate du motif généré. Ceci facilite la modification en temps réel des motifs. Un tel contrôle pourrait être crucial dans les scénarios dans lesquels la viabilité des cellules sur une surface donnée est pas homogène. Un autre avantage du procédé est que la même tête et la chimie peuvent être utilisés pour générer de multiples motifs, ce qui réduit le nombre d'étapes impliquées dans la génération d'une monocouche de cellules à motifs.
Les dimensions des canaux dans la tête et la géométrie de la tête peuvent être adaptées en fonction des besoins de l'application, permettant ainsi le contrôle sur la résolution du motif. Toutes les expériences dans les travaux en cours ont été effectuées à l'aide d'une tête de MFP avec des dimensions d'ouverture fixes, en particulier avec des ouvertures internes à 100 x 100 um et des ouvertures extérieures à 200 × 100 um. Cette conception avec des ouvertures extérieures plus importantes a été choisie pour assurer un fonctionnement continu du hHFC sans colmatage des orifices pardébris cellulaires parasite. Nous avons testé la tête avec des dimensions d'ouverture intérieure 50 x 50 um et 50 um espacement entre eux, avec de bons résultats dans l'élimination des cellules. Utilisation des ouvertures plus petites, jusqu'à 10 x 10 um à 10 um espacement, permettrait de mise à l'échelle à une taille plus petite empreinte (~ 30 x 30 pm), ce qui permet une résolution plus élevée dans un motif. Nous avons observé des problèmes opérationnels avec une ouverture de taille inférieure à 10 pm en raison de l'obstruction de particules. En raison de ces difficultés opérationnelles, 100 um est la limite de résolution courant, et donc une limitation de la technique décrite. Cependant, nous pouvons répondre à cela en utilisant la capacité de mise en forme liquide du hHFC. Nous avons démontré que la résolution de l' élimination des cellules peut être accordée pour un ensemble donné de dimensions d'ouverture en contrôlant Q I2 / Q I1 (figure 4b) et l'écart apex à substrat 10,14. Les étapes utilisées dans les travaux en cours a une taille de pas moins de 100 nm.Une combinaison de ces paramètres contrôlables permet d'améliorer la résolution spatiale de l'élimination des cellules en fonction de la taille de l'empreinte et de la distance de balayage.
Si les co-cultures à motifs sont souhaitées pour étudier les interactions cellule-cellule spécifiques entre différents types de cellules, l'ensemencement séquentiel et de motifs peuvent être effectuées en utilisant le protocole décrit. Enfin, l' ADN amplifiable de haute qualité peut être obtenue à partir du lysat, comme en témoigne le pic singulier dans l'ADN fondre la courbe (voir figure 7). Nous avons évalué une quantité d'ADN d'environ 1,6 ng d'une seule empreinte (environ 300 cellules) en utilisant qPCR, qui est proche de l'attente théorique (6-8 pg / cellule). Ceci indique une quantité de l'ADN extrait adapté pour plusieurs procédés en aval tout en évitant l'utilisation de toutes les méthodes d'isolement de l'ADN. Cela ouvre des pistes pour l'ADN-analyse basée locales sondant des cellules cultivées. La capacité de hHFC en forme de liquides peuvent également être utilisés pour déposer des cellules vivantes et des protéines à courant alternatifsurfaces tionné, qui, en combinaison avec le motif soustractive et la co-culture séquentielle présentée dans ce protocole permet la création de modèles cellulaires et cellules-matrice complexes sur des substrats de culture. La polyvalence et le contrôle fourni par motif soustractive à base hHFC des monocouches de cellules et la possibilité d'effectuer des analyses d'ADN sur les cellules extraites, fournit un nouvel outil puissant mis aux biologistes d'effectuer des études spatialement résolues impliquant des interactions cellulaires.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
This work was supported by the European Research Council (ERC) Starting Grant, under the 7th Framework Program (Project No. 311122, BioProbe). We thank Dr. Julien Autebert and Marcel Buerge for technical assistance and discussions during the development of the protocol and the platform. Prof. Petra Dittrich (ETH Zurich), Prof. Bradley Nelson (ETH Zurich), Dr. Bruno Michel and Dr. Walter Riess are acknowledged for their continuous support.
matériels
| Name | Company | Catalog Number | Comments |
| Materials | |||
| Microfluidic Probe (MFP) | Silicon/glass hybrid probe head with channels patterned in silicon. Fabrication done in-house at IBM Research - Zürich | ||
| Lab Tek II Chamber slides with 2 chambers | ThermoFisher scientific, USA | 154461 | 2 Chamber chamber slides for cell culture with each chamber providing an area of 4 cm2 and capable of holding up to 3 ml of media volume |
| Chemicals and cell lines | |||
| Sodium Hydroxide, Tris-Cl, Ethylenediaminetetraaceticacid, Rhodamine B | SigmaAldrich chemicals, USA | S5881, 252859, E9884, R6626 | Chemicals used for processing and shielding liquids |
| Proteinase K | Qiagen, Germany | 19131 | protease to digest denatuired proteins |
| Deconex 16 Plus | Bohrer Chemie, Switzerland | Universal cleaning agent for labaratory consumables. Used for non stringent cleaning. | |
| DNA away | ThermoFisher scientific, USA | 7010 | Surface decontaminant that denatures DNA and DNAases. |
| DMEM, high glucose, GLUTAMAX supplement | ThermoFisher scientific, USA | 10566-016 | Culturing medium for epithelial cells. |
| CellTracker Green CMFDA dye | ThermoFisher scientific, USA | C7025 | Membrane permeant live cell labeling dye. Dye active for 72 hours. |
| CellTracker Orange CMRA dye | ThermoFisher scientific, USA | C34551 | |
| β-actin genomic primers for qPCR | Integrated DNA technologies, USA | Custom oligos used for DNA quality validation and qPCR. | |
| MCF7 breast carcinoma cells | ATCC, USA | ATCC HTB-22 | Cell lines used to produce co-cultures. |
| MDA-MB-231 breast carcinoma cells | ATCC, USA | ATCC HTB-26 | |
| Equipment and fluidic connections | |||
| Motorized high precision stages | Custom machined components. Linear axis motors from LANG GmBH, Germany | Customized linear axis stages from LT series | 3 × LT for 3 axes. LSTEP controller used for interfacing stages and PC through RS 232 port. |
| Syringes | Hamilton, Switzerland | 1700 TLLX series | Interchangeable with syringes provided by other manufacturers with a 250-500 µl range. |
| Nemesys low pressure syringe pumps | cetoni GmbH, Germany | Component of pumping station. | |
| Circular M1-connector | Dolomite microfluidics, United Kingdom | 3000051 | Interface between vias in MFP head and tubing |
| Tilt/rotation stage Goniometer | OptoSigma, USA | KKD-25C | Goniometer to adjust coplanarity of MFP apex |
| DS Fi2 HD color camera (CCD) | Nikon, Switzerland | Controlled using DS-U3 controller unit | |
| Software | |||
| Win - Commander | LANG GmBH, Germany | Stage control software. | |
| Qmix Elements | cetoni GmbH, Germany | Pump control software. | |
| NIS Elements | Nikon, Switzerland | Basic research module for image acquisition and analysis. | |
Références
- Théry, M. Micropatterning as a tool to decipher cell morphogenesis and functions. J. Cell Sci. 123 (Pt 24), 4201-4213 (2010).
- Goubko, C. A., Cao, X. Patterning multiple cell types in co-cultures: A review. Mater. Sci. Eng. C. 29 (6), 1855-1868 (2009).
- Kaji, H., Camci-Unal, G., Langer, R., Khademhosseini, A. Engineering systems for the generation of patterned co-cultures for controlling cell-cell interactions. Biochim. Biophys. Acta. 1810 (3), 239-250 (2011).
- Cho, C. H., Park, J., Tilles, A. W., Berthiaume, F., Toner, M., Yarmush, M. L. Layered patterning of hepatocytes in co-culture systems using microfabricated stencils. Biotechniques. 48 (1), 47-52 (2010).
- Schütze, K., Lahr, G. Identification of expressed genes by laser-mediated manipulation of single cells. Nat. Biotechnol. 16 (8), 737-742 (1998).
- Salazar, G. T. A., Wang, Y., et al. Micropallet arrays for the separation of single, adherent cells. Anal. Chem. 79 (2), 682-687 (2007).
- Guillaume-Gentil, O., Zambelli, T., Vorholt, J. A. Isolation of single mammalian cells from adherent cultures by fluidic force microscopy. Lab Chip. 14 (2), 402-414 (2014).
- Iwata, F., Adachi, M., Hashimoto, S. A single-cell scraper based on an atomic force microscope for detaching a living cell from a substrate. J. Appl. Phys. 118 (13), (2015).
- Riahi, R., Yang, Y., Zhang, D. D., Wong, P. K. Advances in wound-healing assays for probing collective cell migration. J. Lab. Autom. 17 (1), 59-65 (2012).
- Juncker, D., Schmid, H., Delamarche, E. Multipurpose microfluidic probe. Nat. Mater. 4 (8), 622-628 (2005).
- Kaigala, G. V., Lovchik, R. D., Delamarche, E. Microfluidics in the "open space" for performing localized chemistry on biological interfaces. Angew. Chem. Int. Ed. Engl. 51 (45), 11224-11240 (2012).
- Qasaimeh, M. A., Gervais, T., Juncker, D. Microfluidic quadrupole and floating concentration gradient. Nat. Commun. 2 (May), 464 (2011).
- Christ, K. V., Turner, K. T. Design of hydrodynamically confined microfluidics: controlling flow envelope and pressure. Lab Chip. 11 (8), 1491-1501 (2011).
- Autebert, J., Kashyap, A., Lovchik, R. D., Delamarche, E., Kaigala, G. V. Hierarchical hydrodynamic flow confinement: efficient use and retrieval of chemicals for microscale chemistry on surfaces. Langmuir. 30 (12), 3640-3645 (2014).
- Kaigala, G. V., Lovchik, R. D., Drechsler, U., Delamarche, E. A Vertical Microfluidic Probe. Langmuir. 27 (9), 5686-5693 (2011).
- Cors, J. F., Lovchik, R. D., Delamarche, E., Kaigala, G. V. A compact and versatile microfluidic probe for local processing of tissue sections and biological specimens. Rev. Sci. Instrum. 85 (3), 034301 (2014).
- Pollard, J. W., Walker, J. M. . Basic Cell Culture Protocols. , (1997).
- Mitry, R. R., Hughes, D. R. Human cell culture protocols. Methods Mol. Biol. Springer. 531 (1), (2012).
- Sakai, K., Ushida, T., Nagase, T., Nakamigawa, H. Quantitative analysis of cell detachment by shear stress. Mater. Sci. Eng. C. 17 (1-2), 55-58 (2001).
- Rodriguez, N. M., Desai, R. A., Trappmann, B., Baker, B. M., Chen, C. S. Micropatterned multicolor dynamically adhesive substrates to control cell adhesion and multicellular organization. Langmuir. 30 (5), 1327-1335 (2014).
- Tasoglu, S., Demirci, U. Bioprinting for stem cell research. Trends Biotechnol. 31 (1), 10-19 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon