Method Article
미세 유동 프로브와 라이브 셀 레이어의 빠른 빼기 패터닝
요약
We present a protocol to perform subtractive patterning of live cell monolayers on a surface. This is achieved by local and selective lysis of adherent cells using a microfluidic probe (MFP). The cell lysate retrieved from local regions can be used for downstream analysis, enabling molecular profiling studies.
초록
미세 유체 프로브 (MFP)는 액체의 나노 리터 볼륨을 한정하여 생물학적 기판에 지역 화학을 수행 용이하게한다. 복합기, 계층 유체 흐름 제한 (hHFC)의 한 특정의 구현을 사용하여, 복수의 액체를 동시에 기판과 접촉하게된다. hHFC를 사용하여 로컬 화학적 작용 및 액체 정형 로컬 용균 세포를 제거함으로써 세포의 패턴을 만들기 위해 이용된다. 복합기의 스캔 기능을 이용하여, 세포 단일 층의 사용자 정의 패턴이 생성됩니다. 이 프로토콜은 빠르게 실시간 선택적 세포 - 세포 및 세포 - 기질 상호 작용을 연구 할 수 있도록 공간적으로 제어 된 세포의 패터닝을 가능하게한다.
서문
그 나라의 환경에서, 생체 조직에서의 세포 성장, 조직 및 발달을 유도 생화학 적 및 물리적 큐의 범위를 인식. 이러한 신호를 이해하는 것은 세포 - 세포 및 세포 - 기질 상호 작용을 선택적으로 조사를 필요로한다. 이는 패터닝 세포 단층 방법의 개발을 필요로한다. 방법 문화 (패턴)에 기하학적으로 별도의 다른 세포 유형의 세포 생물학에 물리적, 화학적 단서의 폭 넓은 연구를 할 수 있습니다. 패터닝 세포층의 현재 방식은 대부분 1-4은 표면에 세포 접착 성 단백질을 증착하거나 기판 상에 선택 성장을위한 미세 스텐실 사용에 의존한다. 대조적으로, 여기에 우리는 단일 층의 선택된 영역에서 셀을 제거함으로써, 문화에 빠르게 패턴 셀, 즉 현장에서 단일 층, 세포를 방법을 제시한다. 9 usua - 같은 감산 패턴 (5)을 수행하는 방법에서야 실수 생균 영향을 레이저를 이용하여 특수 기판, 표면 처리, 복잡한 동작을 물리적 접촉 또는 제거를 필요로한다. 우리는 여기에 미세 프로브 (MFP) 10, 11, 유체 역학적으로 기판 상에 액체를 한정하는 비접촉 스캐닝 마이크로 유체 기술을 사용한다. 복합기의 한 가지 중요한 구성 요소는 마이크로 채널을 포함하는 미세 가공 헤드 (도 1)이다. 관련 플랫폼 제어 및 시각화 및 피드백 (그림 2)에 대한 거꾸로 현미경을 스캔하기위한 주사기 액체 제어를위한 펌프 단계로 구성되어 있습니다. 그 기본 구성에있어서, MFP 헤드는 처리 액 및 일부 침지 액체 (도 3a)과 함께 사출 처리 액을 흡인하기위한 다른 주입 정점에 구멍 두 마이크로 하나를 포함한다. MFP 동작 동안, 정점의 기판으로부터 고정 된 거리에있다. 되면 흡입 유량 (QA)이있다 sufficie즉, 주입 유량 (Q의 I) ntly보다 높은 Q A : Q 난 ≥ 2.5, 처리 액을 기판 상에 한정된다. 이것은 유체 유동 제한 (HFC)을 초래한다. 처리 액이 기판과 직접 접촉하는 영역의 면적을 지칭한다. 통상적 인 동작 조건의 경우, HFC 내의 처리 액의 흐름이 저 레이놀즈 수 특징 (≈ 10-2 재) 높은 Péclet 번호 (PE ≈ 10 2). 이 대류 화학 종의 물질 전달의 기본 모드 인 상태 층류 정권에서 액체 흐름을 의미한다. (14) - 흐름 감금에 대한 수치와 분석 모델은 다른 곳에서 12 설명되어 있습니다.
본 논문에서는 계층 HFC (hHFC) (14)라고 동시에 구속 다중 처리 액체의 접근 방식을 사용합니다. 복합기와 hHFC을 구현하려면, 두 additiona난 구멍은 주입과 흡입의 보조 소스를 제공하기 위해 필요하다. 이것은 제 2 액체 내에서 하나의 액체를 한정하기 위해 우리가 할 수 있습니다. 으로부터 내측 (처리) 액체 이점 외측 (차폐) 액에 의해 기판 상에 부유 먼지로부터 보호된다. 또한 hHFC 두 가지 모드에서 동작 수는 (i) 중첩 모드되는 내측 HFC 접촉 표면 (도 3b) 및 (ii) 상기 핀치 모드가되는 내부 액체 상실의 처리 액 접촉 바깥 쪽의 액체는 기판 (도 3c)와 접촉한다. 두 모드 사이의 전환은 사용자가 효과 나, 기판 처리를 중지 할 수 있으며, 헤드에 대한 표면의 간격을 제어함으로써, 또는 분사 흐름 사이의 비율 (Q의 I2 / Q는 I1)를 변화시킴으로써 달성된다. 소정의 채널 구조의 경우, 기판 상에 처리 액의 풋 프린트는 유동 조건 (도 3D)을 조절함으로써 제어 될 수있다. 나트륨 히드 록 사이드산화물 (수산화 나트륨) 세포를 용해시키기 위하여 내부 처리 액으로 사용하고, 용 해물을 연속적으로 표면으로부터 흡입된다. 처리 액의 화학적 효과 HFC 내부 공간에 국소되므로, 인접 셀은 세포 - 세포 상호 작용의 시공간 연구를 허용하는 교란 남아있다. MFP의 스캐닝 기능은 셀 패턴의 사용자 정의 된 형상 (도 4)의 생성을 허용한다. 또한, 처리 액의 NaOH 등의 선택은 하류 DNA 분석 (도 7)를 수용한다.
프로토콜
1. MFP 머리와 플랫폼 청소 및 준비
참고 :이 프로토콜은 MFP는 15, 16 헤드 수직 지향 실리콘 - 유리 하이브리드를 사용합니다. 헤드의 실리콘 성분이 100 ㎛의 깊이까지 에칭하여 미세 채널을 포함한다. 에칭 된 실리콘은 양극 접합을 사용하여 유리 접합된다. 채널 설계는 침지 액체 (도 1)를 주입하기위한 6 개의 채널, 주입 및 흡인이 각각 두 이루어진 패턴을 포함한다. 침지 액체를 주입하기 위해 사용되는 채널들은 매체 및 이에 의한 흡입 증발 손실을 회피 생물학적 시료를 둘러싸 보충. 내부 채널과 현재 작업에 사용되는 외부 채널은 100 × 100 μm의 각각 200 × 100 μm의 수 있습니다. 포스트 제조 및 가공, 명확한 채널과 광택이 정점에 MFP 헤드를 얻을 수있다.
- 펌핑 스테이션의 준비 및 유체 처리기구
- 주사기에 연결된 모든 호스를위한 1/16 ''(1.59 mm) 외경 0.02 ''(0.51 mm) 내경 모세관을 사용합니다. 응용 프로그램에 따라 모세 혈관의 크기를 변경하고 주사기와 MFP 헤드 인터페이스 적절한 커넥터 및 피팅을 구하십시오. 희석이 필요한 곳 초순수를 사용합니다.
- 청소 주사기 (250-500 μL 볼륨) 및 주사기 초순수 전에 대에서 0.5 % 표백제 용액에 초음파에 의해 플런저 및 라이브 세포 실험을 포스트. 물로 깨끗이을 씻어. 수조에 완전히 자신의 팁을 침지하고 플런저를 사용하여 흡입하여 물을 채 웁니다. 동안 주사기의 출구에 밀봉 접촉하는 주사기 샤프트 수조 내의 액체를 제거. 기포 때까지 반복 흡인 및 제거는 주사기 열에서 볼 수 있습니다.
- 루어 록 커넥터를 사용하여 주사기 펌프에 충전 된 주사기를 연결합니다. 에 장착 된 스위치 밸브를 사용하여펌프 (그림 6) MFP 헤드 또는 액체 저수지 중 하나를 선도하는 두 개의 모세 혈관 중 하나에 주사기의 액체를 지시합니다. (어떤 전환 밸브를 사용할 수없는 경우 섹션 1.4.4 참조). 물을 10 μL가 주사기에 남아까지 주사기의 크기에 따라 50 μL / 분 - 10의 유속에서 주사기 물 모두 모세관 퍼지.
- (- 자료를 참조하십시오 예를 들면, M1 커넥터) 머리에 채널 비아와 인터페이스 적절한 미세 유체 커넥터 / 어댑터에 제거 모세 혈관을 사전에 삽입합니다.
- MFP 헤드 제조
- 5 분 동안 엄격한 청소를위한 표준 세척 또는 0.5 % 표백제에 대한 유리 세제를 사용하여 초음파에 의해 MFP 헤드를 청소합니다. 물에 침지 정점 비아에 진공을인가함으로써 물을 제거 채널.
- 잠재적 인 장애물 (막힘) 재에 대한 실체 현미경 하에서 채널을 검사이전 단계 필요한 경우 이탄.
- 헤드 홀더에 깨끗한 머리를 탑재 헤드 상에 미리 삽입 및 제거 튜브와 커넥터를 조입니다. 헤드와 세포 단층 사이의 간극 거리의 제어에 사용되는 Z 스테이지에 헤드 홀더 스크류.
- 복합기 플랫폼 스캐닝 스테이지 교정
- 적절한 소프트웨어 인터페이스 제조사의 프로토콜에 따라 플랫폼을 헤드에 연결하기 전에 X-, Y- 및 Z-스테이지 포인트 보정을 수행한다. 보정 단계는 MFP 헤드의 위치 정확성을 보장한다.
- 세포가없는 챔버 슬라이드를 통해 MFP 헤드를 가져 와서 (제로) 조 제로 갭 거리를 구하는 천천히 5 μm의 단계로 내려. 기판과 프로브 접촉시, 뉴턴의 고리를 관찰해야한다. 이 조 추정치이다. 정확한 위치는 substrat 프로브 에이펙스의 평면성을 조정 한 후 구한다이자형.
- 프로브 선단의 평면성을 보장하기 위해, (헤드의 계면에서와 Z 스테이지)을 고니 오 미터를 이용하여 헤드의 경사를 조정한다. 형성 할 때 뉴턴의 고리가 대칭 (그림 1)되어 있는지 확인하십시오. 멀리 기판으로부터 MFP 헤드 (20) μm의 이동과 고니 오 미터를 사용하여 기울기를 조정합니다. 뉴튼의 고리까지 반복 강림 영점 조정 및 기울기 조정 접촉에 대칭이다. 기울기 조정으로 0으로 대칭 뉴턴 링을 생산하는 Z 위치를 설정합니다.
주 : XY 스테이지는 상기 기판의 스캔 (도 2)를 제어하는 반면, Z 스테이지에서, 머리 - 기판 거리를 제어한다. 상세한 설명은 우리의 이전 연구 (14)에서 찾을 수있다.
- 세포 층의 지방 제거를위한 화학 준비
주의 : 적절한 경우, 사용 안전 장비 (예를 들면, 니트릴 장갑, 보호 안경) 화학 물질에 대한 준비된다. 흄 ~이를 사용하여용액 D의 제조 필요할 경우. 희석제로 초순수 모든 화학 물질과 버퍼를 준비합니다.- (도 1의 유량 Q의 I2와 I2) 내 주입 채널에 대한 처리 액 등의 50 mM NaOH 용액을 준비한다.
- 1mM의 에틸렌 디아민 테트라 아세트산 (EDTA), 0.5 % 트윈 20으로 구성 (도 1의 유량 Q의 I1과 I1) 외 주입에 필요한 추출 완충액을 준비하고, 10 μM 로다 민 B의 50 mM 트리스 (히드 록시 메틸)에 아미노 메탄에 퍼지 용의 pH 8. 흡입 주사기에 물을 사용합니다.
- 0.2 μm의 주사기 필터를 사용하여 모든 솔루션 필터. 드가 용해 된 공기 정지 표면에 기포까지 건조기를 사용하여 필터링 된 모든 솔루션을.
- 주사기 펌프에 접속 된 드레인 선을 사용하여 잔여 물을 제거하고 주사기 (250 또는 500 μL) 전체가 될 때까지 40 μL / 분으로 주입 주사기로 탈기 된 용액을 흡인.이 주사기, 커넥터 및 모세 혈관의 기포없이 충전을 보장합니다. 주사기 스위치 밸브 두 개의 모세관 시스템은 주사기의 중간 실험의 충전을 할 수 있습니다. 이러한 전환 밸브가 없으면, 헤드로부터 모세관을 분리하고 헤드에 다시 연결하는 탈기 된 용액을 흡입하여 모세관 및 주사기를 채운다.
- 처리 흡입 및 모세관을 통해 액체를 차단하는 동작 중에 소량의 사용을 허용한다. 화학 물질을 대량으로 제조 할 수 있다면, 직접 필요한 솔루션 주사기를 채우기. 예를 들어 물을 포함하는 흡인 주사기이 방법을 사용하여 충전 될 수있다.
- 1.4.1 및 1.4.2에 정의 된 각 채널에 할당 된 액체와 MFP 헤드 모세관 퍼지.
주 : 추출 완충액 내부 구속 및 버퍼의 로다 민 성분의 수산화 나트륨을 실드 번째의 시각화를 용이운전 중에 hHFC를 전자. - 세포는 세포 응집체 배양 표면에 나타나는와 오버 합류하는 경우, 이것은 용 해물의 흡입 채널을 입력으로 변성 된 단백질을 용해시켜 이들 응집체의 수산화 나트륨의 작용을 보충하는 10 % 테 K.로 추출 완충액을 보충. 이 동작 중에 채널의 막힘을 방지한다.
- 챔버 슬라이드 세포 단층의 제조
주의 : 세포를 배양을위한 세포 배양 후드를 사용하고 실험실의 생물 안전성 담당자가 설정 한 규정에 따라 장비를 처리합니다. 특정 세포주의 특별한 요구 사항을 참고 따라서 프로토콜 및 장비에 적응.- 문화와 세포의 확장을 위해 사용 세포 배양 인큐베이터 (5 % CO 2에서 37 ºC에서)을 패터닝한다. T 플라스크에 표준 세포 배양 프로토콜 (17, 18)를 이용하여 확장을 수행. 특정 CEL의 요구 사항에 따라 배양 미디어를 사용하여L 라인 (예를 들어, 혈청과 항생제 MCF7 및 MDAMB (231)를 배양하기위한 DMEM을 보충).
- 문화 플라스크에 세포의 합류에 도달에서를 Trypsinize 및 세포와 시드 2 × 10 5 세포를 48 시간 이상 패턴과 문화에 대한 2 챔버 슬라이드의 각 / cm 2를 수집합니다. 세포 성장과 생존에 대한 제어와 챔버 중 하나의 셀을 사용한다.
- 챔버 슬라이드 셀 합류점에 도달에 500 ㎕의 세포 추적 염료 용액으로 45 분 동안 세포를 배양한다 (예컨대, 녹색 - CMRA - CMFDA 또는 오렌지) 혈청 배지에서 제조 10 μM 농도. 이 패턴 중 셀 시각화를 위해 수행됩니다. 부드럽게 피펫을 사용하여 각 챔버를 세척하고, 패터닝 실험을위한 혈청 보충 미디어에서 연속적으로 배양 세포에 의해 PBS로 표지 된 세포를 씻으십시오.
- 셀 카운팅 목적으로 셀 트랙커 염색 세포 표면의 기준 화상을 얻을. 이를 확인하기위한 것입니다세포층 군집. 또한, 샘플을 회수하고 DNA 분석은 목적하는 경우 정량화 실험을위한 보조제로서 작용한다.
주 : 세포 생존 패터닝 동안 평가되어야하는 경우에, 세포가 제조자의 지시에 따라 라이브 / 죽은 세포 독성 키트로 염색 할 수있다.
2. 만들기 계층 유체 역학 흐름 감금 (hHFC)
- 유리 슬라이드 50 ㎛의 간극 거리에 세포 단층을 통해 MFP를 이동합니다. hHFC의 접촉을 보장하는 동안이 간극 거리도 단층 표면과 두께의 변화를 차지한다.
- I2를 통해 분 / 6 또는 8 μL에서의 NaOH를 주입한다. 다른 유속 평가 (즉, Q I1, Q 및 Q A1 A2)도 3의 플로우 규칙을 사용.
- 주입 된 주사기를 사용하여 Q I2 / I1 Q의 비율을 변화시킴으로써, 내부 HFC의 크기를 변조한다.300 세포 - 예를 들어, 150의 NaOH 사용량 결과 8 μL / 분으로 고정 Q I2 1.3 μL / 분 4 μL / 분 사이의 Q I1를 사용하여 (100-200 μm의 2 / 셀) ( 도 3d).
- hHFC의 동작 동안 매체 및 흡입 증발을 고려하여 20 μL / 분의 유속으로 MFP 헤드의 가장 바깥 쪽의 개구로부터 완전 배지를 주입한다.
hHFC를 사용하여 3. 패터닝 세포 단일 층
주 : 주사 패턴은 특정 생물 질문 공부 남은 셀을 떠나 세포 추출 된 세포 단층 (감법 패턴)의 면적을 결정한다. 이러한 패턴은 예를 들어, 직선 또는 점의 배열 일 수있다. 복잡한 패턴은 적절한 주사 궤적의 디자인을 필요로한다. 예를 들어, 체크 무늬의 주사 궤적은도 4a에 도시 된 예를 들면 셀 영역의 그리드 (제공 ) 근접하면서 다른 사각형 셀에 서로 다른 자극의 효과를 연구하는 것이 가능. 이러한 패턴은 상기 제어 소프트웨어가 세포 단층 위에 MFP 헤드 용 주사 궤적 스크립트를 허용 플랫폼의 XY 스테이지 제어를 사용하여 생성 될 수있다.
- 50 ㎛의 간극 거리에서 10 μm의 / s의 스캔 속도 (X, Y 및 Z 좌표를 설정함으로써) 사용자 정의 패턴 세포 단층 위에 프로브 헤드를 스캔 스테이지 소프트웨어를 설정한다.
- 중첩 hHFC 동작 및 단층 접촉으로 패터닝 된 세포의 제거를 행하도록 원하는 패턴의 궤도와 MFP 스캔.
- 제 셀형 제거 후에 공존 배양, 섹션 1.5에 기술 된 방법을 사용하여 간극을 채우기 위해 상이한 세포주 시드. 세포 제거를 제어하기 위해 (예를 들어, 간극 거리를 증가시킴으로써)과 중첩 협지 모드 사이를 이동한다.
참고 : 스캔 속도는 investi해야 할 수 있습니다다른 세포주 게이트. 사용 된 세포주에 대한 검사 영역 이상이 데모 효과 완전한 세포 제거에 사용 된 스캔 속도.
시료 채취 및 DNA 증폭 4. 다운 스트림 처리
- 분해물의 다운 스트림 분석을 위해 샘플링 역을 준비합니다. 샘플링 스테이션, 3 차원 8 스트립 PCR 튜브 홀더를 사용하여 인쇄. 대안 적으로, 기판 외측의 헤드의 스캔 범위 내에 장착 될 수있는,이 어댑터 역할을 적절한 튜브 홀더를 선택한다. 70 % 에탄올 또는 응용 프로그램에 대해 원하는 엄격한에 따라 다른 표면 decontaminants와 튜브 홀더를 닦습니다. 기판 홀더에 부착하는 튜브 홀더 자석 클립을 사용합니다.
- 샘플링 스테이션을 제조 한 후, 단층으로부터 MFP 헤드 100 ㎛의 위치. (1)의 유속 (6) 내 주입 채널에 대한 처리 액 등의 50 mM NaOH 용액으로 hHFC 작동 시작, -7 및 -17.5 μL / 각각 Q I1, I2 Q, Q A1 및 A2 Q에 대한 분.
- 흐름 제한 (약 10 초에서) 안정되면 hHFC와 셀의 선택된 서브 모집단의 NaOH를 기초 지방 분해를 수행하기위한 50 ㎛의 간극 거리 프로브 헤드를 하강. 서브 모집단의 용해가 완료 (면적 당 약 30 초)이되면, 샘플링 튜브 역으로 머리를 지시. PCR을 튜브에 수집 된 해물을 꺼내기 직접 (그림 6).
- 분해물의 하류 공정의 경우, 제 트리스 완충액 (1 : 1)로 분해물을 혼합하여 용액의 pH를 중화. 중화 후, 30 분 동안 95 ºC로 분해물을 가열한다. 장비의 공급 업체가 설정 한 다음 직접 표준 qPCR에 워크 플로우에 해물을로드합니다.
결과
세포 단층의 신속한 감산 패터닝 기술 된 프로토콜은 (도 1, 2) 다 성분 MFP 플랫폼을 사용하여 설명된다. 국부적으로 처리하고, 처리 액으로서 수산화 나트륨을 사용하여, 세포 단층으로부터 세포를 제거하기 위해 (도 3 hHFC) 프로토콜은 계층 유체 유동 제한을 사용한다. hHFC 구성은 내부 및 외부 HFC HFC를 포함한다. 내부 hHFC에 국한 NaOH를 접촉하는 세포에 화학적 작용 및 전단을 소개합니다. 이 공간 내에서, 세포는 균질 내부 및 외부 협착 영역 무시할 확산 대류 구동 물질 전달에 의해, 수산화 나트륨의 화학적 작용에 노출된다. 반면에, 셀의 전단은 수산화 나트륨의 유량을 변화시킴으로써 변경 될 수있다. 동작 파라미터를 단순화하기 위해 전단에 비해 화학적 작용을 세포 제거 지배적 인 메카니즘을 선택했다. 에표면에 hHFC에 의해 적용되는 전단력을 추정하는 유한 요소 모델은 콤솔 멀티 피직스 5.0을 사용하여 구축 하였다. 시뮬레이션은 층류 흐름에 대한 CFD 모듈을 사용하여 실행 하였다. 주입 형상의 구멍과 흡입 구멍에 두 개의 출구 경계 조건 (그림 5)에 두 개의 입구 경계 조건은 현재 데모에 사용 된 유량 및 조리개 크기의 범위에 적용 하였다. 유속은 표면상의 전단력의 크기를 정의하는 반면 얻어진 모델에서, 유동 규칙은 전단 프로파일을 지시. hHFC 컨택 표면 경우 실질적으로 양쪽의 조합을 결정한다. 이와 같은 요인을 유지 우리는 화학적으로 우세한 세포 제거를 얻기 위해 동작 흐름 비율의 범위를 발견하기 위해 출발. hHFC를 생성하기 위해 3.5의 주입 유량 비율 합계 흡인 유량 규칙을 사용한다. 사용되는 다른 흐름 규칙은 흡입 채널 내에 막힘을 최소화하기 위해 정의 된,이는 채널의 표면에 부착 변성 단백질에 의해 야기 될 수있다. 개발 된 모델을 사용하여, 우리는 (1) 및 3 N / m (2) 사이에 전단 응력을 5 내지 10 μL / 분으로 번역 유량을 알았다. 수산화 나트륨의 화학적 효과없이 추출 버퍼의 경우, 예를 들어, 전단 응력은 셀 (19)을 제거하기에 충분히 높지 않을 것이다. 관찰 범위 내에서, 우리는 높은 유속에서 작동이 때문에 채널에서 세포 파편을 둘러 흡입 유속 (즉, Q I2 <4 μL / 분)의 유로에있어서 섭동으로 인해 실용적인되어 있습니다.
연구 된 전단 프로필 및 실제적인 고려, 6 및 8 μL / 분의 NaOH 유량 (Q의 I2)를 고려하는 패터닝 실험을도 3에 도시 된 플로우 규칙에 따라 Q I1, Q A1 및 Q A2에 사용된다. 비율을 주입 흐름의 (Q I2 / Q의 I1)는 U 수 있습니다S는 또한 Autebert 외. (14)에 의해 정교 기본 원칙은 hHFC 발자국 (도 3d 및도 4b)의 크기를 조절한다. MFP 플랫폼 고해상도 주사 능력을 결합 hHFC의 액체 성형 능력을 사용하여, 우리는 여러 비늘 라이브 셀 그리드 생성을 입증하고 또한 공동 배양 (도 4C)을 개발 지정된 프로토콜의 적용을 나타낸다.
이 플랫폼은 또한 우리가 다운 스트림 분석을 위해 샘플 해물 검색을 수행 할 수 있습니다. 얻어진 해물의 품질을 표시하기 위해, 우리는 로컬 해물 (그림 7)에서 얻은 DNA의 양의 변화를 보여주는 두 개의 독립적 인 실험 한 다섯 발자국에서 세포를 용해 샘플링 한. GGATGCAGAAGGAGATCACT 및 역방향 : 여기서 우리는 DNA 앞으로 (β - 굴지 프라이머를 사용하여 용해 액에 포함하여 증폭 CGATCCACACGGAGTACTTG )은 각 PCR 반응의 중화 해물 4 μl를 사용.
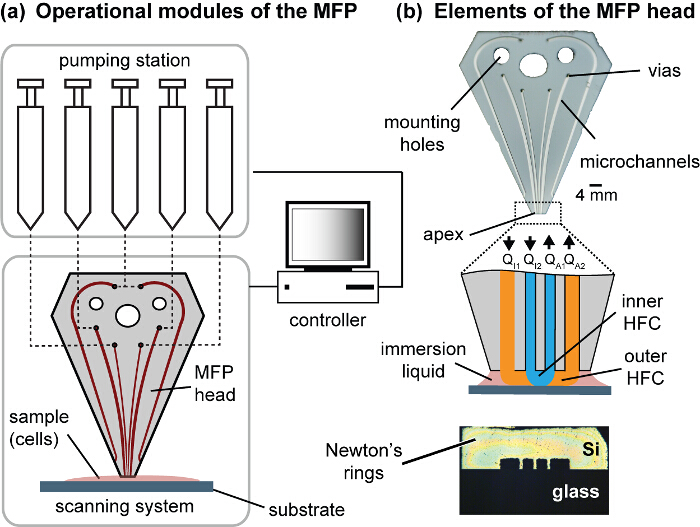
복합기 플랫폼 헤드도 1 모듈. (A), 플랫폼의 작동 모듈은 주사기, 동력 스테이지 및 제어기를 포함 할 동력. 복합기는 헤드와 기판 사이의 간극 거리를 제어하는 전동식 Z 스테이지에 접속되고, 상기 기판 홀더는 X- 및 주사 시스템을 구성하는 Y-동력 스테이지에 부착된다. 연마 정점 나가는 MFP 헤드가 Z 스테이지 상에 헤드를 장착하는 장착 구멍 펌핑 스테이션을 연결하는 유체 비아를 가지고 (B), 및 채널. 정점은 세포 배양 용 기재에 동일면으로 설정된다. 정점과 동일 평면 기판과 접촉 할 때 대칭 뉴턴 링을 관측 할 수있다. p_upload / 54447 / 54447fig1large.jpg "대상 ="_ 빈 ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
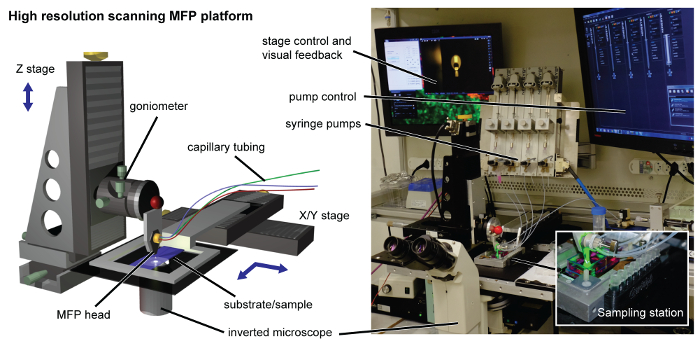
도 2 MFP 플랫폼. 고해상도 주사 플랫폼 가공 헤드 홀더 고정밀 동력 Z 스테이지와의 인터페이스를 갖추고있다. 기판 홀더는 주사 목적 XY 스테이지에 접속된다. 하류 분석 용 해물을 회수를 들어, 3D 인쇄 샘플링 스테이션 (인셋 참조), 기판 홀더의 측면에 자기 잘린다. 주사기 펌프, 거꾸로 현미경, 컨트롤러와 디스플레이가 플랫폼 주위에 위치하고 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3 "SRC ="/ 파일 / ftp_upload / 54447 / 54447fig3.jpg "/>
셀 제거의 공간 및 시간 제어를위한 그림 3. 계층 유체 흐름의 제한 (hHFC). (A) 단일 HFC의 도식. (B) 중첩 및 hHFC 작업의 (C) 슬쩍 모드. 두 개의 서로 다른 주입 / 흡입 유동 비율에 대한 풋 프린트 (D) 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
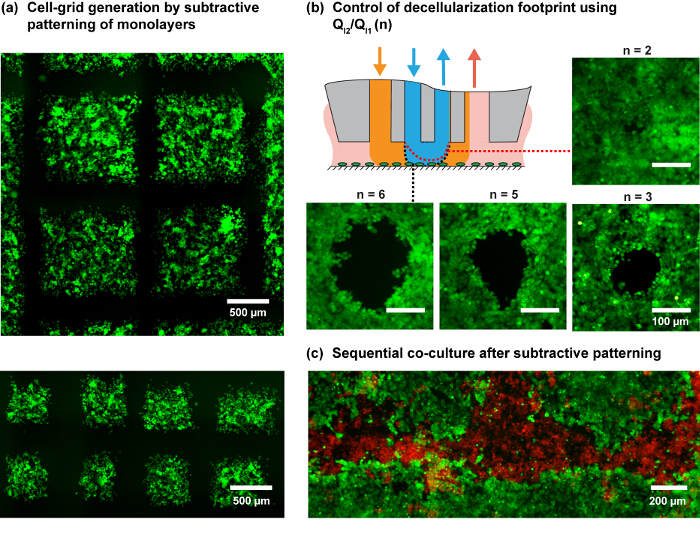
그림 MFP를 사용하여 세포 단층의 4 패턴. MDA-MB-231 세포 단층에 MFP의 프로그램 된 스캔하여 (A) 세포 격자 생성. 세포는 녹색 셀 추적 염료로 염색 하였다. (B) n은 서로 다른 분사 비율의 면적 ()는 MCF7 세포 단층에. 개략도는 N의 변화와 내부 HFC의 모양 예상 변화를 나타낸다. (C) 감산 지역에서 MDA-MB-231 세포를 파종 한 다음 MCF7 단일 층의 감산 패턴에 의해 공동 문화 무늬를. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
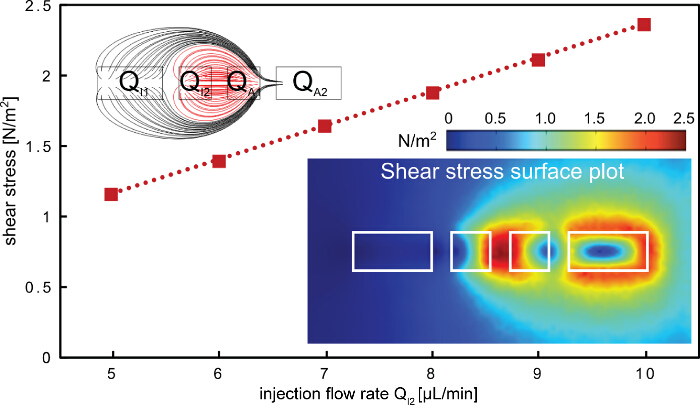
표면도 5 전단 응력 hHFC. 선형 내 주입 유량 표면 증가에 전단 응력을인가. 높은 전단 점은 두 개의 내부 처리 액체가 한정되어 개구부 (오른쪽 아래 인셋) (적색 흐름 선 좌측 상부 인셋) 사이에서 발견된다. 유한 요소 모델에 사용되는 개구의 크기는 200, 100, 100 및 200 ㎛의 I1이고, I2, A1및 A2, 각각. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
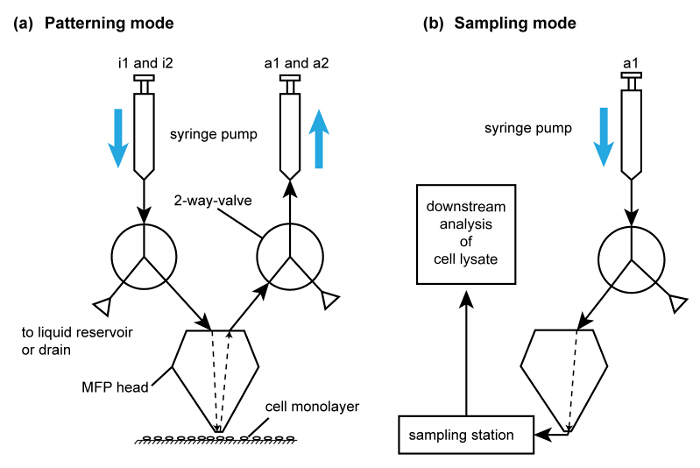
복합기 플랫폼도 6 작동 모드. 세포 분리 및 패터닝을 수행하는 세포 용해에 의한 감산 패터닝 용 유로 (A) 회로도. 간략화를 위해, 각각의 주입 및 흡입 유동 경로 중 하나만이 도시되어있다. 주사기가 펌프의 배출 밸브를 이용하여 채워진다. I1 및 I2는 각각의 추출 완충액에 NaOH를 주입하기 위해 사용된다. 파쇄 회수 유로 (B) 회로도. 이 유동 경로 (A)의 유로를 사용하여 분석을위한 세포 용 해물의 컬렉션 후에 활성화된다. CLIC주세요이 그림의 더 큰 버전을 보려면 여기를 케이.
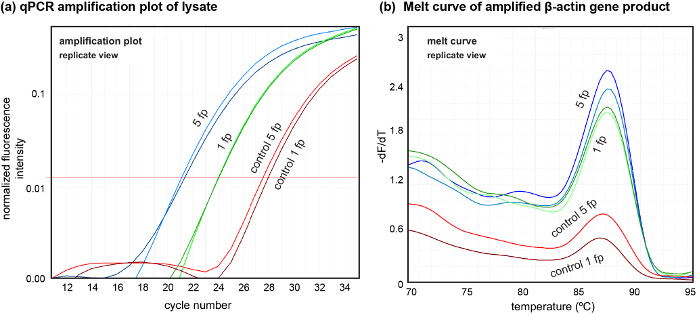
qPCR에를 사용하여 세포 용 해물에서 DNA의 그림 7. 다운 스트림 분석. 다섯 발자국 (5 FP) 1 공간 (1 FP)에서 추출 해물에서 DNA의 (A) 증폭 플롯. 컨트롤은 두 경우 모두에 대한 해물 수집 한 후 추출 하였다. (B)는 상기 추출 된 DNA의 품질을 나타내는 분해물로부터 증폭 된 DNA의 용융 곡선. qPCR에 수행 (N = 2, N = 3). β - 액틴 유전자를 증폭 한 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
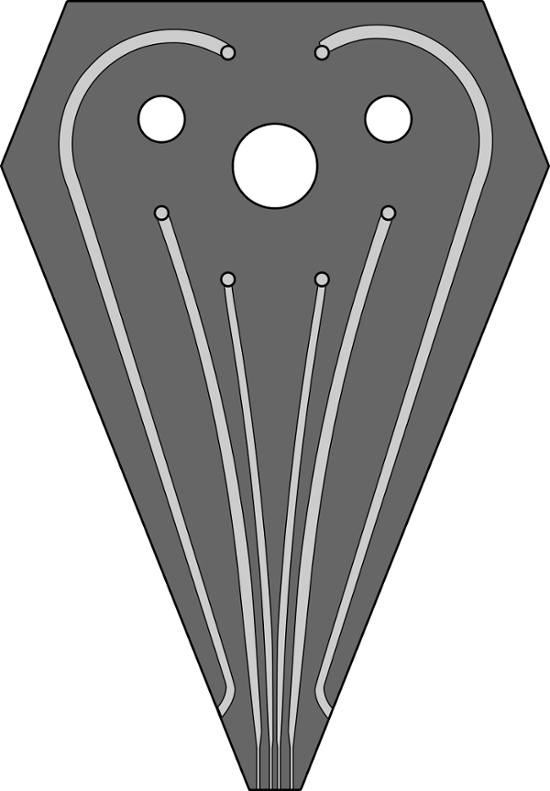
그림 S1. 6 채널 MFP 헤드에 대한 채널 디자인의 축소 이미지hHFC 수행 패터닝 실험에 사용 하였다. 채널 깊이 200, 100, 200, 100 ㎛ 폭, 100 ㎛의이다. 침지 액체를 보충 개의 최 채널은 500 ㎛ 폭, 100 ㎛의 깊이이다. 같은 디자인에 대한 GDS 파일이 문서에 추가로 제공하고있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
우리는 공간적으로 정의 셀 패턴의 신속한 생성을 가능 세포 단층의 감산 패터닝 다목적 프로토콜을 제시한다. 세포 단일 층의 선택적 용해가 hHFC의 처리 액으로의 NaOH를 사용하여 수행된다. NaOH의 순간적 세포막에 포함되는 단백질을 변성시킨다. 우리는 해물의 다운 스트림 처리를 보장하기 위해 NaOH를 50 mM의 농도의 사용을 권장합니다. 이 농도를 제공 해물 하류 처리 대물없고,보다 신속한 세포 제거를 위해 증가 될 수있다. hHFC는 세포 단층의 처리되지 않은 주변 지역은 영향을받지과 패턴을 확장하거나 세포의 다른 속성을 프로빙 중 하나를 사용할 수 있습니다 보장합니다.
셀 제거율 흐름에 의해 제공되는 화학 전단의 함수이다. 우리는 지배적 화학 셀을 제거하도록 유량의 동작 범위를 선택한다. 20 & # - (10)의 스캔 속도181; m / 6의 NaOH를 주입 유량을 사용하여 초 - 8 μL / min으로 급속 '감산 패터닝을 용이하게하기 위해 사용된다. 세포 제거의 빠른 속도 기반의 패터닝 (20, 21)에 근접 표면 인쇄가 직면 한 몇 가지 문제를 해결합니다. 이러한 방법은 미세 접촉 인쇄 패턴을 수득 셀 후속 시드를 통해 세포 부착 단백질을 선택적으로 증착하여, 예를 들어, 공간적으로 정의 된 영역에있는 세포의 성장을 제한하는 메커니즘을 필요로한다. 그들은 낮은 처리량에 의해 제한 및 패턴 생성에 대한 몇 가지 순차적 단계뿐만 아니라 각 패턴에 대한 새로운 스텐실 / 스탬프를 필요로한다. 세포 배양 기판의 추가적인 처리를 필요로하지 않는 반면에 기재된 방법은, 정의 된 영역에 대한 세포의 선택적 성장을 요구하고, 인쇄 달리 감산 패터닝을 수행함으로써 몇몇의 한계를 극복하지 않는다.
이 문서에 설명 된 프로토콜, 패터닝 세포 단층의 처리량생성 된 패턴의 즉각적인 시각적 피드백을 얻는 동안 증가한다. 이것은 패턴의 실시간 수정을 용이하게한다. 이러한 제어는 주어진 표면에 세포 생존 능력이 균일하지 않은 시나리오에 중요 할 수 있습니다. 상기 방법의 또 다른 장점은 동일한 헤드가 화학하여 패터닝 세포 단일 층을 생성에 관련된 단계의 수를 감소시키는 복수의 패턴을 생성하는데 사용될 수 있다는 것이다.
헤드의 채널 헤드 구조의 치수는 이에 따라 패터닝의 해상도를 제어 할 수 있도록, 애플리케이션의 요구 사항에 따라 확장 할 수있다. 현재 작업의 모든 실험은 200 × 100 μm의 100 × 100 μm의 바깥 쪽 구멍에서 내부 구멍으로 특히, 고정 조리개 크기를 가진 MFP 헤드를 사용하여 수행 하였다. 큰 외부 구멍이 설계에 의해 구멍 막힘없이 hHFC의 연속 동작을 보장하기 위해 선택되었다부유 세포 파편. 우리는 세포 제거에 성공 결과, 내부 구멍 크기 50 × 50 μm의 사이 50 μm의 간격을 머리를 테스트했습니다. 아래 10 × 10 μm의 10 μm의 간격으로 작은 구멍의 사용은, 따라서 패턴의 높은 해상도를 가능하게, 더 작은 풋 프린트 크기 (~ 30 × 30 μm의)에 스케일링을 허용합니다. 조리개 인해 미립자에서 막힘에보다 작은 10 μm의 크기와 우리는 운영 문제를 관찰했다. 이러한 동작으로 인해 어려움 100 μm의 해상도의 전류 제한 및 기재된 기술 이에 제한이다. 그러나, 우리는 hHFC의 액체 성형 능력을 사용하여이 문제를 해결 할 수있다. 우리는 셀 제거의 해상도 Q I2 / I1 Q를 제어하여 개구 치수의 주어진 세트에 대해 조정될 수 있음을 보여 주었다 (도 4B를)과 정점 - 대 - 기판 간격 10,14. 현재 작업에 사용되는 단계는 100nm의 최소 스텝 사이즈를 갖는다.이러한 제어 파라미터들의 조합은 풋 프린트 크기 및 주사 거리의 관점에서 셀 제거의 공간 분해능을 향상시킬 수있다.
패터닝 공동 배양 상이한 세포 유형 간의 특정 세포 - 세포 상호 작용을 연구하는 것이 요구되는 경우, 순차 시드 및 패터닝 기술 된 프로토콜을 사용하여 수행 될 수있다. 마지막으로, 고품질의 증폭 DNA는 DNA의 단일 피크로 명백한 바와 같이, 용 해물로부터 수득 될 수 곡선 (도 7 참조) 용융. 우리는 약 1.6 이론적 기대 (6-8 페이지 / 셀)에 가까운 qPCR에를 사용하여 단일 풋 프린트 (약 300 세포)에서 ng를의 DNA의 양을 평가 하였다. 이것은 어떤 DNA 분리 방법의 사용을 미연에 방지하면서 여러 다운 스트림 처리에 적합한 추출 된 DNA의 양을 나타낸다. 이것은을위한 길 열어 배양 된 세포의 프로빙 지역의 DNA 분석을 기반. 액체 형상 hHFC 능력은 AC에 대한 생균 및 단백질을 증착하는데 사용될 수있다이 프로토콜에서 제공 감산 패터닝 순차적 공동 배양과 함께 배양 기판에 조립 전지 셀 매트릭스 패턴의 생성을 가능 tivated 표면. 범용성 및 hHFC 기반 감산 세포 단층의 패턴 추출 된 세포 DNA의 분석을 수행 할 수있는 가능성에 의해 제공되는 제어가 세포 상호 작용을 포함하는 공간 분해 연구를 수행하기 위해 생물학 설정 강력한 새로운 툴을 제공한다.
공개
The authors have nothing to disclose.
감사의 말
This work was supported by the European Research Council (ERC) Starting Grant, under the 7th Framework Program (Project No. 311122, BioProbe). We thank Dr. Julien Autebert and Marcel Buerge for technical assistance and discussions during the development of the protocol and the platform. Prof. Petra Dittrich (ETH Zurich), Prof. Bradley Nelson (ETH Zurich), Dr. Bruno Michel and Dr. Walter Riess are acknowledged for their continuous support.
자료
| Name | Company | Catalog Number | Comments |
| Materials | |||
| Microfluidic Probe (MFP) | Silicon/glass hybrid probe head with channels patterned in silicon. Fabrication done in-house at IBM Research - Zürich | ||
| Lab Tek II Chamber slides with 2 chambers | ThermoFisher scientific, USA | 154461 | 2 Chamber chamber slides for cell culture with each chamber providing an area of 4 cm2 and capable of holding up to 3 ml of media volume |
| Chemicals and cell lines | |||
| Sodium Hydroxide, Tris-Cl, Ethylenediaminetetraaceticacid, Rhodamine B | SigmaAldrich chemicals, USA | S5881, 252859, E9884, R6626 | Chemicals used for processing and shielding liquids |
| Proteinase K | Qiagen, Germany | 19131 | protease to digest denatuired proteins |
| Deconex 16 Plus | Bohrer Chemie, Switzerland | Universal cleaning agent for labaratory consumables. Used for non stringent cleaning. | |
| DNA away | ThermoFisher scientific, USA | 7010 | Surface decontaminant that denatures DNA and DNAases. |
| DMEM, high glucose, GLUTAMAX supplement | ThermoFisher scientific, USA | 10566-016 | Culturing medium for epithelial cells. |
| CellTracker Green CMFDA dye | ThermoFisher scientific, USA | C7025 | Membrane permeant live cell labeling dye. Dye active for 72 hours. |
| CellTracker Orange CMRA dye | ThermoFisher scientific, USA | C34551 | |
| β-actin genomic primers for qPCR | Integrated DNA technologies, USA | Custom oligos used for DNA quality validation and qPCR. | |
| MCF7 breast carcinoma cells | ATCC, USA | ATCC HTB-22 | Cell lines used to produce co-cultures. |
| MDA-MB-231 breast carcinoma cells | ATCC, USA | ATCC HTB-26 | |
| Equipment and fluidic connections | |||
| Motorized high precision stages | Custom machined components. Linear axis motors from LANG GmBH, Germany | Customized linear axis stages from LT series | 3 × LT for 3 axes. LSTEP controller used for interfacing stages and PC through RS 232 port. |
| Syringes | Hamilton, Switzerland | 1700 TLLX series | Interchangeable with syringes provided by other manufacturers with a 250-500 µl range. |
| Nemesys low pressure syringe pumps | cetoni GmbH, Germany | Component of pumping station. | |
| Circular M1-connector | Dolomite microfluidics, United Kingdom | 3000051 | Interface between vias in MFP head and tubing |
| Tilt/rotation stage Goniometer | OptoSigma, USA | KKD-25C | Goniometer to adjust coplanarity of MFP apex |
| DS Fi2 HD color camera (CCD) | Nikon, Switzerland | Controlled using DS-U3 controller unit | |
| Software | |||
| Win - Commander | LANG GmBH, Germany | Stage control software. | |
| Qmix Elements | cetoni GmbH, Germany | Pump control software. | |
| NIS Elements | Nikon, Switzerland | Basic research module for image acquisition and analysis. | |
참고문헌
- Théry, M. Micropatterning as a tool to decipher cell morphogenesis and functions. J. Cell Sci. 123 (Pt 24), 4201-4213 (2010).
- Goubko, C. A., Cao, X. Patterning multiple cell types in co-cultures: A review. Mater. Sci. Eng. C. 29 (6), 1855-1868 (2009).
- Kaji, H., Camci-Unal, G., Langer, R., Khademhosseini, A. Engineering systems for the generation of patterned co-cultures for controlling cell-cell interactions. Biochim. Biophys. Acta. 1810 (3), 239-250 (2011).
- Cho, C. H., Park, J., Tilles, A. W., Berthiaume, F., Toner, M., Yarmush, M. L. Layered patterning of hepatocytes in co-culture systems using microfabricated stencils. Biotechniques. 48 (1), 47-52 (2010).
- Schütze, K., Lahr, G. Identification of expressed genes by laser-mediated manipulation of single cells. Nat. Biotechnol. 16 (8), 737-742 (1998).
- Salazar, G. T. A., Wang, Y., et al. Micropallet arrays for the separation of single, adherent cells. Anal. Chem. 79 (2), 682-687 (2007).
- Guillaume-Gentil, O., Zambelli, T., Vorholt, J. A. Isolation of single mammalian cells from adherent cultures by fluidic force microscopy. Lab Chip. 14 (2), 402-414 (2014).
- Iwata, F., Adachi, M., Hashimoto, S. A single-cell scraper based on an atomic force microscope for detaching a living cell from a substrate. J. Appl. Phys. 118 (13), (2015).
- Riahi, R., Yang, Y., Zhang, D. D., Wong, P. K. Advances in wound-healing assays for probing collective cell migration. J. Lab. Autom. 17 (1), 59-65 (2012).
- Juncker, D., Schmid, H., Delamarche, E. Multipurpose microfluidic probe. Nat. Mater. 4 (8), 622-628 (2005).
- Kaigala, G. V., Lovchik, R. D., Delamarche, E. Microfluidics in the "open space" for performing localized chemistry on biological interfaces. Angew. Chem. Int. Ed. Engl. 51 (45), 11224-11240 (2012).
- Qasaimeh, M. A., Gervais, T., Juncker, D. Microfluidic quadrupole and floating concentration gradient. Nat. Commun. 2 (May), 464 (2011).
- Christ, K. V., Turner, K. T. Design of hydrodynamically confined microfluidics: controlling flow envelope and pressure. Lab Chip. 11 (8), 1491-1501 (2011).
- Autebert, J., Kashyap, A., Lovchik, R. D., Delamarche, E., Kaigala, G. V. Hierarchical hydrodynamic flow confinement: efficient use and retrieval of chemicals for microscale chemistry on surfaces. Langmuir. 30 (12), 3640-3645 (2014).
- Kaigala, G. V., Lovchik, R. D., Drechsler, U., Delamarche, E. A Vertical Microfluidic Probe. Langmuir. 27 (9), 5686-5693 (2011).
- Cors, J. F., Lovchik, R. D., Delamarche, E., Kaigala, G. V. A compact and versatile microfluidic probe for local processing of tissue sections and biological specimens. Rev. Sci. Instrum. 85 (3), 034301 (2014).
- Pollard, J. W., Walker, J. M. . Basic Cell Culture Protocols. , (1997).
- Mitry, R. R., Hughes, D. R. Human cell culture protocols. Methods Mol. Biol. Springer. 531 (1), (2012).
- Sakai, K., Ushida, T., Nagase, T., Nakamigawa, H. Quantitative analysis of cell detachment by shear stress. Mater. Sci. Eng. C. 17 (1-2), 55-58 (2001).
- Rodriguez, N. M., Desai, R. A., Trappmann, B., Baker, B. M., Chen, C. S. Micropatterned multicolor dynamically adhesive substrates to control cell adhesion and multicellular organization. Langmuir. 30 (5), 1327-1335 (2014).
- Tasoglu, S., Demirci, U. Bioprinting for stem cell research. Trends Biotechnol. 31 (1), 10-19 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유