Method Article
Utilisant la Technique de la manche dans un modèle murin de la greffe aortique - une vidéo d’instruction
Dans cet article
Résumé
Nous présentons un modèle d’aortique transplantation orthotopique utilisant la technique de la manche chez les souris. C’est une méthode très rapide d’anastomose, qui peut être utilisée dans les études des maladies vasculaires.
Résumé
Une transplantation orthotopique aortique en utilisant la technique du manchon réduit la lésion de l’aorte avec taux d’échec de seulement 10-20 %. Le temps d’effectuer l’anastomose entre l’aorte chez la souris à l’aide de la méthode de la manche a été courte et facile avec une moyenne de 20 min, permettant des études des greffons d’iso/allo. L’article suivant décrit la procédure de transplantation aortique utilisée dans notre laboratoire. Les souris ont été anesthésiés avec un mélange d’isoflurane volume de 1,5 % et 100 % d’oxygène à travers un masque visage. À ce stade, le segment de l’aorte entre les artères rénales et sa bifurcation a été séparé de la veine cave supérieure, librement établi et clampedat les segments proximaux et distaux avec une suture de soie unique. Avant le retrait de l’aorte, une solution saline contenant de l’héparine a été injectée dans la veine cave inférieure. Puis l’aorte a été coupé entre les mâchoires et une solution saline de l’héparine a été utilisée pour rincer la lumière. La technique du manchon avec sutures monofilament a été utilisée afin de l’aorte abdominale en position orthotopique de transplantation.
Introduction
Comme indiqué dans une étude antérieure, grande attention a été portée aux modèles murins greffe aortique qui permettent la discrimination entre les réponses vasculaires spécifiques causées par la prothèse elle-même et certains facteurs systémiques liés à un environnement arteriogenic 1 , 2 , 3. le principal facteur qui joue un rôle crucial ici est la disponibilité de masquage et de souris transgéniques. Leur implication dans un tel modèle offre la possibilité d’identifier et de déterminer de nouvelles voies physiopathologiques associés au développement des maladies vasculaires dégénératives, telles que l’athérosclérose et anévrisme formation4, 5.
Il est à noter que durant une ischémie/reperfusion intrinsèque de la greffe des blessures pour les bateaux destinés à la transplantation peuvent apparaître. Par conséquent, l’apparition de problèmes spécifiques avec l’intégrité de la prothèse ou une réaction inflammatoire inattendue au cours de la période post-opératoire ne peut être exclue en excluant éventuellement des changements pathophysiologiques dans les maladies vasculaires dégénératives3 ,4,5,6,7. Anastomose de manche est la méthode alternative de bout en bout pour anastomose artérielle des navires de moins d’un millimètre de diamètre et a été appliquée avec succès dans la transplantation rénale et cardiaque chez des rats qui a été adaptée par la suite à aortique transplantation chez les souris par Dambrin et al. 8 , 9 , 10 , 11.
Dommages aortique en utilisant la technique de transplantation de manchon sont réduit au minimum avec un taux de défaillance technique très faible, parce qu’elle a une durée de seulement 20 min en moyenne. Nos résultats antérieurs ont démontré des excellentes propriétés fonctionnelles et structurelles d’un isograft en vivo après la transplantation à l’aide de la gaine technique1. Dambrin et coll. décrivent qui, après une courbe d’apprentissage courte le taux de réussite était supérieur à 78 %10. Complications telles que la thrombose sont rares, par exemple Engelbrecht et coll. n’ont pas observé de thrombose utilisant la technique de la manche dans la transplantation rénale chez le rat8.
Le modèle murin greffe aortique avec manchon anastomoses est un outil rapid et facile à étudier les réactions d’iso/allogreffe dans le vaisseau greffé. Cette vidéo illustre la procédure de transplantation aortique effectuée dans notre laboratoire. Ce modèle de transplantation peut-être être utile pour définir les mécanismes pathologiques sous-jacents des maladies dégénératives vasculaires et peut-être contribuer à une évaluation plus poussée des interventions pharmacologiques et moléculaires12.
Protocole
procédures portant sur des sujets animaux ont été approuvées par le Comité de l’emploi (IACUC) et d’institutionnels animalier à l’Université RWTH Aachen, AZ 84-02.04.2012.A234.
Remarque : la procédure est illustrée à l’aide de souris sauvage mâle adulte avec fond CD1. Gardez les souris dans une unité de laboratoire spécialisé, avant et après la chirurgie, assurant un accès adéquat à la nourriture, contrôle vétérinaire spécialisé et traitement. Si les animaux sont achetés à l’extérieur, permettent une semaine acclimatation avant d’effectuer la chirurgie.
1. préparation du donneur
- utiliser les instruments et le matériel stérile pour maintenir des conditions stériles pendant une intervention chirurgicale pour éviter les infections.
- Anesthésier chaque souris avec un mélange de 1,5 % par volume isoflurane et 100 % d’oxygène à travers un masque visage. Posez la souris sur une plate-forme dans le décubitus dorsal et le ruban toutes ses jambes pour la table d’opération. Vérifier ses réflexes en pinçant les pattes pour s’assurer que la souris est suffisamment anesthésiée. Placez la pommade ophtalmique sur les yeux pour éviter le dessèchement pendant la procédure.
- Retirer tous les poils de l’abdomen à l’aide d’un gel dépilatoire ou utiliser un rasoir. Effectuer l’opération dans des conditions stériles. Désinfecter l’abdomen avec une alternance de scrubs de chlorhexidine et de l’eau stérile.
- Enlever l’aorte donateurs via une incision abdominale médiane avec des ciseaux ou un scalpel. Retirer l’intestin manuellement vers la droite. Doucement manuellement reflètent les intestins sur le côté avec des gants libres de poudre.
- Placer l’intestin sur un morceau de gaze imbibé de sérum physiologique pour le garder humide.
- Disséquer à l’aorte abdominale avec beaucoup d’attention des tissus environnants par une dissection avec des pincettes.
- Séparer le segment de l’aorte entre les artères rénales et sa bifurcation de la veine cave avec des pincettes.
- Sécuriser toutes les petites branches de ce segment très soigneusement à l’aide de suture unique monofilament de 11-0.
- Avant d’enlever l’aorte, injecter 0,5 millilitres (mL) de solution saline contenant 50 U d’héparine dans la veine cave inférieure.
- Laissez l’animal donneur exsanguinate après avoir retiré le segment de l’aorte.
- Rincer la prothèse entièrement avec du sérum physiologique et transférez-le immédiatement vers un récipient d’une solution saline glacée.
2. Préparation du destinataire
- anesthésier l’animal receveur avec un mélange de 1,5 % par volume isoflurane et 100 % d’oxygène à travers un masque de visage, puis enlever les poils et désinfecter (Section 1). Pratiquer une incision de la ligne médiane de la xiphoïde au bassin avec un scalpel et rétracter les parois abdominales. Placer la pommade ophtalmique sur les yeux pour prévenir le dessèchement pendant la procédure.
- Enveloppe l’intestin en solution saline imbibé de gaze et déplacer très doucement l’animal ' droite de s.
- Disséquer l’anévrisme aorte libre entre les artères rénales dans la partie proximale et la bifurcation distalement avec des pincettes.
- Sécuriser toutes les petites branches de ce segment très soigneusement à l’aide de suture unique monofilament de 11-0.
- Fixer les portions proximales et distales de l’aorte avec une suture de soie unique 6-0.
- Diviser l’aorte au milieu entre les pinces et irriguer les extrémités coupées avec du sérum physiologique hépariné afin d’éliminer la lumière ouverte.
- Placer le greffon dans la position de l’orthotopic avec la partie de navire alimentation insérée dans le récipient puis en suturant avec monofilament de 11-0 en prenant soin d’éviter toute torsion de l’aorte en alignant correctement le donateur et le bénéficiaire ( la figure 1) 10.
- libérer soigneusement les ligatures après avoir effectué une inspection de l’anastomose. Relâcher la pince distale tout d’abord. Cela se traduit par une faible pression tenant les murs ensemble avant de remettre le côté haute pression proximal.
- Perfuse le greffon immédiatement et vérifier une impulsion visible. Retirez délicatement les restes de la soie. La longueur optimale de chevauchement entre le donneur et le receveur aorte est 1-2 mm.
- Retourne le contenu abdominal dans la cavité abdominale et fermer le tout enroulé avec une suture acide de course 3-0 polyglycolique.
- Donner la buprénorphine souris (0,05 mg/kg de poids corporel par voie sous-cutanée (SC)) avant de se terminer anesthésie.
- Ne pas laisser un animal sans surveillance jusqu'à ce qu’il est pleinement conscient. Gérer la douleur thérapie avec buprenophine 0,05 mg/kg de poids corporel administrés SC trois fois par jour pendant trois jours après l’opération tel qu’approuvé par l’organisme de surveillance institutionnelle.
- Pour tissu récolte, anesthésier les souris destinataires comme décrit ci-dessus et rincer les vaisseaux avec une solution saline tamponnée au phosphate (PBS) suivie de 4 % formaldéhyde/PBS, (pH = 7,4) par ponction cardiaque. Retirez doucement les greffons. Après fixation au jour le jour à 4 % formaldéhyde/PBS, spécimens de processus plus loin et incorporer à la paraffine.
Résultats
Les souris récupéré de l’anesthésie en 15-30 min avec aucun handicap physique observée, bien qu’il y avait un risque élevé de thrombose. Échographie analyse a été utilisée au cours du suivi postopératoire vers le haut. Les souris de type sauvage utilisées dans l’étude ont montré aucun changement dans les dimensions de leur lumière. En conséquence, les sténoses ni formations anévrysmal ont été observées. Les animaux de transplantation n’a pas à exposer le développement de la plaque des parois des vaisseaux (Figure 2).
Méthodes de coloration classiques tels qu’immunohistologie peuvent servir à déterminer la plaque, modèle de cellules musculaires lisses et l’accumulation de macrophages. Dans notre étude les histologique et coloration immunohistochimique a été réalisée 6 semaines après la greffe pour tester l’intégrité de la prothèse. La coloration histologique (hématoxyline et éosine (HE) et immunohistochemical souillant (actine Muscle lisse (SMA) et macrophages (MAC2)) (Figure 3) nous a montré inchangé des patrons de distribution des cellules musculaires lisses, cellules endothéliales intactes doublure et no accumulation de cellules dans l’intima. Ces résultats indiquent qu’aucune activation significative de lésion ou de la cellule a été détectée dans les vaisseaux greffés (Figure 3).

Figure 1 : Technique de la manche. L’aorte abdominale a été transplanté en utilisant la technique du manchon. Dans cette procédure, aorte du donneur a été placé dans la position de l’orthotopic avec piqûres superficielles présents dans le réservoir d’alimentation. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
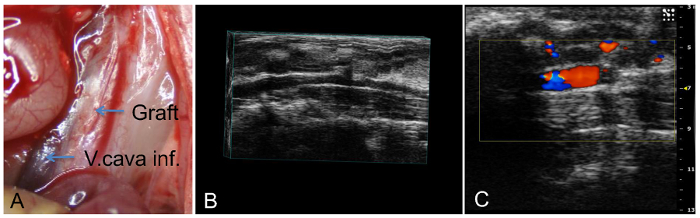
Figure 2 : Peropératoire et échographies. Exemples d’avis peropératoire (autopsie) des greffons 6 semaines après la transplantation (A), son échographie tridimensionnelle (B) et B-mode view (C). Le suivi postopératoire a été réalisé en utilisant des ultrasons. Les photos montrent la perméabilité de la prothèse sans changement dans les dimensions de la lumière. En outre, pas de sténoses ou anévrysmal formations ont été observées. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
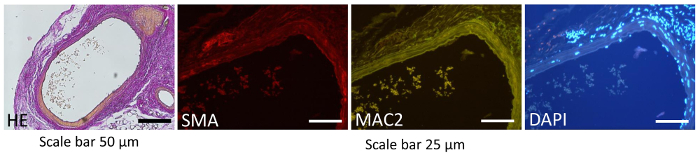
Figure 3 : Histologique et immunohistochimique images. Les images représentant histologiques et immunohistochimique des animaux transplantés à 6 semaines après la transplantation. Aucune lésions importantes ont été observées dans les aortes transplantés par histologie (hématoxyline et éosine, grossissement de X 100, barre d’échelle = 50 µm), immunohistochemical souillant (SMA d’actine Muscle lisse (rouge), ou Macrophage MAC2 (vert), 200 X grossissement, échelle bar = 25 µm). Les noyaux étaient Counter-colorés par DAPI (bleus). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Avant cette étude, divers autres modèles de transplantation chez les souris ont été soigneusement analysées3,6,7,10,13,14. Le modèle de la greffe aortique en utilisant la technique de la manche sous réserve de modifications par Dambrin et coll. a été choisi car il correspond à nos critères et ont montré une grande fiabilité de l’anastomose de manches par rapport aux méthodes conventionnelles de suture bout à bout 1 , 10.
Cette technique est favorable à bien des égards avec croix-pince temps réduit considérablement réduisant au minimum les dommages causés à l’aorte pendant la chirurgie. Une faible incidence de thrombose a été observée en plus éviter une incompatibilité possible au calibre du navire entre le donneur et le receveur. Les observations qui précèdent rendent cette technique hautement adaptées pour enquêter sur les maladies vasculaires dans les transplantations aortiques chez les souris.
Dans une étude de suivi dans laquelle une échographie a été réalisée à 8 semaines après la transplantation, aucune variation significative n’est détectées. Cela a confirmé les hypothèses que tout dommage causé à l’aorte au cours de la chirurgie serait minime1.
Le greffage procédure présentée dans cet article garantit sans altération dans l’intégrité de la prothèse et sa fonction. Par conséquent, on peut conclure que ce modèle de transplantation expérimentales peut-être constituer un outil précieux pour de futures études moléculaires et pharmacologiques de la maladie des vaisseaux dégénératives chez des souris génétiquement modifiées.
Nous pensons que le guide vidéo peut fonctionner comme matériel illustrant l’utilisation de ce modèle simple d’arterio-artériel d’enseignement et qu’il contribuera à plus fructueux débat sur plusieurs questions importantes dans les pathologies vasculaires. Cette méthode anastomose très rapide peut être utilisée pour étudier les maladies vasculaires chez des souris génétiquement modifiées. Il peut également être utilisé comme une modification dans le modèle d’anévrisme combinée à la transplantation.
Il y a des points critiques au cours de la procédure. La mise de la suture elle-même est l’étape la plus critique. Le chirurgien doit prendre soin d’éviter toute torsion de l’aorte par un alignement correct du donneur et du receveur. Les pinces sont soigneusement retirés après inspection de l’anastomose. La pince distale doit toujours être libérée entraînant d’abord basse pression tenant les murs ensemble avant la libération proximale côté haute pression. La conséquence de pas correctement suite à la séquence de sortie pourrait être saignement.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont aucun intérêt financier concurrentes.
Remerciements
Nous tenons à remercier Roma Wieczorek et Peter Kurdybacha pour leur aide montage excellent et Leon Decker Uli Heuter pour leur assistance technique excellente.
matériels
| Name | Company | Catalog Number | Comments |
| Halsey Needle Holder | Fine Science Tools | 12001-13 | |
| Dumont #5 Forceps - | Fine Science Tools | 11254-20 | |
| Lexer-Baby Scissors | Fine Science Tools | 14079-10 | |
| Castroviejo Micro Needle Holder | Fine Science Tools | 12060-01 | |
| Vannas Scissors | Aesculap, Germany | Typ OC498R | |
| Castroviejo Suture Forceps | Geuder, Germany | 19015 | |
| 6-0 silk black (Silk) | Deknatel, Research Triangle Park NC, USA | 18020-60- FST | |
| 11-0 monofilament (Ethilon) | Ethicon, Norderstedt, Germany | EH7438G | |
| 3-0 polyglycolic acid suture (Serafit) | Serag-Wiessner, Naila, Germany | 60203214 | |
| Isofluorane | Any genericon | ||
| Heparin | Any genericon | ||
| 0.9% saline | Any genericon | ||
| Buprenorphine | Any genericon | ||
| Bepanthene eye and nose cream | Bayer, Germany | ||
| Microscop | Zeiss | Opmi MDO/S5 | |
| Vaporiser | Eickemeyer | TEC3 | |
| Ultrasound | Vevo, Canada | 770,2100 |
Références
- Rowinska, Z., et al. Non- invasive in vivo analysis of a murine aortic graft using high resolution ultrasound microimaging. Eur J Radiol. 81 (2), 244-249 (2012).
- Daugherty, A. Mouse models of atherosclerosis. Am J Med Sci. 323 (1), 3-10 (2002).
- Xu, Q. Mouse models of arteriosclerosis: from arterial injuries to vascular grafts. Am J Pathol. 165 (1), 1-10 (2004).
- Daugherty, A., Cassis, L. A. Mouse models of abdominal aortic aneurysms. Arterioscler Thromb Vasc .Biol. 24 (3), 429-434 (2004).
- Zernecke, A., Shagdarsuren, E., Weber, C. Chemokines in atherosclerosis: an update. Arterioscler Thromb Vasc Biol. 28 (11), 1897-1908 (2008).
- Chereshnev, I., et al. Mouse model of heterotopic aortic arch transplantation. J Surg Res. 111 (2), 171-176 (2003).
- Koulack, J., McAlister, V. C., Giacomantonio, C. A., Bitter-Suermann, H., MacDonald, A. S., Lee, T. D. Development of a mouse aortic transplant model of chronic rejection. Microsurgery. 16 (2), 110-113 (1995).
- Engelbrecht, G., Kahn, D., Duminy, F., Hickman, R. New rapid technique for renal transplantation in the rat. Microsurgery. 13 (6), 340-344 (1992).
- Baxter, K., Hao, P. M., Howden, B. O., Saunder, A., Jablonski, P. Modified technique of abdominal heart transplantation in the rat. J Heart Lung Transplant. 17 (11), 1057-1064 (1998).
- Dambrin, C., Calise, D., Pieraggi, M. T., Thiers, J. C., Thomsen, M. Orthotopic aortic transplantation in mice: a new model of allograft arteriosclerosis. J Heart Lung Transplant. 18 (10), 946-951 (1999).
- Siemionow, M. Histopathology of microarterial anastomoses: end-to-end versus end-in-end (sleeve) technique. J Hand Surg Am. 15, 619-625 (1990).
- Charo, I. F., Ransohoff, R. M. The many roles of chemokines and chemokine receptors in inflammation. N Engl J Med. 354 (6), 610-621 (2006).
- Sun, H., et al. Improved surgical technique for the establishment of a murine model of aortic transplantation. Microsurgery. 18 (6), 368-371 (1998).
- Guo, L., Agarwal, A., George, J. F. Orthotopic aortic transplantation in mice for the study of vascular disease. J Vis Exp. (69), e4338 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon