Method Article
Legionella pneumophila membrane externe Vésicules: Isolement et analyse de leur potentiel pro-inflammatoire sur Macrophages
Dans cet article
Résumé
Ici, nous décrivons la purification de Legionella pneumophila (L. pneumophila) des vésicules de membrane externe (OMVS) à partir de cultures liquides. Ces vésicules purifiées sont ensuite utilisés pour le traitement des macrophages pour analyser leur potentiel pro-inflammatoire.
Résumé
Bacteria are able to secrete a variety of molecules via various secretory systems. Besides the secretion of molecules into the extracellular space or directly into another cell, Gram-negative bacteria can also form outer membrane vesicles (OMVs). These membrane vesicles can deliver their cargo over long distances, and the cargo is protected from degradation by proteases and nucleases.
Legionella pneumophila (L. pneumophila) is an intracellular, Gram-negative pathogen that causes a severe form of pneumonia. In humans, it infects alveolar macrophages, where it blocks lysosomal degradation and forms a specialized replication vacuole. Moreover, L. pneumophila produces OMVs under various growth conditions. To understand the role of OMVs in the infection process of human macrophages, we set up a protocol to purify bacterial membrane vesicles from liquid culture. The method is based on differential ultracentrifugation. The enriched OMVs were subsequently analyzed with regard to their protein and lipopolysaccharide (LPS) amount and were then used for the treatment of a human monocytic cell line or murine bone marrow-derived macrophages. The pro-inflammatory responses of those cells were analyzed by enzyme-linked immunosorbent assay. Furthermore, alterations in a subsequent infection were analyzed. To this end, the bacterial replication of L. pneumophila in macrophages was studied by colony-forming unit assays.
Here, we describe a detailed protocol for the purification of L. pneumophila OMVs from liquid culture by ultracentrifugation and for the downstream analysis of their pro-inflammatory potential on macrophages.
Introduction
Les bactéries peuvent sécréter des facteurs de virulence via différents mécanismes 1. Outre les systèmes sécrétoires bien connus, les bactéries Gram-négatives peuvent échanger des informations et de fournir des facteurs de virulence par des vésicules de la membrane externe (OMVS), qui sont petites, vésicules sphéroïdes 10-300 nm de diamètre et avec une structure de membrane bicouche. Elles sont sécrétées dans une variété de milieux de croissance (culture liquide, culture solide, et les biofilms) et dans toutes les phases de croissance 2, 3. OMV sont un important moyen de transport (par exemple, pour les protéines, les adhésines, les toxines et enzymes, ainsi que pour les LPS, qui se trouve sur la surface OMV) 4. La cargaison intraluminale est protégée de la dégradation protéolytique, il est donc en mesure d'agir sur de longues distances et les vésicules peuvent être trouvées dans les fluides corporels et des organes distants 5, 6,"xref"> 7, 8. Ils ne peuvent pas être reconnus et capturés par les cellules eucaryotes , 9, 10, mais en outre, ils sont capables de faciliter la fixation des bactéries et leur invasion dans des cellules hôtes 4. Legionella pneumophila (L. pneumophila) est une bactérie à Gram négatif qui peut libérer OMV. Dans le poumon humain, il infecte principalement les macrophages alvéolaires, même si son hôte naturel sont l' eau douce amibes 11. Une infection de L. pneumophila peut causer la maladie du légionnaire, une forme grave de pneumonie 12. Il bloque la fusion phagosome-lysosome dans la cellule hôte. Il recrute également des organites d'accueil, dans lequel un créneau de réplication, la vacuole de la Legionella (LCV), est formé 13, 14. dégradation lysosomale est inhibée non seulement par tra de protéines effectricesnslocation via le système de sécrétion de type IV, mais aussi par la libération des 15 OMV.
La purification des OMV à partir de cultures bactériennes est nécessaire pour analyser leur effet sur les cellules receveuses. Des études antérieures ont porté sur la teneur en protéine de L. pneumophila OMV et sur l'influence des vésicules sur les cellules épithéliales alvéolaires 16, mais des études ultérieures avec des greffes de tissus de poumon humain ont démontré que L. pneumophila OMV sont repris par les macrophages alvéolaires 17.
Comme OMVS présents motifs associés à des pathogènes moléculaires (PAMP) et d' autres antigènes bactériens, ils pourraient avoir un impact sur l'infection de cellules eucaryotes et moduler la réponse immunitaire de l' hôte 18. L. pneumophila OMV fusionnent rapidement avec les membranes de la cellule hôte et, en outre, ils activent le TLR2 membraneux 19. Comme il est connu que pneumoph L.ila OMVs stimulent les macrophages et les cellules épithéliales d'une manière pro-inflammatoire 16, 17, nous avons analysé l'impact de l' OMVS sur le processus d'infection dans les macrophages humains et murins.
Ici, nous décrivons un protocole pour la culture de L. pneumophila en culture liquide pour isoler les vésicules de membrane externe sécrétées par ultracentrifugation différentielle et d'évaluer l'impact des vésicules sur les cellules hôtes eucaryotes, que ce soit directement ou à la suite d' une infection.
Protocole
1. Préparer moyen et plaques d'agar
- Préparer 1 litre de milieu de bouillon (YEB). Dissoudre 10 g de ACES et 10 g d'extrait de levure dans 900 ml d'eau distillée. Ajuster le pH à 6,9 avec du KOH (5 N). Ajouter 10 ml de L-cystéine (0,4 g dans 10 ml d'eau distillée) et 10 ml de Fe (NO3) 3 x9H 2 O (0,25 g dans 10 ml d'eau distillée). Remplir jusqu'à 1 L avec de l'eau distillée et filtrer stériliser la (taille des pores: 0,22 um) solution. Conserver à 4 ° C.
- Préparer un extrait de levure de charbon tamponnée (BCYE) des plaques d'agar. Dissoudre 10 g de ACES et 10 g d'extrait de levure dans 900 ml d'eau distillée. Ajuster le pH à 6,9 avec du KOH (5 N). Ajouter 15 g d'agar-agar et 2,5 g de charbon activé. Remplir jusqu'à 1 L avec de l'eau distillée et autoclave.
- Ajouter 10 ml de L-cystéine (0,4 g dans 10 ml d'eau distillée) et 10 ml de Fe (NO3) 3 x9H 2 O (0,25 g dans 10 ml d'eau distillée, à la fois stérilisé par filtration sur 0,22 pmpores) à BCYE refroidie (environ 50 ° C). Verser plaques et conserver à 4 ° C.
2. Cultiver L. pneumophila
- Étaler la souche L. pneumophila Corby (type sauvage, WT) sur des plaques de gélose BCYE et incuber à 37 ° C pendant 3 jours. Inoculer 10 ml de YEB à une DO600 de 0,3 à Legionella pneumophila de la plaque de pré - culture; incuber les bactéries à 37 ° C sur un agitateur rotatif (150 tours par minute) pendant 6 h.
- Vérifier la pureté de la culture liquide en étalant 100 ul de la suspension sur une plaque de gélose au sang. Incuber une nuit à 37 ° C.
- Ajouter la culture liquide restant à 90 ml de milieu YEB frais et on incube sur un agitateur rotatif (37 ° C et à 150 tours par minute) pour atteindre une DO600 de 3,0 à 3,5, ce qui prend environ 16 à 20 heures.
3. Préparer et Quantifier L. pneumophila OMV
REMARQUE: Effectuer toutes l'étape de centrifugation suivants dans des conditions stériles et à 4 ° C.
- Centrifuger la culture liquide à 4000 g pendant 20 minutes pour sédimenter les bactéries. Transférer le surnageant dans des tubes de centrifugeuse frais, jeter le culot bactérien, et répéter la centrifugation (4000 g pendant 20 min). Répétez cette étape une fois.
- Stérile filtre le surnageant restant à deux reprises (taille des pores: 0,22 um). Transférer le surnageant exempt de bactéries à des tubes d'ultracentrifugation et ultracentrifugation à 100.000 xg pendant 3 h.
- Décanter le surnageant et le jeter. Remettre en suspension le culot d'OMV dans une solution saline stérile tamponnée au phosphate (PBS) et ultracentrifugation (100 000 x g pendant 3 h) pour éliminer les protéines contaminantes et le LPS.
- Jeter le surnageant et remettre le culot OMV dans 500 ul de PBS stérile. Strie 20 pl sur une plaque de gélose au sang et sur une plaque de gélose BCYE pour exclure la contamination bactérienne des vésicules préparées. Incuber la plaque de gélose au sang pendant une nuit et la plaque de gélose pendant 3 jours BCYE (tous deux à 376; C).
- Quantifier la quantité de protéine obtenue à partir de la préparation d'OMV en utilisant un dosage à l'acide bicinchoninique selon les instructions du fabricant.
Remarque: la concentration de la culture ml de L. pneumophila 100 est habituellement de 1 ug / ul. Stocker les OMV préparés et quantifiés à -20 ° C.
Macrophages 4. Pré-traiter
- Préparer cellules THP-1.
REMARQUE: THP-1 est une lignée cellulaire monocytaire dérivée d'un patient atteint de leucémie.- Ajouter 2x10 5 cellules THP-1 par 24 puits et les différencier par addition de 20 nM de phorbol 12-myristate 13-acétate (PMA) dans des cellules de type macrophage. Incuber pendant 24 h à 37 ° C.
- Remplacer le milieu avec 500 ul de milieu frais et incuber pendant 24 h; le milieu optimal pour les cellules THP-1 est composé de RPMI 1640 haute teneur en glucose additionné de 10% de sérum de veau foetal.
- Isoler les macrophages dérivés de la moelle osseuse murine (mBMDM), comme décrit dans Reportezrence 20.
- Traiter les macrophages THP-1 dérivés ou mBMDM avec OMV.
- Décongeler les OMV préparées à l'étape 3 et l'ajouter en fonction de leur quantité de protéines (0,1, 1 et 10 ug / mL) au macrophages murins ou humains. Incuber les macrophages avec OMV à 37 ° C pendant au moins 20 h. Utilisez le surnageant pour ELISA ou passer à l'étape 5.
5. Infect les Macrophages et évaluer la réplication bactérienne avec un (CFU) Assay unité formant colonie
- L. pneumophila utiliser à l' étape 2.1, prétraité cellules THP-1 ou mBMDM à l' étape 4.3, et non les macrophages pré-traités comme les témoins (2x10 24.5 puits). Ne pas échanger le milieu.
- Infectent les cellules THP-1 avec L. pneumophila WT Corby et mBMDM avec un mutant dépourvu flagelline de L. pneumophila Corby ( à la fois avec une multiplicité d'infection (MOI) de 0,5, 1x10 5 L. pneumophila / 24 puits) et incuber pendant 24 et 48 h, respectivement. Préparer boe Legionella pneumophila Corby (WT flagelline ou mutante dépourvue) comme décrit à l' étape 2.1.
- Lyser les cellules en leur milieu par l'addition de la saponine (concentration finale: 0,1%) et incuber à 37 ° C pendant 5 min.
- Remettre en suspension les bactéries par pipetage et à transférer la suspension dans un récipient de réaction. Préparer des dilutions en série du support de L. pneumophila contenant dans du PBS stérile.
- Strie 50 ul des dilutions requises sur des plaques de gélose BCYE et incuber pendant 3 jours à 37 ° C.
- compter visuellement les colonies formées. Calculer la CFU
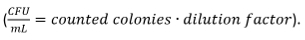 Normaliser le résultat du comptage CFU de ne pas pré-traités, mais les macrophages, qui sont fixés à 100% infectés.
Normaliser le résultat du comptage CFU de ne pas pré-traités, mais les macrophages, qui sont fixés à 100% infectés.
Résultats
Le montage expérimental pour préparer L. pneumophila OMV et d'analyser leur influence sur la réponse pro-inflammatoire des macrophages après l' infection est représentée sur la figure 1. Le potentiel pro-inflammatoire des OMV préparées peuvent être analysées sur PMA différenciées cellules THP-1, qui est représenté sur la figure 2. Cellules THP-1 répondent à une augmentation du temps et dose-dépendante de l'IL-8 et IL-6 sécrétion. En outre, l'influence des différents TLR sur la reconnaissance L. pneumophila OMV peut être analysé en utilisant mBMDM de différentes origines génétiques, tel que présenté par le CXCL1 ELISA à la figure 3. mBMDM de souris WT sécrétées CXCL1 après OMV stimulation, tandis que mBMDM TLR2 / 4 - / - sécrétée nettement moins. Pour étudier l'impact de L. pneumophila OMV sur la réplication bactérienne dans THP-1 macrophages, les cellules ont été pré-incubées avec OMV et ensuite en outre infectéespar L. pneumophila (Figure 4 A). La pré-stimulation des macrophages THP-1 dérivées réduit d'abord la réplication bactérienne après 24 h d'infection, mais elle conduit à un doublement en UFC compte au point de temps plus tard (48 h pi). L'impact du récepteur Toll-like (TLR) de signalisation sur la reconnaissance OMV suite à l'infection des macrophages peut être évaluée par mBMDM, tel que présenté dans la figure 4 B. Réplication bactérienne augmente de dix à mBMDM des animaux WT après OMV pré-incubation, tandis que TLR2 - / - et TRIF / MyD88 - / - cellules ne présentent pas cette augmentation de la réplication de L. pneumophila.
Figure 1: Procédure expérimentale. (A) Legionella pneumophila Corby WT de 10 cm BCYE des plaques de gélose sont utilisées pour ensemencer une culture à petite liquide (10 ml), qui est transféré dans 90 ml de YEB fraismilieu après 6 h. Un petit volume est également étalée sur une plaque de gélose au sang pour vérifier la pureté. Les bactéries sont incubées à 37 ° C jusqu'à la phase stationnaire précoce (DO 600 = 3,0 à 3,5). (B) la culture liquide est centrifugé et stérilisé par filtration pour éliminer les bactéries. Le surnageant exempt de Legionella est ensuite soumis à une ultracentrifugation pour obtenir un culot OMV, qui est remis en suspension dans du PBS et ultracentrifugation à nouveau. Les vésicules isolées sont remises en suspension, vérifier la pureté, et quantifiés pour la quantité de protéine. La barre d'échelle représente 2,5 cm. (C) macrophages humain ou murin sont stimulées avec les OMV quantifiées. Le surnageant de culture cellulaire peut être utilisée pour le test ELISA, ou les macrophages peuvent être infectés par L. pneumophila pour déterminer la replication bactérienne par le dosage CFU sur 10 cm BCYE des plaques d' agar - agar. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
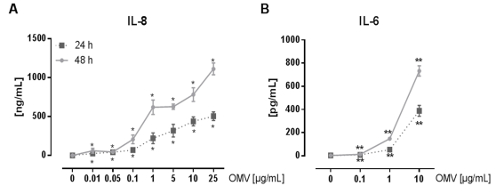
Figure 2: l' activation pro-inflammatoire de cellules THP-1 de L. pneumophila OMV. (A) Ici, les cellules THP-1 lignée cellulaire monocytaire est utilisé comme modèle pour les macrophages alvéolaires. PMA différenciées cellules THP-1 ont été traitées avec des doses croissantes de L. pneumophila OMV (0,01 à 25 ug / ml) pendant 24 heures et 48 heures respectivement. Le surnageant exempt de cellules a été utilisé pour l'IL-8 ELISA. Les valeurs moyennes de trois expériences indépendantes ± SEM sont indiquées. Cellules THP-1 ont réagi à aussi peu que 0,01 pg / ml de L. pneumophila avec OMV significative de la sécrétion d' IL-8, qui est du temps et dépendant de la dose. (B) de L. pneumophila OMV (0,1 à 10 ug / mL) ont été utilisées pour stimuler le PMA différenciées cellules THP-1. Le surnageant a été recueilli après 24 et 48 heures d'incubation, et l'IL-6 libérée a été mesurée dans le surnageant par ELISA. Les valeurs moyennes de trois expériences indépendantes ± SEM sont indiquées. Cellules THP-1 sécrété des quantités significatives d'IL-6, même avec la dose la plus faible de OMV (0,1 pg / ml). La sécrétion d'IL-6 augmente avec des doses croissantes d'OMV et avec des durées d'incubation prolongées. Statistiques: test de Mann-Whitney; * P <0,05 et ** p <0,01 par rapport au 0 pg / ml d'OMV correspondante. Reproduit avec la permission de Référence 20. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
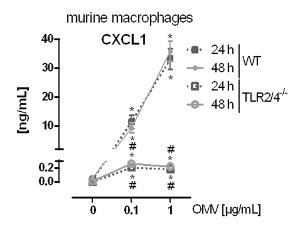
Figure 3: L'activation pro-inflammatoire des macrophages dépend TLR2 / 4. mBMDM de WT et TLR2 / 4 - / - souris ont été mises en incubation avec L. pneumophila OMV (0,1 ou 1 ug / ml). CXCL1 la sécrétion a été analysée par ELISA après 24 et 48 h, respectivement. leLes valeurs moyennes ± SEM de trois expériences indépendantes sont montrés. mBMDM des souris WT a répondu par une sécrétion CXCL1 dépendante de la dose , après une incubation de L. pneumophila OMV. TLR2 / 4 - / - mBMDM sécrétées nettement moins CXCL1 par rapport à WT mBMDM, et cette sécrétion n'a pas augmenté dose-dépendante. Statistiques: test de Mann-Whitney; * P <0,05 par rapport au 0 pg / ml d'OMV correspondant; #p <0,05 par rapport à un échantillon WT également traité. Reproduit avec la permission de Référence 20. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
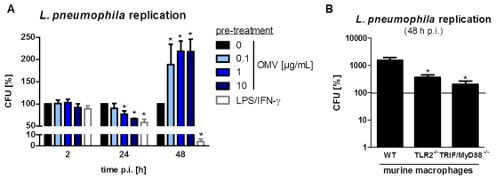
Figure 4: réplication L. pneumophila OMV pré-incubation augmente bactérienne dans les macrophages. (A) Différenciation des cellules THP-1 ont été pré-incubées avec des OMV (0,1, 1 ou 10 μ; G / ml) ou LPS / IFN-γ (200 ng / ml chacun) ou ont été laissées sans traitement pour le contrôle. Après pré-incubation (20 h), les cellules THP-1 ont été infectées par L. pneumophila Corby WT (MOI 0,5) pendant 2, 24 et 48 h, respectivement. Cellules THP-1 ont été lysées par l'addition de la saponine, et les bactéries ont été étalées sur des plaques d'agar BCYE. CFU ont été calculés par rapport à 0 pg / mL OMV après chaque point de temps. Les barres représentent les valeurs moyennes ± ETM de trois expériences indépendantes, chacune réalisée en double techniques. Il n'y avait pas de différence dans l'absorption bactérienne (2 h post-infection (pi)) par comparaison à des cellules non pré-traitées. Des altérations dans la réplication bactérienne ont été déterminées après 24 et 48 h, respectivement. LPS / cellules THP-1 prétraités IFN-γ ont montré une réduction bactérienne charge 24 h pi Ceci a également été observé dose-dépendante des cellules pré-traitées L. pneumophila OMV. Au point de temps plus tard (48 h pi), OMV prétraités cellules THP-1 ont montré un doublement L. pneumophila replicature, tandis que le LPS / macrophages prétraités IFN-y ont montré une réduction supplémentaire de la charge bactérienne. Statistiques: test de Mann-Whitney; * P <0,05 et ** p <0,01 par rapport au 0 pg / ml d'OMV correspondante. (B) mBMDM à partir de souris ayant des antécédents génétiques différents (WT, TLR2 - / - et FTBE / MyD88 - / -) ont été pré-incubées avec 0,1 pg / ml de L. pneumophila OMV pendant 20 heures et ont ensuite été infectées par une flagellin- mutant déficient de L. pneumophila Corby (MOI 0,5) pendant 48 h. mBMDM ont été lysées par l'addition de la saponine et le Legionella ont été étalées sur des plaques d'agar BCYE. CFU ont été calculés par rapport à 0 pg / ml d'OMV, indiqué par la ligne continue. Les barres représentent les valeurs moyennes ±± SEM de trois expériences indépendantes, chacune réalisée en double. mBMDM des souris WT ont montré une augmentation de la réplication de L. pneumophila OMV après le prétraitement. TLR2 - / - macrophages montré une réduction significative La réplication de Legionella, qui est comparable à TRIF / MyD88 - / - mBMDM. Statistiques: test de Mann-Whitney; p <0,05 par rapport à l'échantillon WT. Reproduit avec la permission de Référence 20. S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
Discussion
Les OMV de pathogènes bactériens et l'impact de ces vésicules membranaires sur leurs cellules cibles sont actuellement intensivement étudiés. Par exemple, Clostridium perfringens -derived OMV induisent la sécrétion de cytokines dans les macrophages, les lymphocytes B peuvent être activés par des OMV à partir de Borrelia burgdorferi, et Helicobacter pylori -released vésicules membranaires peuvent agir sur les cellules gastriques epitheliales 21, 22, 23. L. pneumophila, un pathogène intracellulaire qui peut induire une forme grave de pneumonie atypique, libère également OMV qui sont capables d'activer les cellules pulmonaires et les macrophages 16, 19 épithéliales. Ici, nous présentons un protocole détaillé pour l'isolement à petite échelle de L. pneumophila OMV de culture liquide pour étudier le rôle potentiel de l' OMVS dans la pneumonie. Il est essentiel de travailler sous condit stérileions et d'exclure la contamination par d' autres bactéries afin d'obtenir un L. pneumophila pur -derived préparation OMV. L'isolement de l' OMVS comprend une étape de filtration à travers des pores de 0,22 um afin d'éviter la contamination de la pastille OMV obtenue avec L. pneumophila, même si cela réduit le rendement OMV, puisque les plus grands sont perdus par OMV cette étape de filtration.
En outre, nous avons testé la réponse des macrophages humains et murins à ces vésicules isolées et les cellules infectées avec L. pneumophila pour approcher de plus près la situation dans la pneumonie Legionella, où OMV sont libérés à l' intérieur du LCV par des bactéries extracellulaires 15. Les doses employées OMV ont été estimées en fonction de la quantité libre OMV dans une infection des macrophages humains in vitro après 24 h d'incubation (décrits dans la référence 20). Pour la stimulation d'autres cellules réceptrices ou des expériences in vivo,d'autres doses OMV pourraient être nécessaires et doivent être mis en place. L'analyse de l'effet de L. pneumophila OMV représente un progrès le protocole décrit par Jäger et 24 Steinert.
Ici, PMA-différenciés cellules THP-1 servent de modèle pour les macrophages alvéolaires en raison de la disponibilité limitée de matériel humain primaire. L'addition de PMA différencie les monocytaires cellules THP-1 dans des cellules de type macrophage 25. En outre, ils sont une lignée cellulaire modèle bien connu pour L. pneumophila étudie 26. En plus de cette lignée cellulaire monocytaire humaine, les cellules sont utilisées mBMDM. mBMDM sont largement acceptés pour l'étude des effets de L. pneumophila 27, 28, 29. La possibilité d'utiliser KO génétiques pour différents TLR ou d'autres protéines en font un outil précieux pour l'étude des effets OMV. En ordre à réduire la quantité de souris par expérience, mBMDM sont utilisés au lieu des macrophages alvéolaires en raison des limitations des macrophages. expériences clés peuvent nécessiter des macrophages alvéolaires pour validation.
Outre le protocole décrit ici d' une ultracentrifugation pour purifier les OMV, il est possible de réaliser une centrifugation à gradient de densité, qui est inclus dans le protocole par Chutkan et al. 30. Cela pourrait améliorer la pureté de la préparation obtenue OMV et réduire la quantité d'agrégats de co-purifié les protéines, la flagelline, et LPS. La pureté de la préparation d'OMV obtenu peut être analysé par microscopie électronique à transmission ou par analyse de suivi nanoparticule comme une étape supplémentaire dans le contrôle de la qualité. Ceci peut fournir un moyen supplémentaire de quantification au-delà de la procédure de mesure des protéines présentées ici. Éventuellement, la concentration en LPS peut être analysée par un test de lysat Limulus amébocyte. Si le rendement OMV est faible, unl'étape supplémentaire de concentration par des filtres centrifuges pourrait être réalisée, ce qui n'a pas été fait ici. Si le rendement est plus faible que prévu, les OMV ont été rejetées.
Dans le cadre de l'effort continu visant à élucider les mécanismes biologiques et les fonctions derrière OMV, l'influence des différentes conditions de stress sur la production OMV pourrait être testé. La privation des éléments nutritifs, les changements de température d'incubation, ou l' exposition à des agents nocifs pourrait avoir un impact sur la sécrétion 31 OMV. Conditions de stress possibles sont discutées dans le protocole par Klimentova et Stulik 32. En outre, les mutants hyper- ou hypovesiculating L. pneumophila pourraient être générés. Les différentes préparations d' OMV pourraient ensuite être analysés dans des expériences d'infection avec des macrophages, des explants de tissus de poumon humain (décrit dans la référence 17), ou même dans des modèles in vivo. Outre le rôle de l'OMVS dans la signalisation immunitaire innée, leur influence dans la communication bactériennepeuvent être traités expérimentalement. En outre, l'impact des différentes cascades de signalisation immunitaire innée pourrait être analysé par l'utilisation de cellules knockout murins ou la génération de CRISPR KO / cas9 dans des lignées cellulaires humaines. Cette recherche fondamentale en OMVS aider à l'élaboration de nouvelles stratégies de vaccination, qui existent déjà pour la méningite B transmise par Neisseria meningitidis 33.
A partir du protocole sur OMV isolement et la caractérisation, on peut l'appliquer à d'autres bactéries gram-négatives et d'autres cellules hôtes; il doit seulement être adaptée à la croissance des bactéries dans une culture liquide. Le protocole publié par Chutkan et al. fournit des informations détaillées sur la production d'OMV à partir d' Escherichia coli et Pseudomonas aeruginosa 30. La culture ne doit pas atteindre la phase stationnaire tardive afin d'éviter l'augmentation des bactéries lysées et les protéines contaminantes et membranes. En outre, la dose OMV utilisée pour la stimulation des cellules hôtes doit être déterminé en fonction du montant de l' OMVS présente au cours des infections in vivo, tout en assurant un taux de cytotoxicité faible. De cette façon, le rôle pathologique de l'OMVS, leur impact sur la communication inter-espèces, et les interactions hôte-pathogène pourrait être examinée.
Pour étudier davantage le rôle de L. pneumophila OMVS pneumonie, des préparations normalisées OMV avec des rendements et des expériences d'infection comparables suffisantes sont nécessaires. Ce protocole contribuera à normaliser les procédures d'isolement et d'étendre les études OMV à d'autres bactéries Gram-négatives et à d'autres cellules hôtes. En outre, la recherche bénéficiera de la fiche détaillée de la connaissance in vitro, qui peut être utilisé pour étendre les expériences aux paramètres in vivo. À l'avenir, ce protocole pourrait être étendu à l'isolement de l'OMVS de matériel biologique primaire, tels que le sérum ou le lav bronchoalvéolairefluide d'âge, pour mieux comprendre dans la composition de l'OMVS libéré dans des conditions physiologiques. Cela aidera à déterminer les paramètres clés de la composition OMV et de comprendre les propriétés de l' OMVS -generated in vitro.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
Nous remercions Prof. Dr. Markus Schnare pour nous offrir un TLR2 - / - et TLR2 / 4 - / - souris et Prof. Dr. Carsten Kirschning pour TRIF / MyD88 - / - souris. Certaines parties de ce travail a été financé par Bundesministerium für Bildung und Forschung (e: miRSys bio - FKZ 0316175B, e: Med CAPSYS - FKZ 01X1304E; http://www.bmbf.de/), Deutsche Forschungsgemeinschaft (SFB / TR-84; http://www.sfb-tr84.de/) et Hessisches Ministerium für Wissenschaft und Kunst (LOEWE RNomique médicaux - FKZ 519/03 / 00.001- (0003); http://www.proloewe.de/medicalrnomics), tous BS.
matériels
| Name | Company | Catalog Number | Comments |
| 10 cm Petri dish | Sarstedt AG & Co KG (Nuembrecht, Germany) | 82.1473 | |
| 70 Ti rotor | Beckman Coulter Incorporation (California, USA) | 337922 | |
| ACES | Carl Roth GmbH & Co KG (Karlsruhe, Germany) | 9138.2 | |
| activated charcoal | Carl Roth GmbH & Co KG (Karlsruhe, Germany) | X865.2 | |
| agar-agar, Kobe I | Carl Roth GmbH & Co KG (Karlsruhe, Germany) | 5210.2 | |
| Columbia agar with 5% sheep blood | Becton Dickinson GmbH (Heidelberg, Germany) | 254005 | |
| cuvettes | Sarstedt AG & Co KG (Nuembrecht, Germany) | 67.742 | |
| ELISA (human) | BD OptEIA™; Becton Dickinson GmbH (Heidelberg, Germany) | IL-8: 555244 IL-6: 550799 | |
| ELISA (murine) | DuoSet, R&D (Minneapolis, USA) | CXCL1: DY453-05 | |
| Fe(NO3)3x9H2O | Carl Roth GmbH & Co KG (Karlsruhe, Germany) | 5632.1 | |
| Fetal calf serum (FCS) | Life Technologies GmbH (Darmstadt, Germany) | 10270-106 | |
| Heracell 240i CO2 incubator | Thermo Fisher Scientific Germany BV & Co KG (Braunschweig, Germany) | 40830469 | |
| Heraeus Multifuge X3R | Thermo Fisher Scientific Germany BV & Co KG (Braunschweig, Germany) | 75004515 | |
| Inoculation loop | Sarstedt AG & Co KG (Nuembrecht, Germany) | 86.1567.010 | |
| KOH | Carl Roth GmbH & Co KG (Karlsruhe, Germany) | 6751.1 | |
| L. pneumophila Corby | --- | --- | kindly provided by Prof Dr Antje Flieger (RKI, Berlin, Germany) |
| L. pneumophila Corby ΔflaA | --- | --- | kindly provided by Prof Dr Klaus Heuner (RKI, Berlin, Germany) |
| L-cystein | Carl Roth GmbH & Co KG (Karlsruhe, Germany) | ||
| mBMDM | --- | --- | kindly provided by Prof Dr Markus Schnare (Philipps Univeristy Marburg, Marburg, Germany) and Prof Dr Carsten Kirschning (University Duisburg Essen, Essen, Germany) |
| PBS | Biochrom GmbH (Berlin, Germany) | L 1825 | |
| phorbol 12-myristate 13-acetate | Sigma-Aldrich Chemie GmbH (Taufkirchen, Germany) | P8139-1MG | |
| rotating shaker (MaxQ 6000) | Thermo Fisher Scientific Germany BV & Co KG (Braunschweig, Germany) | SHKE6000 | |
| RPMI 1640 high glucose | Life Technologies GmbH (Darmstadt, Germany) | 11875-093 | |
| saponin | Carl Roth GmbH & Co KG (Karlsruhe, Germany) | 9622.1 | |
| Ultrospec 10 | Biochrom Ltd (Cambridge, England) | 80-2116-30 | |
| sterile filter (pore size: 0.22 µm) | Corning Incorporated (new York, USA) | 431096 | |
| THP-1 | Sigma-Aldrich Chemie GmbH (Taufkirchen, Germany) | 88081201-1VL | |
| Sorvall Discovery 100 SE | Thermo Fisher Scientific Germany BV & Co KG (Braunschweig, Germany) | ||
| yeast extract | Carl Roth GmbH & Co KG (Karlsruhe, Germany) | 2363.2 | |
| Pierce BCA protein assay kit | Thermo Fisher Scientific Germany BV & Co KG (Braunschweig, Germany) | 23225 |
Références
- Cambronne, E. D., Roy, C. R. Recognition and delivery of effector proteins into eukaryotic cells by bacterial secretion systems. Traffic. 7 (8), 929-939 (2006).
- Ellis, T. N., Kuehn, M. J. Virulence and immunomodulatory roles of bacterial outer membrane vesicles. Microbiol Mol Biol Rev. 74 (1), 81-94 (2010).
- Beveridge, T. J. Structures of gram-negative cell walls and their derived membrane vesicles. J Bacteriol. 181 (16), 4725-4733 (1999).
- Kuehn, M. J., Kesty, N. C. Bacterial outer membrane vesicles and the host-pathogen interaction. Genes Dev. 19 (22), 2645-2655 (2005).
- Chi, B., Qi, M., Kuramitsu, H. K. Role of dentilisin in Treponema denticola epithelial cell layer penetration. Res Microbiol. 154 (9), 637-643 (2003).
- Kolling, G. L., Matthews, K. R. Export of virulence genes and Shiga toxin by membrane vesicles of Escherichia coli O157:H7. Appl Environ Microbiol. 65 (5), 1843-1848 (1999).
- Horstman, A. L., Kuehn, M. J. Enterotoxigenic Escherichia coli secretes active heat-labile enterotoxin via outer membrane vesicles. J Biol Chem. 275 (17), 12489-12496 (2000).
- Dorward, D. W., Schwan, T. G., Garon, C. F. Immune capture and detection of Borrelia burgdorferi antigens in urine, blood, or tissues from infected ticks, mice, dogs, and humans. J Clin Microbiol. 29 (6), 1162-1170 (1991).
- Mashburn, L. M., Whiteley, M. Membrane vesicles traffic signals and facilitate group activities in a prokaryote. Nature. 437 (7057), 422-425 (2005).
- Kesty, N. C., Mason, K. M., Reedy, M., Miller, S. E., Kuehn, M. J. Enterotoxigenic Escherichia coli vesicles target toxin delivery into mammalian cells. EMBO J. 23 (23), 4538-4549 (2004).
- Abu Kwaik, Y., Gao, L. Y., Stone, B. J., Venkataraman, C., Harb, O. S. Invasion of protozoa by Legionella pneumophila and its role in bacterial ecology and pathogenesis. Appl Environ Microbiol. 64, 3127-3133 (1998).
- Winn, W. C., Myerowitz, R. L. The pathology of the Legionella pneumonias. A review of 74 cases and the literature. Hum Pathol. 12 (5), 401-422 (1981).
- Ge, J., Shao, F. Manipulation of host vesicular trafficking and innate immune defence by Legionella Dot/Icm effectors. Cell Microbiol. 13 (12), 1870-1880 (2011).
- Hubber, A., Roy, C. R. Modulation of host cell function by Legionella pneumophila type IV effectors. Annu Rev Cell Dev Biol. 26, 261-283 (2010).
- Fernandez-Moreira, E., Helbig, J. H., Swanson, M. S. Membrane vesicles shed by Legionella pneumophila inhibit fusion of phagosomes with lysosomes. Infect Immun. 74 (6), 3285-3295 (2006).
- Galka, F., et al. Proteomic characterization of the whole secretome of Legionella pneumophila and functional analysis of outer membrane vesicles. Infect Immun. 76 (5), 1825-1836 (2008).
- Jager, J., et al. Human lung tissue explants reveal novel interactions during Legionella pneumophila infections. Infect Immun. 82 (1), 275-285 (2014).
- Ellis, T. N., Leiman, S. A., Kuehn, M. J. Naturally produced outer membrane vesicles from Pseudomonas aeruginosa elicit a potent innate immune response via combined sensing of both lipopolysaccharide and protein components. Infect Immun. 78 (9), 3822-3831 (2010).
- Jager, J., Keese, S., Roessle, M., Steinert, M., Schromm, A. B. Fusion of Legionella pneumophila outer membrane vesicles with eukaryotic membrane systems is a mechanism to deliver pathogen factors to host cell membranes. Cell Microbiol. , (2014).
- Jung, A. L., et al. Legionella pneumophila-Derived Outer Membrane Vesicles Promote Bacterial Replication in Macrophages. PLoS Pathog. 12 (4), (2016).
- Jiang, Y., Kong, Q., Roland, K. L., Curtiss, R. Membrane vesicles of Clostridium perfringens type A strains induce innate and adaptive immunity. Int J Med Microbiol. 304 (3-4), 431-443 (2014).
- Whitmire, W. M., Garon, C. F. Specific and nonspecific responses of murine B cells to membrane blebs of Borrelia burgdorferi. Infect Immun. 61 (4), 1460-1467 (1993).
- Ismail, S., Hampton, M. B., Keenan, J. I. Helicobacter pylori outer membrane vesicles modulate proliferation and interleukin-8 production by gastric epithelial cells. Infect Immun. 71 (10), 5670-5675 (2003).
- Jager, J., Steinert, M. Enrichment of outer membrane vesicles shed by Legionella pneumophila. Methods Mol Biol. 954, 225-230 (2013).
- Park, E. K., et al. Optimized THP-1 differentiation is required for the detection of responses to weak stimuli. Inflamm Res. 56 (1), 45-50 (2007).
- Casson, C. N., et al. Human caspase-4 mediates noncanonical inflammasome activation against gram-negative bacterial pathogens. Proc Natl Acad Sci U S A. 112 (21), 6688-6693 (2015).
- Molofsky, A. B., Shetron-Rama, L. M., Swanson, M. S. Components of the Legionella pneumophila flagellar regulon contribute to multiple virulence traits, including lysosome avoidance and macrophage death. Infect Immun. 73 (9), 5720-5734 (2005).
- Isaac, D. T., Laguna, R. K., Valtz, N., Isberg, R. R. MavN is a Legionella pneumophila vacuole-associated protein required for efficient iron acquisition during intracellular growth. Proc Natl Acad Sci U S A. 112 (37), 5208-5217 (2015).
- Zhu, W., et al. Sensing cytosolic RpsL by macrophages induces lysosomal cell death and termination of bacterial infection. PLoS Pathog. 11 (3), 1004704 (2015).
- Chutkan, H., Macdonald, I., Manning, A., Kuehn, M. J. Quantitative and qualitative preparations of bacterial outer membrane vesicles. Methods Mol Biol. 966, 259-272 (2013).
- Macdonald, I. A., Kuehn, M. J. Stress-induced outer membrane vesicle production by Pseudomonas aeruginosa. J Bacteriol. 195 (13), 2971-2981 (2013).
- Klimentova, J., Stulik, J. Methods of isolation and purification of outer membrane vesicles from gram-negative bacteria. Microbiol Res. 170, 1-9 (2015).
- . Novartis.com Available from: https://www.novartis.com/news/media-releases/novartis-bexsero%C2%AE-vaccine-approved-fda-prevention-meningitis-b-leading-cause (2016)
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon