Method Article
Легионелл везикул наружной мембраны: Выделение и анализ их провоспалительного потенциала на макрофагах
В этой статье
Резюме
Здесь мы опишем очистку легионелл (L. pneumophila) везикул наружной мембраны (OMV , ) из жидких культур. Эти очищенные везикулы затем используются для лечения макрофагов, чтобы проанализировать их провоспалительного потенциала.
Аннотация
Bacteria are able to secrete a variety of molecules via various secretory systems. Besides the secretion of molecules into the extracellular space or directly into another cell, Gram-negative bacteria can also form outer membrane vesicles (OMVs). These membrane vesicles can deliver their cargo over long distances, and the cargo is protected from degradation by proteases and nucleases.
Legionella pneumophila (L. pneumophila) is an intracellular, Gram-negative pathogen that causes a severe form of pneumonia. In humans, it infects alveolar macrophages, where it blocks lysosomal degradation and forms a specialized replication vacuole. Moreover, L. pneumophila produces OMVs under various growth conditions. To understand the role of OMVs in the infection process of human macrophages, we set up a protocol to purify bacterial membrane vesicles from liquid culture. The method is based on differential ultracentrifugation. The enriched OMVs were subsequently analyzed with regard to their protein and lipopolysaccharide (LPS) amount and were then used for the treatment of a human monocytic cell line or murine bone marrow-derived macrophages. The pro-inflammatory responses of those cells were analyzed by enzyme-linked immunosorbent assay. Furthermore, alterations in a subsequent infection were analyzed. To this end, the bacterial replication of L. pneumophila in macrophages was studied by colony-forming unit assays.
Here, we describe a detailed protocol for the purification of L. pneumophila OMVs from liquid culture by ultracentrifugation and for the downstream analysis of their pro-inflammatory potential on macrophages.
Введение
Бактерии могут секретировать факторы вирулентности с помощью различных механизмов 1. Помимо хорошо известных секреторных систем, грамотрицательные бактерии могут обмениваться информацией и доставлять факторы вирулентности через везикул наружной мембраны (OMV уровень), которые являются небольшими, сфероида везикулы 10-300 нм в диаметре и с двухслойных мембранной структурой. Они секретируются в различных средах роста (жидкая культура, тверда культура и биопленки) и во всех фазах роста 2, 3. OMV , являются важным средством передвижения (например, для белков, адгезинов, токсинов и ферментов, а также для LPS, который находится на поверхности OMV) 4. Внутриполостной груз защищен от протеолитической деградации, так что он способен действовать на большие расстояния, и везикулы можно найти в биологических жидкостях и отдаленных органах 5, 6,"Xref"> 7, 8. Они не могут быть признаны только и поглощается эукариотических клеток 9, 10, но , кроме того, они способны облегчить связывание бактерий и их вторжения в клетки - хозяева 4. Легионелл (L. pneumophila) является грамотрицательная бактерия , которая может освободить OMV уровень . В легких человека, он в первую очередь поражает альвеолярными макрофагами, хотя ее естественный хозяин пресноводные амебы 11. Pneumophila инфекция L. может вызвать болезнь легионеров, тяжелая форма пневмонии 12. Он блокирует фагосоме-лизосом слитый в клетке-хозяине. Он также вербует принимающих органелл, в результате чего ниша репликации, Legionella катио- вакуоль (LCV), образуется 13, 14. деградация Лизосомные тормозится не только эффекторные белка TRAnslocation через систему секреции типа IV, но и выпуском OMV , 15.
Очистка OMV, от бактериальных культур требуется проанализировать их влияние на клетки-реципиенты. Более ранние исследования были сосредоточены на содержание белка L. pneumophila OMV , и о влиянии везикул на альвеолярных эпителиальных клетках 16, но позже исследования с трансплантатами человеческой легочной ткани показало , что L. pneumophila OMVS поглощаются альвеолярными макрофагами 17.
Как OMV уровень нынешних молекулярных моделей патоген-ассоциированных (PAMPs) и другие бактериальные антигены, они могут оказывать воздействие на инфекцию эукариотических клеток и модулировать иммунный ответ на 18 - хозяина. L. pneumophila OMVS быстро сливаться с клеточными мембранами хозяина и, кроме того, они активируют перепончатый TLR2 19. Как известно , что Л. pneumophILA OMVS стимулируют макрофаги и эпителиальные клетки в провоспалительных образом 16, 17, мы проанализировали влияние OMV , на инфекционный процесс в человеческих и мышиных макрофагов.
Здесь мы опишем протокол для культивирования L. pneumophila в жидкой культуре , чтобы изолировать секретируемый OMVS с помощью дифференциального ультрацентрифугирования и для оценки влияния везикул на эукариотических клеток - хозяев, либо непосредственно или после инфекции.
протокол
1. Подготовьте средние и чашки с агаром
- Готовят 1 л среды с бульоном (Йеб). Растворить 10 г Тузы и 10 г дрожжевого экстракта в 900 мл дистиллированной воды. Доводят рН до 6,9 с помощью КОН (5 N). Добавить 10 мл раствора L-цистеина (0,4 г в 10 мл дистиллированной воды) и 10 мл Fe (NO 3) 3 x9H 2 O (0,25 г в 10 мл дистиллированной воды). Наполните до 1 л дистиллированной водой и фильтр стерилизуют (размер пор: 0,22 мкм) раствор. Хранить при температуре 4 ° С.
- Приготовьте буферный древесный уголь дрожжевой экстракт (BCYE) агар пластин. Растворить 10 г Тузы и 10 г дрожжевого экстракта в 900 мл дистиллированной воды. Доводят рН до 6,9 с помощью КОН (5 N). Добавьте 15 г агара и 2,5 г активированного угля. Наполните до 1 л дистиллированной водой и автоклаве.
- Добавить 10 мл раствора L-цистеина (0,4 г в 10 мл дистиллированной воды) и 10 мл Fe (NO 3) 3 x9H 2 O (0,25 г в 10 мл дистиллированной воды, и стерилизуют фильтрацией через 0,22 мкмпоры) к охлажденному BCYE (приблизительно 50 ° C). Налейте пластины и хранить при температуре 4 ° С.
2. Развивайте L. pneumophila
- Spread L. pneumophila штамм Corby (дикого типа, WT) на чашках с агаром BCYE и инкубировать их при 37 ° С в течение 3 -х дней. Привить 10 мл Yeb при OD 600 = 0,3 с L. pneumophila из предкультуральной пластины; инкубировать бактерии при 37 ° С на ротационном шейкере (150 оборотов в минуту) в течение 6 ч.
- Проверьте чистоту жидкой культуры путем распространения 100 мкл суспензии на кровяным агаром. Инкубируют в течение ночи при температуре 37 ° С.
- Добавьте оставшуюся жидкую культуру на 90 мл свежей среды Йеб и инкубировать на ротационном вибраторе (37 ° C и 150 оборотов в минуту) , чтобы достичь OD 600 3,0-3,5, который занимает примерно 16-20 ч.
3. Подготовить и Количественная L. pneumophila OMVS
ПРИМЕЧАНИЕ: Выполните все следующие стадии центрифугированияs в стерильных условиях и при 4 ° С.
- Центрифуга жидкой культуры при 4000 х г в течение 20 мин для осаждения бактерий. Передача супернатант в свежих центрифужные пробирки, выбросьте бактериальных гранул, и повторяют центрифугирование (4000 мкг в течение 20 мин). Повторите этот шаг один раз.
- Стерильный фильтр оставшиеся супернатант дважды (размер пор: 0,22 мкм). Перенести без бактерий супернатант в ультрацентрифуге трубок и ультрацентрифуге при 100000 х г в течение 3 ч.
- Слейте супернатант и выбросьте его. Ресуспендируют осадок OMV в стерильном фосфатно-солевом буферном растворе (PBS) и ультрацентрифуге (100000 х г в течение 3 ч), чтобы удалить примесные белки и LPS.
- Жидкость над осадком сливают и вновь суспендируют таблетку OMV в 500 мкл стерильной PBS. Серия 20 мкл на кровяным агаром и на чашки с агаром BCYE, чтобы исключить бактериальное загрязнение подготовленных везикул. Выдержите кровяным агаром в течение ночи и BCYE агаризованной в течение 3 дней (как на 376; С).
- Количественно количество белка, полученного из препарата OMV с использованием анализа бицинхониновой кислоты в соответствии с инструкциями изготовителя.
Примечание: Концентрация 100 мл L. pneumophila культуры, как правило , 1 мкг / мкл. Храните подготовленные и количественные OMVS при -20 ° С.
4. Предварительная обработка Макрофаги
- Подготовка клеток ТНР-1.
Примечание: ТНР-1 представляет собой клеточной линии моноцитов получена от пациента лейкемии.- Добавить 2x10 5 ТНР-1 клеток в 24 - луночных планшетах и дифференцировать их добавлением 20 нМ форболовыми 12-миристат - 13-ацетата (PMA) в макрофаг-подобных клеток. Инкубировать в течение 24 ч при 37 ° С.
- Заменить среду с 500 мкл свежей среды, и инкубируют в течение еще 24 ч; оптимальная среда для клеток ТНР-1 состоит из среды RPMI 1640, высоким содержанием глюкозы с добавлением 10% фетальной сыворотки теленка.
- Изолировать мышиным из костного мозга макрофаги (mBMDM), как описано в смEnce 20.
- Лечить ТНР-1-производные макрофаги или mBMDM с OMV,.
- Растаяйте OMV уровень, полученный на стадии 3, и добавить их в соответствии с их количеством белка (0,1, 1 и 10 мкг / мл) человеку или мышиных макрофагов. Инкубируйте макрофаги с OMV, при 37 ° С в течение по меньшей мере 20 ч. Используйте супернатант для ELISA или перейти к шагу 5.
5. инфицировать макрофаги и оценку Бактериальный репликации с колониеобразующих единица (КОЕ) Анализ
- Используйте L. pneumophila из шага 2.1, предварительно обработанных клеток ТНР-1 или mBMDM с шага 4.3, а не предварительно обработанные макрофаги в качестве контрольной группы (2x10 5/24 скважины). Не меняйте среду.
- Заражайте ТНР-1 клеток с L. pneumophila Corby WT и mBMDM с флагеллина-мутанта отсутствует L. pneumophila Corby (оба с множественностью заражения (MOI) 0,5; 1x10 5 L. pneumophila / 24 скважины) и инкубировать в течение 24 лет и 48 ч соответственно. Приготовьте бой Л. pneumophila Corby (WT или флагеллином-мутант не хватает) , как описано на стадии 2.1.
- Лизиса клеток в их среде путем добавления сапонина (конечная концентрация: 0,1%) и инкубируют при температуре 37 ° С в течение 5 мин.
- Ресуспендируют бактерии пипеткой и переносят суспензии в реакционный сосуд. Готовят серийные разведения pneumophila L. -содержащий СМИ в стерильной PBS.
- Серия 50 мкл требуемых разведений на чашки с агаром BCYE и инкубировать в течение 3-х дней при 37 ° С.
- Визуально считать образовавшиеся колонии. Вычислить КОЕ
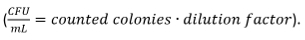 Нормализация КОЕ подсчета результата не предварительно обработаны, но инфицированные макрофаги, которые установлены на 100%.
Нормализация КОЕ подсчета результата не предварительно обработаны, но инфицированные макрофаги, которые установлены на 100%.
Результаты
Экспериментальная установка для подготовки L. pneumophila OMVS и проанализировать их влияние на про-воспалительной реакции макрофагов после инфекции показана на рисунке 1. Провоспалительных потенциал подготовленных OMV , могут быть проанализированы на РМА-дифференцированных клеток ТНР-1, которая показана на рисунке 2. Клетки ТНР-1 реагирует с затрат времени и зависимости от дозы увеличение ИЛ-8 и IL-6 секреции. Кроме того, влияние различных TLRs на признании L. pneumophila OMV можно анализировать с помощью mBMDM из разных генетических фонов, как они были представлены в CXCL1 ELISA на рисунке 3. mBMDM от мышей WT секретируемых CXCL1 после OMV стимуляции, в то время как mBMDM TLR2 / 4 - / - секретируется значительно меньше. Для того, чтобы изучить влияние L. pneumophila OMV , на бактериальной репликации в THP-1 макрофагами, клетки предварительно инкубировали с OMV , а затем дополнительно инфицированныхс Л. pneumophila (Рисунок 4 А). Предварительное стимулирование ТНР-1, полученных из макрофагов первых снижает бактериальную репликацию через 24 часа после заражения, но это приводит к удвоению КОЕ рассчитывать на более поздний момент времени (48 ч Pi). Влияние Toll-подобных рецепторов (TLR) сигнализации о признании OMV после инфицирования макрофагов может быть оценена с помощью mBMDM, как представлено на рисунке 4 B. Бактериальные увеличивается в десять раз по репликации в mBMDM от WT животных после OMV предварительной инкубации, в то время как TLR2 - / - и TRIF / MyD88 - / - клетки не показывают это увеличение репликации pneumophila L..
Рисунок 1: Экспериментальная процедура. (А) Л. pneumophila Corby WT из 10-см BCYE агаром используют для инокуляции небольшой жидкой культуры (10 мл), который передается в 90 мл свежего Йебсреда через 6 ч. Небольшой объем также высевают на кровяным агаром, чтобы проверить на чистоту. Бактерии инкубируют при 37 ° С до ранней стационарной фазы (OD 600 = 3,0-3,5). (В) Жидкую культуру центрифугируют и стерильно фильтруют , чтобы удалить бактерии. -бесплатно Супернатант легионелл затем ультрацентрифуге , чтобы получить осадок OMV, который ресуспендировали в PBS и снова ультрацентрифуге. Выделенные везикулы повторно суспендируют, проверяют на чистоту, и количественно оценивали по количеству белка. Шкалы составляет 2,5 см. (C) человека или мышиные макрофаги стимулируются с количественными OMV , . Супернатант клеточной культуры могут быть использованы для ELISA, или макрофаги могут быть заражены L. pneumophila для определения бактериальной репликации путем CFU анализа на 10 см BCYE чашках с агаром. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
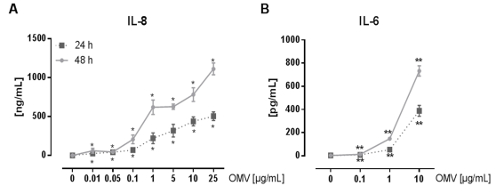
Рисунок 2: Pro-воспалительная активация клеток ТНР-1 Л. pneumophila OMV , . (А) Здесь моноцитарного ТНР-1 клеточную линию используют в качестве модели для альвеолярных макрофагов. Клетки РМА-дифференцированных ТНР-1 обрабатывали возрастающими дозами L. pneumophila OMV , (0.01-25 мкг / мл) в течение 24 и 48 ч соответственно. Бесклеточный супернатант использовали для IL-8 ELISA. Средние значения трех независимых экспериментов ± SEM показаны. Клетки ТНР-1 ответ на всего лишь 0,01 мкг / мл L. pneumophila OMV уровень со значительным секреции IL-8, который был по времени и в зависимости от дозы. (Б) Л. pneumophila OMVS (0,1-10 мкг / мл) , были использованы для стимуляции РМА-дифференцированных клеток ТНР-1. Супернатант собирали через 24 и 48 часов инкубации, и измеряли выпустили ИЛ-6 в супернатанте с помощью ELISA, Средние значения трех независимых экспериментов ± SEM показаны. Клетки ТНР-1, секретируемые значительные количества IL-6, даже при самой низкой дозе OMV уровень (0,1 мкг / мл). Секрецию IL-6 увеличивается с увеличением дозы OMV и при длительном времени инкубации. Статистика: тест Манна-Уитни; * Р <0,05 и ** р <0,01 по сравнению с соответствующим 0 мкг / мл OMV. Печатается с разрешения Reference 20. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
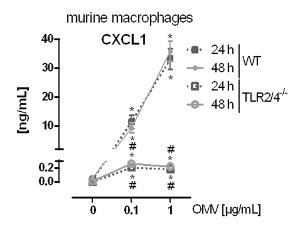
Рисунок 3: провоспалительного активации макрофагов зависит от TLR2 / 4. mBMDM от WT и TLR2 / 4 - / - мышей, инкубировали с L. pneumophila OMV уровень (0,1 или 1 мкг / мл). Секреция CXCL1 анализировали с помощью ELISA через 24 и 48 ч соответственно.средние значения ± SEM трех независимых экспериментов. mBMDM от WT мышей ответили секреции CXCL1 дозозависимым после L. pneumophila OMV инкубации. TLR2 / 4 - / - mBMDM секретируется значительно меньше CXCL1 по сравнению с WT mBMDM, и этот секрет не увеличивалась в зависимости от дозы. Статистика: тест Манна-Уитни; * Р <0,05 по сравнению с соответствующим 0 мкг / мл OMV; #p <0,05 по сравнению с одинаково обработанной пробы WT. Печатается с разрешения Reference 20. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Рисунок 4: L. pneumophila OMV Прединкубационная увеличивается бактериальной репликации в макрофагах. (А) Дифференцированный ТНР-1 клетки предварительно инкубировали с OMV уровень (0,1, 1 или 10 μ; Г / мл) или LPS / IFN-γ (200 нг / мл каждый), или оставить без лечения для контроля. После предварительной инкубации (20 ч), клетки ТНР-1 были заражены L. pneumophila Corby WT (MOI 0,5) в течение 2, 24 и 48 ч соответственно. Клетки ТНР-1 лизируют добавлением сапонина, а бактерии высевали на чашки с агаром BCYE. КОЕ были рассчитаны по отношению к 0 мкг / мл OMV после каждой временной точки. Столбики представляют средние значения ± SEM трех независимых экспериментов, каждый из которых проводили в технических дублей. Там не было никаких различий в бактериальном поглощения (2 ч после инфицирования (пи)) по сравнению с предварительно не обработанных клеток. Изменения в бактериальной репликации определяли через 24 и 48 ч соответственно. LPS / IFN-γ , предварительно обработанных клеток ТНР-1 показали снижение бактериальной нагрузки 24 ч пи Это было обнаружено также дозозависимо для L. pneumophila OMV предварительно обработанных клеток. В более поздний момент времени (48 ч Pi), OMV предварительно обработанные клетки ТНР-1 показал удвоение L. pneumophila репликация, тогда как LPS / IFN-gamma предварительно обработанных макрофагах показали дальнейшее снижение бактериальной нагрузки. Статистика: тест Манна-Уитни; * Р <0,05 и ** р <0,01 по сравнению с соответствующим 0 мкг / мл OMV. (В) mBMDM от мышей с различными генетическими фонов (WT, TLR2 - / -, и TRIF / MyD88 - / -) предварительно инкубировали с 0,1 мкг / мл L. pneumophila OMV уровень в течение 20 ч , а затем инфицировали flagellin- дефицитный мутантный L. pneumophila Corby (MOI 0,5) в течение 48 ч. mBMDM лизировали добавлением сапонина, а легионелл высевали на чашки с агаром BCYE. КОЕ были рассчитаны по отношению к 0 мкг / мл OMV, обозначенное сплошной линией. Столбики представляют средние значения ±± SEM трех независимых экспериментов, каждый из которых проводили в двух экземплярах. mBMDM от WT мышей показали увеличение репликации pneumophila L. после OMV предварительной обработки. TLR2 - / - макрофаги показали значительно снижается Legionella репликации, которая была сравнима с TRIF / MyD88 - / - mBMDM. Статистика: тест Манна-Уитни; р <0,05 по сравнению с образцом WT. Печатается с разрешения Reference 20. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
В OMVS бактериальных патогенов и влияния этих мембранных везикул на их клетки-мишени в настоящее время интенсивно изучаются. Например, Clostridium Perfringens -derived OMVS индуцировать секрецию цитокинов в макрофагах, В - лимфоциты могут быть активированы с помощью OMV , от Borrelia burgdorferi, и Helicobacter Pylori -released мембранные везикулы могут действовать на эпителиальных клеток желудка 21, 22, 23. L. pneumophila, внутриклеточным патогеном , который может вызвать тяжелую форму атипичной пневмонии, также выпускает OMVS, которые способны активировать легких эпителиальные клетки и макрофаги 16, 19. Здесь мы представляем подробный протокол для малой изоляции L. pneumophila OMV , из жидкой культуры для изучения потенциальной роли OMV , при пневмонии. Крайне важно, чтобы работать в стерильных Conditионы и , чтобы исключить загрязнение от других бактерий , с тем , чтобы получить чистый L. pneumophila -derived препарат OMV. Изоляция OMV уровень включает стадию фильтрации через поры 0,22 мкм , с тем , чтобы предотвратить загрязнение полученного OMV окатышей с L. pneumophila, хотя это снижает выход OMV, так как большая OMVS теряются при этом стадии фильтрации.
Кроме того, мы проверили реакцию человека и мышиных макрофагов к этим изолированных везикул и инфицированных клеток с L. pneumophila более тесно приближают ситуацию в Legionella пневмонии, где OMV , высвобождаются внутри LCV внеклеточными бактериями 15. Подсчитано Используемые дозы OMV имеют в соответствии с количеством свободного OMV в инфекции в пробирке макрофагах человека после 24 ч инкубации ( как описано в Сравнительном 20). Для стимуляции других клеток реципиента или в экспериментах естественных условиях,другие дозы OMV могут быть необходимы и должны быть установлены. Анализ влияния L. pneumophila OMV , представляет собой продвижение к протоколу , описанному Jager и Steinert 24.
Здесь РМА-дифференцированные клетки ТНР-1 служат в качестве модели для альвеолярных макрофагов из-за ограниченной доступности первичного человеческого материала. Добавление РМА отличает моноцитов ТНР-1 в макрофаг-подобных клеток 25. Кроме того, они хорошо известная клеточная линия модель для L. pneumophila исследования 26. Помимо этой человеческой линии моноцитов клеток, используются клетки mBMDM. mBMDM широко приняты для изучения эффектов L. pneumophila 27, 28, 29. Показана возможность использования генетических нокаутов для различных TLRs или других белков делает их ценным инструментом для изучения эффектов OMV. В Ordэр, чтобы снизить количество мышей на эксперимент, mBMDM используются вместо альвеолярных макрофагов из-за ограничений макрофагов. Ключевые эксперименты могут потребовать альвеолярные макрофаги для проверки.
Кроме того, в данном документе описанный протокол ультрацентрифугирования для очистки OMVS, можно выполнить центрифугирования в градиенте плотности, который включен в протокол по Chutkan соавт. 30. Это может улучшить чистоту полученного препарата OMV и уменьшить количество коинтегри- очищено белковых агрегатов, флагеллином и LPS. Чистота полученного препарата OMV можно анализировать с помощью просвечивающей электронной микроскопии или путем анализа наночастицами отслеживания в качестве дополнительного шага в области контроля качества. Это может обеспечить дополнительные средства количественной оценки, помимо процедуры измерения белка, представленного здесь. Необязательно, концентрация LPS, могут быть проанализированы с помощью теста с лизатом Лаймулус амебоцит. Если выход OMV низкий,дополнительная стадия концентрирования с помощью центробежных фильтров могут быть выполнены, что не было сделано здесь. Если доходность была ниже, чем ожидалось, были отброшены в OMVS.
В рамках продолжающихся усилий по выяснению биологических механизмов и функций позади OMV, влияние различных стрессовых условиях на производстве OMV может быть проверена. Питательные лишение, изменения температуры инкубации, или воздействие вредных веществ может оказать влияние на секрецию OMV 31. Возможные стрессовые условия обсуждаются в протоколе по Klimentová и Стулик 32. Кроме того, гипер- или hypovesiculating pneumophila мутанты L. могли быть получены. Различные препараты OMV могут быть затем проанализированы в экспериментах с макрофагами инфекции, эксплантатах человеческих тканей легкого ( как описано в Сравнительном 17), или даже в моделях in vivo на . К тому же роль OMV, в врожденной иммунной сигнализации, их влияние в бактериальной коммуникацииможет быть экспериментально решены. Кроме того, влияние различных врожденных иммунных сигнальных каскадах могут быть проанализированы с использованием мышиных клеток нокаутных или генерации CRISPR / cas9 нокаутов в клеточных линиях человека. Это фундаментальные исследования в OMV , будет оказывать помощь в разработке новых стратегий вакцин, которые уже существуют для менингитом B переданной Neisseria менингитов 33.
Исходя из протокола о OMV изоляции и определения характеристик, можно применить это к другим грамотрицательных бактерий и других клеток-хозяев; она должна быть приспособлена к росту бактерий в жидкой культуре только. Протокол опубликованных Chutkan и др. предоставляет подробную информацию о генерации OMV , из кишечной палочки и синегнойной палочки 30. Культура не должна достигнуть поздней стационарной фазы, чтобы избежать увеличения лизированных бактерий и загр зн ющие протеины и MEMбран. Кроме того, доза ОМВ используется для стимуляции клеток - хозяев должно быть определено в соответствии с количеством OMVS , присутствующих во время инфекции в естественных условиях, в то время как по- прежнему обеспечивает низкий уровень цитотоксичности. Таким образом, патологическая роль OMV уровень их влияние на межвидовой связи, и хозяин-патоген взаимодействий могут быть рассмотрены.
Для дальнейшего изучения роли L. pneumophila OMV , при пневмонии, необходимы стандартизированные препараты OMV с достаточными выходами и сопоставимыми экспериментов инфекции. Этот протокол поможет стандартизировать процедуры изоляции и расширить исследования OMV для других грамотрицательных бактерий, а также других клеток-хозяев. Кроме того, исследования выиграют от детальное экстракорпоральное знаний, которые могут быть использованы для расширения экспериментов для установок в естественных условиях. В дальнейшем, этот протокол может быть продлен до выделения OMV, из первичного биологического материала, таких как сыворотка или бронхо LAVвозраст жидкости, чтобы получить представление о составе OMV, выпущенном в физиологических условиях. Это поможет определить основные параметры композиции OMV и понять свойства -порожденных OMV , в пробирке.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
Мы благодарим профессора доктора Маркуса Schnare за предоставленную нам TLR2 - / - и TLR2 / 4 - / - мышей и профессор д - р Карстен Kirschning для TRIF / MyD88 - / - мышей. Части этой работы была профинансирована Bundesministerium für Bildung унд Forschung (е: био miRSys - ФКЗ 0316175B, E: Med CAPSYS - ФКЗ 01X1304E; http://www.bmbf.de/~~HEAD=dobj), Deutsche Forschungsgemeinschaft (SFB / TR-84; http://www.sfb-tr84.de/) и Hessisches Ministerium für Wissenschaft унд Kunst (LOEWE Medical RNomics - ФКЗ 519/03 / 00.001- (0003); http://www.proloewe.de/medicalrnomics), все БС.
Материалы
| Name | Company | Catalog Number | Comments |
| 10 cm Petri dish | Sarstedt AG & Co KG (Nuembrecht, Germany) | 82.1473 | |
| 70 Ti rotor | Beckman Coulter Incorporation (California, USA) | 337922 | |
| ACES | Carl Roth GmbH & Co KG (Karlsruhe, Germany) | 9138.2 | |
| activated charcoal | Carl Roth GmbH & Co KG (Karlsruhe, Germany) | X865.2 | |
| agar-agar, Kobe I | Carl Roth GmbH & Co KG (Karlsruhe, Germany) | 5210.2 | |
| Columbia agar with 5% sheep blood | Becton Dickinson GmbH (Heidelberg, Germany) | 254005 | |
| cuvettes | Sarstedt AG & Co KG (Nuembrecht, Germany) | 67.742 | |
| ELISA (human) | BD OptEIA™; Becton Dickinson GmbH (Heidelberg, Germany) | IL-8: 555244 IL-6: 550799 | |
| ELISA (murine) | DuoSet, R&D (Minneapolis, USA) | CXCL1: DY453-05 | |
| Fe(NO3)3x9H2O | Carl Roth GmbH & Co KG (Karlsruhe, Germany) | 5632.1 | |
| Fetal calf serum (FCS) | Life Technologies GmbH (Darmstadt, Germany) | 10270-106 | |
| Heracell 240i CO2 incubator | Thermo Fisher Scientific Germany BV & Co KG (Braunschweig, Germany) | 40830469 | |
| Heraeus Multifuge X3R | Thermo Fisher Scientific Germany BV & Co KG (Braunschweig, Germany) | 75004515 | |
| Inoculation loop | Sarstedt AG & Co KG (Nuembrecht, Germany) | 86.1567.010 | |
| KOH | Carl Roth GmbH & Co KG (Karlsruhe, Germany) | 6751.1 | |
| L. pneumophila Corby | --- | --- | kindly provided by Prof Dr Antje Flieger (RKI, Berlin, Germany) |
| L. pneumophila Corby ΔflaA | --- | --- | kindly provided by Prof Dr Klaus Heuner (RKI, Berlin, Germany) |
| L-cystein | Carl Roth GmbH & Co KG (Karlsruhe, Germany) | ||
| mBMDM | --- | --- | kindly provided by Prof Dr Markus Schnare (Philipps Univeristy Marburg, Marburg, Germany) and Prof Dr Carsten Kirschning (University Duisburg Essen, Essen, Germany) |
| PBS | Biochrom GmbH (Berlin, Germany) | L 1825 | |
| phorbol 12-myristate 13-acetate | Sigma-Aldrich Chemie GmbH (Taufkirchen, Germany) | P8139-1MG | |
| rotating shaker (MaxQ 6000) | Thermo Fisher Scientific Germany BV & Co KG (Braunschweig, Germany) | SHKE6000 | |
| RPMI 1640 high glucose | Life Technologies GmbH (Darmstadt, Germany) | 11875-093 | |
| saponin | Carl Roth GmbH & Co KG (Karlsruhe, Germany) | 9622.1 | |
| Ultrospec 10 | Biochrom Ltd (Cambridge, England) | 80-2116-30 | |
| sterile filter (pore size: 0.22 µm) | Corning Incorporated (new York, USA) | 431096 | |
| THP-1 | Sigma-Aldrich Chemie GmbH (Taufkirchen, Germany) | 88081201-1VL | |
| Sorvall Discovery 100 SE | Thermo Fisher Scientific Germany BV & Co KG (Braunschweig, Germany) | ||
| yeast extract | Carl Roth GmbH & Co KG (Karlsruhe, Germany) | 2363.2 | |
| Pierce BCA protein assay kit | Thermo Fisher Scientific Germany BV & Co KG (Braunschweig, Germany) | 23225 |
Ссылки
- Cambronne, E. D., Roy, C. R. Recognition and delivery of effector proteins into eukaryotic cells by bacterial secretion systems. Traffic. 7 (8), 929-939 (2006).
- Ellis, T. N., Kuehn, M. J. Virulence and immunomodulatory roles of bacterial outer membrane vesicles. Microbiol Mol Biol Rev. 74 (1), 81-94 (2010).
- Beveridge, T. J. Structures of gram-negative cell walls and their derived membrane vesicles. J Bacteriol. 181 (16), 4725-4733 (1999).
- Kuehn, M. J., Kesty, N. C. Bacterial outer membrane vesicles and the host-pathogen interaction. Genes Dev. 19 (22), 2645-2655 (2005).
- Chi, B., Qi, M., Kuramitsu, H. K. Role of dentilisin in Treponema denticola epithelial cell layer penetration. Res Microbiol. 154 (9), 637-643 (2003).
- Kolling, G. L., Matthews, K. R. Export of virulence genes and Shiga toxin by membrane vesicles of Escherichia coli O157:H7. Appl Environ Microbiol. 65 (5), 1843-1848 (1999).
- Horstman, A. L., Kuehn, M. J. Enterotoxigenic Escherichia coli secretes active heat-labile enterotoxin via outer membrane vesicles. J Biol Chem. 275 (17), 12489-12496 (2000).
- Dorward, D. W., Schwan, T. G., Garon, C. F. Immune capture and detection of Borrelia burgdorferi antigens in urine, blood, or tissues from infected ticks, mice, dogs, and humans. J Clin Microbiol. 29 (6), 1162-1170 (1991).
- Mashburn, L. M., Whiteley, M. Membrane vesicles traffic signals and facilitate group activities in a prokaryote. Nature. 437 (7057), 422-425 (2005).
- Kesty, N. C., Mason, K. M., Reedy, M., Miller, S. E., Kuehn, M. J. Enterotoxigenic Escherichia coli vesicles target toxin delivery into mammalian cells. EMBO J. 23 (23), 4538-4549 (2004).
- Abu Kwaik, Y., Gao, L. Y., Stone, B. J., Venkataraman, C., Harb, O. S. Invasion of protozoa by Legionella pneumophila and its role in bacterial ecology and pathogenesis. Appl Environ Microbiol. 64, 3127-3133 (1998).
- Winn, W. C., Myerowitz, R. L. The pathology of the Legionella pneumonias. A review of 74 cases and the literature. Hum Pathol. 12 (5), 401-422 (1981).
- Ge, J., Shao, F. Manipulation of host vesicular trafficking and innate immune defence by Legionella Dot/Icm effectors. Cell Microbiol. 13 (12), 1870-1880 (2011).
- Hubber, A., Roy, C. R. Modulation of host cell function by Legionella pneumophila type IV effectors. Annu Rev Cell Dev Biol. 26, 261-283 (2010).
- Fernandez-Moreira, E., Helbig, J. H., Swanson, M. S. Membrane vesicles shed by Legionella pneumophila inhibit fusion of phagosomes with lysosomes. Infect Immun. 74 (6), 3285-3295 (2006).
- Galka, F., et al. Proteomic characterization of the whole secretome of Legionella pneumophila and functional analysis of outer membrane vesicles. Infect Immun. 76 (5), 1825-1836 (2008).
- Jager, J., et al. Human lung tissue explants reveal novel interactions during Legionella pneumophila infections. Infect Immun. 82 (1), 275-285 (2014).
- Ellis, T. N., Leiman, S. A., Kuehn, M. J. Naturally produced outer membrane vesicles from Pseudomonas aeruginosa elicit a potent innate immune response via combined sensing of both lipopolysaccharide and protein components. Infect Immun. 78 (9), 3822-3831 (2010).
- Jager, J., Keese, S., Roessle, M., Steinert, M., Schromm, A. B. Fusion of Legionella pneumophila outer membrane vesicles with eukaryotic membrane systems is a mechanism to deliver pathogen factors to host cell membranes. Cell Microbiol. , (2014).
- Jung, A. L., et al. Legionella pneumophila-Derived Outer Membrane Vesicles Promote Bacterial Replication in Macrophages. PLoS Pathog. 12 (4), (2016).
- Jiang, Y., Kong, Q., Roland, K. L., Curtiss, R. Membrane vesicles of Clostridium perfringens type A strains induce innate and adaptive immunity. Int J Med Microbiol. 304 (3-4), 431-443 (2014).
- Whitmire, W. M., Garon, C. F. Specific and nonspecific responses of murine B cells to membrane blebs of Borrelia burgdorferi. Infect Immun. 61 (4), 1460-1467 (1993).
- Ismail, S., Hampton, M. B., Keenan, J. I. Helicobacter pylori outer membrane vesicles modulate proliferation and interleukin-8 production by gastric epithelial cells. Infect Immun. 71 (10), 5670-5675 (2003).
- Jager, J., Steinert, M. Enrichment of outer membrane vesicles shed by Legionella pneumophila. Methods Mol Biol. 954, 225-230 (2013).
- Park, E. K., et al. Optimized THP-1 differentiation is required for the detection of responses to weak stimuli. Inflamm Res. 56 (1), 45-50 (2007).
- Casson, C. N., et al. Human caspase-4 mediates noncanonical inflammasome activation against gram-negative bacterial pathogens. Proc Natl Acad Sci U S A. 112 (21), 6688-6693 (2015).
- Molofsky, A. B., Shetron-Rama, L. M., Swanson, M. S. Components of the Legionella pneumophila flagellar regulon contribute to multiple virulence traits, including lysosome avoidance and macrophage death. Infect Immun. 73 (9), 5720-5734 (2005).
- Isaac, D. T., Laguna, R. K., Valtz, N., Isberg, R. R. MavN is a Legionella pneumophila vacuole-associated protein required for efficient iron acquisition during intracellular growth. Proc Natl Acad Sci U S A. 112 (37), 5208-5217 (2015).
- Zhu, W., et al. Sensing cytosolic RpsL by macrophages induces lysosomal cell death and termination of bacterial infection. PLoS Pathog. 11 (3), 1004704 (2015).
- Chutkan, H., Macdonald, I., Manning, A., Kuehn, M. J. Quantitative and qualitative preparations of bacterial outer membrane vesicles. Methods Mol Biol. 966, 259-272 (2013).
- Macdonald, I. A., Kuehn, M. J. Stress-induced outer membrane vesicle production by Pseudomonas aeruginosa. J Bacteriol. 195 (13), 2971-2981 (2013).
- Klimentova, J., Stulik, J. Methods of isolation and purification of outer membrane vesicles from gram-negative bacteria. Microbiol Res. 170, 1-9 (2015).
- . Novartis.com Available from: https://www.novartis.com/news/media-releases/novartis-bexsero%C2%AE-vaccine-approved-fda-prevention-meningitis-b-leading-cause (2016)
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены