Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un dispositif pour effectuer la migration cellulaire / Wound Healing dans une plaque à 96 puits
Dans cet article
Résumé
Ici, nous présentons un protocole pour effectuer un test de migration des cellules semi-haut débit sur une plaque de culture cellulaire de 96 puits. Ce protocole est une méthode rapide, simple et économique pour créer des blessures à gratter cohérentes sur une monocouche cellulaire.
Résumé
La migration cellulaire / blessure dosage est une méthode couramment utilisée pour étudier la migration cellulaire et d'autres processus biologiques tels que l'angiogenèse et les métastases tumorales. Dans cet essai, les cellules sont cultivées pour former une monocouche confluente et une blessure mécanique est créée par grattage avec un périphérique. Ensuite, le taux des cellules vers la zone dénudée de migration peut être surveillé par imagerie. Notre wounder mécanique à 8 canaux est conçu pour traiter la plupart des problèmes liés à la détermination de la migration cellulaire. Tout d'abord, notre wounder peut être facilement stérilisé par autoclavage ou avec des désinfectants courants. Deuxièmement, les broches individuels réglables permettent même le contact avec la plaque de culture cellulaire de telle sorte que les plaies vives et reproductibles peuvent être créés. Troisièmement, les barres de guidage des deux côtés de la position de wounder assurent une blessure constante dans chaque puits. L'utilisation de jetables conseils de pipette en plastique pour blesser peut en outre assurer une meilleure gestion de la wounder ainsi que pour minimiser les contre-contamination. En conclusion, notre wounder cellulaire peut fournir aux chercheurs un dispositif convivial et reproductible utilisateur pour effectuer le test de migration des cellules en utilisant la plaque standard de culture de 96 puits.
Introduction
La migration cellulaire joue un rôle important dans les processus cellulaires, tels que l' embryogenèse, la neurogenèse, l' angiogenèse, la cicatrisation, la réparation des muqueuses, épithélio-mésenchymateuse transitions en cours de développement normal et la situation de la maladie 1. Il est un processus complexe qui implique la coordination de nombreux événements internationaux et intra-cellulaires , y compris la signalisation des interactions moléculaires, la polarisation de la cellule, la réorganisation du cytosquelette, remodelage de la matrice, protrusion de la membrane et cellule-cellule dynamique adhérence modulation 2. En étudiant la migration cellulaire, la découverte et la validation des produits chimiques ou des biomolécules conduisant à un mouvement cellulaire et les voies biochimiques apparentées peuvent être déterminées. Ce processus fondamental peut être utilisé avantageusement en tant que proxy pour diverses applications, telles que le traitement de la maladie et le ciblage de médicaments.
L'essai est blessant l' un des essais de migration cellulaire 3. Ici, unéchantillon individuel de cellules sera partiellement éliminé par des moyens mécaniques pour produire une zone dénudée où les cellules migrent pour couvrir la zone. Le pourcentage de récupération à un point de temps particulier sera surveillé. Lors de la manipulation grand nombre d'échantillons, des questions telles que le coût expérimental et la contamination croisée dans les échantillons peuvent être problématiques. Bien que de nombreux outils commerciaux et des essais sont disponibles pour l' étude de la migration des cellules 4, 5, 6, beaucoup d'entre eux nécessaire un équipement coûteux et sophistiqué et des améliorations sont encore nécessaires. Pour ces raisons, un wounder cellulaire mécanique à 8 canaux (figure 1) est développée.
Notre wounder mécanique 8 canaux cellulaire a incorporé plusieurs caractéristiques uniques pour résoudre les problèmes mentionnés ci-dessus. Il offre la possibilité d'effectuer la migration des cellules / blesser les dosages dans le format de plaque de culture à 96 puits. Le réglage gubar design Iding veille à ce que la zone de zéro est dans la position centrale de chaque puits. En outre, la hauteur des barres de guidage peut être ajustée de sorte que la wounder est applicable pour les différentes marques de plaques de culture. Enfin, la conception de la broche de blessure réglable permet un contact même des pointes de pipette à la surface de la plaque de culture pour obtenir une blessure simultanée et reproductible 7, 8.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Introduction aux parties du wounder (Figure 1)
- Préparer le porte-broche en fixant les broches blessantes à des distances égales. Tenez les embouts de pipette et d'ajuster la hauteur de la pointe en déplaçant les broches blessantes réglables de haut en bas.
- Monter le guidage-bar ajustable sur différentes marques de plaques de culture de 96 puits et de veiller à ce que la zone de la blessure est dans une position fixe.
- Fixer la tige de blessure réglable en serrant la vis à tête hexagonale. Fixer la barre de guidage en position en serrant la tête bouchons à six pans creux sur les deux extrémités.
2. Réglage de la largeur du titulaire Pin (Figure 2)
- Desserrez les bouchons de tête à six pans creux avec la clé hexagonale M5.
- Insérer un nombre approprié de bagues de réglage sur les deux côtés du porte-broches de sorte que les barres de guidage correspondent parfaitement à la largeur de la plaque de culture à 96 puits.
NOTE: Corning et plaques Iwaki nécessite 1 paire de grands anneaux et 1 paire de petits anneaux. Falcon et Nunc plAtes besoin 1 paire de grands anneaux. - Serrer la tête de douille hexagonale bouchons pour fixer la barre de guidage.
3. Réglage des barres de guidage (Figure 3)
- Monter les goupilles blessant avec 10 ul embouts de pipette en plastique stériles.
- Desserrez les bouchons de tête à six pans creux avec la clé hexagonale M5.
- Tenez le wounder et tremper les tiges blessantes dans une colonne d'une plaque de culture à 96 puits.
- Réglez la hauteur des barres de guidage jusqu'à ce que tous les conseils à peine toucher le fond des puits.
- Serrer les bouchons de tête à six pans creux. Assurez-vous que le wounder maintenant correspond parfaitement sur la plaque de culture et que les broches sont bien placés dans le milieu des puits.
4. Calibrage des Pins
- Tenir la wounder perpendiculaire à une surface stérile plat (c. -à -boîte de Pétri) et desserrer toutes les vis à tête hexagonale avec la clé hexagonale M3.
- Appuyez sur le wounder jusqu'à ce que tous les conseils uniformément toucher la surface stérile plat.
- Serrer les vis à tête hexagonale à nouveau pour verrouiller les broches en position.
- Vérifier la planéité de chaque pointe en appuyant sur le wounder doucement sur la surface stérile plat.
5. Scratching monocouche de cellules (Figure 4)
- Seed cellules ombilicales humaines endothéliales vasculaires sur une plaque à 96 puits revêtu de gélatine à 0,1% de la culture cellulaire. les cellules de culture en milieu 199 supplémenté avec 20% de sérum inactivé à la chaleur de fœtus bovin, 1% de pénicilline / streptomycine et 0,09 g / L de l'héparine. Maintenir les cellules dans un incubateur humidifié avec 5% de dioxyde de carbone à 37 ° C pendant une nuit avant d'être utilisé. Les cellules doivent atteindre 100% de confluence avant blessant.
- Placer les pointes blessantes à l'extrême gauche (ou droite) latérale de chaque puits dans la même colonne de la plaque de culture. Faites glisser le wounder travers de l'autre côté du puits; assurez-vous que les conseils blessantes touchent le fond du puits.
- Répétez le grattage (étape 5.2) pour toutes les colonnes.
- Après la blessure, défausse til milieu de chaque puits et le remplacer par un milieu contenant des composés d'essai frais.
Acquisition de données 6. et analyse d'images
- L'ensemble d' image bien avec la blessure mécanique sur la monocouche cellulaire en utilisant un microscope de faible puissance avec un appareil photo numérique (par exemple un objectif 10X) immédiatement après la blessure (t = 0 h).
- Ajouter des composés d'essai, si désiré et laisser incuber pendant la durée souhaitée. L'ensemble d'image bien avec la surface de la plaie à nouveau après le temps d'incubation désirée (t = Dh).
- En utilisant l' image des logiciels d'analyse tels que ImageJ ( https://imagej.nih.gov/ij/ ), mesurer la zone blessée sur l'image en utilisant l'outil à main levée.
- Calculer le pourcentage de fermeture de la plaie:
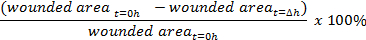
Access restricted. Please log in or start a trial to view this content.
Résultats
Cette wounder mécanique 8 canaux est construit de façon à gratter une monocouche cellulaire afin d'effectuer le test de migration des cellules. Il est un dispositif convivial qui peut effectuer des essais grattage de cellules dans des plaques à 96 puits en moins d'une minute sans formation spéciale. Ce wounder peut introduire des zones enroulées sur des monocouches de cellules avec une largeur uniforme d'environ 600 pm et présentant des arêtes vives (figures 5...
Access restricted. Please log in or start a trial to view this content.
Discussion
Notre wounder cellulaire a plusieurs caractéristiques uniques pour résoudre les problèmes des tests traditionnels de migration cellulaire. La wounder mécanique à 8 canaux cellule est réalisée en acier inoxydable de haute qualité (acier 304) avec une longue durée de vie qui peut être stérilisé par autoclavage. Presque toutes les marques commerciales de plaques de culture à 96 puits disponibles sur le marché peuvent être utilisés avec ce wounder mécanique des cellules en raison de la barre de guidage rég...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs déclarent qu'ils ont aucun intérêt financier concurrents.
Remerciements
Les auteurs tiennent à remercier M. Tam Po Leung, M. Wong Chi Kin et le personnel technique de la Faculté des sciences Atelier, Hong Kong Baptist University, pour leurs compétences techniques et des conseils pour rendre le prototype de ce wounder.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 96-well cell culture plate | Nunc | 167008 | Other brands of 96-well cell culture plate can also be used |
| P10 pipette tips | Axygen | 301-03-051 | Short P10 pipette tip is more easy to create a clear wound |
| Wounder | R&P Technology Limited | ||
| Medium 199 | Sigma | M2520-1L | For cell culture of human umbilical vein endothelial cells. Use appropirate culture medium and condition for other type of cells. |
| Fetal bovine serum | Gibco | 26140079 | For cell culture of human umbilical vein endothelial cells. Use appropirate culture medium and condition for other type of cells. |
| Penicillin/Streptomycin | Gibco | 15140122 | For cell culture of human umbilical vein endothelial cells. Use appropirate culture medium and condition for other type of cells. |
| Heparin sodium salt from porcine intestinal mucosa | Sigma | H3393 | For cell culture of human umbilical vein endothelial cells. Use appropirate culture medium and condition for other type of cells. |
| Gelatin from bovine skin | Sigma | G9391 | For cell culture of human umbilical vein endothelial cells. Use appropirate culture medium and condition for other type of cells. |
Références
- Friedl, P., Wolf, K. Tumour-cell invasion and migration: diversity and escape mechanisms. Nat Rev Cancer. 3 (5), 362-374 (2003).
- Friedl, P. Prespecification and plasticity: shifting mechanisms of cell migration. Curr Opin Cell Biol. 16 (1), 14-23 (2004).
- Lampugnani, M. G. Cell migration into a wounded area in vitro. Methods Mol Biol. 96, 177-182 (1999).
- Sholley, M. M., Gimbrone, M. A. Jr, Cotran, R. S. Cellular migration and replication in endothelial regeneration: a study using irradiated endothelial cultures. Lab Invest. 36 (1), 18-25 (1977).
- Gotlieb, A. I., Spector, W. Migration into an in vitro experimental wound: a comparison of porcine aortic endothelial and smooth muscle cells and the effect of culture irradiation. Am J Pathol. 103 (2), 271-282 (1981).
- Chen, Y. C., et al. Single-cell migration chip for chemotaxis-based microfluidic selection of heterogeneous cell populations. Sci Rep. 18 (5), 9980(2015).
- Yarrow, J. C., Periman, Z. E., Westwood, N. J., Mitchison, T. J. A high-throughput cell migration assay using scratch wound healing, a comparsion of image-based readout methods. BMC Biotechnol. 4, 21(2004).
- Lauder, H., Frost, E. E., Hiley, C. R., Fan, T. P. Quantification of the repair process involved in the repair of a cell monolayer using an in vitro model of mechanical injury. Angiogenesis. 2 (1), 67-80 (1998).
- Yue, P. Y. K., Leung, E. P. Y., Mak, N. K., Wong, R. N. S. A simplified method for quantifying cell migration/ wound healing in 96-well plates. J. Biomol Screen. 15 (4), 427-433 (2010).
- Yue, P. Y., et al. Elucidation of the mechanisms underlying the angiogenic effects of ginsenoside Rg(1) in vivo and in vitro. Angiogenesis. 8 (3), 205-216 (2005).
- Kwok, H. H., Chan, L. S., Poon, P. Y., Yue, P. Y., Wong, R. N. Ginsenoside-Rg1 induces angiogenesis by the inverse regulation of MET tyrosine kinase receptor expression through miR-23a. Toxicol Appl Pharmacol. 287 (3), 276-283 (2015).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon