JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
96 웰 플레이트에 세포 마이그레이션 / 상처 치유를 수행하기위한 장치
요약
여기서, 우리는 96 웰 세포 배양 접시에 반 처리량 세포 이동 분석을 수행 할 프로토콜을 제시한다. 이 프로토콜은 셀 단층에 일관성 스크래치 상처를 만들 수있는, 빠르고 간단하고 경제적 인 방법이다.
초록
셀 마이그레이션 / 분석 부상은 세포 이동 및 혈관 신생 및 종양 전이 등의 생물학적 과정을 공부하기 위해 일반적으로 사용되는 방법이다. 이 분석에서, 세포가 합류 단층을 형성하기 위해 재배 및 기계적 상처는 장치와 긁힘에 의해 생성된다. 다음에 무 결함 영역을 향해 세포의 이동 속도는 촬상에 의해 모니터링 될 수있다. 우리 8 채널 기계적 wounder은 세포 이동 분석법과 관련된 대부분의 문제를 해결하도록 설계된다. 첫째, 우리의 wounder 쉽게 고압 증기 멸균 또는 일반적인 소독제로 살균 할 수있다. 둘째, 개별 조절 핀도 선명하고 재현성 상처가 생성 될 수 있도록, 세포 배양 플레이트에 접촉 허용한다. 셋째, wounder 양측의 안내 바는 각각의 웰에서 일관된 상처 위치를 보장한다. 더 wounder의 더 나은 핸들링을 제공 할뿐만 아니라 크로스 contaminat을 최소화하기 위해 부상에 대한 일회용 플라스틱 피펫 팁의 사용이온. 결론적으로, 우리 셀 wounder은 표준 96 웰 배양 접시를 사용하여 세포 이동 분석을 수행하기위한 사용자 친화적이고 재생 가능한 장치 연구를 제공 할 수있다.
서문
세포 이동은 배아 발생, 신경, 혈관 신생, 창상 치유, 점막 수리, 정상적인 발달 및 질병 상태 하에서 1 상피 간엽 - 천이 같은 세포 과정에서 중요한 역할을한다. 이것은 시그널링 분자 상호 작용, 세포 편광 세포 골격 재구성 매트릭스 리모델링 막 돌기 동적 세포 - 세포 부착 2 변조 등 다양한 인터페이스 및 세포 내 사건의 조정을 포함하는 복잡한 과정이다. 세포 이동을 연구함으로써, 세포 이동과 관련된 생화학 적 경로를 선도 화학 또는 생체 분자의 발견 및 확인을 결정할 수있다. 이러한 기본적인 공정은 이러한 질병 치료 약물 표적 같은 다양한 애플리케이션을위한 프록시로서 유리하게 사용될 수있다.
상처 분석법은 세포 이동 분석 (3)의 하나이다. 여기서,셀들의 각각의 샘플은 부분적으로 셀 영역을 덮는 마이그레이션하는 무 결함 영역을 생성하기 위해 기계적인 방법에 의해 제거 될 것이다. 특정 시점에서 회수의 비율을 모니터링한다. 샘플의 많은 수를 처리 할 때, 이러한 샘플 내에서 실험 비용 및 교차 오염 등의 문제가 문제가 될 수 있습니다. 많은 상용 도구와 분석은 세포 이동 4, 5, 6을 연구 할 수 있지만, 그들 중 많은 사람들이 비싸고 복잡한 장비가 필요하고 개선이 여전히 필요하다. 이러한 이유로, 8 채널 기계적 셀 wounder (도 1)가 개발되고있다.
우리 8 채널 기계적 셀 wounder은 상술 한 문제점을 해결하기에 몇몇의 고유 특징을 포함하고있다. 이것은 96- 웰 배양 플레이트 형식으로 분석 부상 / 세포 이동을 수행 할 수있는 유연성을 제공한다. 조정 번지iding 바 설계는 스크래치 영역을 각 웰의 중앙에 위치되는 것을 보장한다. wounder는 배양 접시의 다양한 브랜드에 적용되도록 또한, 가이드 바의 높이를 조정할 수있다. 마지막으로, 상처 조절 핀 디자인과 동시에 재현성 상처 (7, 8)을 달성하기 위해 배양 접시 표면과 피펫 팁의 짝수 접촉 할 수있다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
Wounder의 부품 1. 소개 (그림 1)
- 동일한 거리에있는 상처 핀을 고정하여 핀 홀더를 준비합니다. 피펫 팁을 잡고 위아래로 조절 상처 핀을 이동하여 팁 높이를 조정합니다.
- 96- 웰 배양 플레이트의 다른 브랜드의 조절, 안내 막대를 장착하고 상처 면적이 고정 된 위치에있을 것을 보장한다.
- 육각 나사를 조여 조정 상처 핀을 고정합니다. 양단에 육각 소켓 헤드 캡을 조여 위치에 안내 바 수정.
2. 핀 홀더의 폭을 설정한다 (그림 2)
- M5의 육각 렌치 육각 소켓 헤드 캡을 풉니 다.
- 가이드 바 96 웰 배양 플레이트의 폭 딱 맞도록 상기 핀 홀더의 양측에 고리를 조절하는 적절한 번호를 삽입한다.
참고 : 코닝과 이와키 플레이트가 큰 반지 1 쌍의 작은 반지 1 쌍을 필요로한다. 팔콘과 눈크 (PL)ATES 큰 반지 1 쌍을 필요로한다. - 육각 소켓 헤드를 체결하면 안내 막대를 해결하기 위해 모자.
3. 안내 바 조정 (그림 3)
- 멸균 10 μL 플라스틱 피펫 팁으로 부상 핀을 맞 춥니 다.
- M5의 육각 렌치 육각 소켓 헤드 캡을 풉니 다.
- wounder를 잡고 96- 웰 배양 플레이트의 한 컬럼에 상처 핀에 담갔다.
- 간신히 우물의 바닥을 터치 팁의 모든 때까지 안내 바의 높이를 조정합니다.
- 육각 소켓 헤드 캡을 조입니다. wounder 이제 완벽하게 배양 접시에와 핀이 우물의 중간에 잘 배치되어 있는지에 맞는지 확인합니다.
핀 4. 교정
- 평면 멸균면 (즉, 페트리 접시)에 수직 wounder를 잡고 M3 육각 렌치로 모든 육각 나사를 풉니 다.
- 균등하게 평면 멸균 표면을 만지지 팁의 모든 때까지 wounder을 누릅니다.
- 위치에 핀을 고정 다시 육각 나사를 조입니다.
- 평면 멸균 표면에 부드럽게 wounder을 눌러 각 팁의 균일 성을 확인합니다.
5. 긁는 셀 단일 플라이 (그림 4)
- 0.1 % 젤라틴 - 코팅 된 96- 웰 세포 배양 플레이트에 시드 인간 제대 혈관 내피 세포. 매체 (199)의 배양 세포는 20 % 열 - 불 활성화 소 태아 혈청, 1 % 페니실린 / 스트렙토 마이신 및 0.09 g / L의 헤파린 보충. 밤새 사용하기 전에 37 ºC에서 5 % 이산화탄소 가습 배양기에서 세포를 유지한다. 세포는 상처 전에 100 % 포화 상태에 도달한다.
- 가장 왼쪽 (또는 오른쪽) 문화 판의 같은 열에서 각 웰의 측면의 상처 팁을 놓습니다. 우물의 반대편에 걸쳐 wounder를 밀어; 상처 팁 잘 하단을 터치 있는지 확인합니다.
- 모든 열에 대한 긁힘 (단계 5.2) 반복합니다.
- , 폐기 t 상처 후그는 중간 각 잘 신선한 매체를 포함하는 시험 화합물로 대체합니다.
6. 데이터 수집 및 이미지 분석
- 디지털 카메라 이미지 (예 10X 대물 렌즈)와 저전력 현미경을 사용하여 세포 단층에서 기계적 상처와 전체 웰 즉시 (t = 0 시간)을 상처 후.
- 원하는 경우, 시험 화합물을 첨가하고 원하는 시간 동안 배양. 이미지 원하는 배양 시간 (t = ΔH) 후 다시 상처 면적 전체도.
- 이러한 ImageJ에 같은 영상 분석 소프트웨어 (사용 https://imagej.nih.gov/ij/ )은 자유형 도구를 사용하여 이미지의 상처 면적을 측정한다.
- 상처 봉합의 비율을 계산한다 :
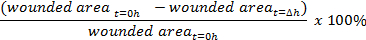
Access restricted. Please log in or start a trial to view this content.
결과
이 8 채널 기계적 wounder은 세포 이동 분석을 수행하기 위해 세포 단층을 긁어 구성된다. 그것은 특별한 교육을받지 않은 분 안에 96 웰 플레이트 세포 긁힘 분석을 수행 할 수있는 사용자 친화적 인 장치입니다. 이 wounder 약 600 ㎛의 균일 한 폭과 날카로운 가장자리 세포 단층에 감긴 영역을 도입 할 수있다 (도 5 및도 6). 상처의 폭은 피펫 팁의 브랜?...
Access restricted. Please log in or start a trial to view this content.
토론
우리의 세포 wounder는 기존의 세포 이동 분석의 문제를 해결하는 몇 가지 독특한 기능을 가지고 있습니다. 8 채널 기계적 셀 wounder은 고압 증기 멸균에 의해 멸균 될 수있는 긴 수명과 높은 등급의 스테인레스 (스틸 304)로 이루어진다. 시판 96- 웰 배양 판의 거의 모든 상업용 브랜드 때문에 조정 안내 막대이 기계적 세포 wounder 함께 사용될 수있다. 조정 안내 바의 설계는 찰 영역을 각 웰의 중앙에있?...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 더 경쟁 재정적 이해 관계가 없음을 선언합니다.
감사의 말
저자는이 wounder의 프로토 타입을 만드는 씨 탐 포 렁 씨 웡 치 킨과 기술 능력에 대한 과학 학부 워크샵의 기술 직원, 홍콩 침례 대학과 조언을 감사의 말씀을 전합니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 96-well cell culture plate | Nunc | 167008 | Other brands of 96-well cell culture plate can also be used |
| P10 pipette tips | Axygen | 301-03-051 | Short P10 pipette tip is more easy to create a clear wound |
| Wounder | R&P Technology Limited | ||
| Medium 199 | Sigma | M2520-1L | For cell culture of human umbilical vein endothelial cells. Use appropirate culture medium and condition for other type of cells. |
| Fetal bovine serum | Gibco | 26140079 | For cell culture of human umbilical vein endothelial cells. Use appropirate culture medium and condition for other type of cells. |
| Penicillin/Streptomycin | Gibco | 15140122 | For cell culture of human umbilical vein endothelial cells. Use appropirate culture medium and condition for other type of cells. |
| Heparin sodium salt from porcine intestinal mucosa | Sigma | H3393 | For cell culture of human umbilical vein endothelial cells. Use appropirate culture medium and condition for other type of cells. |
| Gelatin from bovine skin | Sigma | G9391 | For cell culture of human umbilical vein endothelial cells. Use appropirate culture medium and condition for other type of cells. |
참고문헌
- Friedl, P., Wolf, K. Tumour-cell invasion and migration: diversity and escape mechanisms. Nat Rev Cancer. 3 (5), 362-374 (2003).
- Friedl, P. Prespecification and plasticity: shifting mechanisms of cell migration. Curr Opin Cell Biol. 16 (1), 14-23 (2004).
- Lampugnani, M. G. Cell migration into a wounded area in vitro. Methods Mol Biol. 96, 177-182 (1999).
- Sholley, M. M., Gimbrone, M. A. Jr, Cotran, R. S. Cellular migration and replication in endothelial regeneration: a study using irradiated endothelial cultures. Lab Invest. 36 (1), 18-25 (1977).
- Gotlieb, A. I., Spector, W. Migration into an in vitro experimental wound: a comparison of porcine aortic endothelial and smooth muscle cells and the effect of culture irradiation. Am J Pathol. 103 (2), 271-282 (1981).
- Chen, Y. C., et al. Single-cell migration chip for chemotaxis-based microfluidic selection of heterogeneous cell populations. Sci Rep. 18 (5), 9980(2015).
- Yarrow, J. C., Periman, Z. E., Westwood, N. J., Mitchison, T. J. A high-throughput cell migration assay using scratch wound healing, a comparsion of image-based readout methods. BMC Biotechnol. 4, 21(2004).
- Lauder, H., Frost, E. E., Hiley, C. R., Fan, T. P. Quantification of the repair process involved in the repair of a cell monolayer using an in vitro model of mechanical injury. Angiogenesis. 2 (1), 67-80 (1998).
- Yue, P. Y. K., Leung, E. P. Y., Mak, N. K., Wong, R. N. S. A simplified method for quantifying cell migration/ wound healing in 96-well plates. J. Biomol Screen. 15 (4), 427-433 (2010).
- Yue, P. Y., et al. Elucidation of the mechanisms underlying the angiogenic effects of ginsenoside Rg(1) in vivo and in vitro. Angiogenesis. 8 (3), 205-216 (2005).
- Kwok, H. H., Chan, L. S., Poon, P. Y., Yue, P. Y., Wong, R. N. Ginsenoside-Rg1 induces angiogenesis by the inverse regulation of MET tyrosine kinase receptor expression through miR-23a. Toxicol Appl Pharmacol. 287 (3), 276-283 (2015).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유